一氧化氮參與調節PEG滲透脅迫下白三葉抗氧化酶活性及其基因表達
吳星,王曉娟,彭燕(四川農業大學動物科技學院草業科學系,四川 成都 611130)
?
一氧化氮參與調節PEG滲透脅迫下白三葉抗氧化酶活性及其基因表達
吳星,王曉娟,彭燕*
(四川農業大學動物科技學院草業科學系,四川 成都 611130)
以 ‘拉丁諾’ 白三葉為材料,采用藥理學實驗,研究15%PEG-6000滲透脅迫下,離體葉片內源NO熒光產生及NO含量動態變化,NO清除劑及合成抑制劑對白三葉葉片抗氧化酶活性及其基因表達量的影響以及外源NO供體(SNP)對滲透脅迫的緩解效應。滲透脅迫可誘導白三葉葉片NO熒光產生,NO含量升高,提高抗氧化酶活性,上調抗氧化酶基因表達水平,而Hb、NR、NaVO3和L-NAME則顯著抑制了脅迫誘導的NO含量、抗氧化酶活性及其基因表達水平的提升;外源根施50 μmol/L SNP促進了脅迫下葉片抗氧化酶活性的提高,并有效減緩了相對含水量的下降,抑制電解質滲透率(EL)和MDA含量的升高。以上結果表明,NO是白三葉響應滲透脅迫的重要信號分子,并可能通過調控氧化酶基因表達和提高抗氧化酶活性,以減輕滲透脅迫對白三葉幼苗的過氧化傷害。
白三葉;干旱脅迫;NO;熒光現象;抗氧化酶;基因表達
當前,全球氣候變暖和生態環境破壞導致水資源匱乏的總趨勢越來越明顯,干旱已成為影響農業可持續發展的重要脅迫因素,其危害相當于其他自然災害之和,嚴重威脅作物產量和人類生存環境,是當今人類面臨的最嚴峻的危機之一[1]。因此,深入理解作物抗旱機理,提高作物抗旱性顯得尤為重要。白三葉(Trifoliumrepens)屬于豆科(Leguminosae)三葉草屬(Trifolium),又稱白車軸草,是我國廣泛栽培應用的優良豆科牧草之一,具有產量高,牧草品質優良,生長適應性強,為各種畜禽所喜食等特點[2]。由于白三葉有匍匐生長、擴展能力強、再生速度快等習性,使其成為溫帶地區觀賞性草坪和綠地建植的主要草種,在國內外城鎮綠化、水土保持等方面起著不可替代的重要作用[3]。然而,白三葉屬淺根型作物,喜冷涼濕潤氣候,抗旱性較差是其栽培應用中面臨的主要問題[4]。
一氧化氮(nitric oxide, NO)是一種廣泛存在于動植物和微生物體細胞內與細胞間的信號分子,參與植物的各個生理過程,包括種子萌發,根系和葉片的生長發育,根系重力感應,光形態建成,呼吸作用,氣孔關閉,細胞程序性死亡,組織的成熟和衰老以及各種逆境脅迫響應等[5-9]。植物體內NO的合成途徑主要包括一氧化氮合酶途徑(NOS),硝酸還原酶(NR)途徑以及其他非酶促生成途徑[10]。研究表明,環境脅迫尤其是干旱脅迫能夠誘導植物體內NO合成,促進氣孔關閉,從而使蒸騰作用降低[11]。外源NO處理亦可顯著提高干旱脅迫下水稻(Oryzasativa)種子的發芽率[12];黑麥草(Loliumperenne)的抗鹽性、耐堿性[13-14];小麥(Triticumaestivum)、玉米(Zeamays)等作物的抗旱性[15-16]。也有研究表明,NO在植物體內主要依賴于cGMP和不依賴于cGMP兩條途徑介導信號傳導。依賴于cGMP的信號途徑中,NO與受體鳥苷酸環化酶(GC)結合并激活其活性,導致cADPR、cGMP生成量增加,調節Ca2+濃度,激活依賴于cGMP的蛋白激酶,最終調控植物對病原體的防御反應[17];不依賴于cGMP的信號轉導途徑中,NO通過抑制順烏頭酸酶等含非血紅素鐵類酶活性來參與植物抗逆反應[18]。然而,滲透脅迫下NO的作用機制在白三葉上的研究還未見報道。本研究利用藥理學試驗,結合激光共聚焦顯微技術和分子生物學方法,探討了滲透脅迫下白三葉葉片對內源NO信號的感應,及外源NO對滲透脅迫下白三葉葉片的保護作用,以期深入理解白三葉的抗旱性機制,對探尋提高白三葉抗旱性栽培措施奠定基礎。
1 材料與方法
1.1 試驗材料
本試驗于2013年7月-2014年8月進行,以‘拉丁諾’白三葉(Trifoliumrepenscv. ‘Ladino’)品種為供試材料,采用石英砂基質培養。選取籽粒飽滿、大小一致的白三葉種子,經0.1% HgCl2消毒后,均勻播種在裝有石英砂的白色育苗盤(長35 cm,寬25 cm,高10 cm)中,24 ℃光照培養箱中(光強2000 lx)進行發芽,待發芽7 d后用Hoagland全營養液繼續培養,溫度為白天23 ℃,夜晚19 ℃,時長各為12 h,相對濕度為70%,培養23 d, 每2 d更換一次營養液。取成熟的第2葉進行測試。
1.2 試驗設計與處理
1.2.1 滲透脅迫下葉片NO信號的產生及NO含量的變化 用蒸餾水(對照,CK)和15%PEG溶液分別浸泡白三葉葉片,在0、10、20、30、45、90、120 min后取樣,經NO特定熒光染料3-氨基,4-氨甲基化-2′,7′-熒光素(3-amino,4-aminomethyl-2′,7′-difluorescein,DAF-FM)染色30 min后,測定樣品中NO熒光強度的變化。浸泡的葉片在0、1、1.5、2、4、6 h后取樣,測定樣品中NO含量的變化。
1.2.2 滲透脅迫下NO信號對葉片抗氧化酶活性及其基因表達的調控 剪取白三葉葉片,于蒸餾水中浸泡1 h以洗脫傷害,然后分別置于含有以下5種處理液的離心管中。處理液分別是1)CK(對照,蒸餾水);2)PEG(15%的PEG-6000溶液);3)PEG+Hb(Hb,NO 清除劑牛血紅蛋白50 μmol/L);4)PEG+NaVO3(NaVO3,硝酸還原酶抑制劑偏釩酸鈉5 mmol/L);5)PEG+L-NAME(L-NAME,一氧化氮合酶抑制劑NG-硝基-L-精氨酸甲酯鹽酸鹽200 μmol/L)。各處理重復6次。在處理后第2 h測定NO含量及抗氧化酶基因表達,在處理后第8 h測定抗氧化酶活性。
1.2.3 NO供體對滲透脅迫下白三葉抗氧化脅迫的影響 分別用濃度為0、10、25、50、75、100、150 μmol/L的外源NO供體硝普鈉(sodium nitroprusside,SNP),對上述培育30 d的白三葉幼苗進行為期一周的預處理,期間根施3次,每次間隔1 d,每濃度處理設4次重復,然后用20%的PEG-6000進行滲透脅迫,在脅迫的第8 天分別取樣測定不同處理白三葉葉片相對含水量(relative water content,RWC)和電解質滲透率(electrolyte leakage,EL), 以篩選出SNP的最適濃度。為研究NO供體對消除滲透脅迫下白三葉過氧化傷害的效應,試驗設以下4個處理:1)CK(Hoagland全營養液處理);2)SNP(含有50 μmol/L SNP的Hoagland全營養液);3)PEG[20%(W/V)PEG-6000的Hoagland全營養液進行滲透脅迫];4)PEG+SNP[在20%(W/V)PEG-6000的Hoagland全營養液中加入50 μmol/L的SNP]。每處理重復4次,在處理后的第4、8、12、16 天分別取樣測定SOD、POD、CAT和APX活性及相對含水量、電解質滲透率和丙二醛(MDA)含量。
1.3 測定指標與方法
1.3.1 NO熒光和NO含量 參照Corpas等[19]方法檢測在白三葉幼苗葉片葉肉細胞中NO的熒光發生。所用NO特定熒光探針為3-amino,4-aminomethyl-2′,7′-difluorescein(DAF-FM)。在各處理液處理白三葉幼苗葉片的相應時間,取出10片葉片,迅速吸干表面液體,滴加 1 mL 2 μmol/L DAF-FM置于黑暗中染色 30 min,然后輕輕地取出葉片,用專用緩沖液沖洗數次,立即吸干水分后置于激光共聚焦顯微鏡(IX71, OLYMPUS CO., Ltd, 日本)下拍照。在激發光波長495 nm和發射波長515 nm條件下檢驗葉片熒光顯色效果。NO含量采用試劑盒測定[20],試劑盒購自南京建成生物工程研究所。
1.3.2 葉片相對含水量 采用烘干法測定[21]。剪取葉片0.3 g,用普通吸水紙將其包裹好,放入裝滿水的50 mL離心管中,蓋好蓋子,放置于避光處靜置24 h葉片吸水飽和后,取出葉片,擦干表面水分,稱量飽和鮮重,然后置于鼓風烘箱中在105 ℃下殺青45 min,然后75 ℃下烘至恒重,稱其干重,重復4次,取平均值。計算公式:
相對含水量(%)=[(鮮重-干重)/(飽和鮮重-干重)]×100
1.3.3 電解質滲透率 采用電導率儀測定法[22]。稱取0.1 g葉片,用自來水、去離子水沖洗4次,用潔凈濾紙吸去浮水,然后加10 mL去離子水,真空滲入半小時使葉段完全浸入,于室溫放置4 h,用電導儀測其電導率(S1),然后在沸水浴中煮15 min,冷卻至室溫后測煮后電導率(S2)。
相對電導率(%)=(煮前電導率S1/煮后電導率S2)×100
1.3.4 抗氧化酶活性(antioxidant enzyme activty)和丙二醛(malondialdehyde,MDA)含量 粗酶液的提取,稱取植物鮮重0.4 g放入研缽中,放入液氮研磨組織破碎后,待液氮完全揮發后加入2 mL預冷的磷酸緩沖液和0.1 g聚乙烯吡咯烷酮(PVP)在冰上充分研磨,然后轉入離心管中,再用2 mL緩沖液充分清洗研缽,一并轉入離心管中。4 ℃下15000 r/min離心20 min,上清液即為粗酶提取液。將粗酶液分裝入各管中進行MDA含量和抗氧化酶的活性測定。MDA含量采用硫代巴比妥酸法測定[23];超氧化物歧化酶(superoxide dismutase,SOD)活性采用核黃素-NBT法測定[24];過氧化氫酶(catalase,CAT)活性采用紫外吸收法測定[25];過氧化物酶(peroxidase,POD)活性采用愈創木酚顯色法測定[25];抗壞血酸過氧化物酶(ascorbate peroxidase,APX)活性參照Nakano等[26]的方法測定。
1.3.5 基因表達水平 采用qRT-PCR 的方法分析白三葉葉片中的抗氧化酶轉錄水平,總RNA提取與引物的設計參照王曉娟等[27]的方法,所用引物設計如表1。

表1 試驗中所用到的引物Table 1 All primers used in this experiment
1.4 數據分析
采用Excel 2003進行繪圖與數據處理;SAS 8.0軟件進行方差分析和顯著性檢驗(P<0.05)。
2 結果與分析
2.1 PEG誘導NO熒光產生變化動態及對NO含量的影響
如圖1所示,分別用蒸餾水和15%PEG浸泡的白三葉離體葉片經NO特定熒光染料DAF-FM染色30 min,在激光共聚焦顯微鏡下觀察發現,滲透脅迫可誘導葉片DAF-FM熒光快速產生,熒光現象在處理后10 min開始產生并在45 min時達到最大值,隨后熒光現象逐漸消失,并在120 min時熒光現象幾乎消失殆盡,而蒸餾水浸泡的葉片沒有熒光產生。如圖2所示,在不同時間點PEG處理誘導的白三葉葉片NO含量逐步升高,第2 h時達到最大值,爾后開始下降,在處理的1、1.5、2、4 h時與對照差異顯著(P<0.05)。
2.2 NO清除劑及產生抑制劑對PEG誘導NO含量的影響
如圖3所示,PEG滲透脅迫能顯著(P<0.05)提高白三葉葉片內源NO含量,而PEG處理下NO清除劑Hb、 NR抑制劑NaVO3和NOS抑制劑L-NAME則分別降低NO含量22.99%、20.10%、11.00%,與PEG處理差異顯著。

圖1 PEG處理對白三葉葉肉細胞NO熒光產生時間的影響Fig.1 Time course of nitric oxide (NO) production as affected by PEG treatment in mesophyll cells of white clover leaves
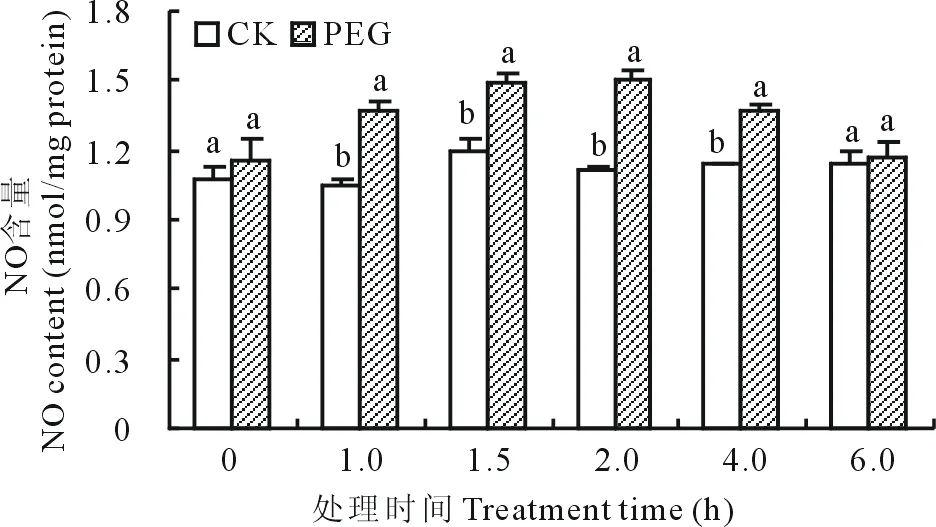
圖2 PEG處理在不同時間點對白三葉葉肉細胞NO含量的影響Fig.2 Effects of NO content of white clover leaves in response to PEG treatment at different time points

圖3 NO清除劑及產生抑制劑對PEG誘導NO含量的影響Fig.3 Effects of NO scavenger and inhibitor on NO content in white clover leaves under PEG stress
不同小寫字母表示差異顯著(P<0.05),下同. The different small letters mean the significant differences atP<0.05, the same below.
2.3 NO清除劑及產生抑制劑對PEG誘導抗氧化酶活性及其基因表達的影響
如圖4、圖5所示,PEG誘導的滲透脅迫使SOD,POD,CAT和APX酶活性分別提高35.42%、155.96%、71.88%、33.05%,且編碼它們的基因相對表達量分別提高69.21%、110.41%、117.11%、54.44%,與對照處理間差異顯著。而Hb,NaVO3和L-NAME處理則顯著降低了PEG誘導的4種抗氧化酶活性及基因相對表達量。表明NO信號參與調控滲透脅迫下白三葉葉片抗氧化酶基因的表達及其活性的提高。
2.4 不同濃度SNP對滲透脅迫下白三葉葉片RWC及EL的影響
圖6A顯示,20% PEG脅迫下, 10、25和50 μmol/L的外源SNP預處理可以顯著提高白三葉葉片相對含水量,而75、100和150 μmol/L的SNP處理則與對照差異不顯著。不同濃度SNP處理下的EL如圖6B所示,除150 μmol/L外,其余濃度處理均顯著降低了PEG脅迫下的EL值,且在50 μmol/L時,EL值最小。綜合相對含水量的變化值,確定PEG滲透脅迫下白三葉的最適外源根施SNP濃度為50 μmol/L。
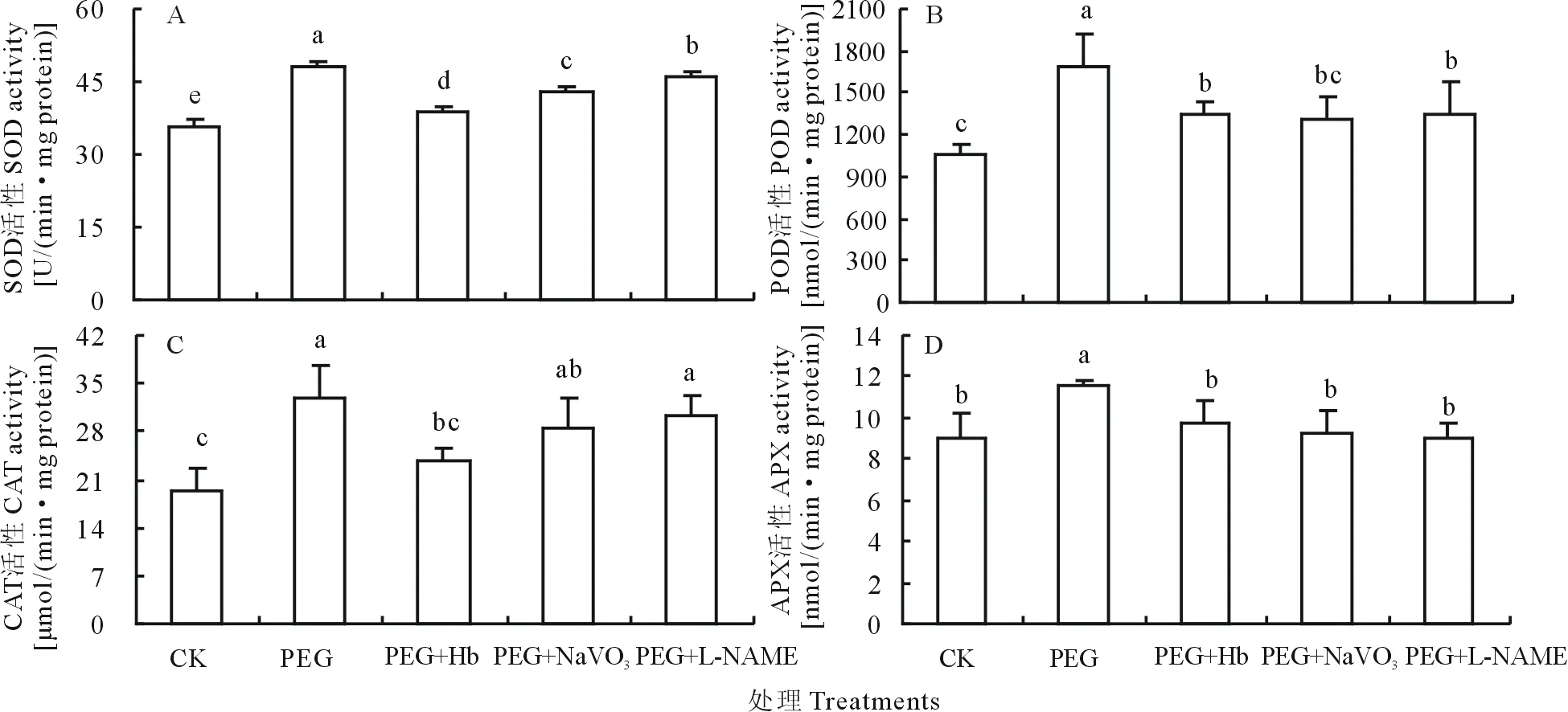
圖4 NO清除劑及產生抑制劑對PEG誘導的抗氧化酶活性的影響Fig.4 Effects of NO scavenger and inhibitor on antioxidative enzyme activities of white clover leaves under PEG stress
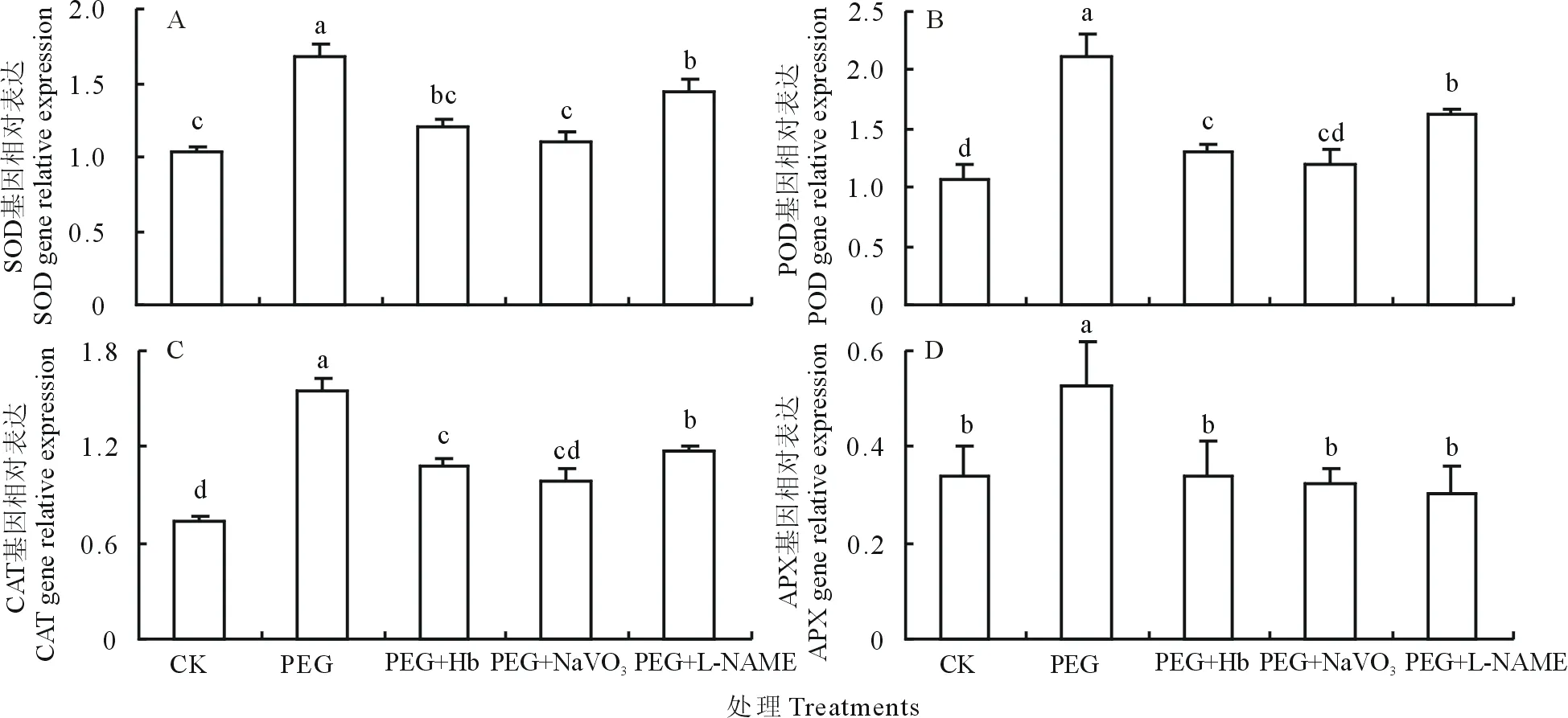
圖5 NO清除劑及產生抑制劑對PEG誘導的抗氧化酶基因表達的影響Fig.5 Effects of NO scavenger and inhibitor on antioxidative enzyme gene expression of white clover leaves under PEG stress
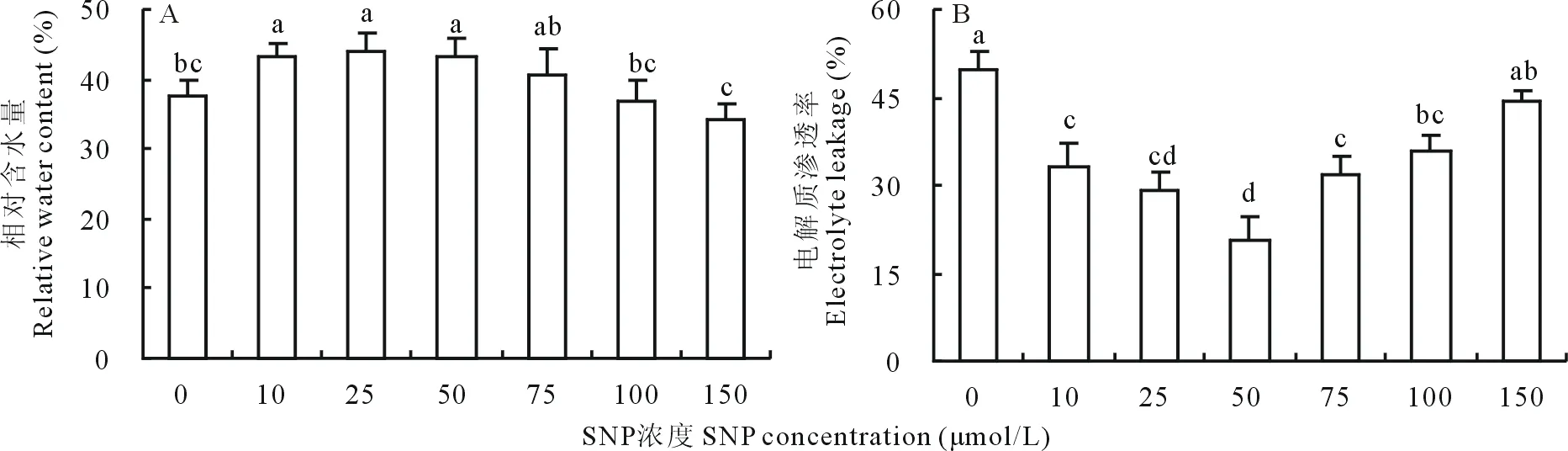
圖6 不同濃度SNP處理對PEG滲透脅迫下白三葉葉片RWC及EL的影響Fig.6 Effects of different concentrations of SNP on RWC and EL in white clover leaves under PEG stress
2.5 SNP對PEG滲透脅迫下白三葉葉片抗氧化酶活性的影響
與CK相比,正常水分條件下根施SNP處理,測試期間白三葉葉片的4種抗氧化酶活性均處于較穩定狀態,無顯著變化。在PEG脅迫下,白三葉葉片SOD和APX酶活性隨時間延長而逐步升高,而PEG+SNP處理的SOD活性在脅迫的第8和16天顯著高于PEG處理,但對APX酶活性影響不明顯(圖7A、D)。PEG脅迫使白三葉葉片POD活性持續下降,在脅迫第8、12和16天,SNP+PEG處理的POD活性比PEG處理分別提高62.68%、27.61%、45.66%,兩處理間差異顯著(圖7B)。在整個PEG脅迫過程中,葉片CAT活性呈先升后降的趨勢,PEG+SNP處理對CAT活性具有一定的促進作用,但僅在脅迫第8天顯著高于直接PEG處理(圖7C)。
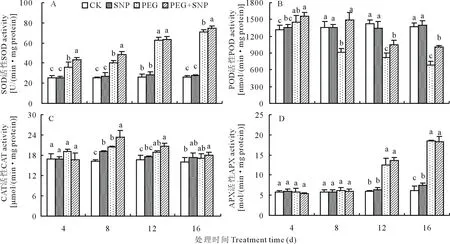
圖7 外源SNP對PEG滲透脅迫下白三葉葉片抗氧化酶活性的影響Fig.7 Effects of SNP on antioxidant enzyme activities of white clover leaves under PEG stress
2.6 SNP對PEG滲透脅迫下白三葉葉片RWC、EL和MDA含量的影響
如圖8A所示,在試驗期間,正常水分條件下SNP處理的白三葉葉片相對含水量與對照間無顯著差異,在PEG處理的第4天,白三葉葉片RWC明顯降低,并且隨著處理時間的延長持續下降,與PEG相比,PEG+SNP處理顯著減緩了RWC的下降趨勢,在處理的第4、8和12天時,葉片相對含水量比直接PEG脅迫分別高10.0%、21.2%和17.3%,兩處理間差異顯著。由圖
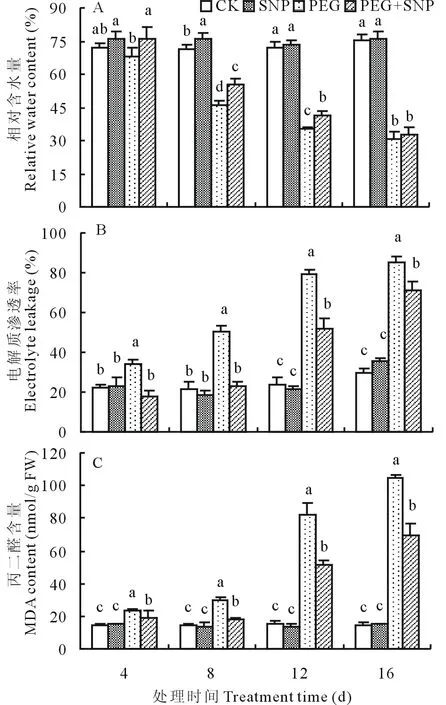
圖8 SNP對PEG滲透脅迫下白三葉葉片RWC、EL及MDA含量的影響Fig.8 Effects of SNP on RWC, EL and MDA content of white clover leaves under PEG stress
8B和圖8C可以看出,正常水分條件下根施SNP處理,在整個試驗期間白三葉葉片EL和MDA含量均處于穩定狀態,與對照相比,均無顯著變化。與CK相比,在PEG處理的第4天,白三葉葉片EL和MDA含量明顯升高,并且隨著處理時間的延長持續上升。脅迫的第4、8、12和16天, 與CK相比,PEG處理的EL分別提高了55.1%、135.9%、229.5%、189.5%,MDA含量分別提高了63.99%、110.92%、444.53%、614.12%,差異均顯著,表明葉片細胞的細胞膜過氧化和受傷害隨滲透脅迫時間延長而不斷加劇。而PEG+SNP處理的葉片EL和MDA含量均比直接PEG脅迫顯著降低,說明外源SNP處理對PEG滲透脅迫所造成的傷害具有明顯的緩解作用。
3 討論
3.1 內源NO參與調控抗氧化酶活性及其基因表達
前人研究表明,植物在逆境脅迫下可誘導NO產生,NO的合成有利于植物抵抗干旱脅迫所造成的傷害。本試驗也發現,PEG滲透脅迫可誘導白三葉離體葉片內源NO特殊熒光產生,并促進NO含量的升高,NO清除劑Hb及NR抑制劑NaVO3和NOS抑制劑L-NAME處理均能使白三葉葉片內源NO含量有所降低,表明滲透脅迫誘導NO的產生可能通過NR和NOS兩條途徑,這與Arasimowicz-Jelonek等[11]的研究結果類似。進一步研究顯示,滲透脅迫可誘導白三葉葉片抗氧化酶活性的提高及其基因的表達,而Hb,NaVO3和L-NAME可不同程度地逆轉滲透脅迫誘導的抗氧化酶活性及其基因表達。NO本身是一個活性氮中間體(RNS), 它對細胞要么起保護作用(抗氧化),要么毒害細胞(氧化強化劑),這取決于NO濃度[28-29]。滲透脅迫促進NO含量升高,對細胞造成過氧化傷害,從而誘導抗氧化酶活性及其基因表達;而Hb,NaVO3和L-NAME可抑制NO含量升高,避免細胞過氧化傷害,從而逆轉抗氧化酶活性及其基因表達。以上結果表明, NO信號參與了調控滲透脅迫下白三葉抗氧化酶基因的表達進而提高抗氧化酶活性,以促進白三葉的抗氧化防護能力。
3.2 外源SNP能有效緩解PEG脅迫傷害,且有濃度效應
SNP常被用作NO供體,且具有濃度效應[16,30]。本研究結果顯示,在滲透脅迫條件下,較低濃度SNP(10~50 μmol/L)可顯著增加白三葉葉片相對含水量,降低電解質滲透率,而高濃度SNP(100~150 μmol/L)處理則效果不明顯,甚至加重脅迫效應。表明SNP對滲透脅迫下白三葉的保護作用存在明顯的劑量效應,當SNP濃度為10~75 μmol/L時,發揮保護作用,而SNP濃度過高時(≥100 μmol/L),SNP釋放的過多NO可能對白三葉產生自由基毒害作用。García-Mata等[30]研究發現,外源NO預處理可以提高干旱脅迫條件下植物葉片的保水能力,降低EL及MDA含量,誘導氣孔關閉。本試驗結果顯示,PEG滲透脅迫使白三葉葉片相對含水量明顯降低,EL和MDA含量迅速升高, 50 μmol/L外源SNP可有效減緩PEG滲透脅迫下白三葉葉片EL和MDA含量,提高葉片相對含水量。研究表明,100 μmol/L外源SNP對干旱脅迫下小麥、高羊茅(Festucaarundinacea)葉片的緩解作用最強[31-32]。這可能是由于物種差異、PEG滲透脅迫與干旱脅迫區別造成。總而言之,適量外源SNP對提高白三葉抗滲透脅迫能力具有較好的效果。
3.3 不同抗氧化酶調節機制存在時間差異
非生物脅迫常導致植物細胞內活性氧(ROS)含量增加,引起膜系統氧化損傷,最終導致細胞死亡[33-36]。植物在長期的進化過程中,形成了一套完整的抗氧化脅迫防御系統,使其自身可以抵抗外界不良環境,使植物細胞內活性氧代謝處于動態平衡中,避免植物受到傷害[28-39]。例如SOD、POD 、CAT和APX作為植物體內常見的抗氧化保護酶,可以清除體內過多的ROS。本試驗結果顯示50 μmol/L外源SNP處理能不同程度提高持續滲透脅迫下白三葉葉片抗氧化酶活性,對POD的活性及其基因表達最為顯著。滲透脅迫4 d時,POD活性及其基因表達水平達到最大值,隨后持續降低,但50 μmol/L外源SNP仍能顯著提高POD活性及其基因表達。CAT活性及其基因表達水平在8 d達到最大值,而SOD、APX則持續升高,且50 μmol/L外源SNP對APX活性及其基因表達的影響不顯著。這可能是因為不同抗氧化酶在生理調節機制上存在時間上的差異,可以延長脅迫時間,做進一步研究。以上數據表明不同抗氧化酶在響應脅迫上協同作用,以提高滲透脅迫下白三葉幼苗抗氧化保護能力。
4 結論
PEG滲透脅迫可誘導白三葉離體葉片內源NO信號產生,并增強抗氧化酶活性及其基因表達,而NO清除劑及抑制劑能不同程度消除這種效應,所以可以推測NO信號參與滲透脅迫下白三葉葉片抗氧化酶活性及其基因表達的調控。外源添加NO供體SNP可提高滲透脅迫下白三葉葉片的抗氧化酶活性和相對含水量,降低EL和MDA含量,從而表明NO是白三葉響應滲透脅迫的重要信號分子,并可能通過調控氧化酶基因表達和提高抗氧化酶活性,以減輕滲透脅迫對白三葉幼苗的過氧化傷害。
References:
[1] Zhang Z B, Zhang J H. Water-saving agriculture: an urgent issue. Journal of Integrative Plant Biology, 2007, 49(10): 1409.
[2] Li Z, Peng Y, Shu X Y. Physiological responses of white clover by different leaf types associated with anti-oxidative enzyme protection and osmotic adjustment under drought stress. Acta Prataculturae Sinica, 2013, 22(2): 257-263. 李州, 彭燕, 蘇星源. 不同葉型白三葉抗氧化保護及滲透調節生理對干旱脅迫的響應. 草業學報, 2013, 22(2): 257-263.
[3] Jin Z M, Sha W. Study on drought resistance ofTrifoliumrepenslinn seedlings. Northern Horticulture, 2010, 18: 50-52. 金忠民, 沙偉. 白三葉抗旱生理的研究. 北方園藝, 2010, 18: 50-52.
[4] Mercer C F, Watson R N. Effects of nematicides and plant resistance on white clover performance and seasonal populations of nematodes parasitizing white clover in grazed pasture. The Journal of Nematology, 2007, 39: 298-304.
[5] Beligni M V, Lamattina L. Nitric oxide stimulates seed germination and deetiolation, and inhibits hypocotyls elongation, three light-inducible responses in plants. Planta, 2000, 210(2): 215-221.
[6] Zhang W L, Shen W B, Xu L L. Signal functions of nitric oxide in plants. Chemistry of Life, 2002, 22(1): 61-62. 張文利, 沈文飚, 徐朗萊. 一氧化氮在植物體內的信號分子作用. 生命的化學, 2002, 22(1): 61-62.
[7] Chandok M R, Ytterberg A J, Wijk van K J,etal. The pathogen-inducible nitric oxide synthase (iNOS) in plants is a variant of the protein of the glycine decarboxylase complex. Cell, 2003, 113(4): 469-482.
[8] Tu J, Shen W B, Xu L L. Regulation of nitric oxide on the aging process of wheat leaves. Acta Botanica Sinica, 2003, 45(9): 1055-1062. 屠潔, 沈文飚, 徐朗萊. 一氧化氮對小麥葉片老化過程的調節. 植物學報, 2003, 45(9): 1055-1062.
[9] Xiong J, Fu G F, Yang Y J,etal. Roles of nitric oxide in growth of plant root. Journal of Huazhong Agricultural University, 2011, 30(3): 375-383. 熊杰, 符冠富, 楊永杰, 等. 一氧化氮在植物根系生長發育過程中的作用研究進展. 華中農業大學學報, 2011, 30(3): 375-383.
[10] Qiao W H, Yang Q W. Nitric oxide synthesis in plant and responses to abiotic stress. Journal of China Agricultural University, 2009, 14(3): 1-6. 喬衛華, 楊慶文. 植物體內一氧化氮的合成及其對非生物脅迫響應的研究進展. 中國農業大學學報, 2009, 14(3): 1-6.
[11] Arasimowicz-Jelonek M, Floryszak-Wieczorek J, Kubis J. Interaction between polyamine and nitric oxide signaling in adaptive responses to drought in Cucumber. Journal of Plant Growth Regulation, 2009, 28(2): 177-186.
[12] Li J, Wu H M, Chen H P. Exogenous carbon monoxide and nitric oxide alleviate the oxidative damage in rice seed germination under drought stress. Acta Botanica Boreali-Occidentalia Sinica, 2011, 31(4): 731-738. 李江, 吳黃銘, 陳惠萍. 外源CO和NO對水稻種子萌發過程中干旱脅迫損傷的緩解效應. 西北植物學報, 2011, 31(4): 731-738.
[13] Sun L R, Hao F S, Lü J Z,etal. Effects of exogenous nitric oxide on growth and physiological characteristics of ryegrass seedlings under salt stress. Acta Ecologica Sinica, 2008, 11(28): 5714-5722. 孫立榮, 郝福順, 呂建洲, 等. 外源一氧化氮對鹽脅迫下黑麥草幼苗生長及生理特性的影響. 生態學報, 2008, 11(28): 5714-5722.
[14] Liu J X, Wang X, Wang R J,etal. Effects of exogenous nitric oxide donor sodium nitroprusside on alkali resistance ofLoliumperenneseedlings. Chinese Journal of Ecology, 2011, 30(10): 2173-2178. 劉建新, 王鑫, 王瑞娟, 等. 外源一氧化氮供體硝普鈉對黑麥草幼苗耐堿性的影響. 生態學雜志, 2011, 30(10): 2173-2178.
[15] Qiu Z B, Li J T, Guo J L. Effect of exogenous nitric oxide on seedling growth and physiological characteristics of wheat under drought stress. Journal of Anhui Agricultural Sciences, 2008, 36(17): 7095-7097. 邱宗波, 李金亭, 郭君麗. 外源一氧化氮對干旱脅迫小麥幼苗生長和生理特性的影響. 安徽農業科學, 2008, 36(17): 7095-7097.
[16] Wang F, Zhao Y J, Wang H N. Regulation of membrane lipid preoxidation by nitric oxide in maize seedlings under drought stress. Agricultural Research in the Arid Areas, 2015, 33(5): 75-79. 王芳, 趙有軍, 王漢寧. 外源NO對干旱脅迫下玉米幼苗膜脂過氧化的調節效應. 干旱地區農業研究, 2015, 33(5): 75-79.
[17] Zhao C Y, Wang Y J, Liu H,etal. Research progress of nitric oxide signal transduction in plant. Food Research and Development, 2015, 36(22): 180-183. 趙朝宇, 王亞喆, 劉慧, 等. 植物一氧化氮信號轉導的研究進展. 食品研究與開發, 2015, 36(22): 180-183.
[18] Jian Z, Han H, Zhang T,etal. Mechano chemotransduction during cardiomyocyte contraction is mediated by localized nitric oxide signaling. Science Signaling, 2014, 317(7): 1-20.
[19] Corpas F J, Barroso J B, Carreras A,etal. Constitutive arginine-dependent nitric oxide synthase activity in different organs of pea seedlings during plant development. Planta, 2006, 224(2): 246-254.
[20] Liu G H, Liu Q, Hou L X. NO may function in the downsream of Ca2+in ethylene induced stomatal closure inViciafabaL. Journal of Molecular Cell Biology, 2009, 42(2): 145-147.
[21] Barrs H D, Weatherley P E. A re-examination of the relative turgidity techniques for estimating water deficits in leaves. Australian Journal of Biological Sciences, 1962, 15(3): 413-428.
[22] Blum A, Ebercon A. Cell membrane stability as a measure of drought and heat tolerance in wheat. Crop Science, 1981, 21(1): 43-47.
[23] Dhindsa R S, Dhindsa P P, Thorpe T A. Leaf senescence: correlated with increased leaves of membrane permeability and lipid peroxidation, and decreased levels of superoxide dismutase and catalase. Journal of Experimental Botany, 1981, 32(1): 93-101.
[24] Giannopolities C N, Ries S K. Superoxide dismutase: I. Occurrence in higher plants. Plant Physiology, 1977, 59(2): 309-314.
[25] Chance B, Meahly A C. Assay of catalase and peroxidase. Methods in Enzymology, 1955, 136(2): 764-775.
[26] Nakano Y, Asada K. Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts. Plant and Cell Physiology, 1981, 22(5): 867-880.
[27] Wang X J, Li Z, Peng Y. The antioxidant enzyme activities and gene expression induced by spermidine in leaves of white clover. Acta Prataculturae Sinica, 2015, 24(4): 140-147. 王曉娟, 李州, 彭燕. NO參與Spd誘導白三葉抗氧化酶活性及其基因表達. 草業學報, 2015, 24(4): 140-147.
[28] Beligni M, Lamattina L. Is nitric oxide toxic or protective. Trends in Plant Science, 1999, 4(8): 299-300.
[29] Li H P, Zhou Q P, Yan H B,etal. Effects of sodium nitroprusside on physiological characteristics of oat seedling under salt stress. Pratacultural Science, 2014, 31(9): 1739-1745. 李海萍, 周青平, 顏紅波, 等. 硝普鈉對燕麥幼苗苗期鹽脅迫緩解作用的生理機制. 草業科學, 2014, 31(9): 1739-1745.
[30] García-Mata C, Lamattina L. Nitric oxide induces stomatal closure and enhances the adaptive plant responses against drought stress. Plant Physiology, 2001, 126(3): 1196-1204.
[31] Li H, Zhao W C, Zhao H J,etal. Effects of exogenous nitric oxide donor sodium nitroprusside on ATPase activity and membrane lipid peroxidation in wheat (TriticumaestivumL. cv. ‘Luohan 6’) seedling leaves under drought stress. Plant Physiology Communication, 2009, 45(5): 455-458. 李慧, 趙文才, 趙會杰, 等. 外源一氧化氮供體硝普鈉對干旱脅迫下小麥幼苗葉中ATP酶活性和膜脂過氧化的影響. 植物生理學通訊, 2009, 45(5): 455-458.
[32] Hui Z L, Li Z L, Li C Z,etal. Influences of exogenous nitric oxide donor SNP on seed germination and seedling resistance physiology inFestucaarundinaceaunder PEG simulated drought stress. Acta Agriculturae Boreali-Sinica, 2013, 28(4): 86-92. 回振龍, 李自龍, 李朝周, 等. 外源NO供體SNP對PEG模擬干旱脅迫下高羊茅種子萌發及幼苗抗性生理的影響. 華北農學報, 2013, 28(4): 86-92.
[33] Asada K. The water-water cycle in chloroplasts: scavenging of active oxygens and dissipation of excess photons. Annual Review of Plant Physiology and Plant Molecular Biology, 1999, 50(4): 601-639.
[34] Reddy A R, Ramachandra R K, Chaitanya V,etal. Drought-induced responses of photosynthesis and antioxidant metabolism in higher plants. Journal of Plant Physiology, 2004, 161(11): 1189-1202.
[35] Sharma P, Jha A B, Dubey R S,etal. Reactive oxygen species, oxidative damage, and antioxidative defense mechanism in plants under stressful conditions. Journal of Botany, 2012, http: //dx.doi.org/10.1155/2012/217037.
[36] Ashraf M, Harris P J C. Photosynthesis under stressful environments: an overview. Photosynthetica, 2013, 51(2): 163-190.
[37] Foyer C H, Deascouveries P, Kunert K J. Protection against oxygen radicals: important defense mechanism studied in transgenic plants. Plant Cell and Environment, 1994, 17(5): 507-523.
[38] Moller I M, Jensen P E, Hansson A. Oxidative modifications to cellular components in plants. Annual Review of Plant Biology, 2007, 58(1): 459-481.
[39] Bian S M, Jiang Y W. Reactive oxygen species, antioxidant enzyme activities and gene expression patterns in leaves and roots of kentucky bluegrass in response to drought stress and recovery. Scientia Horticulturae, 2009, 120: 264-270.
Nitric oxide is involved in regulating antioxidant enzyme activity and expression of their encoding genes in white clover under PEG osmotic stress
WU Xing, WANG Xiao-Juan, PENG Yan*
CollegeofAnimalScienceandTechnology,SichuanAgriculturalUniversity,Chengdu611130,China
The aim of this study was to evaluate the role of endogenous nitric oxide (NO) in regulating antioxidant enzyme activity in white clover (Trifoliumrepenscv. Ladino) under osmotic stress. We investigated endogenous NO fluorescence, dynamic changes in NO content, antioxidant enzyme activity, and the transcript levels of genes encoding antioxidant enzymes in white clover treated with an NO scavenger or NO synthesis inhibitors, and also evaluated the mitigating effects of the exogenous NO donor, sodium nitroprusside (SNP). Leaves of white clover were subjected to osmotic stress (15% PEG-6000). Compared with the leaves in the control, those in the osmotic stress treatment showed higher NO-dependent fluorescence, increased NO content, enhanced activity of antioxidant enzymes, and higher transcript levels of genes encoding antioxidant enzymes. Under osmotic stress, bovine hemoglobin (Hb), sodium vanadate (NaVO3), and LNG-nitro-L-arginine methyl ester hydrochloride (L-NAME) inhibited the accumulation of NO, leading to inhibition of antioxidant enzyme activity and reduced transcript levels of their encoding genes. The NO donor SNP (50 μmol/L) significantly alleviated the decline in the relative water content (RWC), reduced electrolyte leakage, decreased malondialdehyde accumulation, and promoted antioxidant enzyme activities under osmotic stress. These results suggested that NO is an important signaling molecule in response to osmotic stress, and that it plays a role in regulating gene expression and antioxidant enzyme activity to reduce peroxidation injury in white clover.
white clover; osmotic stress; NO; fluorescence phenomenon; antioxidant enzyme; gene expression
10.11686/cyxb2016190
http://cyxb.lzu.edu.cn
2016-05-09;改回日期:2016-08-11
國家自然科學基金(31372371)和四川省支撐項目(2013NZ0013)資助。
吳星(1992-),女,四川南充人,在讀碩士。E-mail: wuxings2015@163.com*通信作者Corresponding author. E-mail: pengyanlee@163.com
吳星, 王曉娟, 彭燕. 一氧化氮參與調節PEG滲透脅迫下白三葉抗氧化酶活性及其基因表達. 草業學報, 2017, 26(4): 178-187.
WU Xing, WANG Xiao-Juan, PENG Yan. Nitric oxide is involved in regulating antioxidant enzyme activity and expression of their encoding genes in white clover under PEG osmotic stress. Acta Prataculturae Sinica, 2017, 26(4): 178-187.

