30026例參芪扶正注射液真實世界聯合用藥注冊登記研究
王連心+謝雁鳴+艾青華+馮倩
[摘要] 該文采取前瞻性、多中心、大樣本、注冊登記式研究方法,進行參芪扶正注射液上市后臨床應用真實世界聯合用藥特征分析,了解真實世界聯合用藥情況。注冊登記使用參芪扶正注射液患者共30 026例,合并用藥化學藥(57 436例次,占82.76%)多于中成藥(11 962例次,占17.24%),以抗酸藥物及抗潰瘍病藥物、營養劑、免疫增強劑等居多,根據關聯規則,2種合并用藥與抑制胃酸分泌和抗腫瘤密切相關;3種合并用藥與抑制胃酸分泌、止吐和抗腫瘤密切相關;4種合并用藥與抑制胃酸分泌、止吐、抗腫瘤、免疫增強密切相關,與說明書適應癥相符,為精準治療提供線索,也為臨床合理用藥奠定基礎。
[關鍵詞] 參芪扶正注射液;注冊登記;聯合用藥;關聯規則;真實世界
[Abstract] Prospective,multi-center,large-sample and registered design was used to analyze the drug combination features of Shenqi Fuzheng injection in the real world clinical application,and comprehend the drug combination in the real world. A total of 30 026 patients with the use of Shenqi Fuzheng injection were registered,where the chemical drugs were used for 57 436 times (accounting for 82.76%),and the Chinese patent medicines were used for 11 962 times (accounting for 17.24%),mainly including anti-acid drugs and anti-ulcer drugs,nutritional agent,immune enhancement agent,etc. According to the association rules,drug combinations of 2 drugs were closely related to inhibiting gastric acid secretion and anti-tumor;drug combinations of 3 drugs were closely related to inhibiting gastric acid secretion,antiemetic and anti tumor;drug combinations of 4 drugs were closely related to inhibiting gastric acid secretion,antiemetic,anti-tumor,and immune enhancement. The above results were consistent with the Instruction,providing clues for accurate treatment,and laying the foundation for clinical rational drug use.
[Key words] Shenqi Fuzheng injection;registration;drug complication;association rules;real world
doi:10.4268/cjcmm20162405
參芪扶正注射液[1](批準文號:國藥準字Z19990065)為麗珠醫藥集團有限公司利民制藥廠與北京中醫藥大學東直門醫院在1987年開始合作研究的具有自主知識產權的中藥新藥。采用我國傳統的扶正補氣中藥黨參、黃芪為原料,以現代高新技術提取分離出黃酮苷、皂苷等有效成分,配制成250 mL的大容量注射劑。其藥品說明書標識該藥具有益氣扶正的功效。用于肺脾氣虛引起的神疲乏力,少氣懶言,自汗眩暈;肺癌、胃癌見上述證候者的輔助治療。為了解參芪扶正注射液真實世界用藥情況,進行前瞻性、多中心、大樣本參芪扶正注射液上市后注冊登記研究[2-3]。從2013年1月到2015年3月,歷時近2年的時間,在全國35家醫院進行注冊登記,共登記30 026例使用參芪扶正注射液的患者。
1 材料與方法
1.1 研究設計
采用全院集中監測模式,注冊登記使用參芪扶正注射液的住院患者和門診患者;三級、二級醫院均作為注冊登記單位。
1.2 注冊登記機構
全國范圍內35家醫院參加注冊登記,北京中醫藥大學附屬東直門醫院、廣州醫科大學附屬腫瘤醫院為監測牽頭單位。
1.3 注冊登記對象
連續注冊登記使用參芪扶正注射液的患者,只要使用1次參芪扶正注射液即納入監測。
1.4 注冊登記變量
包括登記對象的性別、年齡、個人過敏史(過敏原和過敏表現)、家族過敏史等一般信息;以及監測對象的診斷信息,包括西醫診斷、中醫診斷、中醫辨證、合并疾病等;另外,包括患者的體溫、脈搏、呼吸、血壓等生命體征與合并用藥,還包括患者的用藥信息,如用藥天數、使用方式、注射期間輔助療法措施等根據指標性質進行描述。以及開始用藥時間、給藥途徑、劑量、療程、溶媒、室溫、滴速、濃度、注射持續時間、是否不同通路同時使用其他藥物、是否沖管、注射期間是否采取輔助措施等。
1.5 數據來源
所有監測數據來源于監測表和監測平臺。監測表需要監測者人工填寫。監測表數據在監測平臺上錄入,采用統一發放的用戶名與密碼,通過中藥上市后臨床再評價公共服務平臺(http://www.crpcm.com/),由數據管理員進行數據同步錄入,采用雙人雙錄模式進行差異校驗。
1.6 統計分析方法
1.6.1 描述分析 本研究應用SAS9.2統計軟件進行基于頻數與率的描述性分析。正態分布計量資料的描述基于均數、標準差、最小值、最大值,偏態分布計量資料的描述基于中位數、上四分位數和下四分位數、最小值、最大值。分類資料的描述基于頻數及百分比。
1.6.2 多元分析 應用SPSS Clementine 12.0進行關聯規則April規律分析。
2 結果
2.1 注冊登記完成情況
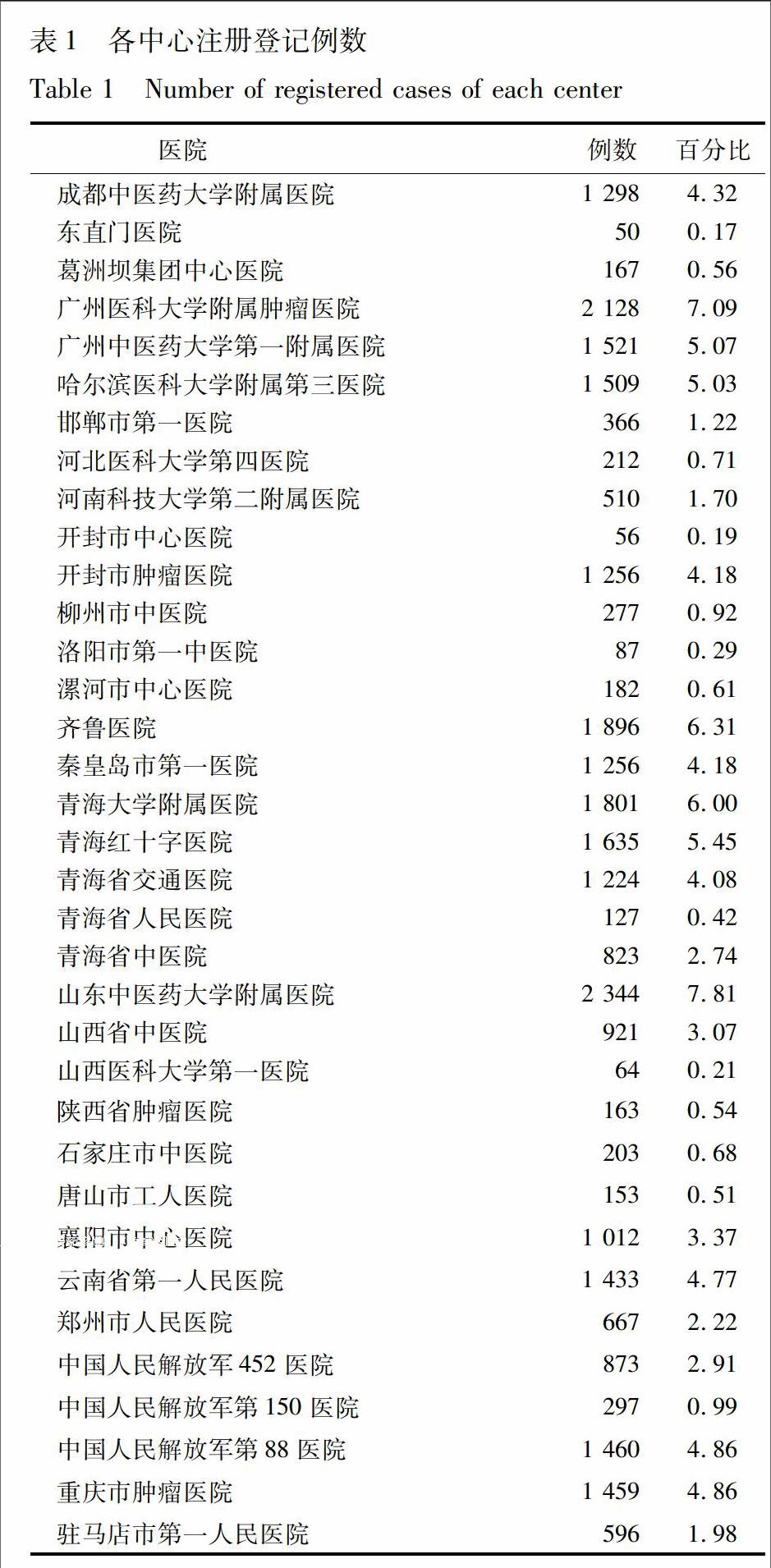
35家臨床分中心共完成30 026例使用參芪扶正注射液患者的注冊登記,見表1。
2.2 注冊登記患者一般信息
2.2.1 性別 注冊登記的30 026例使用參芪扶正注射液的患者,男性(15 136例,占50.41%)略多于女性(14 890例,占49.59%)。
2.2.2 年齡 46~65歲中年居多(14 747例,占49.11%),其次為66~80歲(6 906例,占23%),18~45歲(6 197例,20.64%),80歲以上(2 131例,7.1%),8歲以下(45例,0.15%)。
2.2.3 醫院類型 西醫醫院患者數量(22 502例,占74.94%)多于中醫醫院(7 524例,占25.06%);三級醫院患者數量(28 770例,占95.82%)多于二甲醫院(1 256例,占4.18%)。
2.2.4 診斷 西醫診斷:除參芪扶正注射液說明書適應癥(肺癌、胃癌)共7 306例次,占24.99%,也有用于治療說明書以外疾病,如治療其他消化器官惡性腫瘤(4 016例次,占13.74%)、乳房惡性腫瘤(3 367例次,占11.52%)、女性生殖器官惡性腫瘤(1 999例次,占6.84%)、內分泌、營養和代謝疾病(1 702例次,占5.82%)、循環系統疾病(1 322例次,占4.52%)、泌尿生殖系統疾病(1 258例次,占4.3%)、呼吸系統疾病(1 120例次,占3.83%)、淋巴、造血和相關組織的惡性腫瘤(1 041例次,占3.56%)等。
中醫證候:由于監測醫院多為西醫醫院,21 429例患者沒有中醫辨證,有中醫辨證的患者中,以虛證類(3 713例次,占44.11%)為主,另有肺證類(722例次,占8.58%)、脾證類(674例次,占8.01%)、血證類(589例次,占7.00%)、肝證類(582例次,占6.91%)、寒熱證類(483例次,占5.74%)、腎證類(421例次,占5.00%)、毒證類(204例次,占2.42%)、濕證類(162例次,占1.92%)、心證類(120例次,占1.43%)、痰證類(112例次,占1.33%)、風證類(92例次,占1.09%)、陰證類(82例次,占0.97%)、氣機不利證(69例次,占0.82%)、經絡證類(43例次,占0.51%)、邪侵證(38例次,占0.45%)、陽證類(20例次,占0.24%)、少陰證(8例次,占0.10%)、火證類(5例次,占0.06%)、少陽證類(2例次,占0.02%)。
2.2.5 合并疾病 注冊登記的30 026例使用參芪扶正注射液的患者中,合并疾病以循環系統疾病,消化系統疾病,內分泌,營養和代謝疾病為主,分別為9 619例次(占26.07%)、4 857例次(占13.16%)、4 506例次(占12.21%);另有呼吸系統疾病3 885例次(占10.53%),腫瘤3 605例次(占9.77%),泌尿生殖系統疾病3 020例次(占8.18%),血液及造血器官疾病和某些涉及免疫機制疾患1 561例次(占4.23%),肌肉骨骼系統和結締組織疾病1 281例次(占3.47%),某些傳染病和寄生蟲病1 180例次(占3.2%),損傷、中毒和外因的某些其他后果654例次(占1.77%),癥狀、體征和臨床與實驗室異常所見,不可歸類在他處者578例次(占1.57%),妊娠、分娩和產褥期514例次(占1.39%),神經系統疾病490例次(占1.33%),影響健康狀態和與保健機構接觸的因素362例次(占0.98%),眼及附器疾病191例次(占0.52%),皮膚和皮下組織疾病173例次(占0.47%),精神和行為障礙161例次(占0.44%),起源于圍產期的某些情況127例次(占0.34%),耳和乳突疾病75例次(占0.2%),先天畸形、變形和染色體異常57例次(占0.15%),疾病和死亡的外因1例次。
2.2.6 用法用量 參芪扶正注射液的用法絕大多數靜滴(30 025例,占99.99%),用量絕大多數為250 mL(29 865例,占99.46%);用藥天數以4~7 d居多(10 738例,占35.76%);29 750例患者有注射室溫記錄,276例患者注射室溫信息缺失,計算有注射室溫記錄者,平均在23.56 ℃;滴速平均在51.23滴/min;30 006例患者有注射持續時間記錄,20例患者注射持續時間信息缺失,計算有注射持續時間記錄者,平均在92.82 min。
2.2.7 合并用藥 除1 801例患者沒有合并用藥信息,全部合并用藥中化學藥(57 436例次,占82.76%)多于中成藥(11 962例次,占17.24%),以祛瘀劑、抗菌藥物居多;如抗酸藥物及抗潰瘍病藥物、營養劑、免疫增強劑;注射期間有237例(占0.79%)患者與其他藥物配制使用,以化學藥居多(190例次,占87.16%),如維生素類營養劑;共11 931例患者注射前連續使用其他注射劑,以化學藥居多(14 019例次,占75.59%),如抗酸藥物及抗潰瘍病藥物等;共15 817例患者注射后使用其他注射劑,以化學藥居多(15 199例次,占82.92%),如免疫增強劑等;共184例患者注射本藥物期間同時使用其他注射劑,以化學藥居多(183例次,占86.73%),如化療用藥等。
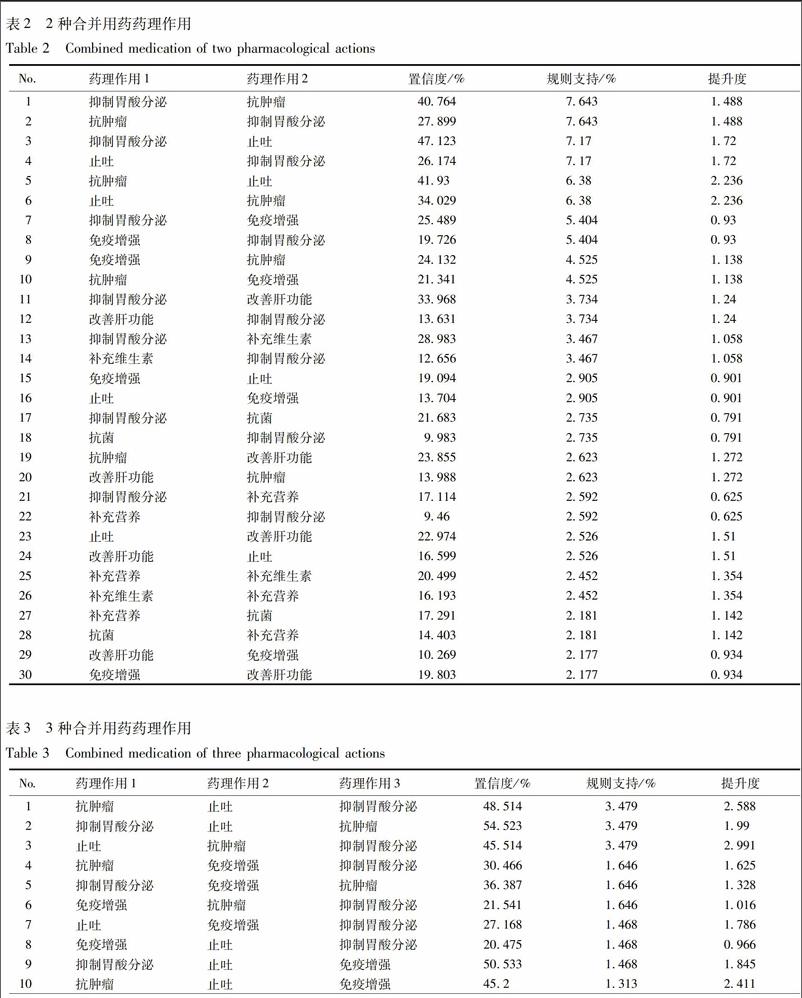
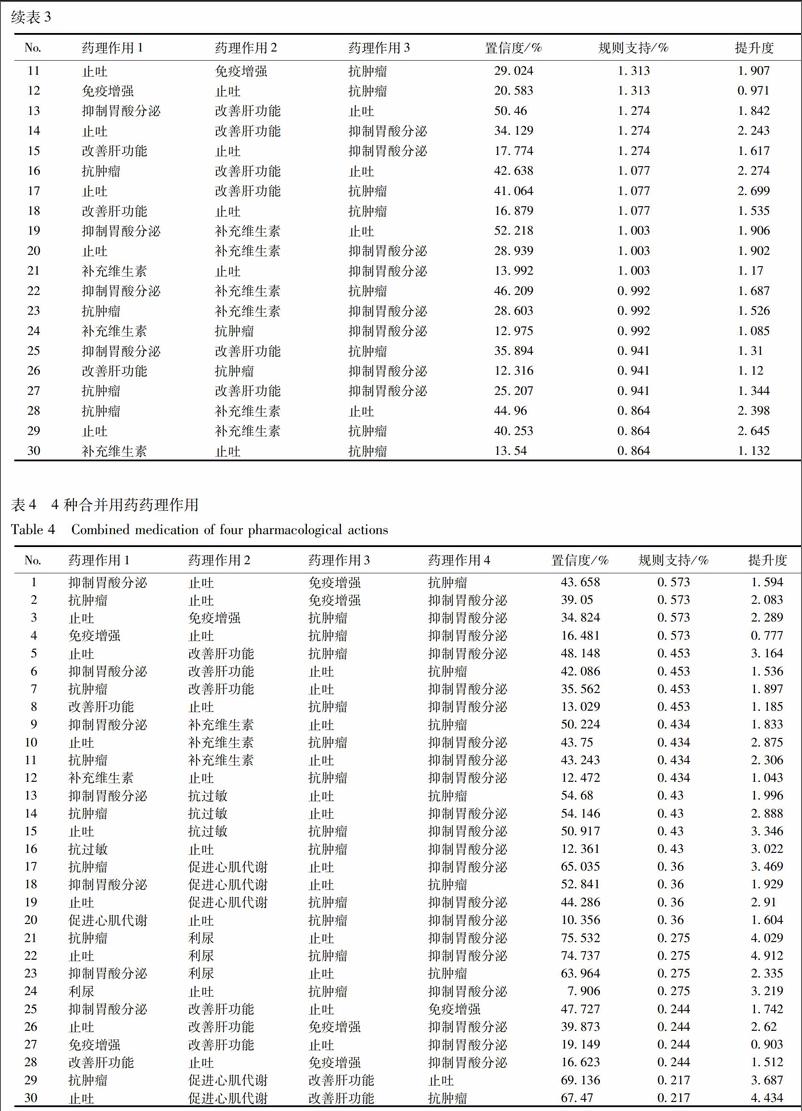
根據關聯規則,合并使用2種藥,以抑制胃酸分泌和抗腫瘤密切相關;合并使用3種藥,以抑制胃酸分泌、止吐和抗腫瘤密切相關;合并使用4種藥,以抑制胃酸分泌、止吐、抗腫瘤、免疫增強密切相關。
全部合并用藥藥理作用分析:包括全部合并用藥和注射參芪扶正注射液期間配制使用、同時使用、注射前后使用的所有藥物,見表2~5。
選取合并用藥藥理作用頻數前10(當第10種藥的頻數和排在它后面藥物的頻數剛好相同時,就會超過10種藥物)進行繪圖,可見參芪用藥人群常用合并用藥中最常見配伍為抗腫瘤與抑制胃酸分泌藥物、止吐與抑制胃酸分泌藥物,見圖1。
全部合并用藥名稱包括全部合并用藥和注射參芪扶正注射液期間配制使用、同時使用、注射前后使用的所有具體藥物,見表6~9。
選取合并用藥藥名頻數前10(當第10種藥的頻數和排在它后面藥物的頻數相同時,就會超過10種藥物)進行繪圖,可見參芪扶正注射液用藥人群常用合并用藥中最常見配伍為還原型谷胱甘肽與泮托拉唑、還原型谷胱甘肽與奧美拉唑,見圖2。
粗線.使用頻率7%以上;虛線. 使用頻率3.5%以下;細線. 使用頻率3.5%~7%。
粗線.使用頻率1%以上;虛線.使用頻度0.5%以下;細線. 使用頻度0.5%~1%。
3 討論
3.1 注冊登記研究設計特點
本研究采用真實世界前瞻性、多中心注冊登記研究。對中藥上市后臨床評價旨在進一步評價藥品對原有適應證的有效性,并發現新的適應病證,以進行精準定位,上市前研究往往局限于效力試驗,關注的是藥物能否在理想用藥環境下產生預期的治療效力;而效果試驗衡量的是藥物在真實臨床環境下帶給患者的受益程度。隨機對照試驗,特別是解釋性隨機對照試驗,往往只關注于治療措施的效力,無法提供藥品上市后在廣大人群中應用的臨床實踐數據。真實世界研究屬于效果研究的范疇,在研究人群選擇、樣本量大小、評價時間點和指標、數據收集和質量控制等方面具有自身的特點,根據患者實際的病情和意愿選用藥物或其他治療措施,而不是采用隨機的方法來安排對受試者的干預和用藥,可以探索真實世界基于大樣本量和廣泛用藥人群干預措施的外部有效性,進而指導臨床合理有效用藥。
3.2 參芪扶正注射液聯合用藥特點
注冊登記的使用參芪扶正注射液的30 026例患者中,合并用藥化學藥(57 436例次,占82.76%)多于中成藥(11 962例次,占17.24%),以抗酸藥物及抗潰瘍病藥物、營養劑、免疫增強劑等居多,根據關聯規則,2種合并用藥與抑制胃酸分泌和抗腫瘤密切相關;3種合并用藥與抑制胃酸分泌、止吐和抗腫瘤密切相關;4種合并用藥與抑制胃酸分泌、止吐、抗腫瘤、免疫增強密切相關,與說明書適應癥相符,為精準治療提供線索,也為臨床合理用藥奠定基礎。另外可見,中成藥與化學藥聯合應用在腫瘤等重大疾病中較為常見[4-5],將有助于提高臨床治療水平,讓群眾享受更便捷高效的醫療衛生服務,更好地服務民生;同時,對于中成藥與化學藥聯合應用的研究,有利于中成藥產品和中藥企業自我定位,立足合適的應用領域,為中藥產業深化發展提供方向,也為推動醫療資源公平提供依據。
[參考文獻]
[1] 王連心,謝雁鳴,艾青華,等.醫院集中監測嵌套巢式病例對照設計的30 026例參芪扶正注射液上市后臨床安全性研究[J].中國中藥雜志,2015,40(24):4739.
[2] 謝雁鳴,魏戌.中藥上市后安全性及有效性再評價臨床試驗設計要求[J].中國中藥雜志,2011,36(20):2768.
[3] 葉曉勤,楊偉,謝雁鳴,等.基于傾向性評分的中醫復雜干預臨床療效評價[J].中國中醫基礎醫學雜志,2012,8(2):1577.
[4] 謝雁鳴,王連心,王永炎.臨床聯合用藥機制研究的探討[J].中國中藥雜志,2014,39(18):3424.
[5] 王海燕,楊薇,謝雁鳴,等.胃惡性腫瘤患者常見合并疾病及中西藥物使用特征的實效研究[J].中國中藥雜志,2014,39(18):3424.
[責任編輯 曹陽陽]

