RNA干擾CXCR4基因對人惡性黑素瘤A375增殖和凋亡的影響*
王正想,馮世軍,張廣靜,張國強 ,劉思源
1.河北省滄州市中心醫院皮膚科(滄州061001),2.河北醫科大學第四醫院皮膚科(石家莊050010), 3.河北醫科大學第三醫院骨與軟組織腫瘤科(石家莊050010)
·基礎研究·
RNA干擾CXCR4基因對人惡性黑素瘤A375增殖和凋亡的影響*
王正想1,馮世軍1,張廣靜1,張國強2,劉思源3△
1.河北省滄州市中心醫院皮膚科(滄州061001),2.河北醫科大學第四醫院皮膚科(石家莊050010), 3.河北醫科大學第三醫院骨與軟組織腫瘤科(石家莊050010)
目的:觀察CXCR4基因沉默后人惡性黑素瘤A375細胞增殖及侵襲能力變化。方法:體外培養人惡性黑素瘤A375細胞,分為A、B、C 3組,分別為siRNA組,轉染空病毒載體的陰性對照組,細胞不做任何處理的空白對照組。轉染后1、3、5、7 d在倒置相差顯微鏡觀察A375細胞分化及形態,MTT比色分析法檢測對A375細胞增殖抑制的影響,采用流式細胞分析術,Anexin-ⅴ-PI雙染色檢測細胞早期凋亡的變化。轉染后7d采用RT-PCR檢測CXCR4 siRNA表達情況。結果:轉染后C組細胞出現不同程度的皺縮、破裂,漂浮細胞增多。轉染后1、3、5、7 d,A組OD值低于B、C組(P<0.05),A組早期凋亡率的變化與B、C組有統計學差異(P<0.05)。RT-PCR半定量分析結果顯示,A、B、C組CXCR4基因 mRNA校正值分別為(0.149±0.043),(0.215±0.030),(0.221±0.020),A 組與B、C組相比差異有統計學意義(P<0.05)。結論:CXCR4基因沉默后A375細胞增殖被抑制,早期凋亡增加,CXCR4基因成為惡性黑素瘤治療的新靶點。
惡性黑色素瘤(Malignant melanoma,MM)是起源于神經嵴的黑素細胞惡性腫瘤,發病率占皮膚惡性腫瘤的第三位[1-2](6.8%~20%),是皮膚科領域最常引起死亡的惡性腫瘤,其病死率占全部皮膚腫瘤的65%[3],且發病人數逐漸增多[4],惡性黑色素瘤的惡性程度高﹑發生轉移早,對放/化療均不敏感 ,目前轉移性黑素瘤的預后差,平均生存時間為6~9個月。近年來,認識到MM是一種異質性疾病,其形成與一些信號轉導途徑的異常相關,其中主要包括CKIT途徑、絲裂原活化蛋白激酶(MAPK)途徑、P13K-AKT等途徑中的多個基因,MM的分子靶向治療成為國內外研究的熱點。一些研究發現趨化因子受體4(Chemokin receptor 4,CXCR4)在包括黑素瘤在內的多種惡性腫瘤細胞中高表達,參與腫瘤侵襲和轉移的多個關鍵環節,基質細胞衍生因子-1(Stromal cell derived factor,SDF-1)與其特異性受體CXCR4所構成的SDF-1/CXCR4生物學軸在多種腫瘤播散、轉移過程中發揮重要作用。本實驗研究通過RNAi的方法沉默趨化因子受體4(Chemokin receptor 4,CXCR4)基因,抑制SDF-1/CXCR4信號通路中趨化因子受體4的表達對黑色素瘤侵襲和轉移的影響,從而在細胞水平抑制惡性黑色素瘤的生長增殖,為MM治療提供新的方法。
材料和方法
1 實驗細胞與材料 人黑色素瘤細胞株A375由河北醫科大學第四醫院科研中心提供,胎牛血清購自杭州四季青生物公司,四甲基偶氮唑藍(MTT)、DMEM(高糖型)培養基均購自美國GIBCO公司,腺病毒載體武漢晶賽生物公司合成,CO2恒溫培養箱(TC2323)購自美國Sheldon公司, RT-PCR酶混合物試劑盒(美國Fermentas公司)、二甲基亞楓(DMSO)北京化工廠。
2 細胞培養與分組 A375細胞常規復蘇后培養于含10%胎牛血清的DMEM培養液中(含濃度為100 μ/ml青霉素、鏈霉素,pH7.2~7.4),置于37℃﹑5% CO2的飽和濕度培養箱中常規傳代培養,3次傳代穩定后用于實驗。將細胞分為A、B、C 組。
3 CXCR4基因合成與轉染 培養4~6 h待細胞完全貼壁,小心吸出各孔培養液。各組均加入不含牛血清的培養基100 μl,A、B分別加入DMEM培養基/CXCR4 siRNA病毒載體復合體、DMEM培養基/病毒載體,C 組不做任何處理,感染時間為90 min,每15 min輕輕晃動培養液一次,以混勻。 90 min后移除含病毒的無血清培養液,加入含血清的常規培養液,放入37℃,5% CO2的培養箱中繼續培養。細胞培養1、3、5、7d時熒光顯微鏡下計算轉染效率(英光顯微鏡下細胞個數/光學微鏡下細胞個數),觀察細胞分化及形態學變化,消化回收細胞備用。
4 RT-PCR檢測三組CXCR4基因mRNA的表達 各組細胞常規培養1 d后,按TRIzol 試劑盒說明書步驟抽提A、B組和C組細胞的總RNA并利用逆轉錄試劑盒,通過RT-PCR生成cDNA,以cDNA作為模板,采用Real-time PCR檢測CXCR4 mRNA,RT-PCR引物設計: 引物由上海捷瑞生物技術服務有限公司負責合成和PAGE純化,用無菌去離子水稀釋,引物序下:上游序列 5-GAACTTCCTATGCAAGGCAGTCC-3,下游序列 5-CCATGATGTGCTGAAACTGGAAC-3。瓊脂糖凝膠電泳: 分別取5ulRT-PCR產物、Marker,在1.5%的瓊脂糖凝膠中,恒壓80V電泳30 min后,用凝膠成像系統觀察電泳結果,進行分析。
5 MTT比色法檢測沉默CRCX4基因后A375細胞的增殖影響情況 取對數生長期的A375細胞,制備單細胞懸液,進行細胞計數調整至1×104個細胞/200μl,分別接種到5個不同的96孔板中,每組接種6個復孔細胞培養過夜,按上述分組及轉染步驟進行轉染。轉染后蓋好蓋子,周邊貼膠布,在其上標明日期。放入37℃﹑5% CO2的培養。分別在轉染后第1、3、5、7天相同時相點時前4 h,每孔加入20 μl MTT(5 mg/ml),37℃﹑5% CO2飽和濕度條件下繼續培養4 h,4 h后棄上清液,每孔加入DMSO150 μl,避光條件下震蕩10~15 min,用全自動酶標儀于波長492nm處測定各孔光吸收值,所有試驗重復3次,記錄結果。
6 AnnexinⅤ與PI雙染,流式檢測轉染后不同時相的早期凋亡情況 取生長狀態良好的瓶裝細胞,胰蛋白酶消化,調整細胞密度為1×106/瓶,分到60不同個培養瓶中進行培養。待細胞培養過夜后,隨機分為A組、B組、C組,各組組又隨機分為1 d,3 d,5 d,7 d組,相當于1 d,3 d,5 d,7 d組每組5個標本,分組后按上述轉染步驟進行轉染,后繼續培養一天,收集1 d組細胞,PBS洗滌后250 μl結合緩沖液重新懸浮細胞,加入5 μlAnnexinⅤ/FITC,室溫下孵育避光15 min,加入10 μl的碘化柄錠(PI)溶液,再避光孵育15 min培養瓶,洗去多余抗體和PI,流式細胞儀(FACS)分析,APOI(凋亡細胞數/細胞計數總數)表示細胞凋亡情況,細胞培養3、5、7 d重復以上操作。
7 統計學方法 采用SPSS 19.0軟件進行分析,所有實驗至少重復3次,數據全部以均數±標準差表示,采用單因素方差分析。P<0.05 表示差異有統計學意義。
結 果
1 倒置相差顯微鏡觀察各組人黑色素瘤細胞A375形態 B、C組細胞生長狀態良好,有很強的貼壁能力,細胞膜完整光滑,呈單細胞層片狀生長。A組細貼壁能力差,有少數圓形細胞,部分細胞皺縮破裂,折光性差,較多懸浮細胞,貼壁細胞數量較B、C組減少,見圖1。
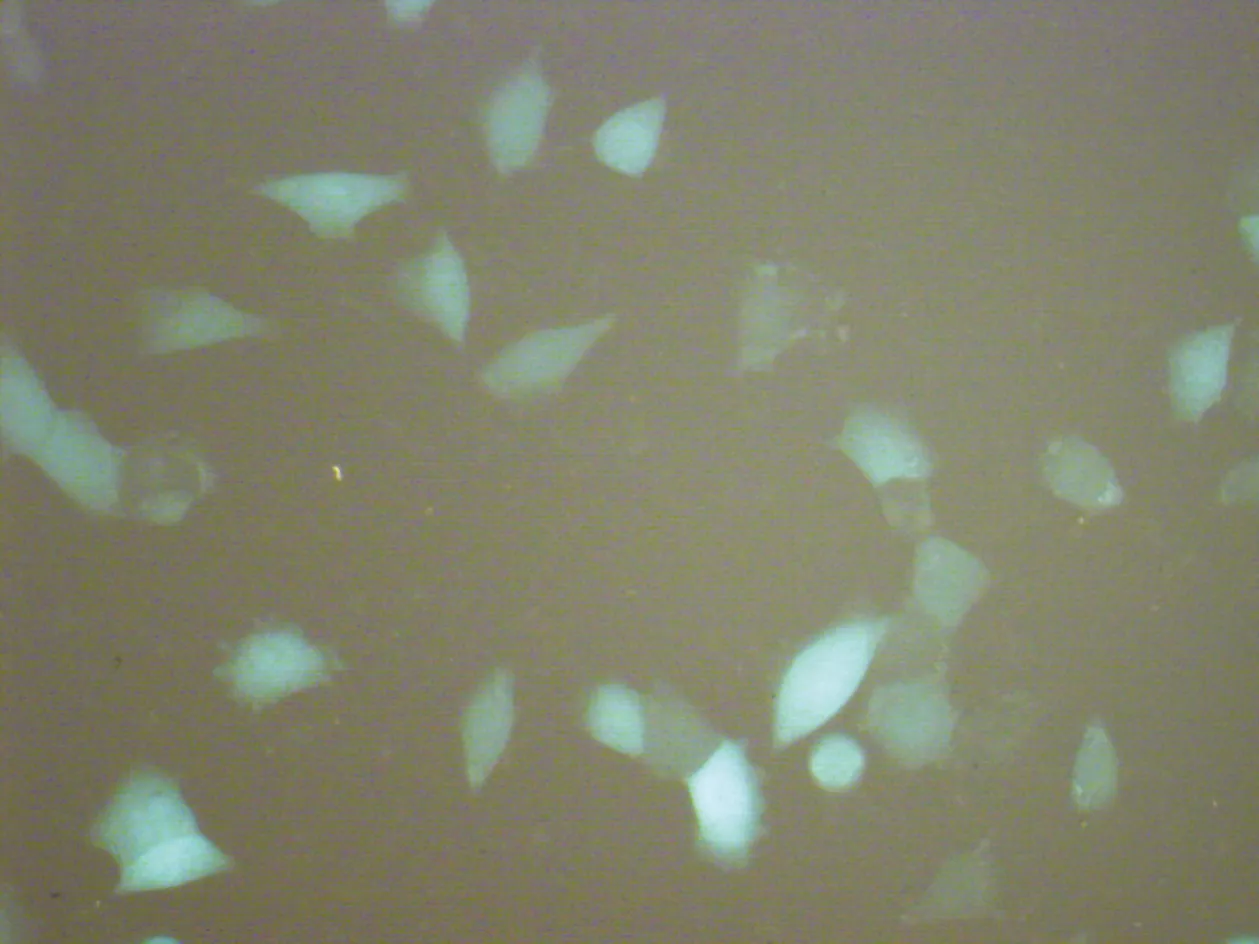
圖1 轉染后熒光顯微鏡下細胞形態 (HE染色×400)
2 轉染CRCX4基因對人惡性黑色素瘤細胞A375增殖抑制的影響 轉染CRCX4基因后應用MTT法檢測細胞生長抑制情況,統計分析結果表明,轉染后1、3、5、7 d, A組吸光光度值低于B、C組, A組與C組有顯著性差異(P<0.05),而B組與C組之間無顯著性差異(P>0.05),見表1。
表1 各組轉染后不同時間OD值比較(±s)
注:A組與 C、B組相比,P<0.05
3 轉染CRCX4基因后對人惡性黑色素瘤細胞A375早期凋亡的影響 AnnexinⅤ-PI雙染色流式細胞儀分析結果顯示轉染CXCR4基因后1、3、5、7 d, A組凋亡率吸光光度值高于于B、C組, A組與C組、B組有顯著性差異(P<0.05),而C組與B組之間無顯著性差異(P>0.05)。
4 RT-PCR方法檢測各組基因mRNA的表達情況 RT-PCR結果顯示:經轉染處理后7 d A、B、C組均在300bp處出現電泳條帶,但A組CRCX4基因轉錄水平明顯下降。RT-PCR半定量分析結果顯示,A組人黑色素瘤A375細胞CRCX4基因 mRNA校正值為(0.149±0.043),較B組(0.221±0.020)、C組(0.215±0.030)相比差異有統計學意義(P<0.05)。
討 論
隨著人們對惡性黑色素瘤分子生物學異常的逐步認識,分子靶向治療成為國內外腫瘤治療中的熱點,開辟了惡性黑色素瘤的新的治療途徑,是該病治療新的發展方向。
RNA干擾技術是人們研究基因調控的一種新的手段,Fire等在進行線蟲基因沉默的研究中將這種雙鏈RNA(ds-RNA)抑制基因表達的現象稱為RNA干擾(RNAi)。后來,大量科研人員一直致力于該項技術的改進與完善,現在在基礎醫學領域,已成為相對比較成熟的調控基因的手段,RNA干擾所采用的載體主要有多聚復合物、納米顆粒載體、病毒和細菌載體等,病毒載體又可分為逆轉錄病毒、腺病毒、腺相關病毒、和慢病毒[5]等。
目前研究報道[6]中與惡性黑色素瘤分子靶向治療有關的基因有Raf基因、Ras基因、c-Kit基因、nm23基因[7]等,CXCR4是最常見的趨化因子受體,表達包括卵巢癌,黑素瘤和前列腺癌等腫瘤,但在正常組織中不表達或表達水平很低,越來越多的研究表明,趨化因子受體CXCR4與腫瘤侵襲和轉移的多個關鍵環節有關,Kim等研究報道,CXCR4在人轉移性黑色素瘤高表達,并發現其CXCR4高表達則預后差,然而,CXCR4在黑色素瘤生長和轉移過程中具體機制研究尚不多,CXCR-4 通過各種信號通路調控人體的各項機能,而且各種信號通路間存在著緊密的聯系,有研究證實CXCR-4可以通過調控 ERK 及PI3K/AKT信號通路影響細胞周期及細胞的增殖 ,因此CXCR4趨化因子可能作為CXCL12的受體通過細胞外信號調節激酶(Extracellular signal-regulated kinase,ERK)信號轉導通路發揮促子黑素瘤細胞增殖和凋亡。本實驗采用腺病毒相關載體沉默CXCR4基因結果表明A375細胞的增殖受到抑制,流式細胞儀檢測細胞的凋亡率增加,沉默CXCR4基因誘導細胞凋亡的機制,目前尚未完全明確。但沉默CXCR4基因后可能通過ERK及MAPK信號轉導通路調控細胞增殖、分化,在瘤細胞分化、侵襲和轉移中起著重要的作用。沉默CXCR4基因誘導細胞凋亡的機制可能是CXCR4細胞質內,能夠使MEK1/2和ERK磷酸化,從而阻斷MAPK通路,進而誘導惡性黑色素瘤細胞株A375的早期凋亡。
[1] 饒國洲,石建峰,王欣欣.Survivin 和 Bcl-2基因靶向 siRNA 對舌癌 Tca-8113細胞生長抑制及誘導凋亡作用的影響[J].陜西醫學雜志,2015,44(2):140-143.
[2] 王玲艷,晉紅中.2014年皮膚惡性腫瘤發病機制研究進展[J].中華皮膚科雜志,2015,(48)11:822-825.
[3] Dzwierzynski W.Managing malignant melanoma[J].Plast Reeonstr Surg,2013,132(3):446e-4460e.
[4] Nikolaou V,Stratigos AJ.Emerging trends in the epidemiology of melanoma[J].Br J Dermatol,2014,170(1):11-19.
[5] 王 歡,馬志強,楊 峰.用于腫瘤治療的小分子干擾RNA非病毒載體研究進展[J].藥學實踐雜志,2015,(6):498-501.
[6] 高鳳琴,張麗莉. RNA干擾的研究進展[J].陜西醫學雜志,2008,37(6):738-739.
[7] 王希勝. 山仙顆粒對小鼠黑色素瘤肺轉移中nm23/NDPK水平的影響[J]. 陜西中醫,2006,27(2):244-245.
(收稿:2016-05-15)
Effection of A375 cells in proliferation and apoptosis after silencing CXCR4 gene
Wang Zhengxiang ,Feng Shijun ,Zhang Guangjing,et al.
Institute of Dermatology,The Center Hospital of Cangzhou(Cangzhou 061001)
Objective:To explore the proliferation and apoptosis of A375 cells after silencing CXCR4 gene. Methods:Human malignant melanoma A375 cells were cultivated and divided into groups A,B and C:siRNA group with adenovirus carrying RNA interference,negative group with vacant adenovirous vector,and control group without any infection.The differentiation and morphology of cells were observed by inverted microscope. 1, 3, 5, 7days after transfection,cells proliferation ability was determined by MTT,and apoptosis was detected by Annexin V-FITC/PI.The expressions of CXCR4 mRNA was detected by RT-PCR 7 days after transfection. Results:The cells proliferation ability of group A at 1, 3, 5 and 7days after transfection was lower than those in groups B and C(P<0.005).The expression of CXCR4 siRNA decreased in the A group than groups B and C .CXCR4 gene silenced by siRNA could inhibit the growth of A375 cell proliferation(P<0.05)and induce early cells apoptosis(P<0.05).Conclusion:The cells proliferation ability of A375 is inhibited and apoptosis is induced after silencing CXCR4 gene.
Melanoma Adenoviruses, Human @A375cell @CXCR4 Apoptosis
*國家自然科學基金資助項目(30440086)
黑色素瘤 腺病毒, 人 @A375細胞 @CXCR4 細胞凋亡
R739.5
A
10.3969/j.issn.1000-7377.2017.04.001
△通訊作者

