FGF8輔助牙源性上皮誘導hDPSCs分化為成牙本質細胞及牙髓細胞*
劉 皓, 姜建萍, 張娟娟, 潘智芳, 李孟杰, 梁 錚 , 趙翔宇, 孫 巖, 劉曉影△
(1濰坊醫學院生物科學與技術學院, 山東 濰坊 261053; 2濰坊市中醫院腦病康復科,山東 濰坊 261041; 3濰坊醫學院口腔教研室,山東 濰坊 261053)
·短篇論著·
FGF8輔助牙源性上皮誘導hDPSCs分化為成牙本質細胞及牙髓細胞*
劉 皓1, 姜建萍2, 張娟娟3, 潘智芳1, 李孟杰1, 梁 錚1, 趙翔宇1, 孫 巖3, 劉曉影1△
(1濰坊醫學院生物科學與技術學院, 山東 濰坊 261053;2濰坊市中醫院腦病康復科,山東 濰坊 261041;3濰坊醫學院口腔教研室,山東 濰坊 261053)
目的: 研究成纖維細胞生長因子8(FGF8)對成人牙髓干細胞(hDPSCs)定向分化為成牙本質細胞及牙髓組織的影響。方法: 首先分離、克隆培養hDPSCs,通過流式細胞術檢測細胞表面標志物鑒定hDPSCs;礦化液中添加50 μg/L的FGF8誘導hDPSCs分化,通過real-time PCR檢測分化后的細胞中牙本質涎磷蛋白(DSPP)、堿性磷酸酶(ALP)、骨涎蛋白(BSP)和核心結合因子α1(Cbfa-1)在mRNA水平的表達;E11.5小鼠牙源性上皮聯合FGF8與hDPSCs細胞團重組,再將組織塊種植于裸鼠腎囊膜下培養,通過DNA原位雜交鑒定成牙本質細胞及牙髓細胞的來源。結果: 成功分離培養hDPSCs,其表面標志物CD29和CD90呈陽性表達;經FGF8誘導的hDPSCs形成較明顯的礦化結節,并且牙本質特異性蛋白DSPP、BSP及Cbfa-1表達量上調;E11.5小鼠牙源性上皮聯合FGF8可以誘導hDPSCs分化為成牙本質細胞及牙髓細胞。結論: FGF8能夠輔助牙源性上皮定向誘導hDPSCs分化為成牙本質細胞及牙髓細胞,并形成牙本質及牙髓腔結構。
成纖維細胞生長因子8; 成人牙髓干細胞; 成牙本質細胞
成人牙髓干細胞(human postnatal dental pulp stem cells,hDPSCs)是從人恒牙牙髓中分離出來的具有克隆形成能力及快速分裂特征的成纖維樣干細胞[1]。牙髓干細胞能夠定向分化為成牙本質細胞、脂肪細胞及神經細胞[2-3], Tamaoki 等[4]把hDPSCs 成功地誘導為誘導性多能干細胞(induced pluripotent stem cells,iPSC)。成纖維細胞生長因子(fibroblast growth factor,FGF)參與胚胎生長發育、器官形成、腫瘤發生及轉移、組織損傷修復等過程[5-6],其家族成員FGF8在口腔上皮不表達時會導致磨牙缺失。目前關于FGF8對hDPSCs分化的影響尚無報道。因此,本研究在體外培養hDPSCs并進行定向誘導,在體內建立組織培養模型,初步研究FGF8對hDPSCs分化及形成牙齒結構的影響。
材 料 和 方 法
1 主要材料
裸鼠購自上海中科院實驗動物中心;成人第3磨牙由濰坊醫學院口腔醫院提供;α-MEM、胎牛血清、FGF8、 I型膠原酶、中性蛋白酶和鼠尾膠原蛋白(Gibco);維生素C、β-磷酸甘油鈉、地塞米松和茜素紅(Sigma);Alu及Pf1探針由上海生物工程有限公司合成;瓊脂糖微球(Bio-Rad);SYBR PrimeScript RT-PCR試劑盒(TaKaRa);CD29-FITC、CD90-FITC、CD34-FITC和CD45-PE(BioLegend)。
2 主要方法
2.1 分離培養hDPSCs 從濰坊醫學院口腔醫院獲得成人(20~30歲)智齒(第3磨牙),在無菌條件下,敲碎牙冠暴露牙髓,用手術刀將牙髓切成1 mm×1 mm×1 mm的小塊,用含有雙抗的PBS沖洗2~3遍;再用消化液(3 g/L I型膠原酶和4 g/L 中性蛋白酶)在37 ℃消化40 min;終止消化后吹打至單細胞懸液,接種于0.1 g/L鼠尾膠原蛋白預包被的培養皿中;37 ℃、5% CO2培養箱中培養48 h后換液繼續培養2~3 d,細胞成簇生長,呈現克隆狀,選取干細胞形態的克隆,利用套環法挑取單克隆,置于鼠尾膠原包被的48孔板中繼續培養。
2.2 通過流式細胞術檢測hDPSCs細胞表面標志物 0.25%胰蛋白酶消化第3代(P3) hDPSCs,1×PBS洗滌細胞3次,并吹打成細胞懸液。抗CD29、CD90和CD34的抗體為FITC標記,抗CD45抗體使用PE標記,將抗體分別加入細胞懸液,最終抗體被稀釋為1∶100,室溫避光孵育30 min后,再用PBS洗滌3遍。依照Beckman Coulter流式細胞儀的操作手冊,檢測細胞表面標志物CD29、CD90、CD34及CD45的表達。
2.3 礦化液誘導hDPSCs分化并檢測其礦化程度 將P3 的hDPSCs以1×107/L的密度接種于膠原蛋白預包被的3.5 cm2培養皿中,培養3 d后將培養液更換為可以誘導分化的礦化液(α-MEM,10% 胎牛血清,50 mg/L維生素C,10 mmol/L β-磷酸甘油鈉,10 nmol/L地塞米松),礦化誘導培養14 d后,終止培養,用冰冷的70%乙醇固定1 h,再用1 mL 40 mmol/L茜素紅(pH 4.1)染色10 min,進行鏡檢礦化結節。
2.4 Real-time PCR檢測牙本質涎磷蛋白(dentin sialophosphoprotein,DSPP)、堿性磷酸酶(alkaline phosphatase,ALP)、骨涎蛋白(bone sialoprotein, BSP)和核心結合因子α1(core-binding factor alpha 1,Cbfa-1)的mRNA表達 設計成牙本質細胞中礦化相關標志物 DSPP、ALP、BSP及Cbfa-1和內參照GAPDH的引物,以未經礦化液誘導分化、礦化液誘導分化14 d及含50 μg/L FGF8的礦化液誘導分化14 d的hDPSCs cDNA為模板,根據SYBR PrimeScript RT-PCR 試劑盒說明書,利用real-time PCR來鑒定hDPSCs分化程度,引物序列見表1。用2-ΔΔCt方法分析各基因的相對表達水平。

表1 引物序列
2.5 FGF8誘導重組嵌合體的制備及其體內種植培養 在無菌條件下,將瓊脂糖微球浸泡于100 μg/L的FGF8溶液中,37 ℃培養箱中孵育1 h,使其完全膨脹,以吸附牛血清白蛋白(bovine serum albumin,BSA)的瓊脂糖微球為對照。將浸泡過的瓊脂糖微球(4~6粒)均勻置于P4的hDPSCs細胞團塊邊緣,將在體視顯微鏡下分離獲得昆明小鼠胚胎11.5 d(E11.5)的牙上皮覆蓋其上。將重組嵌合體在器官培養皿內,用含10%胎牛血清的α-MEM培養液在37 ℃、5% CO2培養箱中培養過夜。再將重組嵌合體種植于裸鼠腎囊膜下進行體內培養6周。
2.6 DNA原位雜交 Alu和Pf1分別是人及小鼠基因組中特有的高度重復序列,均具有種屬特異性,因此地高辛標記的Alu和Pf1探針能夠特異性地分別檢測出人源及鼠源組織。Alu及Pf1探針由上海生物工程有限公司合成:用含有地高辛標記的dUTP,以PCR方法擴增特異性的Alu及Pf1探針(引物見表1),石蠟切片經脫蠟復水后,蛋白酶K(1 mg/L)37 ℃消化10 min,浸入0.2%甘氨酸5 min,4%多聚甲醛室溫下固定10 min,乙酸酐/三乙醇胺孵育10 min,每片加100 μL雜交液(含1 mg/L探針),95 ℃水浴鍋中變性10 min,Alu探針在37 ℃,Pf1探針在30 ℃下分別雜交過夜(16 h)。滴加封閉液,室溫放置20~30 min。加堿性磷酸酶標記的抗地高辛抗體稀釋液,室溫放置2 h。加NBT/BCIP顯色液,4 ℃避光顯色過夜。充分水洗,伊紅復染1 min,梯度乙醇脫水,二甲苯透明,樹膠封片。
3 統計學處理
本研究采用 SPSS 17.0 統計軟件對數據進行統計學分析。數據描述采用均數±標準差(mean±SD)形式表達,數據分析采用兩因素重復測量設計方差分析方法。各實驗組與其對應的對照組比較采用Dunnett-t檢驗方法。以P<0.05為差異具有統計學意義。
結 果
1 hDPSCs的分離培養及初步鑒定
套環法挑取單克隆培養2 d后在顯微鏡下可以觀察到長梭型的細胞分散生長,繼續培養6 d后可見生長為致密的長纖維狀。取克隆培養后的P3細胞經流式細胞術檢測表面標志物,結果顯示,作為骨髓及牙髓干細胞表面標志物的CD29及CD90呈陽性表達,陽性率分別為96.3%和94.5%;而造血干細胞特異性表面標志物CD34及粒系細胞的共同表面標志物CD45陽性率較低,見圖1。該檢測結果說明已經成功分離培養hDPSCs。
2 FGF8促進礦化液誘導hDPSCs分化為成牙本質細胞
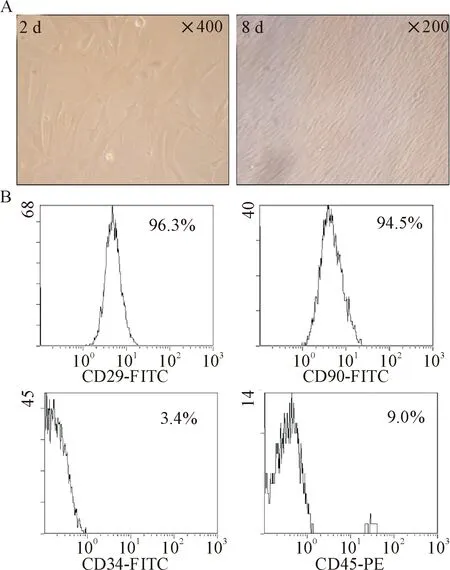
Figure 1.Isolation, culture and identification of hDPSCs. A: clonal culture of hDPSCs for 2 d and 8 d; B: the surface markers of hDPSCs were detected.
圖1 hDPSCs的分離培養及初步鑒定
用礦化液及含50 μg/L FGF8的礦化液培養hDPSCs,誘導分化14 d后細胞呈復層生長均有礦化結節出現,用茜素紅染色均顯示為陽性(圖2A中黑色箭頭所示),而FGF8組單個礦化節結面積較大,在一定程度上也反映了細胞礦化能力的增強,說明FGF8可增強hDPSCs的分化能力。
以未經礦化液誘導分化、礦化液誘導分化14 d及含50 μg/L FGF8的礦化液誘導分化14 d的hDPSCs cDNA為模板,利用real-time PCR來鑒定hDPSCs分化程度。結果顯示未經誘導的hDPSCs幾乎不表達牙本質特異性蛋白DSPP及BSP,經礦化液誘導以后DSPP、BSP、ALP及Cbfa-1的表達均有不同程度的上調,尤其是FGF8組中Cbfa-1的表達量明顯上調,見圖2B。該結果說明FGF8能夠促進hDPSCs向成牙本質細胞的分化。
3 FGF8輔助E11.5小鼠牙源性上皮定向誘導hDPSCs分化為成牙本質細胞及牙髓結構
FGF8聯合E11.5小鼠牙源性上皮與P4的hDPSCs進行重組,種植于裸鼠腎囊膜下培養6周后,取出組織塊,切片后分別進行Alu和Pf1的DNA原位雜交,對照組以BSA代替FGF8。結果FGF8組10例中有4例形成牙本質及牙髓結構,而對照組10例中均未形成牙齒結構。FGF8組具有牙齒結構發育的組織塊大而圓潤,而對照組未能形成牙齒結構的組織塊呈扁平骨基質狀。將組織塊切片后,經Alu和Pf1的DNA原位雜交結果顯示,FGF8組能夠形成的牙齒結構,成釉細胞核被Pf1探針識別染色為紫色,說明成釉細胞來源于鼠組織;成牙本質細胞及牙髓細胞核被Alu探針識別,說明這些細胞由人源組織(hDPSCs)發育而來。而對照組無牙齒結構出現,僅發現角化上皮及松骨質,見圖3。此結果提示FGF8可以輔助E11.5小鼠牙源性上皮定向誘導hDPSCs分化為成牙本質細胞及牙髓結構。
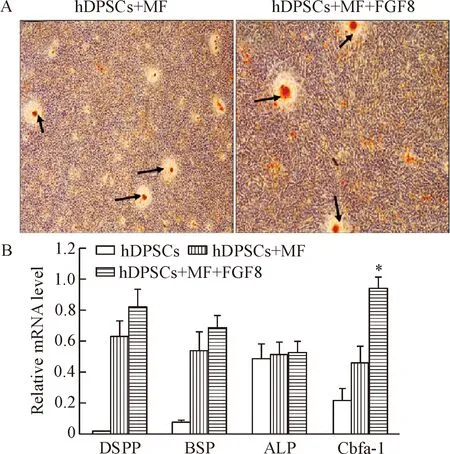
Figure 2.The effect of FGF8 on the differentiation of hDPSCs. The hDPSCs were cultured with the mineralization fluid (MF) and the MF containing 50 μg/L FGF8 for 14 d. A: alizarin red staining (×200); B: the mRNA expression levels of cell mineralization-related genes, DSPP, ALP, BSP and Cbfa-1, were detected by real-time PCR. Mean±SD.n=9.*P<0.05vshDPSCs+MF.
圖2 FGF8對hDPSCs分化能力的影響
討 論
hDPSCs是從人恒牙牙髓中分離出來的具有克隆形成能力及快速分裂特征的成纖維樣干細胞,此種細胞擁有比骨髓干細胞更強的克隆形成能力和分裂潛能,其在牙髓中的含量明顯高于骨髓中骨髓干細胞的含量[1]。大量研究已表明[2-3],牙髓干細胞能夠定向分化為成牙本質細胞,并且可以分泌DSPP、BSP等牙本質形成相關蛋白,但牙髓干細胞是否能參與形成牙齒結構目前尚無報道,所以這是一項值得研究的課題。
FGF8作為成纖維細胞生長因子家族成員,不僅參與胚胎發育、細胞生長、器官形成以及損傷修復等一系列重要的過程,還是牙齒發育過程中的一個重要因子[5-6]。在牙齒發生啟動之前,未來牙上皮就已經開始有強烈的FGF8表達并持續到蕾狀早期,FGF8可以誘導未來磨牙間充質中Barx1的表達[7-9]。然而,FGF8是否為指導性誘導成牙潛能的成份尚不明確,因為當口腔上皮不表達FGF8時,切牙可以形成,但會缺失包括磨牙在內的其它第一腮弓衍生物[10]。
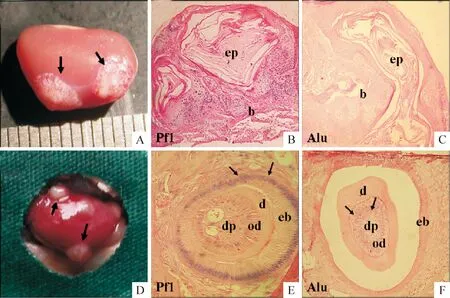
Figure 3.The effects of FGF8 on dental epithelium-induced directional differentiation of hDPSCs into odontoblasts and pulp tissue. A, D: the tissue of tooth structure in FGF8 group (D) and no teeth structure block in control group (A) under the renal capsule of nude mice were observed; B~C: DNAinsituhybridization in control group for Pf1 (B) and Alu (C); E~F: DNAinsituhybridization in FGF8 group for Pf1 (E) and Alu (F). ep: epithelial cells; b: loose bone; eb: the enamel cells; od: the dentin cells; d: dentin; dp: pulp tissue.
圖3 FGF8輔助小鼠牙源性上皮定向誘導hDPSCs分化為成牙本質細胞及牙髓結構
本研究主要觀察FGF8對hDPSCs分化的影響,是否有助于定向誘導hDPSCs分化為成牙本質細胞及牙髓結構。其研究結果對未來牙齒硬組織再生和牙齒損傷修復的研究都具有重要的意義。在本研究中,礦化液中添加50 μg/L的FGF8能夠促進hDPSCs礦化結節的形成,并且經定向誘導后細胞中DSPP、BSP及Cbfa-1表達量均明顯高于未添加FGF8組,DSPP作為牙本質特異性蛋白,也是分化成熟的牙本質細胞特異性的標記物;BSP為礦化組織細胞基質中的重要成分;Cbfa-1作為骨和牙齒發育過程中一個重要的轉錄因子,在牙齒發育的早期階段高表達,參與牙冠的形成和成牙本質細胞的分化。DSPP、BSP及Cbfa-1表達量的升高也反映了hDPSCs的分化程度,提示FGF8能夠促進hDPSCs向成牙本質細胞的分化。
為了進一步證實FGF8對hDPSCs分化的影響,本研究又實施了體內實驗,E11.5小鼠牙源性上皮聯合FGF8與hDPSCs細胞團重組,再將組織塊種植于裸鼠腎囊膜下繼續發育,模擬體內發育環境。結果發現FGF8組10例中有4例形成牙本質及牙髓結構,而對照組10例中均未形成牙齒結構。并通過DNA原位雜交技術確定牙本質細胞及牙髓細胞來源于hDPSCs。該結果說明FGF8作為影響hDPSCs分化的因素之一,可以輔助E11.5小鼠牙源性上皮定向誘導hDPSCs分化成牙本質細胞及牙髓結構。本研究結果與已有的文獻報道相一致,堿性成纖維生長因子 (basic fibroblast growth factor,bFGF)不僅僅誘導間充質干細胞分化[11],還可以誘導hDPSCs分化。Qian等[12]使用bFGF預處理hDPSCs 1周后再進行定向分化誘導,發現hDPSCs向成牙本質細胞分化能力上調;而Kikuchi等[13]用含有bFGF 的明膠凝膠控釋系統,對有牙本質缺損暴露的牙髓組織恒速釋放bFGF,發現牙本質樣顆粒的形成;He等[14]也證實了bFGF可顯著增加牙髓干細胞向成骨/成牙本質方向分化。本研究發現同樣作為成纖維生長因子家族成員之一的FGF8,不但能夠誘導hDPSCs向成牙本質細胞分化,還可以分化為牙髓樣細胞,形成完整的牙齒結構——牙本質及牙髓。
[1] Gronthos S, Mankani M, Brahim J, et al. Postnatal human dental pulp stem cells (DPSCs)invitroandinvivo[J]. Proc Natl Acad Sci U S A, 2000, 97(25):13625-13630.
[2] Gronthos S, Brahim J, Li W, et al. Stem cell properties of human dental pulp stem cells[J]. J Dent Res, 2002, 81(8):531-535.
[3] Liu MY, Sun Y, Liu Y, et al. Modulation of the differentiation of dental pulp stem cells by different concentrations of β-glycerophosphate[J]. Molecules, 2012, 17(2): 1219-1232.
[4] Tamaoki N, Takahashi K, Tanaka T, et al. Dental pulp cells for induced pluripotent stem cell banking[J]. J Dent Res, 2010, 89(8):773-778.
[5] St Amand TR, Zhang Y, Semina EV, et al. Antagonistic signals between BMP4 and FGF8 define the expression of Pitx1 and Pitx2 in mouse tooth forming anlage[J]. Dev Biol, 2000, 217(2):323-332.
[6] Porntaveetus T, Otsuka-Tanaka Y, Basson MA, et al. Expression of fibroblast growth factors (Fgfs) in murine tooth development[J]. J Anat, 2011, 218(5):534-543.
[7] Li CY, Prochazka J, Goodwin AF, et al. Fibroblast growth factor signaling in mammalian tooth development[J]. Odontology, 2014, 102(1):1-13.
[8] Li L, Yuan G, Liu C, et al. Exogenous fibroblast growth factor 8 rescues development of mouse diastemal vestigial toothexvivo[J]. Dev Dyn, 2011, 240(6):1344-1353.
[9] Liu C, Gu S, Sun C, et al. FGF signaling sustains the odontogenic fate of dental mesenchyme by suppressing β-catenin signaling[J]. Development, 2013, 140(21):4375-4385.
[10]Trumpp A, Depew MJ, Rubenstein JL, et al. Cre-mediated gene inactivation demonstrates that FGF8 is required for cell survival and patterning of the first branchial arch [J]. Genes Dev, 1999, 13(23):3136-3148.
[11]周志剛, 李志忠, 林永新, 等. 人臍帶間充質干細胞定向誘導分化成類神經元的實驗研究 [J]. 中國病理生理雜志, 2015, 31(2) :229-233.
[12]Qian J, Jiayuan W, Wenkai J, et al. Basic fibroblastic growth factor affects the osteogenic differentiation of dental pulp stem cells in a treatment-dependent manner [J]. Int Endod J, 2015, 48(7):690-700.
[13]Kikuchi N, Kitamura C, Morotomi T, et al. Formation of dentin-like particles in dentin defects above exposed pulp by controlled release of fibroblast growth factor 2 from gelatin hydrogels [J]. J Endod, 2007, 33(10):1198-1202.
[14]He H, Yu J, Liu Y, et al. Effects of FGF2 and TGFβ1on the differentiation of human dental pulp stem cellsinvitro[J]. Cell Biol Int, 2008, 32(7):827-834.
(責任編輯: 林白霜, 羅 森)
Role of fibroblast growth factor 8 in process of dental epithelium-induced directional differentiation of human postnatal dental pulp stem cells into odontoblasts and pulp cells
LIU Hao1, JIANG Jian-ping2, ZHANG Juan-juan3, PAN Zhi-fang1, LI Meng-jie1, LIANG Zheng1, ZHAO Xiang-yu1, SUN Yan3, LIU Xiao-ying1
(1InstituteofBiologicalScienceandTechnology,WeifangMedicalUniversity,Weifang261053,China;2DepartmentofEncephalopathyRehabilitation,WeifangHospitalofTraditionalChineseMedicine,Weifang261041,China;3DepartmentofStomatology,WeifangMedicalUniversity,Weifang261053,China.E-mail:xiaoying6690@163.com)
AIM: To study the effects of fibroblast growth factor 8 (FGF8) on directional differentiation of human dental pulp stem cells (hDPSCs) into odontoblasts and pulp tissue. METHODS: hDPSCs were isolated and cultured, and identified with flow cytometry by detecting cell surface markers of hDPSCs. FGF8 at concentration of 50 μg/L was added into the mineralization fluid to induce the differentiation of the hDPSCs. The mRNA expression of dentin sialophosphoprotein (DSPP), alkaline phosphatase (ALP), bone sialoprotein (BSP) and core-binding factor alpha 1 (Cbfa-1) in differentiated cells was detected by real-time PCR. FGF8 and mouse E11.5 dental epithelium formed restructuring cell group with hDPSCs, and then the restructuring cell group was transplanted under renal capsule membrane in nude mice for tissue culture. DNAinsituhybridization was used to identify the sources of odontoblasts and pulp cells. RESULTS: The surface markers of CD29 and CD90 showed positive in isolated hDPSCs. FGF8 induced hDPSCs to form a distinct mineralization nodule, and the expression of dentin-specific proteins, DSPP, BSP and Cbfa-1, was increased. hDPSCs were induced to differentiate into odontoblasts and pulp cells by E11.5 dental epithelium and FGF8. CONCLUSION: FGF8 can assist dental epithelium to induce directional differetiation of hDPSCs into odontoblasts and pulp cells, and formation of dentin and dental pulp cavity structure.
Fibroblast growth factor 8; Human postnatal dental pulp stem cells; Odontoblasts
1000- 4718(2017)04- 0730- 05
2016- 11- 11
2016- 12- 22
國家自然科學基金資助項目(No. 81441107);山東省自然科學基金資助項目(No. ZR2013HQ019);山東省高等學校科技計劃項目(No. J15LK09);濰坊醫學院大學生科技創新項目(No. KX2016002)
R363; R781
A
10.3969/j.issn.1000- 4718.2017.04.025
△通訊作者 Tel: 0536-8462053; E-mail: xiaoying6690@163.com

