泄濁解毒方對潰瘍性結腸炎大鼠血清IL-1β、IL-10及結腸黏膜CD14的影響*
河北省中醫院
劉建平 吳鶴伶△ 郎曉猛 康 欣 趙 源 要翠翠△△(石家莊 050011)
實 驗 研 究
泄濁解毒方對潰瘍性結腸炎大鼠血清IL-1β、IL-10及結腸黏膜CD14的影響*
河北省中醫院
劉建平 吳鶴伶△郎曉猛 康 欣 趙 源 要翠翠△△(石家莊 050011)
目的:通過動物實驗證實泄濁解毒方對潰瘍性結腸炎(UC)大鼠治療有效,并探討其可能作用機制。方法:將40只實驗大鼠隨機分為空白對照組、模型對照組、柳氮磺吡啶組、中藥高、低劑量組5組,除空白組外,其余4組均采用TNBS/乙醇聯合造模法制造UC模型。分組灌胃治療14 d后,分別檢測大鼠血清IL-1β、IL-10、結腸黏膜CD14含量。結果:模型組較空白組IL-1β、CD14表達明顯升高,IL-10表達明顯下降,差異有顯著性(P<0.05);中藥高、低劑量組、柳氮磺吡啶組較模型組IL-1β、CD14表達明顯下降,IL-10表達明顯升高,差異有顯著性(P<0.05);中藥高劑量組較柳氮磺吡啶組、中藥低劑量組IL-1β、CD14表達明顯下降,IL-10表達明顯升高,差異有顯著性(P<0.05)。結論:泄濁解毒方干預UC大鼠可降低血清IL-1β、升高血清IL-10、下調結腸黏膜CD14表達,這可能是其作用機制之一。
泄濁解毒方;潰瘍性結腸炎;腸澼;下利;小腸泄;IL-1β;IL-10;CD14;濁毒
潰瘍性結腸炎(UC) 流行于世界各地,好發于青年人,是一種慢性反復發作性、非特異性疾病,嚴重影響患者的生活質量,甚至可危及生命。[1]其病變范圍以直腸、乙狀結腸為主,甚者可達全結腸。現代醫學認為,UC的發病與遺傳、免疫、感染及環境等多種因素有關。白細胞介素-1β(IL-1β) 被認為是誘發UC的重要細胞因子之一,因為其可趨化炎性細胞進入結腸病變部位,從而引發小血管炎、上皮損傷、隱窩膿腫等炎癥反應。[2]IL-10可阻斷免疫炎性反應發生發展的多重環節,還可調節促炎細胞因子與抗炎細胞因子間平衡、穩定腸道黏膜內環境。白細胞分化抗原14 (CD14)是一種特異性巨噬細胞表面標志物,巨噬細胞在其與脂多糖(LPS) 結合后被激活,而后獲得多種增強活性,此過程在介導炎癥性腸病中發揮關鍵作用。[3]此次動物實驗證實,應用泄濁解毒方干預UC大鼠后療效顯著,為探討其可能機制,現報道如下。
1 材料與方法
1.1 實驗動物 本次實驗所用健康清潔級Wistar雄性大鼠40只,由河北醫科大學實驗動物中心供給,大鼠體質量220~250g,動物等級:一級,動物合格證號:1404052。
1.2 藥物與試劑 ⑴泄濁解毒方藥物組成:魚腥草、敗醬草各15g,車前子10g,紅藤15g,葛根、薏苡仁各20g,半夏9g,黃芩12g,黃連、木香各9g。由河北中醫學院附屬醫院中藥房提供。采用中藥顆粒配方,濃縮后所制得液體每毫升含生藥2.0g,4℃冰箱低溫保存備用;柳氮磺吡啶(SASP),250mg/片,按 0.3g/kg體質量灌胃給藥(相當于成人用藥量的10倍),由上海三維制藥有限公司生產,生產批號:200609C15。⑵主要試劑:三硝基苯磺酸(TNBS),東京化成工業株式會社生產;IL-1β放免試劑盒,北京北方生物技術研究所生產;IL-10酶聯免疫試劑盒,上海森雄科技實業有限公司生產;CD14抗bs-1192RBeujingBiosynthesisBiotechnologyCO.TTD。
1.3 實驗方法 將大鼠40只隨機分為空白對照組(BK)、模型對照組(MK)、柳氮磺吡啶組(LK)、中藥高劑量組(GK)、中藥低劑量組(DK),共5組,每組8只。參照相關文獻[4]建立UC大鼠模型。模型建立3d后開始灌胃治療:空白組常規飲食;模型組2mL生理鹽水灌胃;柳氮磺吡啶組SASP混懸液按0.3g/kg灌胃;中藥高劑量組、中藥低劑量組分別以中藥高劑量20.0g/kg、中藥低劑量10.0g/kg灌胃。各實驗組大鼠每日給藥1次,連續14d。
1.4 標本采集 各組大鼠持續給藥14d后,禁食不禁水24h,以水合氯醛注射麻醉,斷頭處死,取全血2~4mL,離心機3 000r/min離心10min,血清儲存至冰箱,溫度設定為-20℃。沿矢狀線正中分層解剖UC大鼠,截取肛門至回盲部結腸組織,選取病變最嚴重部位作為實驗標本。
1.5 指標檢測 用放射免疫法檢測IL-1β水平,酶聯免疫法檢測IL-10水平,免疫組化法檢測大鼠結腸黏膜CD14水平。各試劑操作使用時嚴格遵守試劑盒步驟。

2 結果
5組大鼠血清IL-1β、IL-10含量及大鼠結腸黏膜CD14表達情況比較,與空白組比較,模型組IL-1β、CD14表達明顯升高,IL-10表達明顯下降,差異有顯著性 (P<0.05);與模型組比較,中藥高、低劑量組、柳氮磺吡啶組IL-1β、CD14表達明顯下降,IL-10表達明顯升高,差異有顯著性 (P<0.05);與柳氮磺吡啶組、中藥低劑量組比較,中藥高劑量組IL-1β、CD14表達明顯下降,IL-10表達明顯升高,差異有顯著性(P<0.05);柳氮磺吡啶組與中藥低劑量組相比,差異均無顯著性(P>0.05) 。詳見表1。
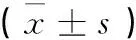

組別例數 IL-1β IL-10CD14空白對照組8 0.108±0.010*39.24±6.31*0.078±0.035*模型對照組8 0.205±0.00922.03±2.820.348±0.056中藥高劑量組8 0.133±0.010*37.60±2.55*0.162±0.042*中藥低劑量組8 0.167±0.016*▲△30.12±3.38*▲△0.246±0.047*▲△柳氮磺吡啶組8 0.169±0.009*▲28.98±3.90*▲0.236±0.043*▲
注:與模型組相比,*P<0.05;與高劑量組相比,▲P<0.05;與柳氮磺吡啶組相比, △P>0.05
3 討論
現代醫學認為,UC的發病與促炎細胞因子、抗炎細胞因子二者間平衡失調所導致的免疫異常關系甚密。[5]研究表明[6-7],IL-1β作為一種強烈的促炎細胞因子,一方面可促進炎癥細胞的活化與聚集,并通過自分泌或旁分泌來刺激相關細胞因子與炎癥遞質的產生,相互影響,誘發UC;另一方面血管內皮-白細胞黏附分子可因IL-1β而表達增強,促使炎細胞進入腸道,引發結腸上皮損傷、小血管炎、隱窩膿腫等破壞。IL-10是典型的抗炎與免疫抑制性細胞因子,發揮著重要的負向調節作用。主要包括通過抑制巨噬細胞、單核細胞、中性粒細胞等產生IL-1β、IL-6、TNF-α等促炎細胞因子和趨化因子,從而阻斷免疫調節、炎癥發生發展的多個環節。Hale研究發現[8],小鼠若缺失IL-10會發生自發性UC。
作為一種特異性巨噬細胞表面標志物,CD14可與LPS高度結合。LPS/脂多糖結合蛋白(LBP)復合物可與細胞膜上的CD14相互作用,CD14進一步參與Toll樣受體(TLR)/核因子-κB(NF-κB)通路,導致巨噬細胞激活,產生多種前炎癥因子,促使炎癥反應發生。有研究表明[9-10], 因為LBP/CD14的存在,極小量的LPS就可誘發炎癥因子釋放,而消除或拮抗LBP/CD14則可大幅度降低炎癥效應。
UC歸屬于中醫學中“腸澼”“下利”“小腸泄”等范疇,臨床上主要表現為腹痛、腹瀉、里急后重、黏液膿血便等,內鏡下可觀察到黏膜充血、水腫、糜爛、潰瘍等病理改變。我們提出“濁毒內蘊”的發病觀,其中“濁與濕同源,濕乃濁之源,濁乃濕之甚”,[11]濁為陰邪,易損傷陽氣,阻礙氣機,其與濕同類,性黏滯難祛;“毒與熱同源,熱乃毒之漸,毒乃熱之極”,[11]毒為陽邪,易損傷氣陰,耗氣傷津,毒邪入血入絡,則可導致瘡瘍。“濁”與“毒”二邪常常相兼為病,稱為“濁毒”之邪。濁毒聚集于腸道,損傷腸道脂膜血絡,出現血敗肉腐,并壅滯成膿;日久內聚不散化為瘀,影響腸道正常傳導功能,從而誘發UC。
在“濁毒致病”理論指導下,總結多年臨床實踐,篩選出經驗方“泄濁解毒方”。泄濁升清、解毒祛瘀為其治療大法。方中魚腥草、車前子合為君藥,奏清熱解毒,利濕化濁功效;敗醬草、紅藤、半夏、黃芩、黃連為臣藥,輔助君藥之時還有活血祛瘀止痛之效;葛根、薏苡仁為佐藥,奏健脾止瀉,升清降濁之功;木香引諸藥直達病變部位,為使藥。
魚腥草清熱解毒、消癰排膿,在《嶺南采藥錄》中記載:“煎服能去濕熱,治痢疾;魚腥草六錢……”藥理學研究證實魚腥草具有良好的抗炎作用,[12]魚腥草注射液可抑制血清中IL-1β的量,[13]其水提物可提高肌體的免疫力。[14]車前子清熱利尿、滲濕止瀉,《本草綱目》記載:“導小腸熱,止暑濕瀉痢。”現代研究證實從車前子中提取的多糖、黃酮及麥角甾苷等成分具有抗氧化作用,并可調節免疫、抑制炎癥、抗擊腫瘤。[15]二者共為君藥。 紅藤清熱解毒、活血止痛,是治療腸癰腹痛的要藥,《閩東本草》曰:“治心腹絞痛,赤白痢疾。”王氏[16]等經體外抗菌實驗表明紅藤制劑對大腸埃希菌、糞腸球菌、金黃色葡萄球菌的標準株、臨床株都有抑菌作用,對后兩者的作用尤為明顯。敗醬草清熱解毒、消癰排膿、祛瘀止痛,《本草綱目》錄“善排膿破血”,《本草會編》錄“明目,主諸痢”,臨床試驗發現,[17]一定劑量的黃花敗醬的根部甲醇提取物與氨基水楊酸比較,效果更為顯著。半夏燥濕化痰、消痞散結,《名醫別錄》曰:“消心腹胸膈痰熱滿結,咳嗽上氣,心下急痛堅痞,時氣嘔逆;消癰腫。”研究發現,半夏具有抗炎、抗腫瘤作用,[18]經典方半夏瀉心湯可使UC模型組CD4T淋巴細胞升高,CD8T淋巴細胞下降,使得CD4與CD8的比值與正常對照組比較顯著升高。[19]黃連、黃芩清熱燥濕、瀉火解毒,黃連被稱為“治痢要藥”,《神農本草經》記錄其“主熱氣目痛……腸澼腹痛下痢”;黃芩“主諸熱黃疸,腸澼,泄利,逐水,下血閉”。現代藥理研究表明,黃連中的多種成分均有抗菌作用,[20]黃連甲醇提取液具有抗炎、免疫調節作用,[21]小檗堿具有抗消化道潰瘍[22]、抗腫瘤作用[23]。黃芩提取物黃芩素對LPS誘導的炎癥反應有負向調節作用,提取物黃芩苷也具有一定的抗炎作用。[24]葛根升陽止瀉擅治脾虛泄瀉。《日華子本草》云:“……止血痢,通小腸,排膿破血。”葛根的主要活性成分之一葛根素具有抗脂質過氧化和驅除自由基的作用,葛根黃酮具有解痙、增強肌體免疫力作用。薏苡仁健脾止瀉、清熱排膿,《本草綱目》云:“薏苡仁,陽明藥也,能健脾益胃。”發揮抗菌抗炎作用,關鍵依賴薏苡仁內酯這一主要成分,[25]抗癌細胞增殖作用主要依賴薏苡仁甘油酯類。[26]木香行氣止痛,行大腸之氣使腸道氣機調暢,則大便通利,解除里急后重不適感。《日華子本草》載:“治心腹一切氣,止瀉,霍亂,痢疾,安胎,健脾消食。”孫氏[27]通過臨床觀察研究發現,香連丸(木香、黃連)可明顯上調活動期UC患者外周血及腸黏膜內自然殺傷T細胞(NKT)、γ干擾素(IFN-γ)和TNF-α的含量,提示對NKT的調節作用可能是其治療活動期UC的免疫機制之一。此外香連丸還具有抗菌、抗腹瀉、調節胃腸功能[28]等作用。
本實驗結果表明:UC大鼠血清IL-1β含量升高、血清IL-10含量降低、結腸黏膜CD14含量明顯升高,說明大鼠血清IL-1β、IL-10、黏膜CD14與UC發病密切相關。經泄濁解毒方干預后,UC大鼠血清IL-1β、結腸黏膜CD14含量明顯下降,血清IL-10含量明顯升高,說明泄濁解毒方可降低UC大鼠血清中IL-1β含量、升高IL-10含量,平衡了促炎因子與抗炎因子間的作用,減輕炎癥反應;同時通過對結腸黏膜中高表達的CD14產生下調作用,以抑制因LPS刺激導致的多種免疫活性細胞激活,減少炎性細胞的釋放,抑制炎癥反應。這可能是泄濁解毒方治療UC的作用機制之一。
[1]羅丹,仝戰旗. 中醫藥治療潰瘍性結腸炎的臨床研究進展[J]. 醫學綜述,2017,23(2):336-339
[2]李艷穎,陳津生.IL監測潰瘍性結腸炎病情變化的研究進展[J]. 天津醫科大學學報,2006(4):597-599
[3]吳思夢,徐德魁,鄭長青. 炎癥性腸病患者腸黏膜白細胞分化抗原-14的表達及意義[J].世界華人消化雜志,2009, 24:2 526-2 529
[4]吳小庚. 實驗性潰瘍性結腸炎大鼠模型的建立[J]. 河北醫藥, 2011, 33(4): 493-495
[5]Sanchez-MunozF,Dominguez-LopezA,Yamamoto-FurushoJK.Roleofcy-tokinesininflammatoryboweldisease.WorldJGastroenterol, 2008, 14 (27)4 280-4 288
[6]康靜靜,姚華偉,梁宏德,等.細胞因子在炎癥性腸病中的作用[J]. 中國細胞生物學學報,2011(2):204-209
[7]PopeRM,TschoppJ.Theroleofinterleukin-1andtheInflammasomeingout:implicationsfortherapy[J].ArthritisRheum, 2007, 56: 3 183-3 188
[8]HaleLP,GreerPK.Anovelmurinemodelofinflammatoryboweldiseaseandinflammation-associatedcoloncancerwithulcerativecolitislikefeatures[J].PLoSOne, 2012,7(7):e41 797
[9]TanakaK.ExpressionofToll-likereceptorsintheintestinalmucosaofpatientswithinflammatoryboweldisease[J].ExpertRevGastroenterolHe-patol, 2008(2): 193-196
[10]TanakaT,OkanobuH,KugaY,etal.Clinicalandendoscopicfeaturesofrespondersandnon-responderstoadsorptiveleucocytapheresis:areportbasedon120patientswithactivelcerativecolitis[J].GastroenterolClinBiol, 2010, 34: 687-695
[11]劉啟泉.慢性胃炎從濁毒論治[J].北京中醫藥大學學報,2010,33(3):153-155
[12]陳婧,方建國,吳方建,等. 魚腥草抗炎藥理作用機制的研究進展[J].中草藥,2014,42(2):284-289
[13]張美玉,李貽奎,閆位娟,等. 魚腥草注射液新制劑抗炎解熱作用及其機制研究 [J]. 中國新藥雜志,2010, 19(9):775-779
[14]DuSH,LiH,CuiYH.Houttuyniacordatainhibitslipopolysaccharideinduc-edrapidpulmonaryfibrosisbyup-regulatingIFN-γandinhibitingtheTGF-β1/Smadpathway[J].IntImmunopharmacol,2012, 13(3):331-340
[15]王芳,王敏. 車前子的新藥理作用及機制的研究進展[J].醫學綜述,2013,19(19):3 562-3 654
[16]王宇歆,李惠芬,周靜,等.大血藤有效部位含量測定及對腹腔感染細菌的抑制活性的研究[J]. 中成藥,2008, 30(8) :1 230-1 232
[17]Eu-jinCho,Ji-SunShin,Young-SuNoh,etal.Anti-inflammatoryeffectsofmethanolextractofPatriniascabiosaefoliainmicewithulcerativecolitis[J].Journalofethnopharmacology, 2011, 136(3):428-435
[18]龔道鋒,王甫成,紀東漢,等. 中藥半夏化學成分及其藥理、毒理活性研究進展[J]. 長江大學學報,2015,12(18):77-79
[19]宋小莉.半夏瀉心湯對潰瘍性結腸炎大鼠T細胞亞群CD4,CD8 的影響[J].微循環學雜志,2011,21(2):97
[20]LINNYC,LUJ,LIMLC,etal.Berberine-inducedhaemolysisrevisited:safetyofRhizomaCoptidisandCortexPhellodendninchronichaematologicaldiseases[J].PhytotherRcs,2012,26(5):682
[21]MABL,MAYM.,GAOCL.etal.LipopolysaccharideincreasedtheacutetoxicityoftheRhizomacoptidisextractinmicebyincreasingthesystemicexposuretoRhizomaCoptidisalkaloids[J].JEthnopharmaco1,2011.138(1):169
[22]鐘祥,李應東.小檗堿藥理作用研究進展[J].亞太傳統醫藥,2012,8(3):185-186
[23]SATOHK,FUKUMOTOY.SHIMOKAWAH.Rho-kinase:importantnewtherapeutictargetincardiovasculardiseases[J].AmJPhysi-HeartandCircPhysi, 2011,301(2):287
[24]FanGW,ZhangY,JiangX,etal.Anti-inflammatoryactivityofbaicaleininLPS-stimulatedRAW264.7macrophagesviaestrogenreceptorandNF-κBdependentpathways[J].Inflammation, 2013,36: 1 584-1 591
[25]金黎明,劉垠孜,趙曉蕾,等.薏苡仁有效成分研究進展[J].安徽農業科學,2011,39(10):5 734-5 750
[26]張明發,沈雅琴. 薏苡仁油抗消化系腫瘤的基礎和臨床研究[J].中國執業藥師,2011,8(8):19-23
[27]孫鶯.香連丸對活動期潰瘍性結腸炎患者自然殺傷T細胞功能的調節作用[J].長治醫學院學報,2013,27(4):244-246
[28]王晶,郝正一,劉仁慧. 黃連與木香的配伍研究進展[J]. 繼續醫學教育,2016,30(5):149-150
(2016-07-12 收稿)
Effect ofXiezhuoJieduFangon IL-1β and IL-10 in Serum and CD14 of UC Rats Hebei Hospital of Traditional Chinese Medicine
LIUJian-pingWUHe-lingLANGXiao-mengKANGXinZHAOYuanYAOCui-cui
(Shijiazhuang 050011)
Objective: to validate through animal experiments the effect ofXiezhuoJieduFangonUCratsandtoexploreitspossiblefunctionalmechanism.Methods: 40ratswererandomlydividedintocontrolgroup,modelgroup,sulfasalazinegroup,highdoseandlowdosegroupoftheChinesemedicine.Exceptcontrolgroup,therestfourwerepreparedintoUCmodelsbycombinedmethodofTNBSandalcohol,whichweretreatedwithintragastricadministrationfor14days,followedbydetectingthecontentsofIL-1βandIL-10andCD14.Results:comparedtocontrolgroup,IL-1βandCD14ofmodelgroupexpressionsincreased,andIL-10decreasedbothwithsignificantdifference(P<0.05);comparedtomodelgroup,IL-1βandCD14ofhigh,lowdosegroupsandsulfasalazinegroupdecreasedandIL-10increasedallwithsignificantdifference(P<0.05);comparedtolowdosegroupandsjlfasalazinegroup,IL-1βandCD14ofhighdosegroupdecreasedandIL-10increasedwithsignificantdifference(P<0.05).Conclusion:XiezhuoJieduFangcandecreaseserumIL-1βandCD14expressions,andincreaseIL-10,whichmightbeoneofthefunctionalmechanisms.
XiezhuoJieduFang;UC(ulcerativecolitis);dysentery;diarrhea;smallintestinaldiarrhea;IL-1β;IL-10;CD14;turbidtoxin
*河北省自然科學基金資助項目:No.H2014206462
郎曉猛,男,碩士,主治醫師。
R
A
1007-5615(2017)02-0001-04
△石家莊市中醫院(石家莊 050051)
△△河北醫科大學研究生學院(石家莊 050017)

