外源ABA和Ca2+對低溫及低溫恢復下赤霞珠幼苗蔗糖代謝的影響
姜寒玉,王旺田,雷天翔,何百,張金林
(1.甘肅農業大學生命科學技術學院, 甘肅 蘭州 730070; 2.中國科學院西北高原生物研究所, 青海 西寧 810008;3.甘肅紫軒酒業公司, 甘肅 嘉峪關 735100; 4.蘭州大學草地農業科技學院, 甘肅 蘭州 730020)
外源ABA和Ca2+對低溫及低溫恢復下赤霞珠幼苗蔗糖代謝的影響

(1.甘肅農業大學生命科學技術學院, 甘肅 蘭州 730070; 2.中國科學院西北高原生物研究所, 青海 西寧 810008;3.甘肅紫軒酒業公司, 甘肅 嘉峪關 735100; 4.蘭州大學草地農業科技學院, 甘肅 蘭州 730020)
為了明確外源ABA及Ca2+處理對低溫條件下釀酒葡萄蔗糖代謝的影響,以赤霞珠幼苗為試驗材料,研究了在不同濃度ABA和Ca2+條件下,5℃低溫及5℃低溫后25℃恢復(5℃和5℃/25℃)兩種條件下碳水化合物積累及蔗糖代謝關鍵酶活性的變化。結果表明:兩種處理條件下,隨著外源ABA和Ca2+濃度的逐漸升高,植株內蔗糖, 果糖, 葡萄糖和淀粉含量不斷增加,并且在5 mg·L-1ABA或15 mmol·L-1CaCl2濃度處理下植株內碳水化合物含量積累至最高,依次較對照增加了67.88%,21.8%,213.77%,7.04%,51.38%,2.35%,8.84%,31.81%或72.81%,35.37%,123.57%,36.44%,25.90%,28.67%,210.56%,210.90%。其中ABA處理后的葡萄糖含量在5℃/25℃條件下較5℃顯著增加。兩種處理條件下,外源ABA及CaCl2提高了赤霞珠幼苗蔗糖合成酶(SS),蔗糖磷酸合成酶(SPS),酸性轉化酶(AI),中性轉化酶(NI)活性,其中在5 mg·L-1ABA或15 mmol·L-1CaCl2處理下4種蔗糖代謝關鍵酶活性顯著增高,依次較對照提高了64.10%,125.00%,193.29%,756.31%,2 291.51%,1 569.31%,1 523.13%,1 336.77%或26.42%,20.38%,30.75%,58.30%,111.63%,14.14%,14.32%,66.39%。說明適宜濃度的ABA及Ca2+處理可增強蔗糖代謝酶活性,促進蔗糖轉化,提高碳水化合物含量,從而增強幼苗的抗寒能力。研究結果為釀酒葡萄糖代謝物質及相關酶在外源ABA及Ca2+處理下響應低溫機理提供理論依據。
釀酒葡萄;ABA;Ca2+;低溫;室溫恢復;蔗糖代謝
低溫影響植物生長, 發育和產量的形成,而低溫脅迫下植物能夠通過感知刺激和信號傳導,從而啟動各種防御機制來響應低溫[1]。ABA和Ca2+作為細胞的第二信使在植物的生長發育及對逆境的應答反應中具有重要的作用[2-5]。研究發現外源ABA能夠提高植株內源ABA的合成水平,誘導抗寒基因的表達及冷信號的傳遞,增強超氧化物歧化酶(SOD)和過氧化物酶(POD)等保護性酶的活性,增加可溶性糖和可溶性蛋白等滲透調節物質的含量,最終增強植物的抗冷性[6-7]。
Ca2+是植物生長發育的必需元素之一,是植物抗偶聯胞外信號與胞內生理反應的第二信使,在提高植物抗冷性上可能有兩方面作用,一是通過穩定細胞壁,細胞膜結構和提高保護酶活性以增強植物的抗冷力,二是通過傳遞低溫信息誘導抗冷基因的表達以提高植物的抗冷力[8-10]。
可溶性糖是一種重要的滲透調節物質,其在植物體內積累有利于植物抗冷性的提高,對適應低溫逆境起著重要的調節作用,可作為抗冷性的鑒定指標[11]。可溶性糖主要由果糖,蔗糖和葡萄糖組成,這些糖類物質在體內的轉換積累量與代謝相關酶的活性有關。而參與糖代謝的關鍵酶有轉化酶(酸性轉化酶AI和中性轉化酶NI),蔗糖合成酶(SS)及蔗糖磷酸合成酶(SPS)[12]。
葡萄是具有優良食用品質和釀酒特性的多年生藤本落葉果樹,其栽培面積和產量長期位居世界水果生產首位[13]。我國的釀酒葡萄產業近年來發展迅速,其中西北地區的釀酒葡萄種植面積逐年增加,但該地區的春冷和冬寒對葡萄生長造成嚴重傷害。如西北地區的釀酒葡萄主載品種赤霞珠抗寒性差,通常采用冬季下架埋土, 春季出土的越冬方式,費時費工。因此低溫已上升為影響西北地區葡萄產業迅速發展的瓶頸問題。目前,有關低溫條件下ABA和Ca2+對釀酒葡萄蔗糖代謝影響的研究尚未見報道。本研究以釀酒葡萄赤霞珠幼苗為材料,在低溫及室溫恢復條件下測定釀酒葡萄幼苗的蔗糖,果糖,葡萄糖,淀粉含量及SPS,SS,NI和AI的活性,探討低溫條件下外源ABA和Ca2+與釀酒葡萄蔗糖代謝的關系,旨在為ABA和Ca2+調控釀酒葡萄蔗糖代謝應答低溫的作用機制提供理論依據。
1 材料與方法
1.1 材料處理
將生長健壯的赤霞珠莖段接種在GS培養基上,待長至10 cm左右時,繼代接種于不同濃度ABA(1,2,5 mg·L-1)和CaCl2(5,15 mmol·L-1)的去Ca2+的GS培養基上,置于光照強度200 μmol·m-2·s-1,光照時數16 h/d的光照培養箱中。待長至5~6片葉時,分為兩種處理條件:5℃低溫處理24 h(低溫處理,5℃);5℃低溫處理24 h后25℃室溫恢復24 h(低溫恢復處理,5℃/25℃),分別測定幼苗可溶性糖含量及蔗糖代謝酶的活性變化。對照為培養基中不加ABA和CaCl2生長的赤霞珠幼苗,培養條件同前。每個處理3個重復,每個重復6株幼苗。
1.2 試驗方法
本研究測定了反映赤霞珠抗寒性的可溶性糖及蔗糖代謝關鍵酶活性等生理指標。蔗糖,葡萄糖,果糖含量的測定均參照蔡武成等的試驗方法[14],SS活性測定參照Douglas[15]和Tsai-Mei[16]的方法,SPS活性測定參照Wardlaw[17]和Yu[18]的方法,AI和NI活性測定參照Nielsen[19]的試驗方法,淀粉含量的測定選用碘顯色法[20]。
1.3 數據分析
采用SPSS 16.0等分析軟件處理實驗數據。
2 結果與分析
2.1 外源ABA對低溫及低溫恢復下赤霞珠幼苗可溶性糖含量的影響
對照植株的蔗糖,葡萄糖和果糖含量在5℃/25℃處理條件下較5℃分別增加了44.01%,208.87%和62.99%。在5℃低溫條件下,5 mg·L-1ABA處理較1 mg·L-1和2 mg·L-1ABA處理,植株內蔗糖含量顯著增加了64.79%和45.90%(圖1A),葡萄糖含量則顯著增加了147.90%和103.26%(圖1B),果糖含量顯著增加了59.32%和46.87%(圖1C)。此外,除果糖外,蔗糖和葡萄糖含量經ABA處理后較對照均顯著增加。

注:不同處理不同字母表示差異顯著(P<0.05)。下同。Note: Different treatments with the different letters mean significant difference by Duncan's test atP<0.05. The same as below.
圖1 不同濃度ABA對低溫及低溫恢復下赤霞珠幼苗可溶性糖含量的影響
Fig.1 Influence of soluble sugar contents on Cabernet sauvignon plantlet under low-temperature and low-temperature-recovery with different ABA concentrations
在5℃/25℃處理下,2 mg·L-1和5 mg·L-1ABA處理較1 mg/LABA處理蔗糖含量顯著增加,增幅分別為222.61%和244.15%(圖1A),葡萄糖含量則顯著增加了41.35%和76.88%(圖1B),果糖含量顯著增加了191.57%和200.99%(圖1C)。此外,三種可溶性糖含量經1 mg·L-1和2 mg·L-1ABA處理后較對照顯著降低,而在5 mg·L-1ABA處理下除葡萄糖外二者無顯著差異。
總體而言,赤霞珠植株在兩種處理條件下,蔗糖,果糖和葡萄糖均呈現一致的變化趨勢(圖1)。說明外源ABA的加入可以顯著提高低溫條件下赤霞珠幼苗內蔗糖,果糖和葡萄糖含量,而對低溫恢復條件下上述指標無顯著影響。
2.2 外源Ca2+對低溫及低溫恢復下赤霞珠幼苗各種糖含量的影響
對照植株在5℃/25℃處理下蔗糖,葡萄糖和果糖含量均增加,其含量分別增加了45.43%,182.62%和61.78%。5℃低溫條件下,5 mmol·L-1CaCl2處理蔗糖含量較對照有所降低,但15 mmol·L-1較5 mmol·L-1CaCl2處理蔗糖含量增加了155.22%(圖2A),差異顯著,而葡萄糖和果糖含量的變化相似,隨CaCl2濃度的增加而增加,15 mmol·L-1CaCl2處理和5 mmol·L-1CaCl2處理葡萄糖含量較對照增幅為123.58%和29.27%(圖2B),果糖含量較對照增幅分別為25.89%和8.72%(圖2C)。

圖2 外源CaCl2對低溫及恢復下赤霞珠幼苗各種糖含量的影響
Fig.2 Influence of soluble sugar contents of Cabernet sauvignon plantlet under low-temperature and low-temperature-recovery with different CaCl2concentrations
5℃/25℃條件下15 mmol·L-1CaCl2處理較5 mmol·L-1CaCl2處理蔗糖含量增幅為70.57%(圖2A),葡萄糖含量增幅為221.35%(圖2B),果糖含量增加154.10%,比對照增加28.67%(圖2C),但5 mmol·L-1CaCl2處理較對照蔗糖,葡萄糖,果糖含量均有所降低(圖2)。
綜上所述,高濃度CaCl2(15 mmol·L-1)處理后,可以顯著提高低溫及低溫恢復條件下赤霞珠幼苗枝條內葡萄糖和果糖含量,從而增強赤霞珠幼苗抗寒性。
2.3 外源ABA和Ca2+對低溫及低溫恢復下赤霞珠幼苗淀粉含量的影響
在ABA和Ca2+處理下,對照植株5℃/25℃條件下淀粉含量較5℃低溫處理顯著增加,增幅分別為153.45%和145.88%。5℃條件下,2 mg·L-1和5 mg·L-1ABA處理比1 mg·L-1ABA處理增加了126.53%和149.49%,但差異不顯著(P>0.05);5℃/25℃條件下,5 mg·L-1ABA處理比1 mg·L-1和2 mg·L-1ABA處理幼苗淀粉含量分別增加了345.98%和224.69%,差異顯著(P<0.05),但均低于對照(圖3A)。在不同CaCl2處理條件下,5℃及5℃/25℃條件下淀粉含量變化趨勢相同,隨著培養基中CaCl2濃度的增加植株淀粉含量增加,15 mmol·L-1CaCl2處理較對照淀粉含量分別增加了210.47%和211.05%,較對照均達顯著水平(P<0.05)(圖3B)。

圖3 外源ABA和CaCl2對低溫及低溫恢復下赤霞珠幼苗淀粉含量的影響
Fig.3 Influence of starch contents of Cabernet sauvignon plantlet under low-temperature and low-temperature-recovery in different ABA and CaCl2concentrations
2.4 外源ABA對低溫及低溫恢復下赤霞珠幼苗蔗糖代謝相關酶活性的影響
AI,NI,SS和SPS活性隨著ABA濃度的升高而升高,當ABA濃度達到5 mg·L-1時蔗糖代謝相關酶AI,NI,SS和SPS活性達到最大(圖4)。5℃處理下,對照植株較低溫恢復處理,NI活性顯著升高,增幅為182.11%(圖4B),AI活性在ABA為5 mg·L-1時較1 mg·L-1和2 mg·L-1分別增加30.61%和24.27%(圖4A),NI活性增加565.79%和353.13%(圖4B)。
5℃/25℃條件下AI活性較低溫條件下升高,升高幅度在7.65%~72.27%,1 mg·L-1ABA處理較對照差異不顯著,2 mg·L-1和5 mg·L-1ABA較1 mg·L-1ABA處理AI活性增幅為37.93%和109.02%(圖4A)。而在ABA低濃度時5℃/25℃條件下NI活性低于5℃而在ABA高濃度下高于5℃。在不同ABA濃度下5℃/25℃處理NI活性的變化與5℃低溫條件呈相同趨勢,5 mg·L-1ABA處理比1 mg·L-1和2 mg·L-1ABA處理的增幅分別為698.39%和300.04%(圖4B)。
SS活性在5℃/25℃條件下低于低溫條件,但均高于對照,特別是5 mg·L-1ABA處理后,兩種條件下SS活性顯著增加,分別高達蔗糖55.09 mg·g-1·h-1和44.13 mg·g-1·h-1FW,比對照增加了2 291.32%和1 569.06%(圖4C)。
5℃低溫和5℃/25℃兩種條件下,對照,1 mg·L-1和2 mg·L-1ABA處理間植株SPS活性變化均無顯著差異。但經5 mg·L-1ABA處理后,兩種條件下SPS活性顯著增加,分別高達蔗糖38.77 mg·g-1·h-1和35.54 mg·g-1·h-1FW,比對照增加了1 523.02%和1 336.70%(圖4D)。
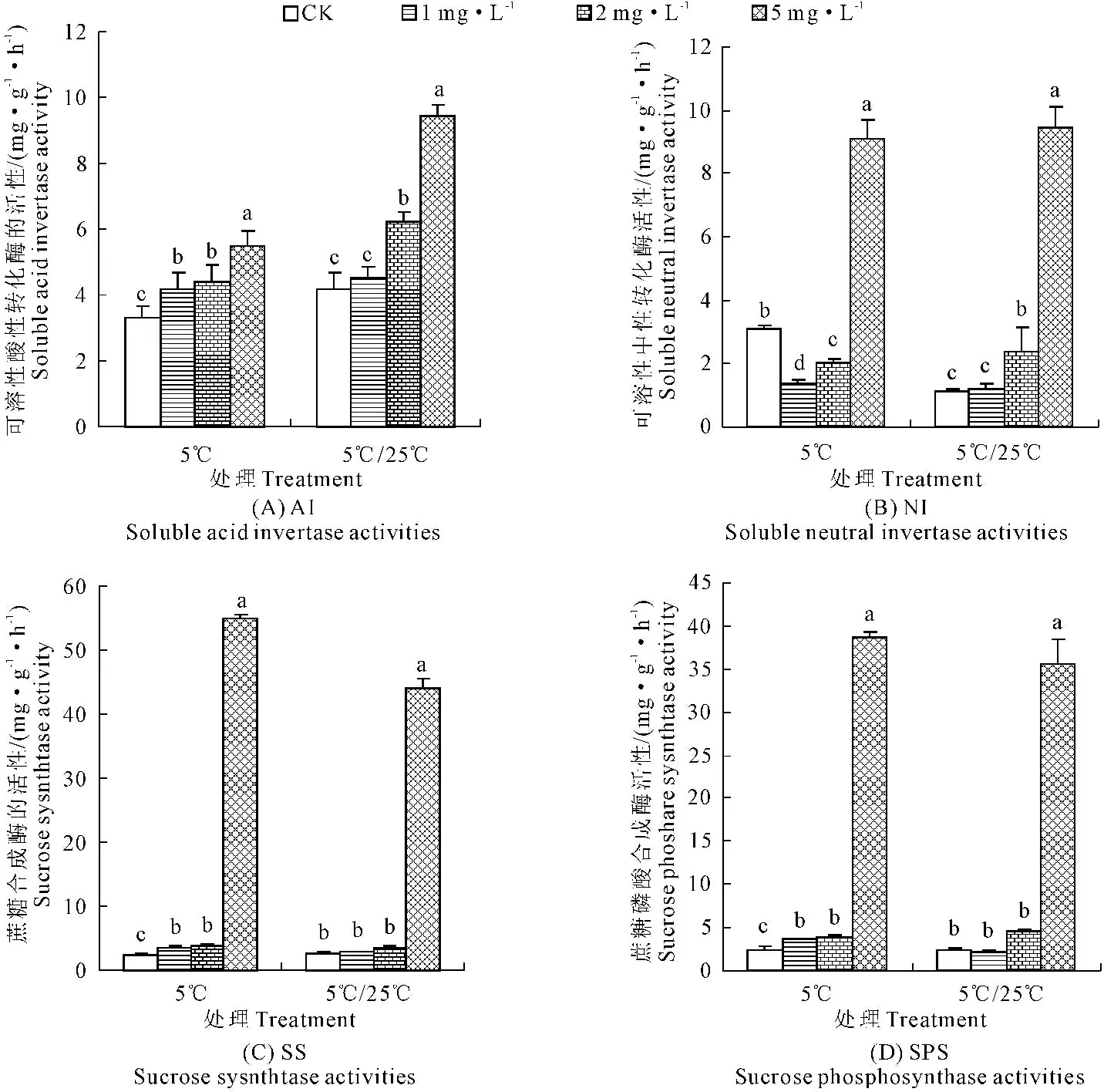
圖4 外源ABA對低溫及低溫恢復下赤霞珠幼苗蔗糖代謝相關酶活性的影響
Fig.4 Influence of the activities of sucrose metabolism enzymes in Cabernet sauvignon plantlet under low-temperature and low-temperature-recovery at different ABA concentrations
2.5 外源Ca2+對低溫及低溫恢復下赤霞珠幼苗蔗糖代謝相關酶活性的影響
對照植株在5℃/25℃處理比5℃低溫處理AI和SS活性分別增加了43.96%和36.93%,而NI和SPS活性降低,降低幅度分別為62.39%和8.75%。5℃處理下,隨著CaCl2濃度的升高,AI的活性增強,各處理間差異顯著,15 mmol·L-1CaCl2處理較對照AI活性增加了26.42%。5℃/25℃條件下,15 mmol·L-1CaCl2處理比對照AI活性增加了20.38%,但5 mmol·L-1較對照減少,差異顯著(圖5A)。
NI,SS和SPS活性在低溫及5℃/25℃條件下變化趨勢一致,NI,SS呈現先降后升趨勢,SPS活性則隨CaCl2濃度的不斷升高而增加(圖5B,C,D)。CaCl2濃度的升高顯著影響NI和SS活性的變化,5 mmol·L-1CaCl2處理均使NI和SS的活性較對照有所降低,而15 mmol·L-1CaCl2處理后,兩種條件下NI和SS活性顯著增加,較對照NI活性分別增加30.75%和58.3%,而SS活性分別增加111.63%和14.14%(圖5B,C)。但5℃低溫條件下SPS活性變化差異不顯著,而5℃/25℃條件下,5 mmol·L-1CaCl2和15 mmol·L-1CaCl2處理較對照SPS活性顯著增加,分別高達蔗糖2.747 mg·g-1·h-1和3.729 mg·g-1·h-1FW,比對照增加了22.58%和66.39%(圖5D)。
3 討 論
3.1 外源ABA和CaCl2對低溫及低溫恢復下赤霞珠幼苗各種糖和淀粉含量的影響
ABA在適應環境變化如低溫及其它脅迫響應中發揮主要作用[21-22]。Ca2+作為偶聯胞外信號與胞內生理反應的第二信使,具有調節植物細胞對低溫逆境反應和適應性的重要作用[23]。有研究探討茶樹葉片對低溫適應性反應時發現,一定濃度的外源ABA能夠提高葉片內可溶性糖的含量,從而增強其抗寒性[24]。此外在低溫脅迫下,50 μM和15 μM ABA處理能夠顯著提高黃瓜幼苗水蘇糖,棉籽糖和蔗糖的含量。本研究顯示,赤霞珠幼苗在5℃低溫條件下,隨著外源ABA和CaCl2濃度的逐漸升高,植株內蔗糖,果糖,葡萄糖含量均不斷增加,說明一定濃度的外源ABA和CaCl2促進了滲透調節物質蔗糖,果糖和葡萄糖的積累,提高了赤霞珠的抗冷性,同時在5 mg·L-1ABA或15 mmol·L-1CaCl2濃度處理下葡萄植株內糖含量積累至最高水平。

圖5 外源Ca2+對低溫及低溫恢復下赤霞珠幼苗蔗糖代謝相關酶活性的影響
Fig.5 Influence of sucrose metabolism enzyme activities of Cabernet sauvignon plantlet under low-temperature and low-temperature-recovery in different CaCl2concentrations
研究發現,低溫及恢復培養對番茄的光合作用和蔗糖代謝具有一定影響,其中淀粉,果糖,葡萄糖,蔗糖和總糖的含量顯著增加[25]。本研究在低溫恢復條件下,ABA或CaCl2作用下的蔗糖含量均低于低溫條件,說明在低溫恢復過程中,呼吸作用增強,有更多的蔗糖轉化為葡萄糖和果糖;而在高濃度的ABA或CaCl2處理下,淀粉,葡萄糖和果糖含量均高于低溫,說明ABA或CaCl2在低溫處理下糖含量的積累并未對恢復培養階段產生反饋抑制。表明外源ABA和CaCl2促進了低溫條件下蔗糖,果糖及葡萄糖的積累,對釀酒葡萄赤霞珠幼苗的抗寒性具有一定調控作用。本研究還發現,無外源激素處理的赤霞珠植株在低溫恢復條件下,淀粉,蔗糖,葡萄糖和果糖含量均高于低溫條件,說明低溫恢復過程中光合作用增強,促進糖分的積累及淀粉的合成。
3.2 外源ABA和CaCl2對低溫及低溫恢復下赤霞珠幼苗蔗糖代謝關鍵酶活性的影響
研究表明,短期夜間低溫會使番茄體內果糖和葡萄糖含量升高,酸性轉化酶和中性轉化酶的活性降低,蔗糖合成酶和蔗糖磷酸合成酶的活性增加,增加番茄果實內蔗糖的積累[26-27]。此外,高羊茅植株經過低溫鍛煉后,蔗糖含量急劇上升,莖基的蔗糖合成酶和蔗糖磷酸合成酶的活性則成倍提高[28]。而外源ABA和Ca2+也促進低溫條件下植株體內酶活性的變化,研究表明高濃度的ABA能夠提高瓜爾豆種子中酸性轉化酶,中性轉化酶,蔗糖合成酶,蔗糖磷酸合成酶的活性[29]。向體外培養1 d的玉米小苗的培養基中加入ABA后發現,1 h后根中液泡轉化酶活性增強,4 h后達到最高;2 h后在葉片中增強,8 h后達到最高。在擬南芥中,外源ABA促進了肌醇半乳糖苷酶l和2基因的表達[30]。在玉米中,外源ABA促進了蔗糖磷酸合成酶活性的提高[31]。外源Ca2+能夠明顯提高葡萄幼苗在低溫鍛煉期間莖和根中SOD及POD活性,降低MDA含量,減輕質膜的膜脂過氧化程度,提高幼苗抗寒性[32-33]。目前有關外源Ca2+對低溫下蔗糖代謝關鍵酶活性影響的研究鮮少報道。本研究發現,隨著外源ABA和CaCl2濃度的逐漸升高,赤霞珠幼苗植株酸性轉化酶,堿性轉化酶,蔗糖磷酸合成酶及蔗糖合成酶活性的變化趨勢一致,均表現出隨著ABA濃度的增加,蔗糖代謝相關酶活性有逐漸升高的趨勢,同時在5 mg·L-1ABA和15 mmol·L-1CaCl2處理下4種蔗糖代謝關鍵酶活性顯著提高,但ABA作用顯著高于CaCl2。且在5 mg·L-1ABA處理下4種蔗糖代謝相關酶較1 mg·L-1ABA時活性增加順序為:SPS>SS>NI>AI。而本研究表明ABA促進了各種糖含量的積累,說明外源ABA通過提高4種蔗糖代謝相關酶活性來促進糖的積累方面起作用,也說明外源ABA促進蔗糖積累的同時也促進了蔗糖的分解,但積累大于分解。而蔗糖代謝相關酶活性的提高促進了糖的積累,減少低溫對葡萄幼苗的傷害。綜上,外源ABA和Ca2+在低溫信號傳導和增強植物抵抗低溫方面發揮了積極的作用,適當施加外源ABA和Ca2+可以在一定程度上提高釀酒葡萄的抗冷性,研究結果也為后續探討釀酒葡萄Ca2+誘導抗寒性信號產生,信號轉導途徑等調控機理奠定研究基礎。
[1] 李素麗,李志剛,楊麗濤,等.低溫對不同冷敏感型甘蔗品種根系一些生理指標的影響[J].華南農業大學學報,2012,33(2):178-182.
[2] 劉慧麗,李 玲.脫落酸(ABA)誘導基因表達的調控元件[J].植物學通報,2001,18(3):276-282.
[3] McAinsh M R, Pittman J K. Shaping the calcium signature[J]. New Phytol,2009,181(2):275-294.
[4] DeFalco T A, Bender K W, Snedden W A. Breaking the code:Ca2+ sensors in plant signaling[J]. Biochem J, 2010,425:27-40.
[5] 黃杏,陳明輝,楊麗濤,等.低溫脅迫下外源ABA對甘蔗幼苗抗寒性及內源激素的影響[J].華中農業大學學報,2013,32(4):6-11.
[6] Liu J, Jiang M Y, Zhou Y F, et al. Production of polyamines is enhanced by endogenous abscisic acid in maize seedlings subjected to salt stress[J]. J Integr Plant Biol, 2005,47(11):1326-1334.
[7] 劉麗杰,蒼 晶,李懷偉,等.外源ABA對冬小麥越冬期呼吸代謝關鍵酶與糖代謝的影響[J].麥類作物學報,2013,33(1):65-72.
[8] Carpaneto A, Ivashikina N, Levchenko V, et al. Cold transiently activates calcium permeable channels in Arabidopsis mesophyll cells[J]. Plant Physiology, 2007,143:487-494.
[9] 周 芳,趙玉霞,王文巖,等.局部根區水分脅迫下鈣對冬小麥生長及養分吸收的影響[J].干旱地區農業研究,2015,33(1):14-19,71.
[10] 廖金珂,朱新霞,胡小燕,等.低溫脅迫下棉花幼苗對外源鈣的生理影響[J].西北農業學報,2013,22(2):60-64.
[11] 張懷山,趙桂琴,栗孟飛,等.中型狼尾草幼苗對PEG,低溫和鹽脅迫的生理應答[J].草業學報,2014,23(2):180-188.
[12] 陸秀君,劉月洋,李天來,等.變溫層積過程中GA3誘導天女木蘭種子貯藏物質及糖代謝關鍵酶活性的變化[J].沈陽農業大學學報,2010,41(1):18-22.
[13] 曲凌慧,車永梅,侯麗霞,等.低溫脅迫對葡萄品種梅鹿輒和貝達活性氧代謝的影響[J].青島農業大學學報(自然科學版),2010,27(2):117-121,125.
[14] Cai W C, Yuan H J. Chemical analysis method of biological substance[M]. Beijing: Science Press, 1982.
[15] Douglas C D, Tsung M K, Frederick C F. Enzymes of sucrose and hexose metablism in development kernels of two inbreds of maize[J]. Plant Physiology, 1988,86:1013-1019.
[16] Tsai M, Ou L, Setter T L. Effect of increased temperature in apical regions of maize ears on starch-synthesis enzymes and accumulation of sugars and starch[J]. Plant Physiology, 1985,79:852-855.
[17] Wardlaw I F, Willenbrink J. Carbohydrate storage and mobilization by the culm of wheat between heading and grain maturity: the relation to sucrose synthase and sucrose-phosphate synthase[J]. Australian Journal of Plant Physiology, 1994,21:251-271.
[18] Yu X J. The activity measurement of sucrose syntheses and sucrose phosphate sythase. Experimental manual of plant physiology[M]. Shanghai: Shanghai Science and Technology Press, 1985.
[19] Nielsen T H, Skiarbek H C, Karlsen P. Carbohydrate metabolism during fruit development in sweet pepper (Capsicum annuum) plants[J]. Plant Physiology, 1991,82:311-319.
[20] 徐昌杰,陳文峻,陳昆松,等.淀粉含量測定的一種簡便方法-碘顯色法[J].生物技術,1998,8(2):41-43.
[21] Schfoeder J I, Kwak J M, Allen G J. Guard cell abscisic acid signalling and engineering drought hardiness in plants[J]. Nature, 2001,410:327-330.
[22] 陳俊偉,謝 鳴,秦巧平.植物糖信號與激素信號之間的聯系[J].植物生理學通訊,2005,41(3):279-285.
[23] Nayyar H, Kaushal S K. Chilling induced oxidative stress in germinating wheat grains as affected by water stress and calcium[J]. Biologia Plantarum, 2002,45(4):601-604.
[24] 張 麗,周 欣,蔣家月,等.外源ABA對茶樹抗寒生理指標的影響[J].茶業通報,2012,34(2):72-74.
[25] 李苗苗,馮 雪,鄒春靜.外源Ca2+對干旱脅迫下沙地云杉幼苗抗旱性生理指標的影響[J].安徽林業科技,2013,39(1):12-14.
[26] 齊紅巖,姜巖巖,華利靜.短期夜間低溫對栽培番茄和野生番茄果實蔗糖代謝的影響[J].園藝學報,2012,39(2):281-288.
[27] 劉玉鳳,李天來,焦曉赤.短期夜間亞低溫及恢復對番茄光合作用和蔗糖代謝的影響[J].園藝學報,2011,38(4):683-691.
[28] 王世珍,蔡慶生.高羊茅蔗糖合成能力在低溫鍛煉下的部位差異[J].草地學報,2004,12(2):129-131,149.
[29] 魏小春,李 格,鄭 群.脫落酸與赤霉素對瓜爾豆蔗糖代謝酶類的影響[J].作物雜志,2012,(3):44-48.
[30] Blochl A, Grenier M G, Sourdioux M, et al. Induction of raffinose oligosaccharide biosynthesis by abscisic acid in somatic embryos of alfalfa(MedicagosativaL)[J]. Plant Science, 2005,168:1075-1082.
[31] Wattana P. Exoggenous abscisic acid enhances sugar accumulation in rice (OryzasativaL.) under drought stress[J]. Asian Journal of Plant Sciences, 201l,10(3):212-219.
[32] 王燕凌,廖 康,劉 君,等.外源CaCl2對提高葡萄幼苗抗寒性的研究[J].新疆農業大學學報,2006,29(3):64-67.
[33] 劉鐵錚,王獻革,索相敏,等.外源鈣及鈣離子抑制劑對杏扁雌蕊抗寒性的影響[J].吉林農業科學,2015,40(5):90-92.
Effects of exogenous ABA and Ca2+on sucrose metabolism in grape (VitisviniferaL.) seedlings under low temperature treatment and recovery
JIANG Han-yu1, WANG Wang-tian1, LEI Tian-xiang2, HE Bai-jun3, ZHANG Jin-lin4
(1.CollegeofLifeScienceandTechnology,GansuAgriculturalUniversity,Lanzhou,Gansu730070,China; 2.NorthwestPlateauInstituteofBiology,ChineseAcademyofScience,Xining,Qinghai810008,China; 3.GansuZixuanWineCo.,Ltd.,Jiayuguan,Gansu735100,China; 4.CollegeofPastoralAgricultureScienceandTechnology,LanzhouUniversity,Lanzhou,Gansu730020,China)
In order to figure out the responsing mechanisms of exogenous abscisic acid (ABA) and Ca2+on sucrose metabolism and key enzymes under low temperature, we measured the contents of sucrose, glucose, fructose and starch, the activities of sucrose-phosphate synthase (SPS), sucrose synthase (SS), acid invertase (AI) and neutral invertase (NI) in Cabernets (VitisviniferaL.) leaves at 5℃ and recovery at 25℃ treatment. The results showed with the increase in concentrations of ABA or Ca2+, the contents of sucrose, glucose, fructose and starch were increased significantly, and they were at the maximums when the concentrations of ABA or Ca2+were 5 mg·L-1or 15 mmol·L-1, resulting in increases of 67.88%, 21.8%, 213.77%, 7.04%, 51.38%, 2.35%, 8.84%, and 31.81%, or 72.81%, 35.37%, 123.57%, 36.44%, 25.90%, 28.67%, 210.56%, and 210.90%, respectively; The activities of acid invertase (AI), neutral invertase (NI), sucrose-phosphate synthase (SPS) and sucrose synthase (SS) were also increased markedly by 64.10%, 125.00%, 193.29%, 756.31%, 2 291.51%, 1 569.31%, 1 523.13%, and 1 336.77%, or 26.42%, 20.38%, 30.75%, 58.30%, 111.63%, 14.14%, 14.32%, and 66.39%, respectively. Our results provided evidence that exogenous ABA or Ca2+may impose damages to grape seedlings caused by low temperature. Key components of the response are: enhanced the activities of AI, NI, SS and SPS, increased soluble sugar level in leaves, promoting cold resistance ability for seedling.
VitisviniferaL.; ABA; Ca2+; Low temperature; Sucrose metabolism
1000-7601(2017)02-0127-07
10.7606/j.issn.1000-7601.2017.02.20
2015-09-27基金項目:國家自然基金(31560552);甘肅省農業生物技術研究及應用開發項目(GNSW-2014-12,GNSW-2010-16);甘肅省自然基金項目(506RJZA011)
姜寒玉(1980—),女,博士,講師,主要從事作物逆境分子生物學研究。 E-mail:jianghy@gsau.edu.cn。
共同第一作者:王旺田(1975—),男,博士,副教授,主要從事作物逆境分子生物學研究。 E-mail: wangw@gsau.edu.cn。
S601
A

