MAPK信號通路在高糖高脂誘導的心肌細胞肥大中的差異調節作用
閆佳敏+王瑞玲+馬琴+崔桂麗+王亞靜


【摘要】 目的:探討絲裂原激活蛋白激酶(MAPK)通路在高糖高脂誘導的H9c2細胞肥大中的作用。方法:高糖(33 mmol/L)及不同濃度脂(250、500、1000 ?mol/L)不同時間(12、24、36、48 h)干預H9c2細胞,應用乳酸脫氫酶(LDH)試劑盒檢測細胞培養液中LDH的活性,采用RT-PCR技術分別檢測肥厚指標心房鈉尿肽(ANP)、α-心肌肌動蛋白(α-SKA)的mRNA表達,利用蛋白免疫印跡(Western blot)技術檢測p-ERK/T-ERK、p-JNK/T-JNK、p-p38/T-p38的活化程度。結果:結果顯示上清LDH的活性與高糖高脂處理間具有濃度及時間依賴性,高糖高脂顯著增加ANP和α-SKA的mRNA表達(P<0.05),在高糖高脂(33 mmol/L+500 ?mol/L)36 h時ANP、α-SKA的mRNA表達最高(P<0.01)。與對照組相比,高糖高脂顯著促進MAPK信號活化,其中p-ERK和p-JNK的活化分別增加了1.39倍和1.47倍(P<0.05),而p-p38活化增加了3.34倍(P<0.01)。結論:高糖高脂可導致H9c2細胞損傷并顯著促進細胞肥大,在此過程中MAPK信號通路差異調控作用扮演重要角色。
【關鍵詞】 H9c2; 高糖高脂; 心肌肥厚; 糖尿病心肌病; MAPK
The Role of MAPK Signaling Pathway in Diabetic Cardiomyopathy/YAN Jia-min,WANG Rui-ling,MA Qin,et al.//Medical Innovation of China,2017,14(10):005-009
【Abstract】 Objective:To investigate the role of mitogen-activated protein kinase (MAPK) pathway in high glucose and high fat induced hypertrophy of H9c2 cells.Method:H9c2 cells were treated with high glucose(33 mmol/L) and different concentrations of lipids(250,500,1000 μmol/L) at different time (12,24,36,48 h).The activity of LDH in cell culture medium was detected by lactate dehydrogenase(LDH) kit.Quantitative Real-time PCR(RT-PCR) was used to detect the mRNA expression of atrial natriuretic peptide (ANP) and α-skeletal muscle actin (α-SKA) in hypertrophic myocardium.The activation of p-ERK/T-ERK,p-JNK/T-JNK and p-p38/T-p38 were detected by Western blot.Result:The results showed that the activity of supernatant LDH was concentration and time dependent with high glucose and high lipid treatment.Hyperglycemia and hyperlipidemia significantly increased the mRNA expression of ANP and α-SKA,the mRNA expression of ANP and α-SKA was the highest at high glucose and high fat (33 mmol/L+500 μmol/L) for 36 h(P<0.05).Compared with the control group,high glucose and high fat significantly promoted MAPK activation.Among them the activation of p-ERK and p-JNK were increased by 1.39-fold and 1.47-fold(P<0.05),while p-p38 activation was increased by 3.34-fold(P<0.01).Conclusion:High glucose and high fat can cause H9c2 cell damage and promote cell hypertrophy,in which MAPK signal pathway play an important role in the regulation of differences.
【Key words】 H9c2; HGHL; Myocardial hypertrophy; DCM; MAPK
First-authors address:Shanxi Medical University,Taiyuan 030001,China
doi:10.3969/j.issn.1674-4985.2017.10.002
糖尿病是心血管系統疾病發病的重要危險因素,糖尿病心肌病(diabetic cardiomyopathy,DCM)是一種以心肌肥大、心肌纖維化、細胞水平鈣轉運缺陷、心肌收縮蛋白膠原形成和脂肪酸代謝異常等為特征的一種獨特的心肌病變[1-3]。其發病機制復雜,可能涉及代謝紊亂(如葡萄糖轉運子活性下降、游離脂肪酸增加、胰島素抵抗等)、微血管病變、心臟植物神經功能紊亂及心肌纖維化(與高血糖、心肌細胞凋亡、炎性細胞因子等有關)等多種因素的一種,是病因尚不明確的糖尿病主要合并癥之一[4-6]。絲裂原激活蛋白激酶(mitogen-activated protein kinases,MAPK)鏈是真核生物信號傳遞網絡中的重要途徑之一,是一類廣泛存在于真核細胞中的絲/蘇氨酸蛋白激酶,在DCM的發生發展過程中起到重要作用,其中MAPK成員p38、JNK信號主要介導細胞凋亡和炎癥等,而ERK介導細胞增殖增生等[7-9]。越來越多的實驗證據表明,MAPK信號家族在心肌肥大的啟動以及心肌肥大病理進程中起重要作用[10]。據此本研究采用高糖高脂處理的H9c2病理變化模型,探討病理進程中MAPK家族如何發揮作用,即凋亡信號及增生信號是如何變化的。本研究旨在通過探討MAPK家族與糖尿病心肌病之間的關系,試圖闡明凋亡與增生變化規律,現報道如下。
1 材料與方法
1.1 材料 大鼠胚胎心肌細胞H9c2(北納創聯生物技術研究院,北京);DMEM高糖培養基、青鏈霉素混合液、PBS緩沖液、0.25%胰蛋白酶(博士德生物工程有限公司,武漢);胎牛血清(Gibco公司,美國);葡萄糖D-GLUCOSE(索萊寶生物科技有限公司,北京);棕櫚酸鈉Sodium palmitate(Sigma,美國);乳酸脫氫酶測定試劑盒(南京建成生物工程研究所,南京);Trizol總RNA提取試劑、RT-PCR測定試劑盒、RNA引物合成(TaKaRa,日本);無RNA酶槍尖、氯仿、乙醇、DEPC、八聯管等(生工生物工程股份有限公司,上海);BCA蛋白定量試劑盒(碧云天,上海);單克隆兔抗p-JNK、p-p38、t-p38抗體、多克隆兔抗p-ERK、t-JNK、t-ERK(CST公司,美國);辣根過氧化物酶標記的二抗(中杉金橋生物技術有限公司,北京);Western blotting 發光液(愛必信生物科技有限公司,上海)。
1.2 方法
1.2.1 細胞培養與處理 H9c2心肌細胞來源于大鼠胚胎期心臟組織,接種于含10%胎牛血清的DMEM高糖培養基中,將其置于5% CO2、37 ℃孵箱進行培養,待細胞生長至70%~80%進行實驗干預。實驗分為4組:正常對照組,高糖高脂A組(33 mmol/L葡萄糖+250 ?mol/L棕櫚酸鈉),高糖高脂B組(33 mmol/L葡萄糖+500 ?mol/L棕櫚酸鈉),高糖高脂C組(33 mmol/L葡萄糖+1000 ?mol/L棕櫚酸鈉)。
1.2.2 乳酸脫氫酶測定試劑盒檢測LDH的活性 于六孔板中種植H9c2心肌細胞,待細胞融合度達到70%~80%時,按照分組給予不同處理后,在不同時間收集。操作流程根據試劑盒說明書進行,操作結束后用酶標儀測定各孔450 nm處的吸光度值計算其活力。
1.2.3 Real-time PCR檢測ANP、α-SKA的mRNA的表達 按照Trizol說明書步驟提取細胞總RNA,采用分光光度計檢測RNA樣品的A260/A280比值在1.8~2.0,以確定RNA純度,并計算出RNA的濃度。參照RT-PCR試劑盒說明書進行反轉錄,將反轉錄管放于PCR儀中進行逆轉錄反應,逆轉錄反應參數:37 ℃ 15 min(反轉錄反應),85 ℃ 5 s(反轉錄酶的失活反應),4 ℃。兩步法進行PCR擴增反應,RT-PCR擴增的引物序列(表1),按照說明書加入SYBR熒光染料、引物序列以及反轉錄后的產物,在Mx 3000p熒光定量PCR儀(Stratagene) 上進行,擴增反應參數為:預變性:95 ℃,30 s,1個循環;PCR反應:95 ℃ 5 s、60 ℃ 30~34 s,40個循環。每組樣品設置3個復孔以保證實驗結果的有效性、重復性和準確性。
1.2.4 Western blot檢測高糖高脂干預H9c2心肌細胞24 hp-ERK、p-JNK、p-p38的蛋白表達量 H9c2心肌細胞接種于六孔板中,培養至70%~80%滿時分為兩組:正常對照組和高糖高脂B組,給予不同的處理,然后待處理時間為24 h時棄去培養液,用預冷的PBS洗兩次,加入配好的裂解液進行裂解并收集于離心管中進行超聲破碎和離心。然后用BCA法測定蛋白濃度調整相應的上樣量制備好蛋白樣本。95 ℃煮5 min變性,制備12%SDS分離膠和5%濃縮膠進行電泳從而分離蛋白質,電泳結束后使用半干轉將已分離的蛋白質轉印至PVDF膜上,然后再用5%脫脂奶粉室溫封閉1 h。封閉結束后用TBST洗膜3次,5 min/次,將膜置于相應的一抗稀釋液(1∶1000)中4 ℃搖床過夜。次日取出膜用TBST洗膜3次,5 min/次,將膜置二抗稀釋液(1∶10 000)中于搖床上室溫孵育1 h,洗膜后即可進行ECL發光法顯影。
1.3 統計學處理 采用SPSS 18.0統計軟件進行數據的分析處理,計量資料采用(x±s)表示,先進行數據的正態性檢驗、方差齊性檢驗,符合上述條件者行單因素方差分析比較多組間的差異,以P<0.05為差異有統計學意義。
2 結果
2.1 各組不同時間對H9c2細胞中LDH活力的影響 高糖高脂處理H9c2,細胞上清LDH的活性呈濃度及時間依賴性,隨著濃度和時間的逐漸增加,上清LDH的活性與高糖高脂處理間呈濃度及時間依賴性(P<0.05),見表2。
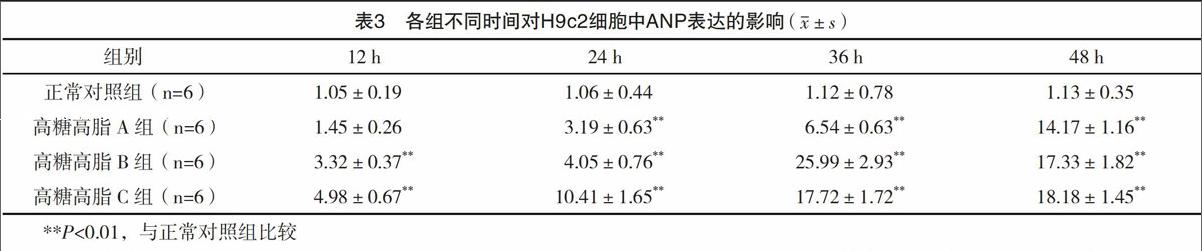
2.2 高糖高脂可增加H9c2細胞中ANP mRNA水平的表達 隨著濃度和時間的逐漸增加,ANP的表達也逐漸升高,且在高糖高脂B組(33 mmol/L葡萄糖+500 ?mol/L棕櫚酸鈉)干預細胞36 h時ANP表達量達到高峰(P<0.01)。見表3。
2.3 高糖高脂促進α-SKA mRNA的表達 相比對照組而言,高糖高脂促進α-SKA 的表達,且在36 h高糖高脂B組其表達達到最高(P<0.05),這與ANP的結果一致,據此確定高糖中濃度脂干預細胞36 h為干預濃度和時間,見表4。
2.4 高糖高脂可誘導MAPK蛋白磷酸化 相比對照組,高糖高脂B組干預24 h MAPK家族成員p38、ERK、JNK磷酸化水平均增高,比較差異均有統計學意義(P<0.05)。其中p-ERK的活化水平增加了約1.39倍(0.96±0.16 vs 0.69±0.04),p-JNK的活化水平增加了約1.47倍(1.05±0.21 vs 0.78±0.09),而p-p38的活化水平相對于對照組增加了約3.34倍(2.35±0.35 vs 0.71±0.14),見圖1。
3 討論
糖尿病心肌病是在1972年由Rubler等首先提出的,糖尿病心肌病的定義為有明確糖尿病病史,同時有明確的心肌結構和功能改變,排除缺血性疾病、高血壓及其他可能引起心肌病變的疾病[11-13]。本實驗通過離體實驗用高糖高脂將正常心肌細胞處理作為體外糖尿病心肌病模型,證實:高糖高脂可誘發心肌肥大,進而導致心肌結構改變;在心肌肥大的發生及發展過程中MAPK信號家族具有重要作用。
糖尿病是由遺傳因素、免疫功能紊亂、微生物感染及其毒素、自由基毒素、精神因素、生活方式等各種原因導致機體持續高血糖高血脂以及長期代謝紊亂綜合征[14-15]。高糖高脂持續狀態下,細胞外基質大量增生、膠原降解異常以及心肌間質纖維化,纖維化的增加直接促進成纖維細胞增殖,導致心肌肥大和重構,心臟功能受限[16]。目前已有研究利用高糖及不同濃度高脂干預H9c2心肌細胞建立糖尿病心肌病模型,通過檢測特異性基因A型心房鈉尿肽(ANP)和α-心肌肌動蛋白(α-SKA)來確定模型的建立成功[17]。據此筆者采用高糖(33 mmol/L)
及不同濃度高脂(250、500、1000 ?mol/L)干預細胞,從而檢測ANP、α-SKA的表達。相比對照組,高糖高脂顯著增加ANP和α-SKA的mRNA表達,在高糖高脂(33 mmol/L+500 ?mol/L)36 h時ANP、α-SKA的mRNA表達最高,因此成功建造了體外糖尿病心肌病模型。
MAPK主要有3個亞組:細胞外信號調節激酶1/2(Extracellular signal regulated kinase1/2,ERK1/2)、p38、c-Jun氨基端激酶/應激活化蛋白激酶(c-Jun N-terminal kinase/stress activated protein kinase,JNK/SAPK)。每條信號通路都具有高度特異性,具有獨立的功能,在某些程度上幾條信號通路間存在著一定的關聯,很多刺激因素如缺血、缺氧、激素、細胞因子、細胞應激等各種細胞外刺激均可誘導其激活,從而成為細胞增殖、分化、凋亡等與生理過程密切相關的核反應共同通路或匯聚點[18]。有研究已表明ERK主要參與介導細胞的生長、分化、發育、增殖等生理病理過程;而p38和JNK則與細胞炎癥、凋亡、生長、分化、應激反應等過程有關[19-20]。在此實驗中,筆者檢測到在糖尿病心肌病的發生發展過程中ERK、JNK、p38均被激活,且p38的活化水平增加最顯著。這提示筆者p38主導凋亡過程同時伴隨ERK活化而促進細胞增生的現象很有可能是引起DCM發生發展過程中的重要環節。但細胞內的信號通路是一個復雜的網絡系統,是否有其他通路在DCM的發展過程中發揮作用還需通過大量研究來進一步說明。
綜上所述,筆者通過探討MAPK在由高糖高脂誘導的H9c2心肌細胞肥厚過程中的作用,揭示以凋亡信號為主導的細胞凋亡通路及增生通路并存在其中扮演重要角色,從而在機理方面為DCM的治療提供新的思路,最終為糖尿病心肌病的預后提供新的靶點。
參考文獻
[1]周彬,錢孝賢.糖尿病心肌病的研究進展[J].新醫學,2010,41(3):197-199.
[2]馮新星,陳燕燕.糖尿病心肌病的研究進展[J].中國循環雜志,2015,30(1):87-89.
[3]高嵩,危春英.糖尿病心肌病發病機制及對心功能影響的研究進展[J].醫學綜述,2011,17(18):2796-2799.
[4] Poornima I G,Parikh P,Shannon R P.Diabetic cardiomyopathy:the search for a unifying hypothesis[J].Circ Res,2006,98(5):596.
[5] Wende A R,Abel E D.Lipotoxicity in the heart[J].Biochim Biophys Acta,2010,1801(3):311-319.
[6] Lloyd-Jones D,Adams R J,Brown T M.Executive summary:heart disease and stroke statistics-2010 update:a report from the American Heart Association[J].Circulation,2010,121(7):948-954.
[7]王文聰,謝春毅.絲裂原活化蛋白激酶MAPK信號通路與糖尿病心肌病關系的研究進展[J].當代醫學,2016,22(14):8-10.
[8]王譽霖,張勵才.p38MAPK信號轉路與細胞凋亡研究進展[J].慢性病學雜志,2010,12(12):1665-1667
[9] Lijnen P,Petrov V,Rumilla K.Transforming growth factor-beta 1 promotes contraction of collagen gel by cardiac fibroblasts through their differentiation into Myofibroblasts[J].Methods Find Exp Clin Pharmacol,2003,25(2):79-86.
[10] Ravingerova T,Barancik M,Strniskova M.Mitogen-activated protein kinases:a new therapeutic target in cardiac pathology[J].Mol Cell Biochem,2003,247(1):127-128.
[11]劉曉禹,萬沁.Nrf2-ARE信號通路與2型糖尿病心肌病的相關研究[J].中外醫學研究,2013,11(26):154-155.
[12] Goyal B R,Mehta A A.Diabetic cardiomyopathy:pathophysiological mechanisms and cardiac dysfunction[J].Hum Exp Toxicol,2013,32(6):571-590.
[13]丁文龍,潘大彬.內質網應激在糖尿病心肌病發病機制中的作用[J].承德醫學院學報,2016,33(4):336-339.
[14]黃婭茜,王憲,孔煒.糖尿病性疾病發病機制的研究進展[J].生理科學進展,2010,41(1):31-36.
[15]郭世彪,程春梅.抗糖尿病藥物的研究現狀與展望[J].中國藥物與臨床,2014,14(8):1066-1068.
[16] Moreira L F,Benicio A,Bacal F,et al.Determinants of long-term mortality of current palliative surgical treatment for dilated cardiomyopathy[J].Eur J Cardiothorac Surg,2003,23(5):756-764.
[17] Xiaoyu Wang,Susan V,McLennan.Adverse effects of high glucose and free fatty acid on cardiomyocytes are mediated by connective tissue growth factor[J].Am J Physiol Cell Physiol,2009,297(6):C1490-C1500.
[18]賈林,林智峰,馬莉.P38MAPK抑制劑SB203580對高糖誘導HK-2細胞轉分化的影響[J].天津醫藥,2016,44(4):426-429.
[19]陳建勇,王聰,王娟.MAPK信號通路研究進展[J].中國醫藥科學,2011,1(8):32-34.
[20] Ding F,Yu L,Wang M.O-Glc NAcylation involvement in high glucose-induced cardiac hypertrophy via ERK1/2 and cyclin D2[J].Amino Acids,2013,45(2):339-349.

