犀角地黃湯合銀翹散通過PKC-SSeCKS通路抑制TNF-α誘導的肺微血管內皮細胞通透性增加*
任睿芳, 張 舒, 李曉瑞, 游雷鳴, 吳 珺, 郝 鈺
(北京中醫藥大學基礎醫學院, 北京 100029)
犀角地黃湯合銀翹散通過PKC-SSeCKS通路抑制TNF-α誘導的肺微血管內皮細胞通透性增加*
任睿芳, 張 舒, 李曉瑞, 游雷鳴, 吳 珺, 郝 鈺△
(北京中醫藥大學基礎醫學院, 北京 100029)
目的: 觀察犀角地黃湯合銀翹散(XDY)對TNF-α誘導的大鼠肺微血管內皮細胞(PMVEC)通透性的影響及其與PKC-SSeCKS信號通路的關系,以探究該方治療病毒性肺炎的作用環節和分子機制。方法: 原代培養大鼠PMVEC,在Transwell小室上用電導法于不同時點監測TNF-α誘導的PMVEC跨內皮細胞單層電阻(TER)測定其通透性。不同的干預因素作用24 h后,檢測PMVEC的TER、PKC活性、SSeCKS mRNA水平和磷酸化SSeCKS蛋白水平,激光共聚焦顯微鏡觀察PMVEC中SSeCKS的定位和F-actin的結構變化。結果: TNF-α作用24 h后PMVEC通透性達高峰;與對照組比較,TNF-α組TER降低,PKC活性增強;與TNF-α組比較,TNF-α加PKC抑制劑組和TNF-α加XDY含藥血清組PKC活性降低,而TER升高且與對照組無差別。與對照組比較,TNF-α組SSeCKS的mRNA和蛋白表達升高;與TNF-α組比較,TNF-α加XDY含藥血清組SSeCKS的mRNA水平和磷酸化SSeCKS蛋白水平降低。對照組PMVEC中F-actin主要分布在細胞周邊和核周,形成致密周圍束,SSeCKS均勻散在分布于細胞中;TNF-α組細胞周邊的F-actin致密束基本消失,SSeCKS集中分布于核周;TNF-α加含XDY含藥血清組F-actin結構及SSeCKS的分布趨于正常。結論: 犀角地黃湯合銀翹散可以抑制TNF-α誘導的PMVEC PKC信號通路的激活,降低PKC結合底物SSeCKS的表達,最終影響肌動蛋白的變構、阻止內皮細胞變形而降低PMVEC的通透性。
肺微血管內皮細胞; PKC-SSeCKS信號通路; TNF-α; 犀角地黃湯合銀翹散
犀角地黃湯合銀翹散(Xijiao Dihuang decoction combined with Yinqiao powder,XDY)是源于《溫病條辨》的經典合方,具有解毒、化瘀、通絡之功效,臨床可用于治療重癥病毒性肺炎。前期研究表明:犀角地黃湯合銀翹散可有效降低病毒性肺炎小鼠肺微血管的通透性,降低肺含水量與肺指數,明顯減少肺泡灌洗液中白細胞總數,減輕病毒性肺炎小鼠肺組織炎性改變[1-2]。但其降低肺微血管通透性的機制尚未闡明。
肺微血管內皮細胞(pulmonary microvascular endothelial cells,PMVEC)是構成血氣屏障的重要結構之一,其通透性的增加是急性呼吸窘迫綜合征(acute respiratory distress syndrome,ARDS)的重要病理生理基礎。在病毒性肺炎病變過程中,在各種致炎因子的共同作用下,PMVEC通透性增加而使其屏障功能障礙,導致肺微血管滲漏,蛋白和細胞滲出,最終引起肺間質水腫。TNF-α作為致炎物質能破壞血管內皮細胞間連接,從而導致血管內皮細胞通透性增高[3]。已發現參與血管內皮細胞通透性改變的信號通路有多種[4],蛋白激酶C(protein kinase C, PKC)-Src抑制的蛋白激酶C底物(Src-suppressed C kinase substrate,SSeCKS)信號通路為其中之一。
因此,本實驗研究犀角地黃湯合銀翹散對TNF-α誘導的PMVEC通透性改變及對PKC-SSeCKS通路的影響,以探討該方降低肺微血管通透性的機制。
材 料 和 方 法
1 材料
1.1 細胞 根據陳瑞華等[5]的方法進行大鼠PMVEC的原代培養和鑒定。
1.2 藥物 犀角地黃湯合銀翹散(水牛角 30 g, 生地 30 g, 芍藥 12 g, 丹皮 9 g, 連翹 9 g, 銀花 9 g, 苦桔梗 6 g, 薄荷 6 g, 竹葉 4 g, 生甘草 5 g, 荊芥穗 5 g, 淡豆豉 5 g, 牛蒡子 9 g)制成水煎劑,藥材購自北京同仁堂藥店。根據張晨月等[2]的方法和劑量制備含藥血清。
1.3 主要試劑和儀器 M199培養基和胎牛血清(HyClone);雙抗(Solarbio);ECGS(BD);PKC活性檢測試劑盒(Promega);PKC抑制劑(Midostaurin);4%多聚甲醛(Solarbio);Triton X-100(Amresco);綿羊抗大鼠SSeCKS抗體(Sigma);TRITC標記的免抗綿羊 IgG(Jackson);FITC-鬼筆環肽(Molecular Probes)。
Real-time PCR儀(ABI);凝膠成像系統(Bio-Rad);激光共聚焦顯微鏡(Olympus);跨膜電阻儀(Millipore);Transwell小室(Costar)。
2 方法
2.1 內皮細胞通透性的檢測 將大鼠PMVEC(2×105cells)接種于0.5%明膠包被的Transwell小室內,上、下室分別加入0.5 mL和1.5 mL M199完全培養液,細胞達單層融合后,設置對照組、TNF-α (100 μg/L)組、TNF-α加PKC抑制劑(10 μmol/L)組和TNF-α加含藥血清(15%)組。將跨膜電阻儀調至歐姆檔,將2個STX-2電極分別于固定位置置于Transwell小室表面和下室內,于不同時點測量各組阻抗值,并測未接種細胞的小室阻抗值,每室重復3 次。TER=(測得阻抗值-空白阻抗值)×Transwell小室的底面積,單位為:Ω·cm2。TER反映溶質離子傳遞電流的強弱,與通透性呈反比,反映細胞單層通透性的變化。
2.2 PMVEC PKC活性的檢測 設對照組、TNF-α組、TNF-α加PKC抑制劑組和TNF-α加含藥血清組。干預因素作用24 h,將各組細胞收集并勻漿,離心(4 ℃,14 000 r/min,5 min)取上清,按PKC試劑盒操作說明測定上清液的PKC活性(試劑盒自帶了PKC激酶的短肽底物,正電的短肽底物在被PKC激酶磷酸化修飾后帶負電,負電短肽底物越多表示PKC激酶活性越強)。當上清液PKC活性越強,被磷酸化修飾的短肽底物越多(帶負電短肽電泳時向陽極移動越多越亮),反之未被磷酸化修飾的短肽底物越多(帶正電短肽電泳時向陰極移動越多越亮)。因此,短肽物的電泳檢測時,同一泳道的陽極條帶和陰極條帶比值(用條帶的灰度比值來表示)反映了上清液中PKC激酶活性。
2.3 PMVEC中SSeCKS的mRNA和蛋白表達檢測 設置對照組、TNF-α組和TNF-α加含藥血清組,干預因素作用24 h,收集細胞,按RNeasy Mini 試劑盒說明書提取細胞總RNA,用TE10倍稀釋。根據GenBank 提供的SSeCKS基因已知序列(AY695056),用Primer Premier 5.0 軟件設計CDS 區的上游引物序列為5’-AATCCATCCCAATCATAGTAAC-3’,下游引物序列為5’-TCTCAAGGTCCCAACAGC-3’;內參照GAPDH的上游引物序列為5’-ATGACCCCTTCATTGACC-3’,下游引物序列為5’-GAAGATGGTGATGGGATTTC-3’。PCR擴增按One-Step SYBR PrimeScript PT-PCR KitⅡ試劑盒說明書進行,結果以2-ΔΔCt表示。
收集細胞,用蛋白裂解液提取蛋白,用BCA法進行蛋白定量。用Western blot 方法檢測SSeCKS蛋白表達量,用ImageJ 凝膠分析軟件分析電泳圖像,以目標條帶的灰度值同GAPDH灰度值的比值表示待檢測蛋白相對水平。
2.4 激光共聚焦顯微鏡觀察SSeCKS和F-actin在細胞內的定位和結構的改變 將5×108cells/L的細胞100 μL種于激光共聚焦專用96孔板內,分組如上,干預因素作用24 h后,置于4%多聚甲醛中4 ℃固定1 h,以1% Triton X-100進行膜通透10 min,PBS清洗后,加正常兔血清室溫封閉1 h,傾去。SSeCKS用抗SSeCKS抗體4 ℃孵育過夜,洗滌后避光,以TRITC熒光 II 抗4 ℃孵育1 h,F-actin用FITC-鬼筆環肽染色,洗滌,封片,在激光共聚焦顯微鏡下觀察。每個樣品設3個復孔,進行3次獨立實驗。
3 統計學處理
用SPSS 16.0軟件進行統計分析,以均數±標準差(mean±SD)表示,多組差異采用單因素方差分析(one-way ANOVA),兩兩組間比較用LSD法(方差齊時)或Games-Howell法(方差不齊時)。以P<0.05為差異有統計學意義。
結 果
1 XDY對TNF-α刺激大鼠PMVEC后TER變化的影響
TNF-α作用于PMVEC 12 h后 TER開始下降,24 h TER達低點(圖1)。24 h時,與對照組相比,TNF-α組TER顯著降低(P<0.01);與TNF-α組相比,TNF-α加PKC抑制劑組和TNF-α加XDY含藥血清組TER明顯增高(P<0.01),且與對照組的差異無統計學顯著性(圖2)。
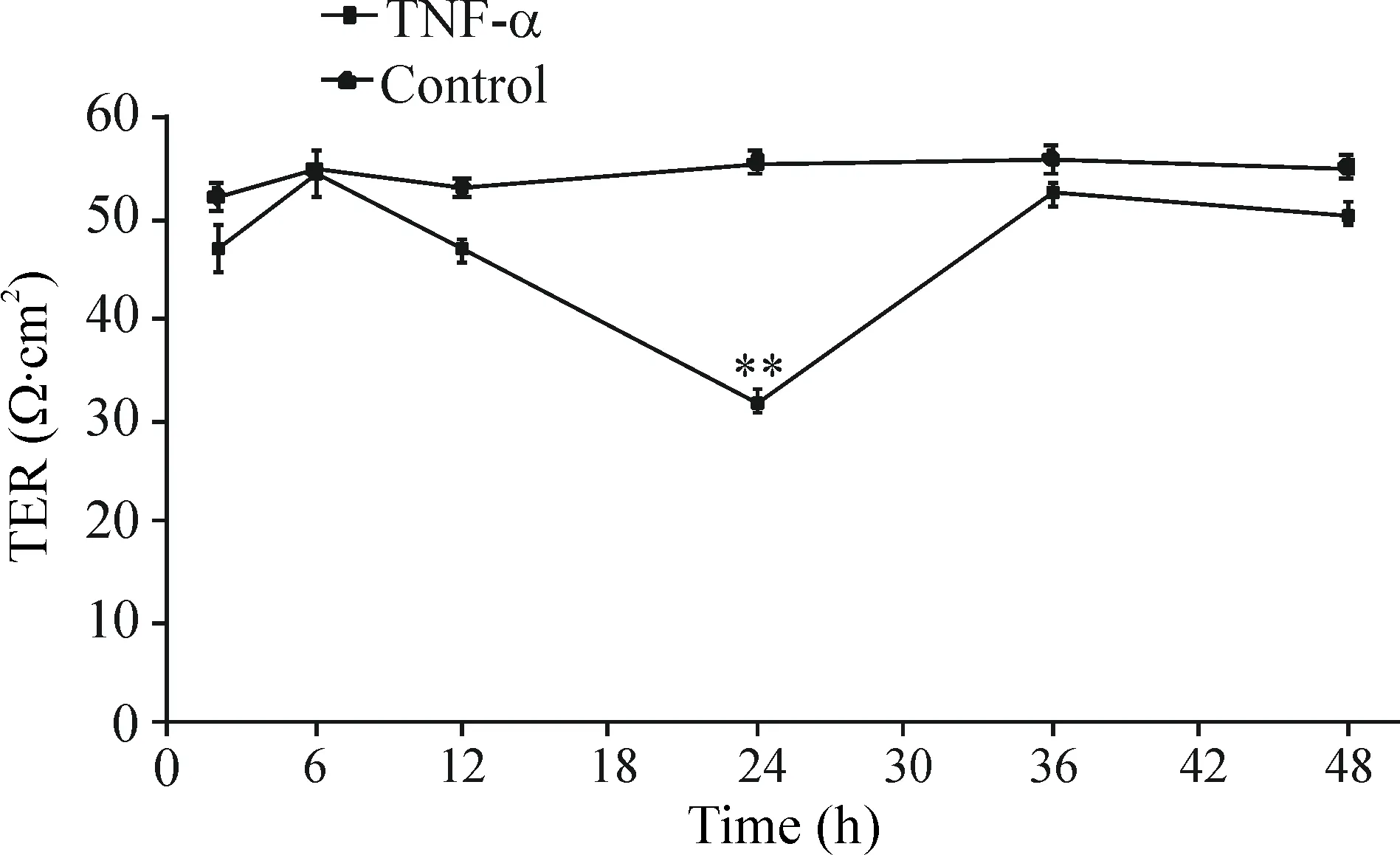
Figure 1.The change of TER of rat PMVEC induced by TNF-α. Mean±SD.n=3.**P<0.01vscontrol.
圖1 TNF-α誘導大鼠PMVEC TER的變化
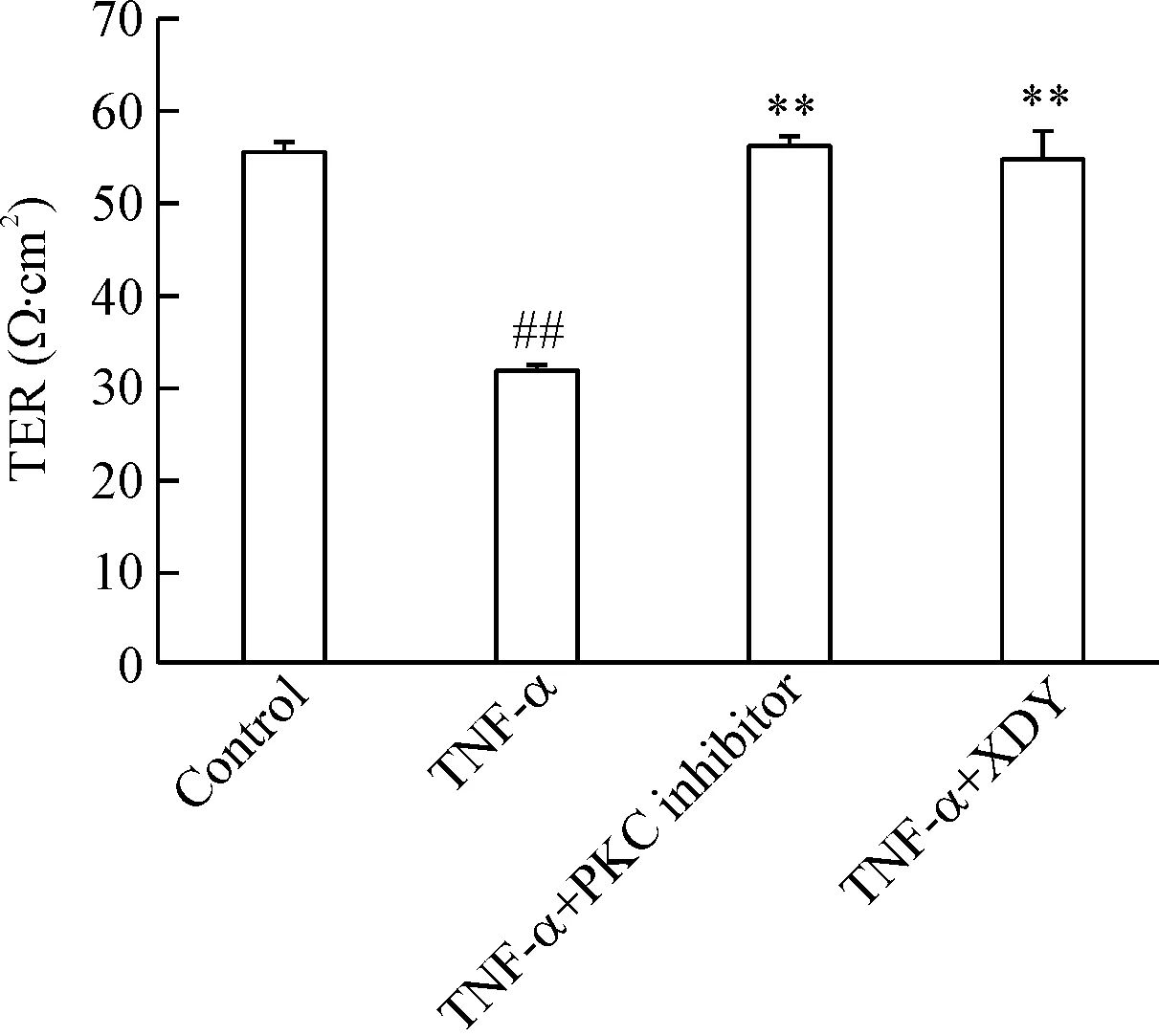
Figure 2.The effect of XDY on TER of rat PMVEC induced by TNF-α at 24 h. Mean±SD.n=3.##P<0.01vscontrol group;**P<0.01vsTNF-α group.
圖2 XDY對TNF-α誘導大鼠PMVEC 24 h TER的影響
2 XDY對TNF-α刺激大鼠PMVEC 24 h后 PKC活性的影響
干預因素作用24 h,與對照組相比,TNF-α組PKC活性增強(P<0.01);與TNF-α組相比,TNF-α加PKC抑制劑組和TNF-α加XDY含藥血清組PKC活性顯著降低(P<0.01)。各組PKC活性變化趨勢同TER變化趨勢呈負相關(r=0.8),TER同細胞通透性呈反比,因此各組PKC活性變化趨勢同PMVEC通透性變化趨勢呈正相關,見圖3。
3 XDY 對TNF-α刺激大鼠PMVEC 24 h后SSeCKS mRNA及蛋白表達的影響
與對照組相比,TNF-α組SSeCKS mRNA與磷酸化SSeCKS蛋白表達明顯增多,且差異有統計學顯著性(P<0.05);與TNF-α組相比,TNF-α加XDY含藥血清組SSeCKS的mRNA及磷酸化SSeCKS蛋白水平降低,差異有統計學顯著性(P<0.05),見圖4。
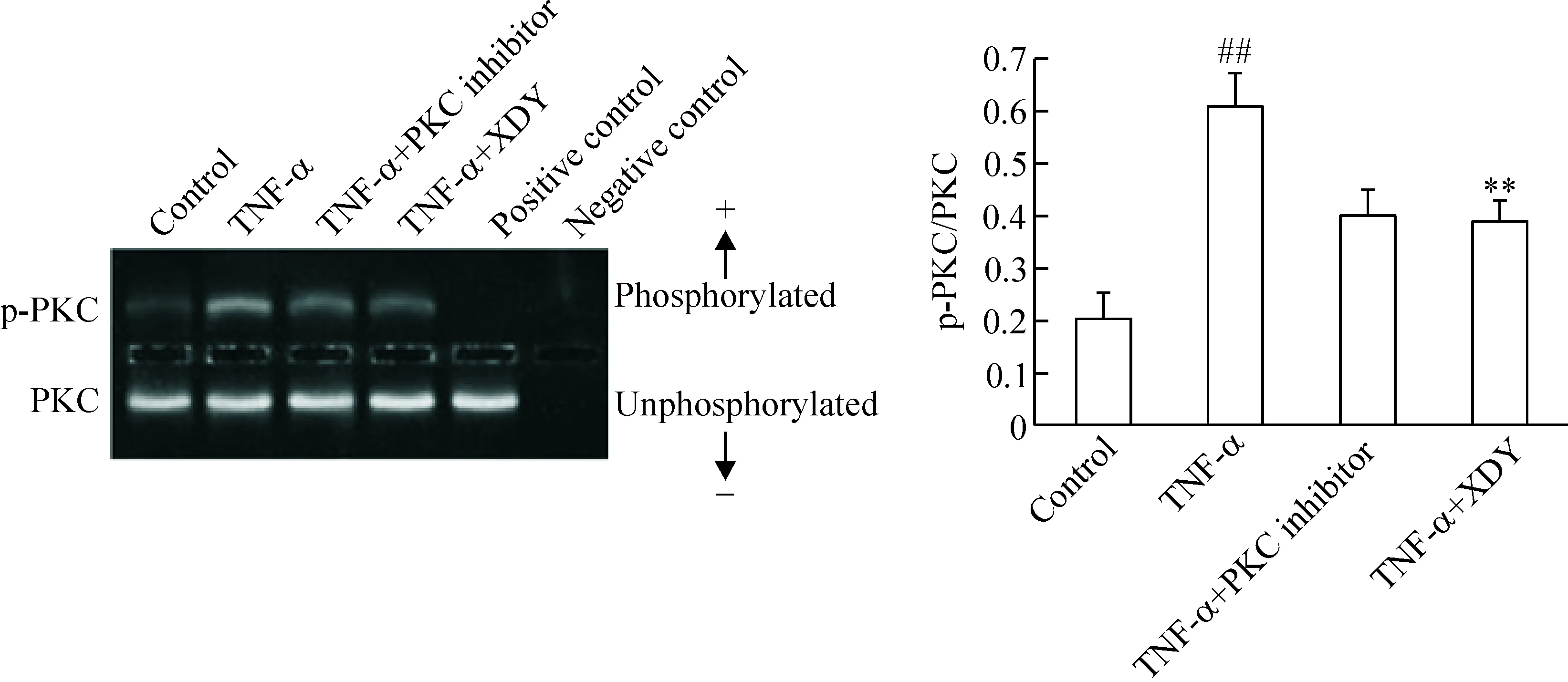
Figure 3.The effect of XDY on activity of PKC in rat PMVEC induced by TNF-α at 24 h. Mean±SD.n=3.##P<0.01vscontrol group;**P<0.01vsTNF-α group.
圖3 XDY對TNF-α 刺激大鼠PMVEC 24 h PKC活性的影響
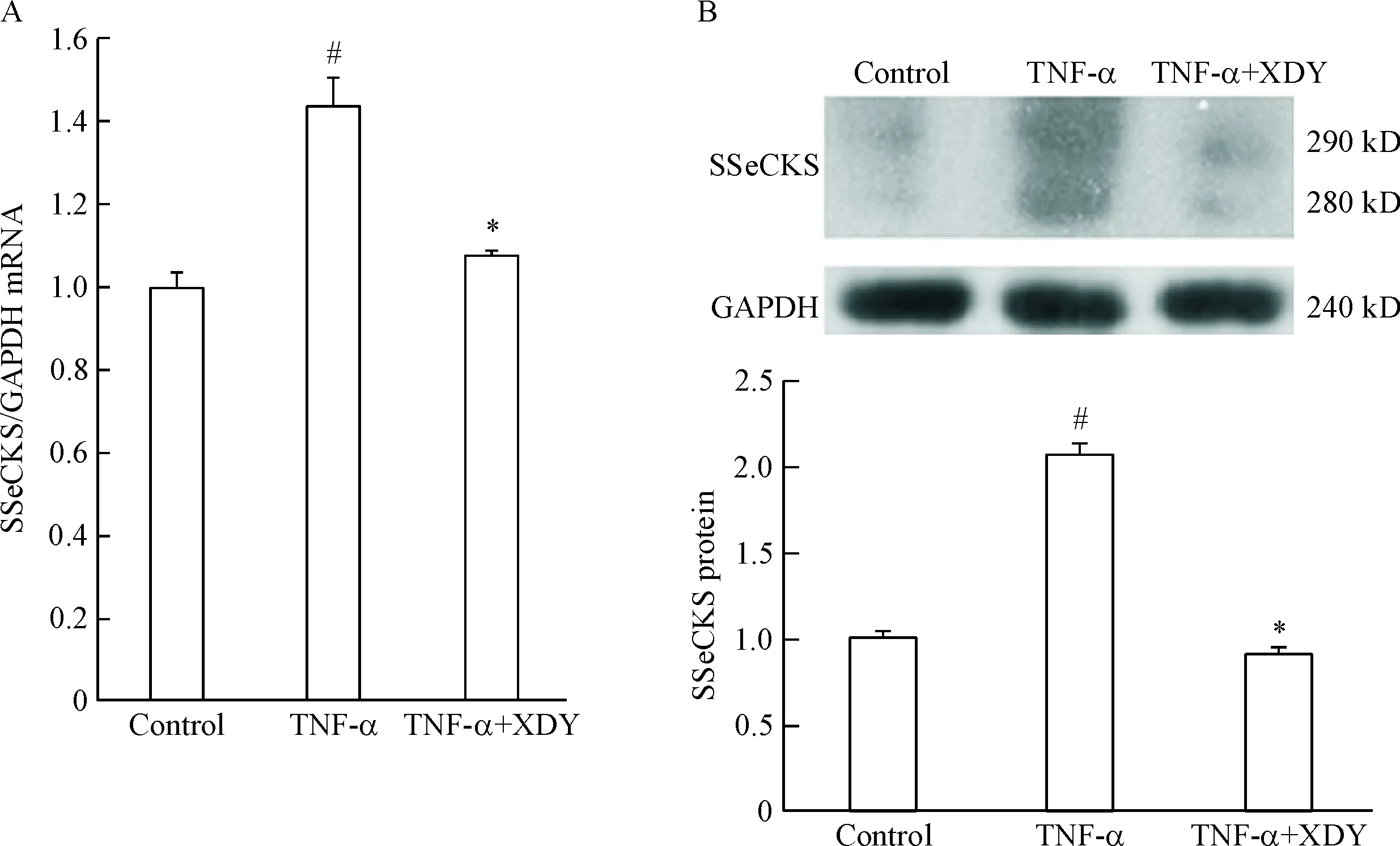
Figure 4.The SSeCKS mRNA (A) and the phospho-SSeCKS protein (B) levels in rat PMVEC. Mean±SD.n=3.#P<0.05vscontrol group;*P<0.05vsTNF-α group.
圖4 SSeCKS mRNA和磷酸化SSeCKS蛋白的變化
4 激光共聚焦顯微鏡觀察XDY對TNF-α刺激大鼠PMVEC 24 h后 SSeCKS和F-actin在細胞內的定位和結構改變的影響
對照組PMVEC中F-actin主要分布在細胞周邊和核周,微絲微管分布均勻、排列整齊,胞周可見F-actin形成的致密周圍束,SSeCKS均勻散在分布在細胞中;與對照組相比,TNF-α組細胞周邊的F-actin致密束基本消失,SSeCKS集中分布于核周;與TNF-α組相比, TNF-α加XDY含藥血清組的PMVEC中可見F-actin分布于細胞周邊的致密周圍束,SSeCKS均勻散在分布于細胞中,見圖5。
討 論
由于PMVEC是氣血屏障的主要組成部分,所以急性肺損傷或急性呼吸窘迫綜合征的主要發病環節就是其通透性的改變[6]。在流感病毒性肺炎中,血管內皮細胞損傷,肺微血管通透性增加,從而導致肺間質炎性滲出增多。TNF-α作為炎性介質,可觸發并加重肺微血管內皮細胞的改變[7]。它可使骨架蛋白活動和內皮細胞回縮,引起連接蛋白結構和功能失調, 細胞間裂隙形成,內皮細胞通透性增加[8]。PKC活化是內皮細胞的骨架蛋白活動的重要途徑之一[9]。TNF-α、IL-1β和LPS均可通過激活PKC信號通路來參與內皮細胞屏障功能的調控[10]。PKC信號通路被激活后,位于其下游的PKC結合底物SSeCKS的激活在內皮細胞通透性改變中發揮著重要作用。SSeCKS是一種相對分子質量為280~290 kD的細胞支架蛋白,它是PKC的結合蛋白,也是PKC的底物,同時也是絲狀肌動蛋白相關蛋白,被PKC磷酸化后,參與細胞的多種功能調控,如信息傳遞、F-actin重構[11]。SSeCKS蛋白存在3種亞型,分別是280 kD、290 kD(構成雙聯體)以及 240 kD,只有280/290 kD雙聯體蛋白的磷酸化顯著,而240 kD的SSeCKS 蛋白為可溶性蛋白,不被PKC和其它絲/蘇氨酸激酶磷酸化。磷酸化的SSeCKS蛋白與F-actin關聯,參與細胞骨架重構[12]。TNF-α、LPS等炎癥因子刺激后,SSeCKS由散在分布于變為聚集于細胞核周和細胞皺折處,球狀肌動蛋白聚集成F-actin,與各種F-actin相關蛋白連接增加,引起致密周圍束消失,形成應力纖維;將信號傳遞給黏附連接、緊密連接、縫隙連接和整合素-細胞外基質復合物,最終導致細胞間和細胞-基質間的連接物解聚,細胞收縮、細胞間縫隙增寬,通透性增加[13]。但經PKC抑制劑預處理的內皮細胞經TNF-α、LPS刺激后,骨架蛋白重構和SSeCKS的再分布明顯受到抑制[10]。
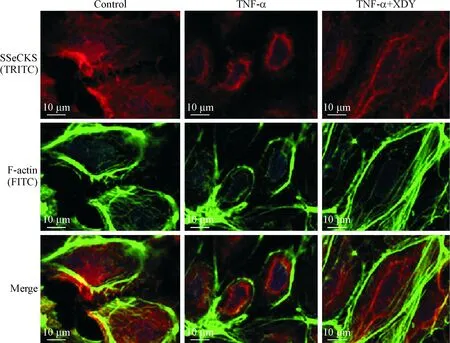
Figure 5.The effect of XDY on distribution and structure of F-actin and SSeCKS in rat PMVEC induced by TNF-α at 24 h observed under laser confocal microscope.
圖5 激光共聚焦顯微鏡觀察XDY對SSeCKS分布及F-actin結構的影響
我們的前期動物實驗研究已證實:犀角地黃湯合銀翹散可以有效降低流感病毒性肺炎小鼠血管的通透性,降低肺含水量與肺指數,減輕肺水腫[1]。本研究結果顯示TNF-α作用后12 h,PMVEC通透性開始增高,約24 h左右達高峰,因此本研究選取24 h作為進一步觀察TNF-α引起PMVEC通透性變化具體機制及含藥血清干預的時點。本研究證實TNF-α可激活PKC信號通路,并使PMVEC通透性增高,而特異性PKC抑制劑可抑制TNF-α的作用,說明TNF-α誘導的PMVEC通透性增高依賴PKC信號通路的激活。本研究結果顯示TNF-α刺激可引起SSeCKS mRNA表達和蛋白磷酸化水平的增加,同時可以使F-actin致密周圍束降解,微絲微管排列紊亂甚至消失;而犀角地黃湯合銀翹散可以減輕降低TNF-α刺激后PMVEC通透性增高,抑制PKC的活化,并減少SSeCKS mRNA表達和蛋白磷酸化水平,還可減輕細胞骨架蛋白的變構,這提示該方可能是通過抑制PKC的活化,進而減少PKC底物SSeCKS的表達,抑制SSeCKS相關的F-actin變構,降低PMVEC的通透性,減輕肺組織的炎癥反應。前期研究表明XDY還明顯抑制流感病毒感染后肺組織內炎癥因子TNF-α的表達,體外抑制大鼠肺泡巨噬細胞TNF-α的分泌[14],所以XDY也可通過抑制TNF-α的產生而降低肺微血管內皮細胞的通透性。由于病毒性肺炎過程中,引起肺微血管通透性升高的因素較多,如病毒、IL-1等就可誘導肺微血管通透性增加,且均可通過PKC-SSeCKS通路(另文發表),所以XDY除減少TNF-α產生外,對PKC-SSeCKS通路的抑制在降低肺微血管通透性作用中有重要意義。
本研究結果表明TNF-α可通過激活PKC-SSeCKS信號傳導通路而引起PMVEC通透性的增加,犀角地黃湯合銀翹散可以抑制PKC-SSeCKS信號通路的激活,降低SSeCKS的表達,減輕下游F-actin致密周圍束解聚,阻止細胞收縮導致的細胞間隙增大,從而降低病毒性肺炎中炎性介質TNF-α引起的PMVEC通透性增高,緩解內皮細胞的損傷,減輕肺水腫。
[1] 吳 瑩, 李季倩, 孟 建, 等. 中藥復方對流感病毒性肺炎小鼠肺血管通透性的影響及機制[J]. 北京中醫藥大學學報, 2011, 10(34): 668-672, 682.
[2] 張晨月, 張 舒, 吳 瑩, 等. 犀角地黃湯合銀翹散對流感病毒感染的小鼠肺組織及大鼠肺微血管內皮細胞ICAM-1和VCAM-1表達的影響[J]. 中國病理生理雜志, 2013, 29(9):1685-1690.
[3] 鄧小鹿, 彭 鏡, 何 芳, 等. TNF-α對小鼠腦微血管內皮細胞RhoA活性的影響[J]. 中國病理生理雜志, 2011, 27(6): 1210-1212, 1217.
[4] Koss M, Pfeiffer GR, Wang Y, et al. Ezrin/radixin/moesin proteins are phosphorylated by TNF-α and modulate permeability increases in human pulmonary microvascular endothelial cells[J]. J Immunol, 2006, 176(2): 1218-1227.
[5] 陳瑞華, 趙自剛, 牛春雨, 等. 大鼠肺微血管內皮細胞的培養[J]. 中國微循環, 2007, 11(1):16-19.
[6] Kuebler WM. Inflammatory pathways and microvascular responses in the lung [J]. Pharmacol Rep, 2005, 57(Suppl):196-205.
[7] Dull RO, DeWitt BJ, Dinavahi R, et al. Quantitative assessment of hemoglobin-induced endothelial barrier dysfunction[J]. J Appl Physiol (1985), 2004, 97(5):1930-1937.
[8] 趙克森, 黃巧冰. 血管通透性增高的基本機制[J]. 中國病理生理雜志, 2003, 19(4):549-553.
[9] Huang Q, Yuan Y. Interaction of PKC and NOS in signal transduction of microvascular hyperpermeability [J]. Am J Physiol, 1997, 273(5 Pt 2):H2442-H2451.
[10]You QH, Sun GY, Wang N, et al. Role of src-suppressed C kinase substrate in rat pulmonary microvascular endothelial hyperpermeability stimulated by inflammatory cytokines[J]. Inflamm Res, 2010, 59(11):949-958.
[11]Nelson PJ, Moissoglu K, Vargas J Jr, et al. Involvement of the protein kinase C substrate, SSeCKS, in the actin-based stellate morphology of mesangial cell[J]. J Cell Sci, 1999, 112(Pt 3):361-370.
[12]Lin X, Tombler E, Nelson PJ, et al. A novelsrc- andras-suppressed protein kinase C substrate associated with cytoskeletal architecture[J]. J Biol Chem, 1996, 271(45): 28430-28438.
[13]Liu T, Guevara OE, Warburton RR, et al. Modulation of HSP27 alters hypoxia-induced endothelial permeability and related signaling pathways[J]. J Cell Physiol, 2009, 220(3):600-610.
[14]吳 瑩, 李季倩, 孟 建, 等. 犀角地黃湯合銀翹散對流感病毒性肺炎小鼠炎性因子和自由基表達的影響[J]. 中國中醫藥信息雜志, 2012, 19(7): 28-30.
(責任編輯: 陳妙玲, 羅 森)
Xijiao Dihuang decoction combined with Yinqiao powder inhibits TNF-α-induced permeability increase in PMVEC via PKC-SSeCKS pathway
REN Rui-fang, ZHANG Shu, LI Xiao-rui, YOU Lei-ming, WU Jun, HAO Yu
(SchoolofBasicMedicalSciences,BeijingUniversityofChineseMedicine,Beijing100029,China.E-mail:yuhao64@sina.com
AIM: To investigate the molecular mechanism of Xijiao Dihuang decoction combined with Yinqiao powder (XDY) in treating viral pneumonia, and the effects of XDY on TNF-α-induced permeability in pulmonary microvascular endothelial cells (PMVEC) and the role of PKC-SSeCKS pathway involved.METHODS: The electric conductivity method was used to detect transendothelial electrical resistance (TER) of primarily cultured PMVEC on Transwell chamber at different time points to determine the permeability of PMVEC. After pretreatment for 24 h, the activity of PKC, TER, and the expression of SSeCKS at mRNA and protein levels were detected. Laser scanning confocal microscopy was used to observe the location of SSeCKS and construction of F-actin in PMVEC. RESULTS: The permeability of PMVECs induced by TNF-α reached the peak at 24 h. Compared with control group, the TER in TNF-α group was decreased, and the activity of PKC was increased. Compared with TNF-α group, the activity of PKC in TNF-α with PKC inhibitor group and TNF-α with XDY group was decreased, while the TER was increased, without difference from control group. Compared with control group, the mRNA expression of SSeCKS and phospho-SSeCKS was increased in PMVEC of TNF-α group, but decreased in TNF-α with XDY group compared with TNF-α group. In control group, F-actin was mainly located around the nucleus and at cytoplasmic borders of PMVEC, forming the dense peripheral bundle, and SSeCKS was evenly scattered in the cell. In TNF-α group, the dense peripheral bundle of F-actin surrounding the cells almost disappeared, and SSeCKS was concentrated around the nucleus. Compared with TNF-α group, the distribution and the structure of F-actin and SSeCKS nearly returned to normal in TNF-α with XDY group. CONCLUSION: XDY inhibits the activation of PKC signaling pathway in PMVEC caused by TNF-α to reduce the mRNA expression of SSeCKS and the phosphorylation of SSeCKS, thus preventing the deformation of endothelial cells and reducing the permeability of PMVEC.
Pulmonary microvascular endothelial cells; PKC-SSeCKS signaling pathway; TNF-α; Xijiao Dihuang decoction combined with Yinqiao powder
1000- 4718(2017)05- 0871- 06
2016- 11- 22
2017- 03- 08
國家自然科學基金資助項目(No. 81573723);教育部博士點博導類基金資助項目(No. 20130013110010)
10.3969/j.issn.1000- 4718.2017.05.017
R285.5; R392.1; R563.1+4
A
雜志網址: http://www.cjpp.net
△通訊作者 Tel: 13671032107; E-mail: yuhao64@sina.com

