腹腔注射LPS建立認知功能障礙相關的中樞神經系統免疫炎癥小鼠模型*
程小鳳, 趙佳儀, 袁 羽, 藍 欣, 袁瓊茹, 黃翠芹, 陸大祥, 朱麗紅, 畢 偉△
(暨南大學 1附屬第一醫院, 2醫學院病理生理學系, 國家中藥管理局三級科研實驗室, 廣東 廣州 510632)
腹腔注射LPS建立認知功能障礙相關的中樞神經系統免疫炎癥小鼠模型*
程小鳳1, 趙佳儀2 ▲, 袁 羽2, 藍 欣2, 袁瓊茹2, 黃翠芹2, 陸大祥2, 朱麗紅2, 畢 偉1△
(暨南大學1附屬第一醫院,2醫學院病理生理學系, 國家中藥管理局三級科研實驗室, 廣東 廣州 510632)
目的: 建立認知功能障礙相關的中樞神經系統免疫炎癥小鼠模型。方法: 實驗采用9~11周的C57/6J雄性小鼠,腹腔注射脂多糖(lipopolysaccharide, LPS)500 μg/kg或750 μg/kg。采用Morris水迷宮和避暗實驗評價小鼠的認知功能,爬桿試驗檢測小鼠的運動協調性。免疫熒光法觀察小鼠海馬區神經元特異性微管相關蛋白2(microtubule-associated protein 2, MAP-2)的表達和小膠質細胞的形態和數量。Western blot實驗檢測小鼠腦組織勻漿液中環氧合酶2(cyclo-oxygenase-2, COX-2)和誘導型一氧化氮合酶(inducible nitric oxide synthase, iNOS)蛋白的表達。結果: Morris水迷宮結果提示,與對照組相比,LPS組小鼠逃避潛伏期延長,目標象限停留時間及穿越目標象限次數減少(P<0.05);避暗實驗結果提示LPS組均能使小鼠的潛伏期縮短,錯誤次數增加(P<0.05);爬桿實驗結果提示LPS組小鼠爬完全程時間高于正常對照組;LPS組小鼠海馬區的神經元減少,小膠質細胞增加,COX-2和iNOS蛋白表達增加(P<0.01)。結論: 腹腔注射LPS可引起小鼠認知功能障礙,模擬認知功能障礙相關的中樞炎癥動物模型。
認知功能障礙; 脂多糖; 神經炎癥
認知功能障礙,又稱為認知功能衰退。泛指由各種原因導致認知功能受到不同程度損害的狀態,重者如各種類型的癡呆,輕者如輕度認知功能障礙等[1-2]。隨著我國老齡化現象日益嚴重,其發病率也逐年增加。因此,對認知功能障礙的研究已經成為我國生物醫學研究中的熱點之一。
迄今為止,本病的病因尚未十分明確,發病機制錯綜復雜,更缺乏有效的干預治療措施。目前,臨床上對這類疾病的治療尚停留在對癥治療階段,仍不能對該類疾病進行根本性的治療。根據相關的文獻報道[3],神經遞質障礙、基因突變、淀粉樣蛋白沉積、氧化應激和炎癥/免疫反應等因素,可能與其發病有關。研究發現,神經環境中的小膠質細胞在認知功能障礙的發生和發展中起了很大的推動作用[4-7]。小膠質細胞的過度活化引起的中樞神經系統免疫炎癥更是本病的重要發病機制之一[8]。過度活化的小膠質細胞會釋放大量的炎癥因子如腫瘤壞死因子α(tumor necrosis factor alpha,TNF-α)、白細胞介素1(interleukin,IL-1)、一氧化氮(nitrc oxide,NO)和前列腺素E2(prostaglandin E2,PGE2)等,它們能造成腦內神經元的變性和死亡[9],同時小膠質細胞引起的神經炎癥還可促進磷酸化微管蛋白tau的聚集[10],導致細胞骨架的結構異常和神經細胞的死亡[11]。
動物疾病模型是研究疾病發病機制和防治的基礎,因此建立一個合理的動物疾病模型對于本病的發病機理的研究和藥物篩選有重要的意義。
本實驗采用C57BL/6J小鼠,通過腹腔注射不同劑量的脂多糖(lipopolysaccharide,LPS),觀察其行為學、海馬神經元的數量、小膠質細胞的活化狀態及炎癥蛋白環氧合酶2(cyclo-oxygenase-2,COX-2)和誘導型NO合酶(inducible NO synthsae,iNOS)的表達,旨在建立認知功能障礙相關的中樞神經系統免疫炎癥的小鼠模型。
材 料 和 方 法
1 動物
C57BL/6J雄性小鼠,9~11周齡,體重18~22 g,購于廣東省實驗動物中心,合格證號:SYXK(粵)2012-0117,粵監證字:2013-0002。恒溫恒濕條件下,使用滅菌飼料和墊料,室溫始終保持(22±2) ℃,照明和黑暗周期12/12 h,自由進食進水。適應實驗環境10 d后開始實驗。
2 主要試劑
LPS(革蘭氏陰性細菌細胞壁的主要成分)購自Sigma,實驗前用生理鹽水配置成實驗所需濃度;抗COX-2抗體和抗iNOS抗體均購自Cell Signaling Technology;微管相關蛋白2(microtubule-associated protein 2,MAP-2)抗體購自Millipore;離子鈣接頭蛋白分子1(ionized calcium-binding adaptor molecule-1,IBA-1)抗體購自Abcam;辣根過氧化酶標記的山羊抗兔II抗購自北京鼎國生物科技有限公司。
3 主要方法
3.1 實驗分組 小鼠隨機分為3組(每組15只):(1)正常對照組:腹腔注射生理鹽水;(2)LPS低劑量組:腹腔注射LPS 500 μg/kg;(3)LPS高劑量組:腹腔注射LPS 750 μg/kg。整個實驗過程通過暨南大學實驗動物倫理委員會審查。
3.2 Morris水迷宮實驗(Morris water maze, MWM) 由定位航行實驗和空間探索實驗2個部分組成。(1)定位航行實驗:小鼠連續接受7 d的訓練,于第8天開始腹腔注射LPS,注射6 h后開始水迷宮實驗。在每日的水迷宮實驗中,隨機選取一個象限,輕輕地將小鼠面向池壁、尾部朝水池中央放入水中。記錄小鼠找到隱藏平臺所需的時間,作為潛伏期。若小鼠在60 s內未找到平臺,實驗者需引導其至平臺并停留10 s,并記其潛伏期為60 s。(2)空間探索實驗用于測量小鼠對平臺空間位置的準確記憶,即記憶保持能力。于定位航行實驗結束后撤除平臺,從平臺所在象限的對角線象限放入小鼠,記錄下小鼠在60 s內穿過平臺的次數及在平臺象限內停留的時間。
3.3 避暗實驗 將小鼠放入明室,打開閘門,不通電,讓小鼠在明暗室兩邊自由穿梭3 min。此法訓練3 d。第3天,同樣的方法讓小鼠適應環境3 min后,電壓為39 V,通電5 min。第4天,小鼠腹腔注射LPS 6 h后,進行避暗實驗。小鼠第1次進入暗室受到電擊的時間,為逃避潛伏期,以及記錄5 min內小鼠進入暗室的次數。
3.4 爬桿實驗 桿長60 cm,粗1 cm,桿周纏2層紗布。腹腔注射LPS前對小鼠爬桿訓練5 d。腹腔注射LPS 6 h后進行實驗,記錄小鼠爬完桿長上半部分所用時間、下半部分所用時間及全長所用時間。若在3 s內完成上述的某一動作記為3分、6 s內完成記為2分、超過6 s完成記為1分,最后將3次得分記為總分。
3.5 Western blot實驗 取小鼠海馬組織,提取各組蛋白,BCA定量試劑盒(碧云天)進行蛋白定量。以8%或10% SDS-聚丙烯酰胺凝膠電泳分離,半干電轉移法轉移至PVDF膜,5%脫脂奶粉室溫封閉1 h。根據Marker標志切取目的條帶,分別加入相應Ⅰ抗(1∶1 000稀釋)于4 ℃孵育過夜,用相應的辣根過氧化物酶標記的Ⅱ抗,室溫孵育1 h,ECL發光液發光顯色,X線底片曝光;GAPDH作為內參照。實驗重復3次。
3.6 免疫熒光染色 冰凍切片用PBS洗3次。用0.3% Triton X-100通透10 min。再用0.025% Triton X-100/PBS洗3次。1% BSA室溫封閉1 h,棄封閉液,加入用抗體稀釋液稀釋至工作濃度的Ⅰ抗于4 ℃濕盒中孵育過夜。去除Ⅰ抗,PBS洗3次,相應的熒光Ⅱ抗室溫孵育1 h后PBS洗3次,最后DAPI室溫孵育10 min,封片后在Leica熒光顯微鏡下觀察,并拍照。
4 統計學處理
使用SPSS 13.0統計軟件進行統計學處理分析。所有數據采用均數±標準誤(mean±SEM)表示,組間比較用單因素方差分析(one-way ANOVA),以P<0.05為差異有統計學意義。
結 果
1 腹腔注射LPS對小鼠定位航行實驗及空間探索實驗的影響
與正常對照組相比,LPS 500 μg/kg組和750 μg/kg組小鼠的逃避潛伏期延長(P<0.01),見圖1。
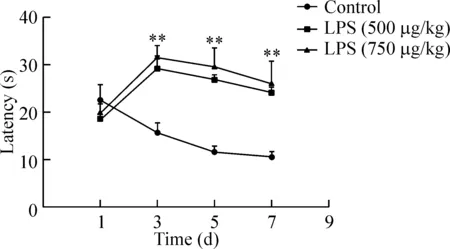
Figure 1.Mice showed impaired spatial learning and recognition after injection LPS. The latency to escape the hidden platform in the mice treated with LPS or saline.n=15.**P<0.01vscontrol group.
圖1 LPS對小鼠學習和記憶能力的影響
在空間探索實驗中,第7天撤除平臺后,LPS 500 μg/kg組和750 μg/kg組小鼠在60 s內穿越目標象限的次數和停留時間減少,差異具有統計學意義(P<0.01),見表1。
表1 腹腔注射LPS對小鼠空間探索實驗的影響
Table 1.Spatial probe test for retention of crossing target platform and stay time after treatment with LPS (Mean±SEM.n=15)

GroupStaytime(s)ThroughplatformnumberControl29.28±1.455.5±0.8LPS500μg/kg25.08±1.31*##4.4±0.5*#LPS750μg/kg16.38±1.23**3.4±0.4*
*P<0.05,**P<0.01vssaline group;#P<0.05,##P<0.01vsLPS 750 μg/kg group.
2 腹腔注射LPS對小鼠避暗實驗的影響
連續腹腔注射LPS 7 d的小鼠在避暗實驗中,與正常對照組相比,小鼠逃避潛伏期明顯縮短(P<0.05),而錯誤次數明顯增加(P<0.05),見圖2。
3 腹腔注射LPS對小鼠爬桿實驗的影響
連續7 d腹腔注射LPS后小鼠在爬桿試驗中出現運動不協調,行動遲緩甚至跌落的現象,而正常對照組全程運動流暢,見圖3。
4 LPS誘導的小鼠海馬區組織形態學的改變
如圖4所示,小鼠海馬區, MAP-2表達減少,小膠質細胞特異性標志物IBA-1數量增多,胞體變大,突起變長呈分枝狀。結果提示,LPS可明顯激活小膠質細胞趨向海馬組織聚集,神經元丟失顯著。
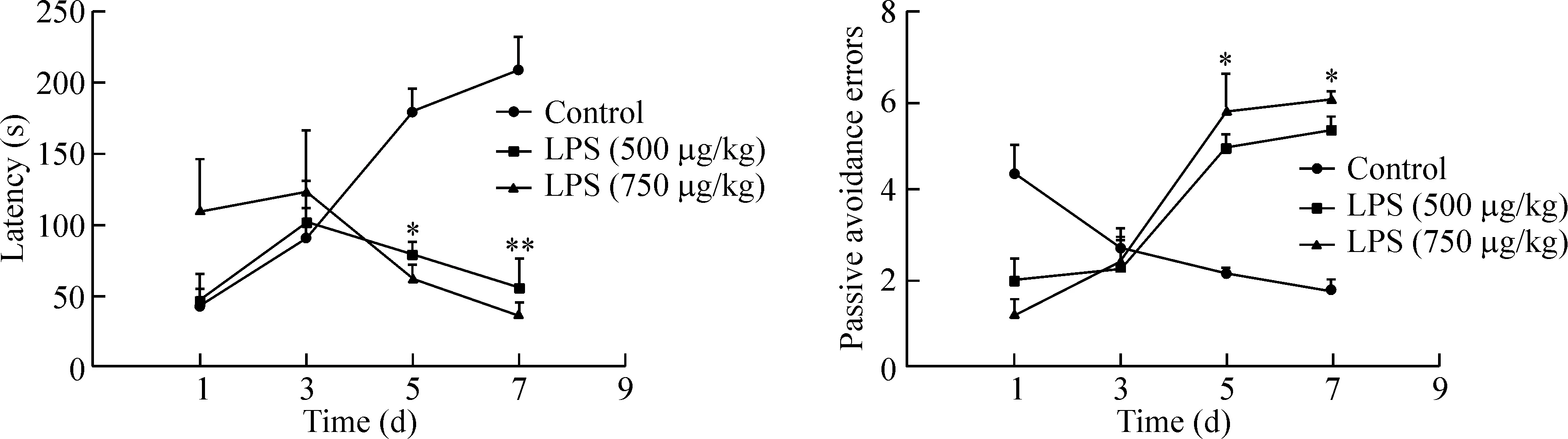
Figure 2.Effects of LPS on the memory and learning of the mice in passive avoidance test. Mean±SEM.n=15.*P<0.05,**P<0.01vscontrol group.
圖2 LPS對小鼠在避暗實驗中的影響
5 腹腔注射LPS對小鼠海馬組織中COX-2和iNOS蛋白表達的影響
腹腔注射LPS 500 μg /kg組和750 μg /kg組小鼠炎癥蛋白COX-2和iNOS表達較正常對照組增加(P<0.01),提示LPS可誘導小鼠腦部海馬組織中促炎蛋白的表達,見圖5。
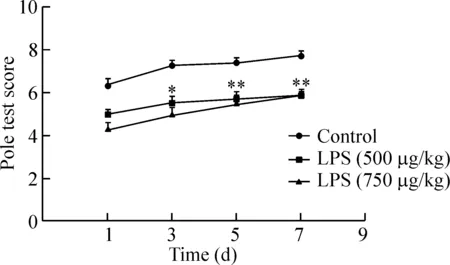
Figure 3.The effects of LPS on the memory and learning of the mice in pole test. Mean±SEM.n=15.*P<0.05,**P<0.01vscontrol group.
圖3 LPS對小鼠在爬桿實驗中的影響
討 論
在生物醫學研究中,理想的動物疾病模型是人們研究疾病發病機制和防治的基礎,因此建立合理的動物疾病模型至關重要。目前常用來研究認知功能障礙的動物模型以大鼠居多,運用小鼠建立疾病動物模型的研究較少,且缺乏統一的衡量標準。近年來應用較多的大鼠認知功能障礙的動物模型主要有以下4種:(1)側腦室注射β-淀粉樣肽(Aβ)所致大鼠阿爾茨海默病(Alzheimer disease, AD)模型;(2)側腦室注射LPS復制大鼠AD模型[12];(3)經鼻腔給藥LPS炎癥刺激模型[13];(4)腹腔注射LPS致慢性炎癥刺激的大鼠模型[14-15]。不同方法的動物模型其病理生理學進展過程不同、優缺點不同,對其干預措施的反應也大不相同。主要區別在于:(1)Aβ本身就具有毒性;(2)側腦室注射技術操作難度系數大,造價較高,盡管炎癥表現明顯但在國內實際應用有一定的局限性;(3)經鼻腔給藥時間太久,操作難度系數較大容易造成鼻黏膜損傷;(4)LPS大鼠腹腔注射抓取不方便,但腹腔注射操作簡單。
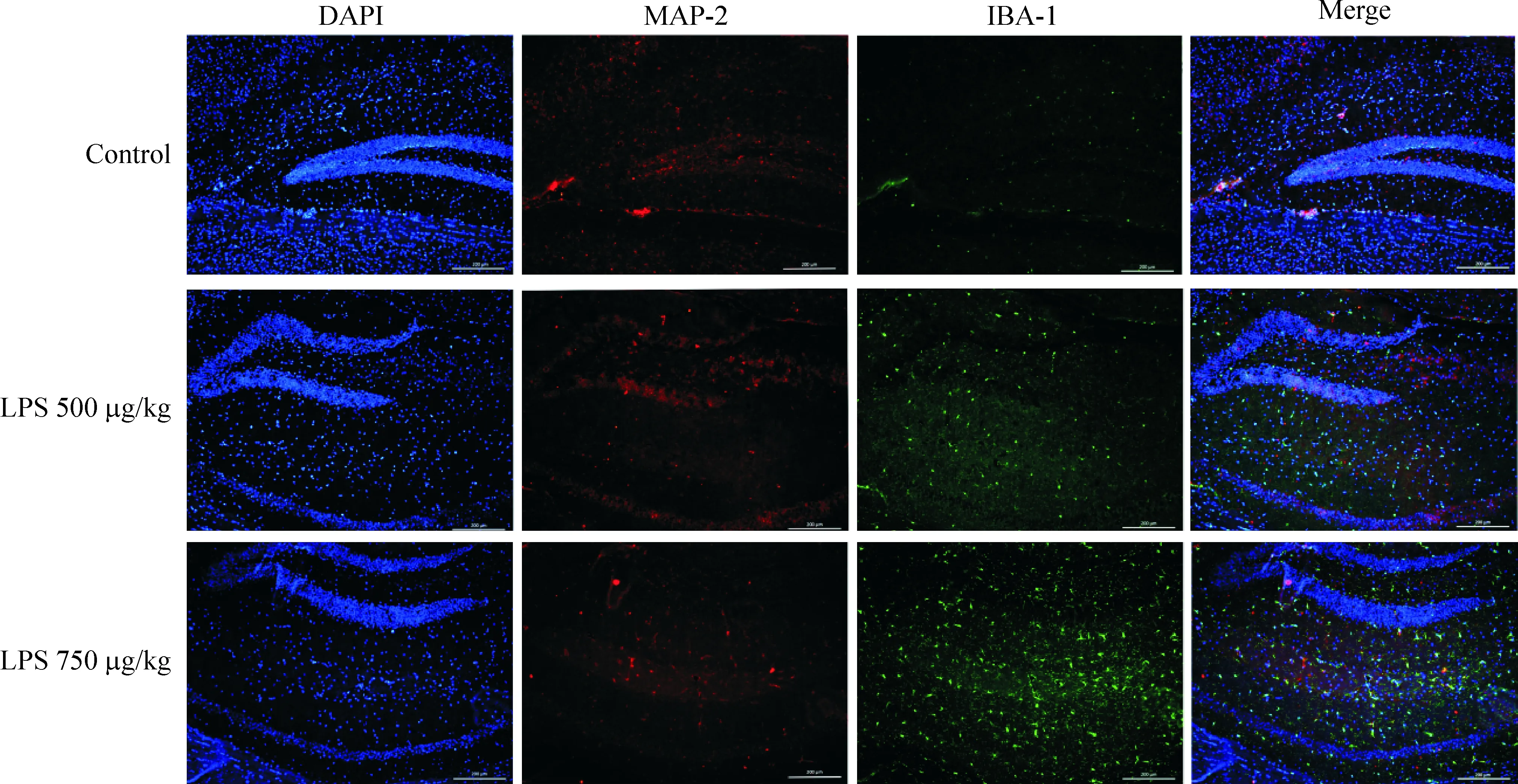
Figure 4.The expression of MAP-2 and IBA-1 in a mouse model of cognitive impairment induced by LPS (×200).
圖4 LPS誘導的各組小鼠腦組織中MAP-2和IBA-1的表達
隨著近年來人們對認知功能障礙發病機制研究的重視。學者提出腦內慢性炎癥反應可能是其中一個重要的病理特征[16-17]。同時在許多神經炎癥或由神經炎癥引起的認知功能障礙中可觀察到變性的神經元周圍有大量激活的小膠質細胞積聚。
小膠質細胞是中樞神經系統(central nervous system,CNS)的固有免疫細胞。國內外研究總體認為小膠質細胞在認知功能障礙中起到“雙刃劍”的作用[18-19]。正常狀態下的小膠質細胞本身具有吞飲和遷移能力,可以有效清除代謝產物和毒性物質,很好地起到了凈化作用[20-21]。受到適當的機械損傷或炎癥刺激時,小膠質細胞被迅速激活,發生形態學的變化,并遷移到病變部位,清除損傷的細胞碎片從而發揮免疫防御功能。此外,還會釋放一些營養因子為附近的神經元提高營養支持。但是,如果小膠質細胞受到持續性刺激,則轉變成“過度活化”狀態,將不可控的釋放大量的炎癥因子(TNF-α、IL-1、NO和PGE2等)造成神經元的死亡,從而引起CNS內眾多疾病(認知功能障礙,中樞神經系統感染,腦外傷等)。
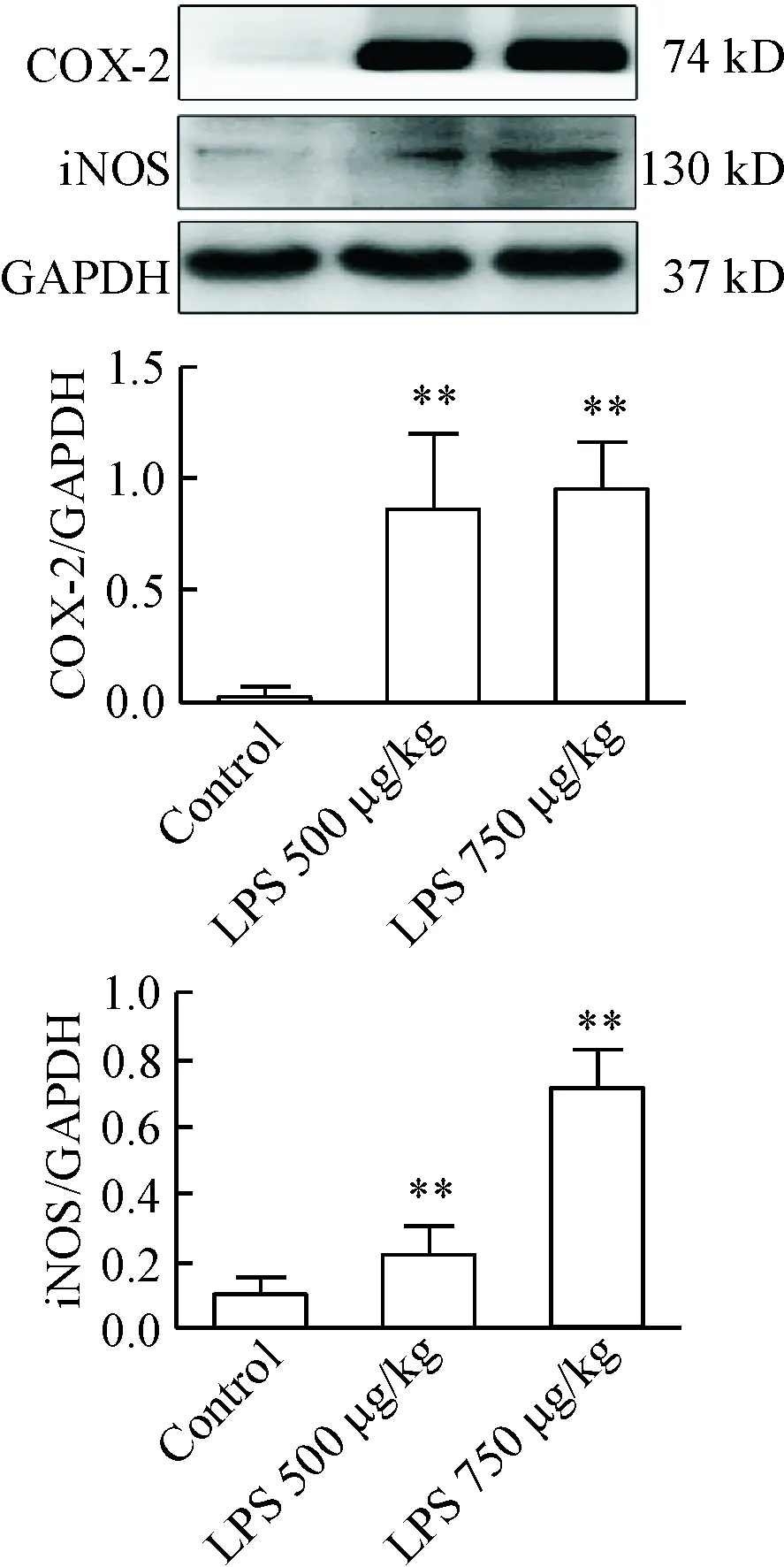
Figure 5.LPS induced COX-2 and iNOS expression in the hippocampus determined by Western blot analysis. Mean±SEM.n=15.*P<0.05,**P<0.01vscontrol group;#P<0.05vsLPS 750 μg/kg group.
圖5 LPS對小鼠腦組織中COX-2和iNOS蛋白表達的影響
近期的文獻報道[21],腹腔注射LPS引起的外周炎癥可進入缺乏血腦屏障的腦室周圍,作用于腦實質激活CNS中的小膠質細胞進一步引起神經炎癥導致認知功能障礙[22-23]。在本實驗中,我們用腹腔注射LPS的方法較好地復制了小鼠認知功能障礙的模型。首先我們運用Morris水迷宮和避暗實驗檢測小鼠的學習記憶能力。Morris水迷宮是心理學家Morris上世紀80年代初設計的用來研究小鼠學習記憶的裝置,它是考察小鼠的學習記憶能力的經典行為學檢測方法,主要由定位航行試驗和空間探索試驗2個部分相互承接而組成[24]。其中,定位航行試驗主要用來考察小鼠尋找隱藏在水下平臺的能力,可以間接地反映出小鼠在水迷宮中的學習記憶能力,而空間探索試驗主要反映小鼠對空間記憶的保持能力。Lee等[25]及Jain等[26]通過行為實驗方法發現,腹腔注射LPS可以使小鼠學習和記憶能力明顯降低。在本實驗中我們發現LPS組小鼠較正常對照組逃避潛伏期明顯增加,穿越平臺數和目標象限停留時間明顯減少。其中LPS 750 μg/kg組比500 μg/kg組學習記憶能力損傷更為明顯、持續時間更長。小鼠屬夜行動物,喜好黑暗的地方逃避光亮之地。若小鼠在暗處給予電刺激,小鼠會被迫逃回亮處,并獲得記憶。據此特性,人們設計此實驗,檢測小鼠的學習記憶能力。在避暗實驗中,通過電刺激的方法讓小鼠獲得記憶[27]。實驗結果發現,LPS組小鼠和正常對照組相比,潛伏期明顯縮短,錯誤次數明顯增加。
研究表明認知功能障礙患者體內乙酰膽堿神經元不足,膽堿乙酰轉移酶活性下降,乙酰膽堿的合成、釋放和攝取出現功能障礙,可導致運動不協調。因此我們通過爬桿實驗,觀察小鼠的運動協調情況。在爬桿實驗中,分數越高,所需時間越短,說明小鼠整個運動情況越好。結果顯示LPS組得分較正常對照組低,提示腹腔注射LPS可降低小鼠的運動協調能力。
為了進一步揭示小鼠行為學上的改變,我們觀察神經元、小膠質細胞在海馬區的形態改變。通過對各組小鼠微觀結構的觀察,LPS組小鼠海馬區活化的小膠質細胞數目及密度均增加,呈分枝狀。神經元胞體變小,突起變短,細胞數量減少。免疫熒光結果進一步揭示了LPS誘導小膠質細胞的過度活化導致小鼠認知功能的障礙。
COX是催化花生四烯酸轉變成前列腺素的限速酶,前列腺素E2被認為是前列腺素中最強的炎癥介質之一[28]。COX一般有2種同源異構體:COX-1和COX-2,同時COX-2在炎癥刺激物誘導下呈增加趨勢,并會釋放促炎因子PGE2造成中樞神經系統免疫炎癥。NO是一種在炎癥介導的認知功能障礙疾病中起到重要作用的介質。其合成主要由3種同工酶催化: 神經型一氧化氮合酶、誘導型一氧化氮合酶和內皮型一氧化氮合酶。研究報道[29],LPS、Aβ等可以刺激小膠質細胞誘導合成誘導型一氧化氮合酶iNOS,進而合成大量NO造成神經元的死亡。隨后我們用Western blot技術檢測這2個蛋白的表達情況,LPS組這2個蛋白的表達較正常組增加。
綜上所述,腹腔注射LPS可較好地模擬認知功能障礙相關的中樞神經系統免疫炎癥小鼠模型,此模型可用于認知功能障礙發病機理的研究和藥物的篩選。
[1] 中國防治認知功能障礙專家共識專家組.中國防治認知障礙專家共識[J]. 中華內科雜志, 2006, 45(2):171-173.
[2] 張振馨. 認知功能障礙研究進展[J]. 中華內科雜志, 2005, 44(9):633-634.
[3] Lee YJ, Han SB, Nam SY, et al. Inflammation and Alzheimer’s disease[J].Arch Pharm Res, 2010, 33(10):1539-1556.
[4] Perry VH, Gordon S. Macrophages and microglia in the nervous system[J]. Trends Neurosci, 1988, 11(6):273-277.
[5] Zielasek J, Hartung HP. Molecular mechanisms of microglial activation[J]. Adv Neuroimmunol, 1996, 6(2):191-202.
[6] Bhaskar K, Konerth M, Kokiko-Cochran ON, et al. Re-gulation of tau pathology by the microglial fractalkine receptor[J]. Neuron, 2010, 68(1):19-31.
[7] Iervolino A, Trisciuoglio D, Ribatti D, et al. Bcl-2 overexpression in human melanoma cells increase angiogenesis through VEGF mRNA stabilization and HIF-1-mediated transcriptional activity[J]. FASEB J, 2002, 16(11):1453-1455.
[8] Block ML, Hong JS. Microglia and inflammation-mediated neurodegeneration: multiple triggers with a common mechanism[J]. Prog Neurobiol, 2005, 76(2):77-98.
[9] Ouchi Y, Yoshikawa E, Sekine Y, et al. Microglial activation and dopamine terminal loss in early Parkinson’s disease[J]. Ann Neurol, 2005, 57(2):168-175.
[10]Block ML, Zecca L, Hong JS, et al. Microglia-mediated neurotoxicity: uncovering the molecular mechanisms[J]. Nat Rev Neurosci, 2007, 8(1):57-69.
[11]Gerhard A, Pavese N, Hotton G, et al.Invivoimaging of microglial activation with [11C](R)-PK11195 PET in idiopathic Parkinson’s disease[J]. Neurobiol Dis, 2006, 21(2):404-412.
[12]Hauss-Wegrzyniak B, Vraniak PD, Wenk GL. LPS induced neuroinflammtory effects do not recover with time[J]. Neuroreport, 2000, 11(8):1759-1763.
[13] 李艷花, 和 青, 尉杰忠, 等. 硫辛酸對LPS誘導的帕金森病小鼠黑質多巴胺能神經元損傷的影響[J]. 中國病理生理雜志, 2015, 31(2):201-206.
[14]Eriksson C, Nobel S, Winblad B, et al. Expression of IL-1 alpha and beta and IL-1 receptor antagonist mRNA in the rat central nervous system after peripheral administration of lipopolysaccharides[J]. Cytokine, 2000, 12(5):423-431.
[15]Laflamme N, Riverst S. Effects of systemic immunogenic insults and circulating proinflammatory cytokines on the transcriptions of the inhibitoty nuclear factor κBα within specific cellular populations of the rat brain[J]. J Neurochem, 2000, 73(1):309-321.
[16]Halliday G, Robinson SR, Shepherd C, et al. Alzheimer’s disease and inflammation: a review of cellular and therapeutic mechanisms[J]. Clin Exp Pharmacol Physiol, 2000, 27(1-2):1-8.
[17]Guo JT, Yu J, Grass D, et al. Inflammation-dependent cerebral deposition of serum amyloid a protein in a mouse model of amyloidosis[J]. J Neurosci, 2002, 22(14):5900-5909.
[18]Kauppinen TM, Suh SW, Higashi Y, et al. Poly(ADP-ribose) polymerase-1 modulates microglial responses to amyloid beta[J]. J Neuroinflammation, 2011, 8(1): 1-17.
[19]Block MI, Hong JS. Chronic microglial activation and progressive dopaminergic neurotoxicity[J]. Biochem Soc Trans, 2007, 35(5):1127-1132.
[20]Morgan D, Gordon MN, Tan J, et al. Dynamic complexity of the microglia activation response in transgenic models of amyloid deposition:implications for Alzheimer therapeutics[J]. J Neuropathol Exp Neurol, 2005, 64(9):743-753.
[21]Kettenmann H, Hanisch UK, Noda M, et al. Physiology of microglia[J]. Physiol Rev, 2011, 91(2):461-553.
[22]Teeling JL, Perry VH. Systemic infection and inflammation in acute CNS injury and chronic neurodegeneration:underlying mechanisms[J]. Neuroscience, 2009, 158(3):1062-1073.
[23]談丹丹, 洪道俊, 徐仁伵, 等. 神經膠質細胞和神經退行性疾病[J]. 中國老年學雜志, 2013, 1(33):464-466.
[24]Brandeis R, Brandys Y, Yehuda S. The use of the Morris water maze in the study of memory and learning[J]. Int J Neurosci, 1989, 48(1-2):29-69.
[25]Lee JW, Lee YK, Yuk DY, et al. Neuro-inflammation induced by lipopolysaccharide causes cognitive impairment through enhancement of beta-amyloid generation[J]. J Neuroinflammation, 2008, 5:37.
[26]Jain NK, Patil CS, Kulkarni SK, et al. Modulatory role of cyclooxygenase inhibitors in aging- and scopolamine or lipopolysaccharide-induced cognitive dysfunction in mice [J]. Behav Brain Res, 2002, 133(2):369-376.
[27]Jarvik ME, Kopp R. An improved one-trial passive avoi-dance learning situation[J]. Psychol Rep, 1967, 21(1):221-224.
[28]Ramsy RG, Ciznadija D, Vanevski M, et al. Transcriptional regulation of cyclo-oxygenase expression: three pillars of control[J]. Int J Immunopathol Pharmacol, 2003, 16(2 Suppl):59-67.
[29]Yu WF, Guan ZZ, Bogdanovc N, et al. Hign selective expression of α7 nicotinic receptors on astrocytes in the brains of patients with sporadic Alzheimer’s disease and patients carrying Swedish APP670/671 mutation: a possible association with neuritic plaques[J]. Exp Neurol, 2005, 192(2):215-225.
(責任編輯: 林白霜, 羅 森)
Model of neuroinflammation associated with cognitive dysfunction established by intraperitoneal injection of LPS
CHENG Xiao-feng1,ZHAO Jia-yi2, YUAN Yu2, LAN Xin2, YUAN Qiong-ru2, HUANG Cui-qin2, LU Da-xiang2, ZHU Li-hong2, BI Wei1
(1TheFirstAffiliatedHospital,2DepartmentofPathophysiology,KeyLaboratoryofStateAdministrationofTraditionalChineseMedicine,SchoolofMedicine,JinanUniversity,Guangzhou510632,China.E-mail:biwei4762@sina.com)
AIM: To establish a mouse model of immuno-inflammation in central nervous system (CNS) associated with cognitive dysfunction. METHODS: C57BL/6J male mice were divided into 3 groups.Lipopolysaccharide (LPS) was intraperitoneally injected into the mice to induce cognitive impairment. Morris water maze test, passive avoidance test and pole test were used to observe the behavioral changes of mice. The histomorphology was analyzed by the method of immunofluorescence. The detailed molecular mechanism was determined by Western blot. RESULTS: Compared with saline group, LPS induced mouse sickness behavior and memory loss. Microglia activation and neuronal loss in the hippocampus were observed. The expression of neuroinflammatory proteins COX-2 and iNOS in the brain of LPS-induced mice was increased. CONCLUSION: Intraperitoneal injection of LPS induces cognitive dysfunction in mice.
Cognitive dysfunction; Lipopolysaccharide; Neuroinflammation
1000- 4718(2017)05- 0890- 06
2017- 01- 19
2017- 03- 14
國家自然科學基金資助項目(No. 81371442);廣東省高等學校優秀青年教師培養計劃(No. YQ2015024);廣州市科技計劃珠江科技新星專項(No. 201506010095)
R363.2; R749.7+9
A
10.3969/j.issn.1000- 4718.2017.05.020
雜志網址: http://www.cjpp.net
△通訊作者 Tel: 020-38688709; E-mail: biwei4762@sina.com
▲并列第1作者

