棒葉蕨藻變種對重金屬Cu2+、Pb2+和Cd2+脅迫的生理響應
王榮霞黃 敏陳傅曉譚 圍
(1海南省海洋與漁業科學院,海南海口570203;2海南省熱帶海水養殖技術重點實驗室,海南省熱帶海水養殖工程技術研究中心,海南海口570203;3南海生物資源開發與利用協同創新中心,廣東廣州510275)
棒葉蕨藻變種對重金屬Cu2+、Pb2+和Cd2+脅迫的生理響應
王榮霞1,黃 敏1,2,陳傅曉1,3,譚 圍1,3
(1海南省海洋與漁業科學院,海南海口570203;2海南省熱帶海水養殖技術重點實驗室,海南省熱帶海水養殖工程技術研究中心,海南海口570203;3南海生物資源開發與利用協同創新中心,廣東廣州510275)
為研究棒葉蕨藻變種(Caulerpa sertularoides f.Longipes)對重金屬離子脅迫的生理響應,通過恒溫光照培養方法探討棒葉蕨藻變種在重金屬銅離子(Cu2+)、鉛離子(Pb2+)、鎘離子(Cd2+)的脅迫下對其日特定生長率(SGR)、可溶性蛋白含量、葉綠素a(Chl-a)、谷胱甘肽轉移酶(GST)和超氧化物歧化酶(SOD)等指標的影響。結果顯示,3種重金屬離子的脅迫會影響藻體的正常生長,SGR均出現負增長,可溶性蛋白和Chl-a含量隨處理濃度的增大而呈下降趨勢,其中Cu2+的影響尤為明顯;重金屬對藻體生長的抑制能力大小為Cu2+>Pb2+>Cd2+;3種重金屬離子對SOD和GST影響均表現為先升后降趨勢,除了Cd2+對SOD影響峰值出現在5.00 mg/L之外,其他處理組的峰值均出現在質量濃度為2.50mg/L時。研究結果可為棒葉蕨藻變種的重金屬脅迫機理研究提供參考。
棒葉蕨藻變種;重金屬;脅迫;生理響應
海藻與植物一樣,體內產生的活性氧與其清除系統保持著動態的平衡,當環境中存在逆境脅迫時,抗氧化系統會增強,從而達到對抗逆境的作用[1]。重金屬對水體的污染日漸嚴重,如果重金屬脅迫長期存在,植物細胞會產生大量自由基損傷細胞膜中不飽和脂肪酸和蛋白質,使細胞膜結構松散,嚴重時會影響細胞膜的結構和功能,對藻體產生巨大傷害甚至死亡[2-4]。國內有關海藻重金屬脅迫下抗氧化系統的響應有少量的報道研究,如:鈍頂螺旋藻在CdCl2脅迫下,超氧化物歧化酶(SOD)和過氧化物酶(POD)活性隨著濃度增加呈現出先上升后下降的規律[5];龍須菜隨著Cd2+濃度的升高,其生長受到抑制,藻紅素、葉綠素a、可溶性蛋白均呈下降趨勢[6]。
棒葉蕨藻變種 (Caulerpa sertularoides f.Longipes)屬于綠藻門,綠藻綱,蕨藻目,蕨藻科,蕨藻屬。對棒葉蕨藻變種的研究主要集中在養殖廢水中的氨氮、硝酸鹽氮的吸收[7],以及南美白對蝦[8]和番紅硨磲[9]生態養殖模式構建等方面,而其對重金屬離子脅迫的生理響應等方面的文獻報道甚少。本研究著重針對棒葉蕨藻變種對重金屬Cu2+、Pb2+、Cd2+脅迫的生理響應,旨在深入探討重金屬對大型海藻藻體內的生理生化指征的影響,為重金屬脅迫機理研究以及大型海藻進行養殖廢水處理、改善海區環境研究提供應用參考。
1 材料與方法
1.1 材料及處理
棒葉蕨藻變種取自海南省三沙市西沙海域的珊瑚礁盤上,先在室外大量擴繁,再在智能人工氣候培養箱(賽福PRX-350B)中暫養。培養條件:溫度25℃,光照度為8 000~9 000 Lx,鹽度31。
1.2 方法
設置3組培養液:Cu2+(A組)、Pb2+(B組)、Cd2+(C組)。每組培養液設計一個空白對照(0.00 mg/L)和 5個濃度梯度,分別為 0.05、0.50、2.50、5.00和10.00 mg/L。空白對照組分別標記為A0、B0和C0,0.05 mg/L實驗組標記分別為A1、B1和C1,其他組別以此類推。實驗用1 L燒杯裝800 mL培養液,在每個燒杯中接種3 g健康藻體,每組金屬離子培養液各濃度梯度均設平行3組,培養6 d,每天對培養的棒葉蕨藻變種進行觀察,并紀錄表征變化情況。在第6天分別測定日特定生長率(SGR)、可溶性蛋白含量、谷胱甘肽-s轉移酶(GST)、超氧化物歧化酶(SOD)活性等指標。
特定生長率(SGR)計算公式:
FSGR=[(Wt/W0)1/t-1]×100%
式中:W0—初始時刻棒葉蕨藻變種的鮮重,g;Wt—t時刻棒葉蕨藻變種的鮮重,g;t—兩次測定間隔時間,d;FSGR—特定生長率,%/d。
葉綠素a測定參照劉濤等[10]方法,可溶性蛋白、谷胱甘肽-s轉移酶(GST)、超氧化物歧化酶(SOD)活性的測定分別采用南京建成生物公司購買的可溶性蛋白、谷胱甘肽-s轉移酶(GST)、超氧化物歧化酶(SOD)試劑盒測定。
1.3 數據處理
用Excel軟件進行數據處理。SGR等指標在系列濃度重金屬下的變化趨勢采用線性回歸分析(Linear Regression Analysis)方法進行分析。
2 結果
2.1 藻體的表征變化
A0、B0和C0組連續培養6 d,藻體正常。A2組和A3組在培養的第2天藻體棒葉開始出現白化,而A4和A5組在培養的第2天藻體棒葉、假根出現白化和變細。至第6天,A1和A2組棒葉、假根白化、變軟;A3、A4和A5組藻體則出現部分白化。在第3天,B3、B4和B5組藻體棒葉、假根開始出現少量白化現象;至第6天,B3、B4和B5組藻體匍匐枝、直立枝、棒葉、假根均出現了白化、脫落,B5組部分藻體出現潰爛,B1和B2組藻體的棒葉、假根開始出現白化和變細;C2、C3、C4和C5組的藻體匍匐枝出現白化、變細,直立枝、棒葉、假根出現白化、脫落。至第6天,C4和C5組的藻體匍匐枝、直立枝、棒葉、假根均出現嚴重白化、脫落現象;至第6天,C1和C2組藻體的棒葉、假根開始出現白化、變軟。
2.2 日特定生長率的變化
圖1顯示了藻體在培養第6天的FSGR值,其與Cu2+、Pb2+、Cd2+質量濃度均呈現出負相關性(R2分別為0.917、0.980、0.978),表明藻體的FSGR隨著Cu2+、Pb2+、Cd2+質量濃度增加而下降,出現了負增長,其中Cu2+的下降速率(k=-1.775)大于Pb2+(k=-1.040)、Cd2+(k=-0.942)。由圖1可以看出,A1組(FSGR=-3.13%/d)在培養的第6天對藻體的生長起到非常明顯的抑制作用,而B1組(FSGR=-0.33%/d)和C1組(FSGR=-0.39%/d)對藻體的抑制作用遠小于A1組。
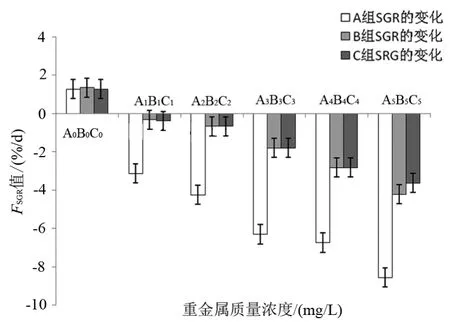
圖1 SGR隨Cu2+、Pb2+、Cd2+質量濃度變化情況Fig.1 Changes of SGR according to Cu2+,Pb2+and Cd2+concentrations
2.3 可溶性蛋白含量的變化
藻體的可溶性蛋白與Cu2+、Pb2+、Cd2+質量濃度均呈現出負相關性(R2分別為0.905,0.943,0.976),表明藻體的可溶性蛋白含量隨著Cu2+、Pb2+、Cd2+質量濃度的增大而呈下降趨勢(圖2)。

圖2 不同Cu2+、Pb2+、Cd2+質量濃度下可溶性蛋白含量變化Fig.2 Changes of soluble proteins according to different Cu2+,Pb2+and Cd2+concentrations
其中,A組的下降速率(k=-0.619)高于B組(k=-0.588)和C組(k=-0.550)。在實驗的第6天,A0、B0和C0組的可溶性蛋白含量分別為3.30、3.06和3.14 mg/g;A1、B1和C1組可溶性蛋白含量僅為A0、B0和C0組的59.1%、91.2%和89.6%;而A5、B5和C5組在實驗的第6天分別降至0.11、0.22和0.32 mg/g。
2.4 葉綠素a含量的變化
圖3表明,Cu2+、Pb2+、Cd2+對藻體Chl-a含量的影響與可溶性蛋白的相似,藻體Chl-a的含量隨著Cu2+、Pb2+、Cd2+處理濃度的增大而呈下降趨勢,其中A組的下降最為明顯,B組次之。實驗第6天,A0、B0和C0組的Chl-a含量分別為0.53、0.52和0.56 mg/g,是A3組的6.2倍、B3和C3組的2倍。
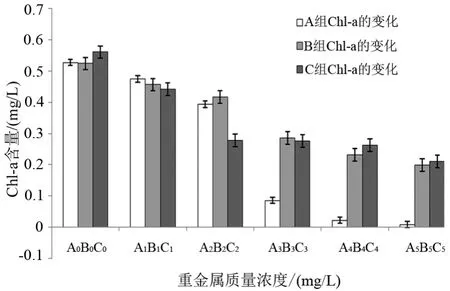
圖3 不同Cu2+、Pb2+、Cd2+質量濃度下Chl-a的含量變化Fig.3 Changes of chlorophyll-a according to different Cu2+2+,Pb2+and Cd2+concentrations
2.5 超氧化物歧化酶(SOD)活性的影響
Cu2+、Pb2+、Cd2+對藻體SOD活性的影響隨著處理濃度的增加呈現出先升后降的趨勢。從圖4中可以發現,各處理組的SOD值均高于空白對照組(A0、B0和 C0),說明達到0.05 mg/L以上的Cu2+、Pb2+、Cd2+對藻體均具有脅迫作用。
實驗第6天,當A組的濃度≤2.50 mg/L時,SOD與培養液中Cu2+的濃度呈正相關;在濃度2.50 mg/L時 SOD值達到峰值(195.54 U/mg prot),為 A0組的 4倍;濃度>2.50 mg/L時,SOD值有所下降。實驗第6天,B0組的SOD值為37.89 U/mg prot,SOD隨著Pb2+濃度的增加而呈現先上升后下降的趨勢;B3組的SOD值達到峰值(111.24 U/mg prot),為B0組的2.9倍;C組與A和B組不同,其峰值(93.57 U/mg prot)出現在C4組,是C0的2.5倍。
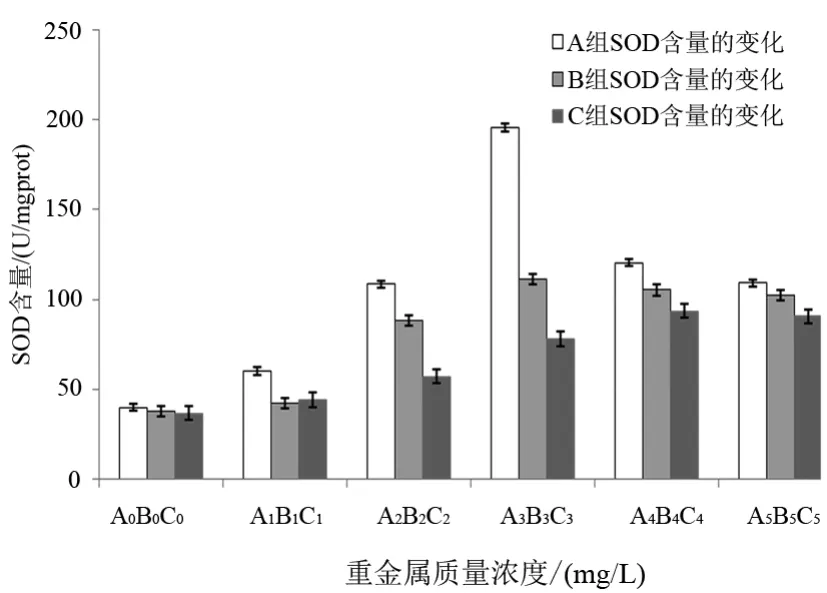
圖4 不同Cu2+、Pb2+、Cd2+質量濃度下SOD的含量變化Fig.4 Changes of SOD concentration according to different Cu2+,Pb2+and Cd2+concentrations
2.6 谷胱甘肽轉移酶(GST)活性的影響
Cu2+、Pb2+、Cd2+對藻體GST活性的影響隨著處理濃度的增加呈現出先升后降的趨勢。從圖5可以發現,所有的濃度處理組的GST值均高于空白對照組(A0、B0和C0),表明大于0.05 mg/L的3種重金屬離子對藻體均具有脅迫作用。

圖5 不同Cu2+、Pb2+、Cd2+質量濃度下GST的含量變化Fig.5 Changes of GST concentration according to Cu2+,Pb2+and Cd2+concentrations
實驗第6天,A0組GST為15.11U/mg prot,當Cu2+的濃度≤2.50mg/L時,GST與培養液中Cu2+的濃度呈正相關,峰值(104.56 U/mg prot)出現在A3組,是A0組的6.9倍;濃度>2.50 mg/L時,GST值雖有所下降,但仍高于較低濃度組。實驗第6天,GST隨著Pb2+濃度的增加而呈現先上升后下降的趨勢,B3組的 GST達到峰值(100.76 U/mg prot),為 B0組的 9倍。實驗第6天,C0組的GST為10.98U/mg prot,當Cd2+的濃度≤2.50 mg/L時,GST與Cd2+的濃度呈正相關性,C3組的 GST達到所有實驗組的峰值(158.33 U/mg prot),為C0組的14倍。
3 討論
3.1 對藻體生長的影響
棒葉蕨藻變種是一種適應能力非常強的藻類,其生長速度較快,具有吸收養殖廢水中氨氮和硝酸鹽氮的能力[7]。研究表明,重金屬能夠直接或間接作用于生物體DNA,會引起海洋生物的遺傳物質發生突變,引起生長緩慢、異常發展,降低胚胎、幼體及成體的存活率,通過敏感種的滅絕,導致生態退化,對生態系統構成直接和間接的威脅[11-13]。本實驗結果顯示,Cu2+、Pb2+、Cd2+的脅迫會影響藻體的正常生長。在培養第6天,藻體均出現不同程度的白化和脫落現象,SGR出現負增長,Cu2+、Pb2+、Cd2+濃度越大對藻體生長的抑制越大,且Cu2+的毒性大于Pb2+和Cd2+,表明重金屬對藻體生長的抑制能力大小依次為Cu2+>Pb2+>Cd2+。
3.2 對藻體生化特征的影響
植物在受到重金屬污染時,細胞膜的通透性會改變,對葉綠體、線粒體、細胞核等亞顯微結構有一定程度的破壞[14]。大型海藻是地球重要的生產者之一,光合色素和捕光色素蛋白種類繁多,其中大多數藻類光能傳遞的順序為類胡蘿卜素→Chl-b→Chl-a。Chl-a的含量能代表海藻的生產力。重金屬的污染會破壞葉綠體膜系統,過量的重金屬甚至會破壞葉綠體的結構,重金屬的存在一定程度上阻礙了植物對其他營養元素的吸收,阻斷了營養元素的運輸,影響了葉綠素的正常合成[14]。本實驗中,隨著Cu2+、Pb2+、Cd2+濃度的增長,Chl-a含量呈下降趨勢,A組下降尤為明顯。
可溶性蛋白是植物的滲透調節劑之一,是植物適應環境、增強抗逆性的基礎[15]。研究發現,低濃度的Pb2+對細基江蘺可溶性蛋白的影響不顯著,但高濃度(大于5.00 mg/L)的Pb2+存在顯著的影響[16]。本實驗中,隨著Cu2+、Pb2+、Cd2+濃度的增長,可溶性蛋白含量越來越低,說明濃度越高,藻體對環境的脅迫響應越明顯,其中A組的可溶性蛋白含量下降比B、C組明顯。
實驗結果表明,藻體對重金屬 Cu2+、Pb2+、Cd2+毒害的生理響應機理是隨著重金屬離子濃度的增加,Chl-a和可溶性蛋白含量逐漸下降,這可能是由于重金屬離子影響了藻體葉綠素的合成,或者直接破壞了葉綠體的結構,加劇影響藻體的光合作用。隨著重金屬離子濃度和處理時間的增加,重金屬離子與-SH基結合導致蛋白變形,也可能是重金屬取代了酶蛋白的活性中心,影響了酶的活性,導致蛋白質合成受阻。因此,可溶性蛋白隨著實驗組濃度的增加而迅速下降,抗氧化系統的平衡隨之被打破,相應的抗氧化酶含量也出現變化。
3.3 對藻體抗氧化系統的影響
超氧化物歧化酶(SOD)和谷胱甘肽轉移酶(GST)是植物抗氧化系統的兩種關鍵酶。藻體內SOD和GST含量的增加表明了藻體對重金屬Cu2+、Pb2+、Cd2+的脅迫做出了相應的生理響應,增強了藻體對逆境的耐受力。
SOD是一種酸性蛋白,是清除活性氧反應過程中第一個發揮作用的抗氧化酶,它能催化超氧陰離子自由基發生歧化反應,生成O2和H2O,避免由O-2生成破壞力更強大的羥自由基[17]。本實驗結果顯示,3種重金屬離子對SOD影響的變化趨勢相似,均為先升后降。A、B組以2.50 mg/L為界限,濃度≤2.50 mg/L時SOD呈現正相關,濃度>2.50 mg/L時為負相關(C組SOD影響峰值則出現在C4組)。這是因為Cu2+、Pb2+、Cd2+能激發棒葉蕨藻變種自身的抗逆境體系,誘導SOD活性增加,但這種應激的調節能力是相對有限的,當脅迫強度增強至某一閾值時,SOD活力就出現了下降。實驗還發現,SOD對 Cu2+的響應比 Pb2+和Cd2+要靈敏,A3組中Cu2+的SOD含量分別為B3、C3組的1.75倍和2.5倍,出現這種情況可能與藻體中金屬結合蛋白 Cu/Zn-SOD有一定的關系[18]。
GST是動植物重要的解毒酶,其分布廣泛且功能多樣,主要參與外源性有毒物質的解毒過程[19]。實驗中,GST的變化與A、B和C組SOD變化相似,以2.50 mg/L為界,濃度≤2.50 mg/L時GST呈正相關,濃度>2.50 mg/L的GST呈負相關。這說明在濃度較低時,藻體在較低濃度的Cu2+、Pb2+、Cd2+外源有毒物質的脅迫下,能增強體內的GST活性來緩解有毒物質的毒害作用。但隨著有毒物質濃度的增大,GST的活性也隨之降低,說明GST對重金屬Cu2+、Pb2+、Cd2+的耐受力也是相對有限的。GST可以調控谷胱甘肽(GSH)或親電基團中的巰基、咪唑基和Cd2+結合并轉移,使得細胞質中的Cd2+保持低濃度[20]。實驗中,C3組GST含量約為B3和A3組的1.56倍,可能是GST參與了細胞對重金屬Cd2+的轉移過程,使得藻體對Cd2+有一定的耐受力,這可能也是Cd2+實驗組SOD的峰值出現在C4組的原因之一。
4 結論
Cu2+、Pb2+、Cd2+三種重金屬離子的脅迫會影響藻體的正常生長,SGR均出現負增長,可溶性蛋白和Chl-a含量隨處理濃度的增大而呈下降趨勢,其中Cu2+的影響尤為明顯。重金屬對藻體生長抑制能力大小為Cu2+>Pb2+>Cd2+。三種重金屬離子對SOD和GST影響的變化趨勢相似,均表現為先升后降,除了Cd2+對SOD影響峰值出現在5.00 mg/L處理濃度之外,其他處理組的峰值均出現在濃度為2.50 mg/L時。其中,Cu2+的處理濃度為2.50 mg/L時,SOD值達到峰值(195.54 U/mg prot);Cd2+的處理濃度為2.50 mg/L時,GST達到峰值(158.33 U/mg prot)。本研究結果可為棒葉蕨藻變種的重金屬脅迫機理研究提供參考。 □
[1] 張容芳,唐東山,劉飛.藻類抗氧化系統及其對逆境脅迫的響應[J].環境科學與管理,2011,36(12):21-25.
[2] DE VOS C H,VONK M J,VOOIJS R,et al.Glutathione depletion due to copper-induced phytochelatin synthesis causes oxidative stress inSilene cucubalus[J].Plant Physiol,1992,98(3):853-858.
[3] SCHUTZENDUBELA,POLLEA.Plant responses toabiotic stresses:heavy metal-induced oxidative stress and protection by mycorrhization[J].Journal of Experimental Botany,2002,53:1351-1365.
[4] PEREIRA P,DE PABLO H,ROSA-SANTOS F,et al.Metal accumulation and oxidative stress inUlva sp.substantiated by response integration into a general stress index[J].Aquatic Toxicology,2009,91(4):336-345.
[5] 王紅葉,楊芳,陳思嘉,等.鈍頂螺旋藻對Cd脅迫的生理反應[J].海洋環境科學,2007,26(2):151-153.
[6] 余江,楊宇峰,聶湘平,等.大型海藻龍須菜對重金屬鎘脅迫的響應[J].四川大學學報,2007,39(3):83-90.
[7] 王榮霞,黃敏,譚圍,等.羽毛藻對石斑魚養殖廢水中氮和磷的吸收特征[J].安徽農業科技,2017,45(1):89-90,104.
[8] 李衛東,王榮霞,沈銘輝,等.南美白對蝦與羽毛藻生態養殖研究[J].現代農業科技,2015(10):249-250.
[9] 譚圍,王榮霞,黃敏.番紅硨磲水泥池循環水養殖模式研究[J].安徽農業科技,2016,44(29):102-106.
[10]劉濤.大型海藻實驗技術[M].北京:海洋出版社,2016:94.
[11]AKHTERM S,AL-JOWDERO.Heavy metal concentrations in sediments from the coast of Bahrain[J].International Journal of Environmental Health Research,1997(7):85-93.
[12]TUNCER G,KARAKAST,BALKAST,et al.Land-based sources of pollution along the Black Sea coast of Turkey:Concentrations and annual loads to the Black Sea[J].Marine Pollution Bulletin,1998,36(6):409-423.
[13]陳靜生,鄧寶山,陶澍,等.環境地球化學[M].北京:海洋出版社,1990:196-235.
[14]魯先文,宋小龍,王三應,等.重金屬鉛對小麥葉綠素合成的影響[J].濰坊教育學院學報,2008,21(2):47-48,59.
[15]方志紅,董寬虎.NaCl脅迫對堿蒿可溶性糖和可溶性蛋白含量的影響[J].中國農業通報,2010,26(16):147-149.
[16]顏海波.江蘺屬海藻在N營養鹽和重金屬Pb、Cd脅迫下的生理生化響應及蛋白質組學研究[D].汕頭:汕頭大學,2010.
[17]張薇薇,黃曉林,朝霞,等.棉花酶促抗氧化系統對逆境脅迫生理響應的研究進展[J].中國農業通報,2009,25(19):108-112.
[18]時萌,王芙蓉,王棚濤.植物響應重金屬鎘脅迫的耐性機理研究進展[J].生命科學,2016,28(4):504-511.
[19]易樂飛,郝偉,李信書,等.條斑紫菜Mu型谷胱甘肽轉移酶基因克隆與分析[J].水產科學,2016,35(1):67-71.
[20]胡延玲,張春華,居婷,等.鎘脅迫下兩種水稻GSH和GST應答差異的研究[J].農業環境科學學報,2009,28(2):305-310.
The physical responses of Caulerpa sertularoides f.Longipes to heavy metal(Cu2+、Pb2+、Cd2+)stress
WANG Rongxia1,HUANG Min1,2,CHEN Fuxiao1,3,TAN Wei1,3
(1 Academy of Marine and Fishery of Hainan Province,Haikou 570203,China;2 Hainan Provincial Key Laboratory for Tropical Seawater Aquaculture Technology,Hainan Provincial Research Center for tropical seawater aquaculture Engineering technology,Haikou 570203,China;3South China Sea Bio-resource Exploitation and Utilization Collaborative Innovation Center,Guangzhou 510275,China)
In order to study the physiological responses of the algaeCaulerpa sertularoides f.Longipesto heavy metal(Cu2+,Pb2+,Cd2+)stress,constant-temperature illuminating cultivation method has been adopted to explore the influence of the stress from Cu2+,Pb2+and Cd2+on the specific growth rate(SGR),content of soluble protein,chlorophyll-a(Chl-a),glutathione-S-transferase(GST)and superoxide dismutase(SOD)of the algae.The results show that stress of the three kinds of heavy metal ions affects the normal growth of the algae;SGR showed negative growth;soluble protein and Chl-a contents decreased when the content of heavy metal ions increased;the influence of Cu2+was most obvious.The inhibition ability of heavy metals on the growth of algae was as follows:Cu2+>Pb2+>Cd2+.Both the SOD and GST contents,under the influence of the three heavy metal ions,increased first and then declined;the peak effect on the SOD concentration appeared when the concentration of Cd2+was 5 mg/L,but in other treatment groups the peak effect appeared at the concentration of 2.50 mg/L.This study will provide a scientific basis for the study on the mechanism of heavy metal stress toCaulerpa sertularoides f.Longipes.
Caulerpa sertularoides f.Longipes;Heavy metal;stress;physiological responses
10.3969/j.issn.1007?9580.2017.02.005
S955.7
A
1007-9580(2017)02-025-06
2017-01-15
海南省重點研發計劃項目(ZDYF2017027);海南省自然科學基金項目(20164167)
王榮霞(1987—),女,工程師,碩士,研究方向:大型海藻養殖與漁業生態環境。E-mail:103490682@qq.com
:譚圍(1982—),男,高級工程師,碩士,研究方向:水產經濟動物繁殖生物學。E-mail:tanwei2599@163.com

