ZnFe2O4及ZnO/ZnFe2O4復合材料的光催化性能的研究
亓淑艷+趙博超+吳超+胥煥巖


摘要:采用沉淀法制備出了ZnFe2O4及ZnO/ZnFe2O4復合材料。利用X衍射儀(XRD)及掃描電鏡(SEM)對其結構和形貌進行表征。實驗結果表明, 通過XRD可知制備出ZnFe2O4及ZnO/ZnFe2O4樣品;通過SEM可知ZnFe2O4為不規則的顆粒狀,ZnO/ZnFe2O4為球型且附著有細小顆粒。在模擬太陽光(氙燈)下用02 gZnO/ZnFe2O4對100 mL模擬有機廢水(20 mg/L的亞甲基藍)進行實驗,降解效率可達892%。
關鍵詞:ZnO/ZnFe2O4;模擬太陽光;催化氧化;亞甲基藍
DOI:1015938/jjhust201702002
中圖分類號: TQ 1324文獻標志碼: A文章編號: 1007-2683(2017)02-0007-05Investigation on the Preparation and Photocatalytic
Properties Study of ZnO/ZnFe2O4
Abstract:In this paper, ZnFe2O4 and ZnO/ZnFe2O4 were synthesized by precipitation method The structure and appearance of the synthesized nanoparticles were characterized by XRD and SEM The results show that ZnFe2O4 and ZnO/ZnFe2O4 can be successfully prepared by XRD; we can find that the ZnFe2O4 is irregular, and the ZnO/ZnFe2O4 is the ball type and the small particles are attachedA study on the photocatalytic performance of the simulated wastewater (Methylene blue) with ZnO/ZnFe2O4 under the simulated sunlight showed that the highest degradation rate could reach to 892%
Keywords:ZnO/ZnFe2O4; simulated solar; irradiation photocatalysis; methylene blue
0引言
隨著工業時代的到來,各種類型的工廠大量產生,工廠的產生自然帶來大量經濟效益,但是帶來經濟效益的同時環境也隨之被破壞了。其中廢水的污染最為嚴重,因為廢水還會污染土地、河流、海洋,而且讓人們使用受污染的水的時候人們的健康就受到了危險。因此污染的治理尤為重要,為了治理環境污染:氧化處理法、物理吸附法、凝聚法、膜分離法等方法隨之誕生,但是它們都存在著成本高、處理效率低、無法將污染物徹底氧化等不足,所以光催化氧化法因為操作簡單、適用范圍廣、成本低廉、高效等優點而受到人們的廣泛關注。其中高效的催化劑ZnO[1-4] ,TiO2[5],MgO[6-7]等。
ZnO作為半導體n型半導體材料,具有優良的性能,如它的禁帶寬度為337eV,具有良好的激子束縛能(60meV)[8-9],這有利于在室溫的條件下降低ZnO的閾值,而且還有阻礙電子和空穴復合的作用。這些優良的性質都決定了它能在紫外光下被激發。而太陽光中有包含有紫外光波段,所以作為半導體材料ZnO在光催化領域就有了發展前景。但是它的回收一直成為一個難題。近些年來具有n型半導體結構的磁性材料ZnFe2O4[10-11]廣受人們關注。雖然ZnFe2O4它的禁帶寬度(19eV)比ZnO、TiO2等材料的禁帶寬度窄,但是它有著自己獨特的屬性——磁性。磁性可以幫助它更好的回收,這樣就可以多次利用,提高利用率。
ZnO/ ZnFe2O4[12-14]與純ZnO相比雖然沒有更高的光催化性能,但是在回收方面具有很大的優勢,因此在光催化領域具有比純ZnO更為廣闊的應用前景。目前,關于ZnO復合物的制備方法有很多。主要包括模板法、電紡絲法、離子體增強化學氣相沉積法、ECV功法、水熱法、溶劑熱法等[15-19]。但是這些制備方法都存在著不足,例如火焰噴霧熱解法等的制備工藝復雜操作起來比較困難,水熱法制備的ZnO復合物具有較高的結晶度,但是反應過程中需要高溫高壓的苛刻條件,電紡絲法操作雖然簡便,但需要與高分子有機物復合,而且產品純度低。本文采用沉淀法制備ZnO。沉淀法具有效率高、沉淀顆粒大小在1μm左右且粒度均勻等優點。但是原材料硝酸鋅濃度高時產物易出現團聚現象。而且產量可隨濃度的增加而增加。操作簡單、成本低廉、便于大量生產,對現代環境治理有著重要的意義。本文采用沉淀法制備出了ZnFe2O4及ZnO/ ZnFe2O4樣品,通過XRD和SEM手段對其結構和形貌進行了表征,進行了初步的研究。
1實驗
11實驗藥品
本實驗主要化學試劑:Zn(NO3)2·6H2O、Fe(NO3)3·9H2O、CO(CH2CH2O)nH、NH3·H2O、C16H18ClH35·3H2O均為分析純
12ZnFe2O4的制備
按照比例稱量609g Zn(NO3)2·6H2O和83gFe(NO3)3·9H2O放入燒杯中,加入750mL水,將混合鹽溶液放在70℃的水浴鍋中保溫并且攪拌。硝酸鋅與氨水的物質的量比為8∶1來配制硝酸鋅溶液。配制聚乙二醇(PEG)氨水的混合溶液130mL,緩慢滴加到Zn(NO3)2·6H2O、Fe(NO3)3·9H2O的混合溶液中為使其充分反應8h。待反應結束,靜置使溶液溫度冷卻到室溫。然后在砂芯漏斗中加入濾膜再抽濾,分別用蒸餾水和酒精清洗數次。將濾餅取出,并放入恒溫烘箱中,溫度設置為60℃烘干6h,得到ZnFe2O4復合粉體。
13ZnO/ ZnFe2O4的制備
配制硝酸鋅溶液,按照目標產物的化學式中各元素化學計量比計算硝酸鋅的用量。硝酸鋅與氨水的物質的量比為8∶1來配制硝酸鋅溶液。計算出六水合硝酸鋅的用量為609g。用天平稱取定量的藥品,放入燒杯中與750mL水混合配制成溶液,將鹽溶液放在70℃的水浴鍋中保溫并且攪拌,在溶液中加入一定量已制備好的ZnFe2O4。配制PEG和氨水的混合溶液,然后向燒杯中緩慢滴加氨水和PEG的混合溶液為使其充分反應8h。將燒杯從水浴鍋中取出,靜置使溶液溫度冷卻到室溫。然后在砂芯漏斗中加入濾膜再抽濾,分別用蒸餾水和酒精清洗數次。將濾餅取出,并放入恒溫烘箱中,溫度設置為60℃烘干6h,得到ZnO/ZnFe2O4復合粉體。
14表征手段
使用日本理學公司生產的,型號為D/MAX3B型X射線衍射儀(XRD)分析樣品結構,掃描范圍10°~80°。使用英國Camscan生產的掃描電鏡(SEM)分析其形貌。模擬光源是用北京紐比特科技公司生產的氙燈。分析濃度的變化是用上海生產的722型分光光度計測量樣品的吸光度,然后通過計算反應其濃度變化。
15光催化實驗步驟
1)配制20mg/L的亞甲基藍溶液作為實驗室模擬廢水,取35mL溶液用722分光光度儀測其吸光度,記為溶液初始吸光度;
2)將100mL濃度為20mg/L的亞甲基藍溶液倒入250mL燒杯中,稱量02g樣品放入燒杯中;
3)將裝置置于模擬太陽光燈下,用磁力攪拌。每隔30min取上層液5mL上層液用離心管,然后在離心機中離心,取上層清液讓入比色皿中后測其吸光度并記錄;
4)計算亞甲基藍的溶液脫色率,并繪制脫色率與時間的變化曲線。
實驗采用分光光度計來定性測量亞甲基藍溶液濃度的變化。分光光度計采用一個可以產生多個波長的光源,通過系列分光裝置,從而產生特定波長的光源(本實驗中測量亞甲基藍的吸光度在664nm下進行)。光源透過測試的樣品后,部分光源被吸收,計算樣品的吸光值,從而轉化成樣品的濃度,樣品的吸光值與樣品的濃度在一定范圍內成正比。根據濃度的大小就可以判斷出哪種溫度下制備的ZnO及其復合物的降解亞甲基藍的能力更強。
16光催化實驗回收步驟
1)配制20mg/L的亞甲基藍溶液作為實驗室模擬廢水,取35mL溶液用722分光光度儀測其吸光度,記為溶液初始吸光度;
2)將100mL濃度為20mg/L的亞甲基藍溶液倒入250mL燒杯1中,稱量02g樣品放入燒杯中;
3)將裝置置于模擬太陽光燈下,用磁力攪拌。每隔30min取上層液5mL上層液用離心管,然后在離心機中離心,取上層清液讓入比色皿中后測其吸光度并記錄,離心管的下層懸濁液收集在燒杯2中;
4)待反應結束后,將燒杯1中的懸濁液用離心管洗滌,洗滌干凈過放入燒杯2中,放入干燥箱中干燥;
5)計算亞甲基藍的溶液脫色率,并繪制脫色率與時間的變化曲線。
2表征
21物相分析
圖1ZnFe2O4的XRD圖圖1為所制得的基準樣品ZnFe2O4的XRD圖。在圖中顯示了2θ角對應的衍射晶面為(111)、(220)、(311)、(222)、(400)、(422)、(511)、(440)、(620)、(533)和(622),標準ZnFe2O4的PDF號為22-1012。從圖中可以看出, XRD圖譜中沒有雜相峰出現,所有峰出現的位置都與標準圖譜PDF 22-1012相一致,證明所制樣品為尖晶石型鐵氧體且衍射峰強度較高,峰型窄結晶度較好。
圖2為不同配比的ZnO/ ZnFe2O4的XRD圖,可以看到在2θ=31880,34410,36260, 47520,56700,62800,66800,67900,6900處,分別對應六方晶相ZnO的(100),(002),(101),(102),(110),(l03),(200), (201),(112)晶面。而且在圖中顯示了衍射峰分別為(111)、(220)、(311)、(222)、(400)、(422)、(511)、(440)、(620)、(533)和(622)的鐵酸鋅衍射峰。由此可知氧化鋅與鐵酸鋅復合的很好。由這5條曲線還可看出10∶5的衍射峰最寬,證明ZnO晶粒成長的不好。而其它4個衍射峰相對而言比較窄,尤其是10∶1和10∶2的衍射峰最窄,這證明復合量越少越有利于ZnO的結晶長大。
22形貌分析
圖3 為ZnFe2O4及ZnO/ZnFe2O4的SEM圖。圖a)為鐵酸鋅的SEM圖,從圖a中可以看出ZnFe2O4的粒徑要大于氧化鋅的粒徑。而從其它復合圖片中可以看出大粒徑的ZnFe2O4已經沒有了,可能是在ZnO形成的過程中兩者相互作用使ZnFe2O4的粒徑減小。圖b)、c)、d)中粒子的形狀大多為球形而且粒徑大體一樣。但也有些略微的變化,能從圖中看出氧化鋅的形貌在從球型到橢球形過渡。圖e)中看出其粒徑略微變小。圖f)中可以看出粒徑明顯比其它樣品小,而且形狀有所變化。證明隨鐵酸鋅量影響氧化鋅晶粒的長大。
23降解亞甲基藍的脫色率分析
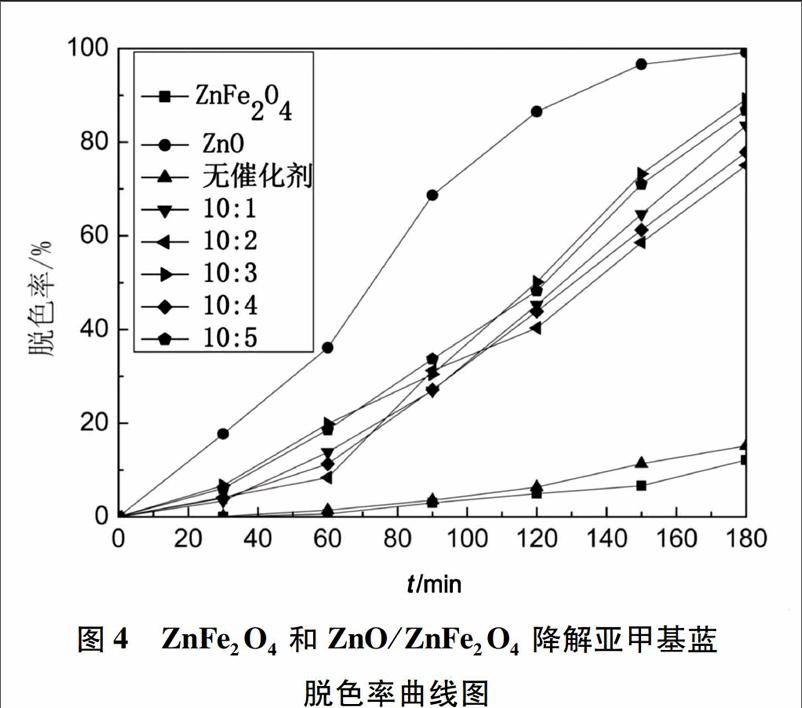
圖4為ZnO/ZnFe2O4在模擬太陽光下處理亞甲基藍模擬廢水的脫色率變化圖。
從圖4中可以看出,單獨ZnO的催化效果很好。單獨使用ZnFe2O4降解亞甲基藍的效果非常不好,證明ZnFe2O4在模擬太陽光基本對解亞甲基藍不產生降解作用。而ZnO與ZnFe2O4復合之后,相對于ZnFe2O4的催化效果明顯提高,都為75%以上。這5種復合物降解效率相差不大,降解率都能達到75%以上。但是復合鐵酸鋅就是為了想回收氧化鋅,所以首選ZnFe2O4的量最多的樣品。因為ZnFe2O4具有很好的磁性,它的含量越高磁性就越大,在脫色率相差不大的情況下, ZnO∶ZnFe2O4=10∶5的復合物為最優的選擇。
產生這樣結果,原因可能是:ZnFe2O4與ZnO相比導帶的電位更顯負電性,而ZnO與ZnFe2O4相比價帶的點位更顯正電性,所以光生電子能從ZnFe2O4的導帶遷移到ZnO導帶,而空穴卻停留在ZnFe2O4的價帶,從而減小了電子和空穴復合的幾率[20]。所以·OH(羥基自由基)會在ZnFe2O4粒子的表面上大量產生,提升其對亞甲基藍分子的催化氧化降解速度。另一方面,由于ZnO/ ZnFe2O4粒子較小,所以具有很大的比表面積可提供更多的表面活性位,提高了光催化活性。
24多次回收ZnO/ZnFe2O4的光降解分析
圖5為ZnO/ZnFe2O4比例為10∶5的樣品經過多次回收降解亞甲基藍圖。五次的回收率分別為925%、85%、775%、55%、40%,它們分別降解018mg/L、017mg/L、015mg/L、011mg/L、008mg/L的亞甲基藍溶液。雖然復合物的降解率不如ZnO的降解率,但是由于鐵酸鋅有磁性,所以這樣對ZnO的回收具有很重要的意義。雖然每次回收后質量都在減少,但是其降解的效率基本不會產生太大的變化。這說明ZnO∶ZnFe2O4=10∶5可以多次的循環使用,而且降解效率不會因為回收次數增多而受到影響。
2結論
本文將已經制備好的ZnOFe2O4加入到ZnO的制備過程中,得到不同配比樣品ZnO/ZnOFe2O4的復合材料。通過物相和形貌進行了分析,發現體系當中含有ZnO和ZnOFe2O4兩相,形貌均為球形。通過光催化結果顯示,ZnO∶ZnOFe2O4=10∶3的降解亞甲基藍效果最佳,降解率為892%。產生這樣的原因可能是由于ZnFe2O4與ZnO相比導帶的電位更顯負導致電子和空穴復合的幾率降低,從而提升了光催化效果。
參 考 文 獻:
[1]GHIMPU L, REIMER T, SMAZNA D, et al Photocatalytic Applications of Doped Zinc Oxide Porous Films Grown by Magnetron Sputtering[C]// 3rd International Conference on Nanotechnologies and Biomedical Engineering, 2016, 55:353-356
[2]HU Junjie, YUAN Hai, LI Peng, et al Synthesis and Photocatalytic Activity of ZnOAu25 Nanocomposites [J]. Science China Chemistry, 2015,59(3): 1-5
[3]ARJUNAN Nithya, KANDASAMY, JOTHIVENKATACHALAM Chitosan Assisted Synthesis of ZnO Nanoparticles: An Efficient Solar Light Driven Photocatalyst and Evaluation of Antibacterial Activity [J]. Journal of Materials Science: Materials in Electronics, 2015, 26(12): 10207-10216
[4]賈相華, 黃海亮, 付斯年 不同襯底溫度對ZnO薄膜結構和光學性質的影響[J]. 哈爾濱理工大學學報, 2014, (1): 108-111
[5]丁軍, 吳澤, 單連偉 銀系TiO2光催化無機抗菌材料的制備及抗菌性能測試[J]. 哈爾濱理工大學學報, 2014(4): 75-78
[6]鄭威, 崔賽, 張曉娜 染料敏化納米晶MgO/TiO2薄膜太陽能電池[J]. 哈爾濱理工大學學報, 2015(5): 5-8
[7]張文龍, 徐景文, 吉超 均勻沉淀法制備納米MgO[J]. 哈爾濱理工大學學報, 2010(6): 112-115
[8]YI Zao, CHEN Jiafu, LUO Jiangshan, et al SurfacePlasmonEnhanced Band Emission and Enhanced Photocatalytic Activity of Au Nanoparticlesdecorated ZnO Nanorods [J]. Plasmonics, 2015, 10: 1373-1380
[9]PAZHANIVELU V, PAUL BLESSINGTON SELVADURAI A, MURUGARAJ R Effect of Ist group elements codoping on structural, optical and magnetic properties of ZnO:Co nanoparticles [J]. Journal of Materials Science: Materials in Electronics, 2015: 1-8
[10]孫墨杰, 胡全, 李健, 等 ZnFe2O4/TiO2納米管陣列電極的制備及光電催化降解苯酚的研究[J]. 化學學報, 2013, 71: 213-220
[11]陸勝, 劉仲娥 ZnFe2O4納米微粉低溫制備及其電磁特性[J]. 硅酸鹽學報, 2005, 33(6): 665-668
[12]徐莉, 唐吉龍, 房丹, 等 ZnFe2O4/ZnO納米復合纖維的制備及性質研究[J]. 長春理工大學學報, 2014,37(6): 1-8
[13]鞏宗霞, 李斌, 張飛躍, 等 ZnFe2O4/ZnO氣相法催化合成烷基毗嗓[J]. 精細化工, 2014, 31(4): 524-528
[14]LI Yun, DAI Guozhang, ZHOU Chunjiao, et al ZnO Formation and Optical Properties of ZnO:ZnFe2O4 Superlattice Microwires[J]. Nano Research, 2010, 3(5):326-338
[15]龔良玉, 劉建靜 ZnO模板法合成的MnO2納米棒及其電容特性研究[J]. 化學通報, 2011, 74(2):184-187
[16]袁卉華, 屠紅斌, 李碧云, 等 穩定射流電紡絲法制備定向排列的殼聚糖超細纖維[J]. 高分子學報,2014(1):131-140
[17]侯國付, 薛俊明, 袁育杰, 等 高壓射頻等離子體增強化學氣相沉積制備高效率硅薄膜電池的若干關鍵問題研究[J]. 物理學報, 2012, 61(5):1-4
[18]魏龍福, 余長林, 陳建釵, 等 水熱法合成Ag2CO3/ ZnO異質結復合光催化劑及其光催化性能[J]. 有色金屬科學與工程, 2014, 5(1):47-53
[19]薛源, 賈沖, 陳翌慶, 等 溶劑熱法制備Co,Ni共摻雜ZnO納米棒及其性能研究[J]. 熱加工工藝, 2014, 43(2):21-23
[20]SUN M J,HU Q, LI J, et al Preparation of ZnFe2O4/TiO2 Nanotube Array Electrode and Photoelecatalysis Degradation of Phenol[J].Acta China Sinica, 2013(7): 213-220
(編輯:溫澤宇)

