超聲微泡造影劑攜帶PE38生物毒素殺傷血管內皮細胞的實驗研究
紀巧,周顯禮,凌耿強,王曉蕾,韋虹,杜琳瑤
超聲微泡造影劑攜帶PE38生物毒素殺傷血管內皮細胞的實驗研究
紀巧,周顯禮,凌耿強,王曉蕾,韋虹,杜琳瑤
目的研究超聲微泡造影劑 PLGA-COOH 聯(lián)合生物毒素PE38 對內皮細胞的殺傷效應。
方法制備超聲微泡造影劑 PLGA-COOH,包裹生物毒素PE38 后形成復合物,將血管內皮細胞分為空白對照組、輻照微泡組、PE38 組、復合物組、輻照復合物組,以 TUNEL實驗檢測凋亡指數,以 Western blot 實驗檢測 cleaved caspase-3,并進行組間比較。
結果TUNEL 結果顯示:輻照微泡組細胞凋亡與空白對照組無顯著差異(P = 0.946);PE38 組細胞凋亡較空白對照組顯著增加(P < 0.001);復合物組細胞凋亡較 PE38 組顯著下降(P < 0.001),較空白對照組顯著增加(P < 0.001);輻照復合物組細胞凋亡較 PE38 組顯著增加(P < 0.001)。蛋白檢測結果與凋亡檢測相符。
結論超聲造影劑微泡復合物聯(lián)合生物毒素殺傷血管內皮細胞具有較高的安全性、特異性及有效性,是一種具有前景的腫瘤血管殺傷方法。
超聲微泡造影劑; 生物毒素; 內皮細胞
抗血管生成療法在多種腫瘤的治療中起著重要的作用,其主要機制之一是抑制腫瘤血供從而“餓死”腫瘤細胞[1]。抑制腫瘤血供主要有兩種方式,即阻止內皮細胞構成血管和殺傷腫瘤血管結構。內皮細胞構成血管的信號通路極其復雜,阻斷單一通路難以達到徹底抑制腫瘤血供的效果[2]。而殺傷腫瘤血管結構是一種直接有效的方法,目前已有研究證實應用重組免疫毒素能夠抑制腫瘤血供[3]。由于重組免疫毒素造價高昂,短時間內大規(guī)模應用于治療對患者負擔巨大,因此需要探索一種造價相對低廉的特異性切斷腫瘤血供的方法。
超聲微泡造影劑是一種造價低廉、可大規(guī)模生產的藥劑,且其具有包裹攜帶藥物的功能。通過超聲輻照,微泡造影劑可以在特定的組織器官內破裂,釋放出攜帶的藥物,使藥物在局部的濃度明顯增高,達到更好的治療目的[4]。目前對于超聲微泡攜帶生物毒素殺傷腫瘤血管的研究很少。因此,在本研究中我們首次嘗試應用超聲微泡造影劑包裹非特異性生物毒素形成復合物,并觀察其安全性,以及在超聲輻照前后其殺傷血管內皮細胞的效果。
1 材料與方法
1.1 材料
1.1.1 試劑 人臍靜脈內皮細胞(HUVEC)購自中科院上海細胞庫;一抗兔抗人 cleaved caspase-3抗體為上海碧云天生物技術有限公司產品;兔抗人GAPDH 抗體為 LSBio 公司產品;TUNEL 試劑盒為美國 Roche 公司產品。
1.1.2 儀器 聲振儀購自愛德森電子有限公司。
1.2 方法
1.2.1 細胞培養(yǎng)及分組 人臍靜脈內皮細胞培養(yǎng)于含 5 ng/ml bFGF 和 5% FBS 的 HE-SFM 培養(yǎng)基中,培養(yǎng)箱設置條件為 37 ℃、5% CO2。細胞株分 5 組分別為空白組(未處理)、輻照微泡(陰性對照)組(僅添加超聲微泡造影劑,超聲輻照)、PE38 組(僅含 PE38 蛋白)、復合物(微泡 + PE38)組(含微泡復合物,不輻照)、輻照復合物(輻照 +微泡 + PE38)組(含微泡復合物,超聲輻照)。
1.2.2 PLGA-COOH 超聲造影劑的制備 將 1 g聚乳酸-羥基乙酸共聚物(PLGA-COOH)加入 20 ml二氯甲烷中充分攪拌,加入 4 ml 雙蒸水,聲振儀聲振 30 s 成乳化液;將乳化液倒入適量 4% 聚乙烯醇(PVA)溶液中,均質機中均質 5 min,加入 200 ml 2% 異丙醇溶液,室溫下攪拌 2 ~ 5 h,使微球表面固化,二氯甲烷盡量自然揮發(fā);多次雙蒸水與正己烷洗滌、離心,收集微球、冷凍干燥后充入氟碳氣體,即得 PLGA-COOH 微泡超聲造影劑凍干粉。
1.2.3 制備攜帶 PE38 生物毒素的超聲造影劑顆粒 通過將前期我們獲得的重組質粒pDsRed-PE38-N1 轉染 E.coli BL21 感受態(tài)細胞,化學裂解法提取包涵體,獲得 PE38 表達蛋白,然后用 PBS 溶解,調整濃度為 0.2 mg/ml,有效殺傷細胞的最低毒素濃度為 0.1 mg/ml;將PLGA-COOH 造影劑凍干粉與 PBS 相混合制成造影劑微泡混懸液(濃度為 12.5 mg/ml);將兩種溶液 1∶1 混合均勻,4 ℃ 保存?zhèn)溆谩?/p>
1.2.4 超聲輻照 培養(yǎng)瓶置于水槽內,探頭距培養(yǎng)瓶底部約 30 mm,超聲機械指數 1.4,輻照時間為 60 s。
1.2.5 TUNEL 法計算凋亡細胞數 各組細胞進行相應處理后,應用 TUNEL 試劑盒,按說明書進行試驗,在光學顯微鏡下每組隨機取 3 ~ 5 個視野,計算細胞凋亡指數。凋亡指數(%)= TUNEL 陽性細胞數/總細胞數 × 100%。實驗重復 2 次。
1.2.6 Western blot 檢測 cleaved caspase-3 蛋白表達水平 收集細胞加入 4 ℃ RIPA 中充分裂解。4 ℃ 下 12 000 × g 離心 15 min,上清總蛋白用BCA 法定量。每組 10 μg 總蛋白經電泳分離、轉膜。室溫下封閉 1 h,加入一抗(兔抗人 cleaved caspase-3 抗體,兔抗人 GAPDH 抗體體積稀釋比均為 1∶1000),4 ℃ 過夜;洗膜后加入 HRP 標記的山羊抗兔 IgG(體積稀釋比均為 1∶500),室溫1 h,洗膜;ECL 試劑顯色、采圖,Image J 2x 掃描灰度值。實驗重復 2 次。以(cleaved caspase-3 灰度值/GAPDH 灰度值)× 100% 表示蛋白表達水平。
1.3 統(tǒng)計學處理
應用 SPSS 13.0 統(tǒng)計軟件處理數據,實驗數據采用表示,多組間比較采用單因素方差分析,組間兩兩比較采用 LSD-t 檢驗,P < 0.05 為差異有統(tǒng)計學意義。
2 結果
2.1 超聲微泡造影劑通過胞吞作用進入內皮細胞
如圖 1 所示,在細胞培養(yǎng)基中添加微泡造影劑后,細胞將造影劑吞噬至胞內,說明超聲微泡造影劑制作成功,可用于攜帶生物毒素進行細胞殺傷。

圖 1 細胞將造影劑微泡吞噬至胞內Figure 1 The microbubbles were phagocytosed into cells
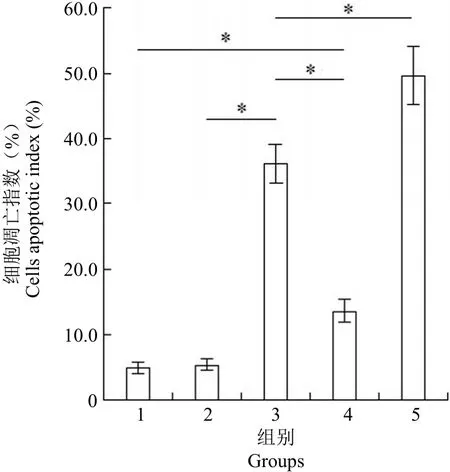
圖 2 各組細胞凋亡指數比較(*P < 0.001)Figure 2 The comparison of cells apoptotic index between groups (*P < 0.001)
2.2 內皮細胞在各組條件下的凋亡數測定
如圖 2 所示,TUNEL 檢測結果顯示,各組細胞凋亡指數平均值分別為空白對照組(5.05 ± 1.08)、輻照微泡(陰性對照)組(5.44 ± 1.13)、PE38 組(36.19 ± 3.84)、復合物(微泡 + PE38)組(13.64 ± 2.30)、輻照復合物(輻照 + 微泡 + PE38)組(49.67 ± 5.70),組間比較有統(tǒng)計學差異(F = 327.065,P < 0.001)。陰性對照組與空白組無顯著差異(P = 0.946),表明微泡造影劑及超聲輻照對細胞無毒性作用;PE38 組細胞凋亡較空白組顯著增加(P < 0.001),表明 PE38 毒素對內皮細胞有明顯的殺傷作用;將微泡造影劑包裹 PE38 毒素形成復合物后(微泡 + PE38),其對細胞的非特異性殺傷作用較 PE38 組顯著下降(P < 0.001),表明微泡造影劑可以保護細胞免受毒素殺傷,但較空白組顯著增加(P < 0.001),表明仍有少量 PE38 無法被造影劑包裹;當利用超聲輻照將微泡造影劑破壞后(輻照 + 微泡 + PE38),PE38 重新得到釋放,同時由于細胞形成微孔,毒素進入胞內增多,該組的細胞凋亡較 PE38 組顯著增加(P < 0.001)。
2.3 細胞凋亡標志物 cleaved caspase-3 蛋白水平檢測
如圖 3 所示,Western blot 檢測結果顯示,各組 cleaved caspase-3 灰度值占 GAPDH 灰度值的百分比分別為空白組(7.90% ± 0.85%)、輻照微泡(陰性對照)組(8.23% ± 0.91%)、PE38 組(21.63% ± 1.20%)、復合物(微泡 + PE38)組(11.50% ± 0.92%)、輻照復合物(輻照 + 微泡 + PE38)組(74.10% ± 2.89%),組間比較有統(tǒng)計學差異(F = 976.124,P < 0.001)。陰性對照組與空白組無顯著差異(P = 0.799);PE38 組表達較空白組顯著增加(P < 0.001);微泡 + PE38 組表達較 PE38組顯著下降(P < 0.001),但對空白組顯著增加(P = 0.018 < 0.05);輻照復合物組的表達較 PE38 組(P < 0.001)及復合物組(P < 0.001)均顯著增加。

圖 3 各組 cleaved caspase-3 表達比較(A:各組 cleaved caspase-3 Western blot 條帶圖;B:各組 cleaved caspase-3 比較柱狀圖;*P < 0.01,**P < 0.001)Figure 3 The comparison of cleaved caspase-3 expression among groups (A: Western blot band of cleaved caspase-3 in each group; B: Histogram of comparison of cleaved caspase-3 among groups;*P < 0.01,**P < 0.001)
3 討論
生物毒素是一類由植物或細菌產生的天然毒性蛋白,有極強的細胞毒性。綠膿桿菌外毒素(pseudomonas extoxin,PE)是目前研究和應用比較廣泛的毒素之一[5]。其主要包含 3 個功能性結構域,即細胞膜結合結構域、轉位結構域和核糖化酶活性結構域,既往的研究中將除去細胞膜結合結構域的 PE 毒素稱為 PE38[6]。毒素分子通過細胞膜結合結構域與細胞膜表面受體結合后被細胞內吞,在吞飲泡內毒素的細胞膜結合結構域被降解從而暴露出轉位結構域,在轉位結構域的作用下毒素分子從吞飲小泡轉位至胞漿并進入內質網,通過對真核細胞延長因子-2(EF-2)的不可逆性二磷酸核糖化修飾使其失活,從而阻斷靶細胞蛋白質合成過程。此毒性過程為一種酶促反應過程,具有高效性,理論上僅一個毒素分子進入細胞就可將其殺死[7]。但是,如何能夠引導毒素特異性地殺傷腫瘤血管內皮細胞是要解決的關鍵問題。
超聲造影劑作為血池顯像劑能夠切實反映組織的血供情況,良好地反映組織的微循環(huán)灌注[8],目前已被成熟應用于肝臟、腎臟、膽囊等臟器局灶性病變的定性診斷[9]。近年來,研究發(fā)現超聲造影劑微泡可以作為靶向治療的載體。微泡可以以多種方式攜帶基因或藥物,當微泡復合物在“感興趣區(qū)”聚集時,增強該區(qū)域聲壓使微泡破裂、引發(fā)藥物的定點定時釋放,微泡破裂時產生強烈的沖擊波及高速微射流在血管壁或生物屏障上形成暫時性微孔,可以增強基因轉染或藥物傳輸[10]。Nakaya等[11]在兔類風濕性關節(jié)炎模型膝關節(jié)腔內注射微泡與氨甲蝶呤混合物,證實在超聲暴露下微泡能增強氨甲蝶呤對兔滑膜細胞的抗炎作用。因此,超聲造影劑微泡作為向細胞內輸送藥物的載體為我們應用生物毒素提供了條件。聚乳酸羥基乙酸共聚物PLGA-COOH 是一種具有良好生物相容性的高分子材料,可在體內緩慢降解,最終產物是二氧化碳和水,被廣泛用于藥物、基因的傳遞與控釋中,是近年來發(fā)展起來的一種新型造影劑[12]。
本次實驗結果顯示,應用 PLGA-COOH 制作的超聲微泡造影劑對細胞幾乎無毒性,當其包裹PE38 形成復合物后,復合物的生物毒性明顯下降。當應用超聲輻照將復合物振蕩破碎后,PE38 毒素大量釋放,且由于細胞受輻照后造影劑破裂影響形成許多微孔,使釋放的毒素能更多地進入胞內,比單純應用 PE38 對內皮細胞產生了更顯著的殺傷作用,這表明超聲微泡造影劑包裹 PE38 后,復合物安全性更高,對殺傷血管內皮細胞的特異性更明顯,有效性亦有所增高。為充分驗證各組細胞凋亡水平,我們進一步檢測了 caspase-3 裂解產物cleaved caspase-3 的表達。Caspase-3 是細胞凋亡過程中最關鍵的執(zhí)行分子之一,它的激活需要被剪切產生有活性的 17 kD 亞基[13]。蛋白檢測結果和TUNEL 檢測的結果基本相符,從分子水平驗證了我們的猜想。但是,復合物在體內實驗中能否達到體外實驗的效果,需要后續(xù)動物實驗的進一步驗證。
綜上,超聲微泡復合物聯(lián)合生物毒素殺傷血管內皮細胞具有較高的安全性、特異性及有效性,是一種具有前景的腫瘤血管殺傷藥物。
[1] El-Kenawi AE, El-Remessy AB. Angiogenesis inhibitors in cancer therapy: mechanistic perspective on classification and treatment rationales. Br J Pharmacol, 2013, 170(4):712-729.
[2] Cook KM, Figg WD. Angiogenesis inhibitors: current strategies and future prospects. CA Cancer J Clin, 2010, 60(4):222-243.
[3] Alewine C, Hassan R, Pastan I. Advances in anticancer immunotoxin therapy. Oncologist, 2015, 20(2):176-185.
[4] Zhang Y, Mi CR, Wang W. Research progress of targeted microbubble contrast agent. J Ningxia Med Univ, 2016, 38(4):475-479. (in Chinese)張陽, 米成嶸, 王文. 靶向微泡超聲造影劑的研究進展. 寧夏醫(yī)科大學學報, 2016, 38(4):475-479.
[5] Kaloshin AA, Isakov MA, Mikhailova NA, et al. Preparation of recombinant atoxic form of exotoxin a from pseudomonas aeruginosa. Bull Exp Biol Med, 2013, 154(3):346-350.
[6] Jiang H, Xie Y, Burnette A, et al. Purification of clinical-grade disulfide stabilized antibody fragment variable--Pseudomonas exotoxin conjugate (dsFv-PE38) expressed in Escherichia coli. Appl Microbiol Biotechnol, 2013, 97(2):621-632.
[7] Lin JY, Fu MJ, Xie JM. Research advances in immunotoxin. Strait Pharm J, 2014, 26(9):4-6. (in Chinese)林接玉, 付明娟, 謝捷明. 免疫毒素的研究進展. 海峽藥學, 2014, 26(9):4-6.
[8] Dindyal S, Kyriakides C. Ultrasound microbubble contrast and current clinical applications. Recent Pat Cardiovasc Drug Discov, 2011, 6(1):27-41.
[9] Claudon M, Dietrich CF, Choi BI, et al. Guidelines and good clinical practice recommendations for contrast enhanced ultrasound (CEUS) in the liver--update 2012: a WFUMB-EFSUMB initiative in cooperation with representatives of AFSUMB, AIUM, ASUM, FLAUS and ICUS. Ultraschall Med, 2013, 34(1):11-29.
[10] Wang AM, Wu XP. Clinical application and research advance of ultrasound contrast agent. Chin Foreign Med Res, 2015, 13(14):160-162. (in Chinese)汪艾曼, 吳曉萍. 超聲造影劑的臨床應用和研究進展. 中外醫(yī)學研究, 2015, 13(14):160-162.
[11] Nakaya H, Shimizu T, Isobe K, et a1. Microbubble-enhanced ultrasound exposure promotes uptake of methotrexate into synovial cells and enhanced antiinflammatory effects in the knees of rabbits with antigen-induced arthritis. Arthritis Rheum, 2005, 52(8):2559-2566.
[12] Wang CW, Du J, Yang SP, et al. Preparation of VEGFR2-targeted PLGA ultrasound contrast agent and in vitro targeting tests. J Shanghai Jiaotong Univ (Med Sci), 2014, 34(6):772-776. (in Chinese)王翠薇, 杜晶, 楊仕平, 等. 攜抗VEGFR2抗體PLGA靶向超聲造影劑的制備及體外尋靶實驗. 上海交通大學學報(醫(yī)學版), 2014, 34(6):772-776.
[13] Zhang XT, Song TB. The study on Caspase-3 and cell apoptosis. Med Recapitulate, 2002, 8(11):621-623. (in Chinese)張曉天, 宋天保. Caspase-3與細胞凋亡的研究. 醫(yī)學綜述, 2002, 8(11):621-623.
www.cmbp.net.cn Chin Med Biotechnol, 2017, 12(3):227-231
關于公布協(xié)會2015 – 2016年度分支機構評估結果的通知
為規(guī)范協(xié)會分支機構管理,促進分支機構工作,協(xié)會組織開展了 2015 – 2016 年度分支機構評估。按照《中國醫(yī)藥生物技術協(xié)會分支機構評估辦法》規(guī)定,對協(xié)會各分支機構工作進行評分,本次評估設優(yōu)秀獎 1 名、先進獎 6 名。評估結果已經協(xié)會理事長辦公會審議通過,現將獲獎名單公布如下:
一、優(yōu)秀獎
組織生物樣本庫分會
二、先進獎
1.骨組織庫分會
2.醫(yī)藥生物技術臨床應用專業(yè)委員會
3.生物診斷技術分會
4.再生醫(yī)學專業(yè)委員會
5.心電學技術分會
6.精準醫(yī)療分會
Experimental study on killing vascular endothelial cells of biological toxin PE38 carried by an ultrasound microbubble contrast-enhanced agent
JI Qiao, ZHOU Xian-li, LING Geng-qiang, WANG Xiao-lei, WEI Hong, DU Lin-yao
ObjectiveTo study the killing effect on endothelial cells of biological toxin PE38 carried by an ultrasound microbubble contrast-enhanced agent PLGA-COOH.
MethodsAn ultrasound contrast-enhanced agent PLGA-COOH was prepared and encapsulated biological toxin PE38. Thevascular endothelial cells were divided into control group (untreated), irradiation microbubble group (only added contrast-enhancedultrasound agent, ultrasonic irradiation), PE38 group (only contained PE38 protein), compound group (contained microbubble compound, no irradiation) and irradiation compound group (contained microbubble compound, ultrasonic irradiation). TUNEL was used to test the apoptotic rate. Western blot was used to test the cleaved caspase-3. The results of both tests were compared among groups.
ResultsThere was no significant difference between the control group and irradiation microbubble group (P = 0.946). The apoptotic rate of PE38 group was significantly higher than that of the control group (P < 0.001). The apoptotic rate of the compound group was significantly lower than that of the PE38 group (P < 0.001), while higher than that of the control group (P < 0.001). The apoptotic rate of the irradiation compound group was significantly higher than that of the PE38 group. The results from Western blot assays were similar to that from the TUNEL assays.
ConclusionThe biological toxin carried by an ultrasound microbubble contrast-enhanced agent has high safety, specificity and effectiveness in killing vascular endothelial cells, and is a promising method in killing tumor blood vessels.
Contrast-enhanced ultrasound microbubble; Biological toxin; Endothelial cells
ZHOU Xian-li, Email: zhouxianli@ems.hrbmu.edu.cn
10.3969/j.issn.1673-713X.2017.03.006
黑龍江省衛(wèi)生廳科研課題資助項目(2013056)
150086 哈爾濱醫(yī)科大學附屬第二醫(yī)院住院處超聲科(紀巧、周顯禮、王曉蕾、韋虹、杜琳瑤);150086 哈爾濱醫(yī)科大學心肌缺血教育部重點實驗室(凌耿強)
周顯禮,Email:zhouxianli@ems.hrbmu.edu.cn
2017-03-16
www.cmbp.net.cn 中國醫(yī)藥生物技術, 2017, 12(3):227-231
Author Affiliation: In-Patient Ultrasound Department, The Second Affiliated Hospital of Harbin Medical University, Harbin 150086, China (JI Qiao, ZHOU Xian-li, WANG Xiao-lei, WEI Hong, DU Lin-yao); Key Laboratory of Myocardial Ischemia, Harbin Medical University, Ministry of Education, Harbin 150086, China (LING Geng-qiang)

