甘草酸二銨對百草枯誘導肺泡上皮Ⅱ型細胞高遷移率族蛋白1的影響
方 辰,張劍鋒,喻 莉,向 瀝
甘草酸二銨對百草枯誘導肺泡上皮Ⅱ型細胞高遷移率族蛋白1的影響
方 辰,張劍鋒,喻 莉,向 瀝
目的 了解甘草酸二銨(DG)對百草枯(PQ)誘導肺泡上皮Ⅱ型細胞(alveolar epithelial cell Ⅱ, AECⅡ)中高遷移率族蛋白1(high mobility group box 1, HMGB1)的影響。方法 AECⅡ用含10%胎牛血清的RPMI 1640培養基,并加入青霉素100 U/ml、鏈霉素100 μg/L,置于37℃含5% CO2的培養箱中培養。將培養后的細胞分為3組,空白對照組(NS組)不采用任何藥物干預培養24 h;模型組(PQ組):以1000 μmol/L PQ培養24 h;DG預治療組(DG組):先以0.6 mg/ml DG培養2 h,再以0.6 mg/ml DG+1000 μmol/L PQ培養24 h。采用MTT法測定DG對PQ誘導下AECⅡ的增殖作用;采用酶聯免疫吸附法檢測3組細胞中的HMGB1、Toll樣受體4(TLR-4)、髓樣分化因子88(MyD88)、細胞核因子-κB(NF-κB)、腫瘤壞死因子(TNF)-α含量;采用實時熒光定量聚合酶鏈式反應測定3組細胞中HMGB1、TLR-4、MyD88、NF-κB P65 mRNA表達。結果 在1000 μmol/L PQ誘導下,AECⅡ以0.6 mg/ml DG干預24 h時生存率最高,以0 mg/ml DG干預生存率最低。與NS組比較,PQ、DG組HMGB1、TLR-4、MyD88、NF-κB P65、TNF-α水平均明顯升高,且DG組升高程度低于PQ組,差異均有統計學意義(P<0.01);與NS組比較,PQ組、DG組HMGB1、TLR-4、MyD88、NF-κB P65 mRNA表達均升高,且DG組升高程度低于PQ組,差異均有統計學意義(P<0.01)。結論 DG可降低HMGB1、TLR-4、MyD88、NF-κB、TNF-α水平,減輕PQ誘導的AECⅡ損傷。
甘草酸二銨;高遷移率族蛋白質類;百草枯
百草枯(PQ)中毒早期即可出現肺水腫、肺出血、肺不張,并可迅速發展為不可逆性肺纖維化[1-3],且在此過程中肺泡上皮Ⅱ型細胞(alveolar epithelial cell Ⅱ, AECⅡ)受到明顯損傷[4]。目前PQ中毒并無有效的拮抗劑,如何防治PQ中毒所致的急性肺損傷(acute lung injury, ALI)是臨床研究的熱點與難點[5]。甘草酸二銨(DG)是從中草藥甘草中提取的一種有效成分單體[6],結構與腎上腺皮質激素類似,具有廣泛的抗炎、抗氧化、抗病毒、調節免疫、護肝等功效[7]。本課題組前期研究證實,DG可抑制PQ中毒致ALI的SD大鼠肺組織中Toll樣受體4(TLR-4)及細胞核因子-κB(NF-κB) P65的異常表達,具有較強的免疫調節和抗炎作用,進而可改善大鼠預后[8];DG還可增強PQ中毒致急性腎損傷SD大鼠腎組織中白細胞介素(IL)-10的表達,并且可抑制TLR-4、髓樣分化因子88(MyD88)、NF-κB P65及IL-17的異常表達,從而減輕腎損傷[9-10]。然而,DG調控TLR-4、GR基因及炎性因子的作用機制尚不明確。本研究推測PQ中毒引起ALI的過程中,TLR4-MyD88-NF-κB信號通路中高遷移率族蛋白1(high mobility group box 1, HMGB1)可能發揮重要作用。本研究用DG行預干預,以PQ誘導AECⅡ建立體外模型,經酶聯免疫吸附法(ELISA)和實時熒光定量聚合酶鏈式反應(RT-PCR)測定,了解PQ和DG對HMGB1表達的影響,并探討DG與HMGB1、TLR4-MyD88-NF-κB信號通路的關系及DG對肺泡上皮細胞保護作用的可能機制。
1 材料與方法
1.1 實驗材料 ①實驗細胞:大鼠AECⅡ購自上海滬震實業公司;②藥品及試劑:胎牛血清、RPMI 1640購自美國Gibco公司,DG購自江蘇正大天晴制藥有限公司,PQ、米非司酮(以無水乙醇配制)及MTT試劑購自美國Sigma公司,TriPure總RNA抽取試劑盒、反轉錄試劑盒及FastStart Universal SYBR Green Master購自美國Roche公司,大鼠HMGB1 ELISA試劑盒購自武漢華美生物工程有限公司;③儀器:CO2培養箱購自美國Forma scientific Inc公司,正置顯微鏡購自日本Olympus公司,酶標儀購自美國BioTek Instruments公司,熒光定量PCR儀購自美國Applied Biosystems StepOne公司。
1.2 實驗方法
1.2.1 細胞培養及分組:AECⅡ用含10%胎牛血清的RPMI 1640培養基培養,并加入青霉素100 U/ml、鏈霉素100 μg/L,置于37℃含5% CO2的培養箱中培養。將實驗細胞分為3組:①空白對照組(NS組):未采用任何藥物干預,培養24 h;②模型組(PQ組):以1000 μmol/L PQ培養24 h;③DG預治療組(DG組):先以0.6 mg/ml DG培養2 h,再以0.6 mg/ml DG+1000 μmol/L PQ培養24 h。
1.2.2 MTT法測定細胞存活率:細胞培養及接種同前,分別于96孔板中加入0、0.2、0.4、0.6、0.8、1.0、2.0、4.0 mg/ml DG孵育2 h,再以對應濃度的DG+1000 μmol/L PQ孵育24 h后加入10μl MTT(5 mg/ml),繼續培養4 h后加入二甲基亞砜150 μl/孔,酶標儀570 nm處測定吸光度(OD值),計算細胞存活率。存活率(%)=用藥組OD值/對照組OD值×100%。
1.2.3 ELISA定量檢測質量濃度:取細胞培養物上清,用ELISA試劑盒檢測各組大鼠細胞HMGB1、NF-κB P65、TLR4、MyD88、腫瘤壞死因子(TNF)-α質量濃度。操作步驟均按說明書進行。
1.2.4 RT-PCR測定基因表達:取3組大鼠AECⅡ,用TriPure法提取總RNA,以反轉錄試劑盒反轉錄成cDNA,采用FastStart Universal SYBR Green Master(ROX)試劑盒以已合成的cDNA為模板進行RT-PCR。HMGB1、TLR-4、MyD88、NF-κB P65的引物序列見表1。聚合酶鏈式反應條件:95℃預變性10 min,95℃變性15 s,60℃退火/延伸60 s,擴增40個循環。PCR后,用ABI 7500軟件分析基因擴增情況,得到相應Ct值,以β-actin作為內參照,每組設3個復孔,基因相對表達量采用2-△△Ct方法計算。

表1 實時熒光定量聚合酶鏈式反應引物
注:HMGB1為高遷移率族蛋白1,TLR-4為Toll樣受體4,MyD88為髓樣分化因子88,NF-κB為細胞核因子-κB
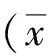
2 結果
2.1 DG對PQ誘導下AECⅡ增殖作用的影響 在1000 μmol/L PQ誘導下,AECⅡ以0.6 mg/ml DG干預24 h生存率最高,以0 mg/ml DG干預生存率最低,見圖1。
2.2 ELISA定量檢測質量濃度 PQ組、DG組中HMGB1、TLR-4、MyD88、NF-κB P65、TNF-α水平較NS組均有不同程度的升高,差異有統計學意義(P<0.01);但DG組升高程度低于PQ組,差異有統計學意義(P<0.01)。見表2。
2.3 RT-PCR測定基因表達 PQ組、DG組中HMGB1、TLR-4、MyD88、NF-κB P65 mRNA表達均較NS組不同程度升高(P<0.01);DG組升高程度低于PQ組,差異有統計學意義(P<0.01)。見表3。

圖1 甘草酸二銨對1000 μmol/L百草枯誘導的大鼠肺泡上皮Ⅱ型細胞增殖作用的影響

表2 3組大鼠肺泡上皮Ⅱ型細胞HMGB1、TLR-4、MyD88、NF-κB P65、TNF-α水平比較
注:NS組未采用任何藥物干預培養24 h;PQ組以1000 μmol/L百草枯培養24 h;DG組先以0.6 mg/ml甘草酸二銨培養2 h,再以0.6 mg/ml甘草酸二銨+1000 μmol/L百草枯培養24 h;HMGB1為高遷移率族蛋白1,TLR-4為Toll樣受體4,MyD88為髓樣分化因子88,NF-κB為細胞核因子-κB,TNF-α為腫瘤壞死因子-α

表3 3組大鼠肺泡上皮Ⅱ型細胞HMGB1、TLR-4、MyD88、NF-κB P65 mRNA表達
注:NS組未采用任何藥物干預培養24 h;PQ組以1000 μmol/L百草枯培養24 h;DG組先以0.6 mg/ml甘草酸二銨培養2 h,再以0.6 mg/ml甘草酸二銨+1000 μmol/L百草枯培養24 h;HMGB1為高遷移率族蛋白1,TLR-4為Toll樣受體4,MyD88為髓樣分化因子88,NF-κB為細胞核因子-κB
3 討論
PQ的結構與內源性聚胺類似,因肺內存在著一種聚胺轉運系統,故PQ進入人體后在肺組織中大量聚集[11],肺組織中濃度要比血液中高10~90倍[12]。AECⅡ主要功能為參與肺泡上皮細胞的再生及分泌表面活性物質。PQ中毒18 h后,AECⅡ開始出現水腫,肺泡表面活性物質減少;24 h后,AECⅡ中線粒體明顯水腫、破裂[13];72~96 h后,肺泡上皮細胞出現破裂,成為碎片或完全消失[14]。
目前甘草酸廣泛應用于臨床抗炎、抗病毒治療,具有抑制NF-κB活化、炎性細胞因子產生及炎性細胞的遷移等作用。本研究觀察DG對PQ誘導AECⅡ的增殖抑制作用,結果顯示在一定濃度范圍內DG可增加PQ誘導AECⅡ的存活率。
本研究證實,AECⅡ在PQ誘導24 h后,HMGB1 mRNA表達顯著增強,而DG預治療能抑制HMGB1 mRNA的過度表達。HMGB1是一種新發現的炎性介質,其普遍存在于真核細胞中,是一種高度保守的核蛋白,它在核內的主要功能為穩定核小體的結構及調節基因轉錄[15-16]。細胞在缺氧等病理狀態下HMGB1可被釋放到包漿與細胞外,參與組織的炎性損傷過程,在各種炎癥性疾病中發揮重要作用[17]。目前已有許多研究表明,細胞外HMGB1和許多疾病及缺血/再灌注損傷等病理狀態的嚴重程度呈正相關[18-20];并且在細胞外,HMGB1還可作為致炎因子,在炎性反應中發揮重要作用[21]。本研究顯示,PQ組HMGB1水平高于對照組,表明HMGB1可在PQ誘導的肺泡上皮細胞中表達并釋放,且可在細胞外發揮細胞因子樣功能并激活炎癥途徑。亦有實驗表明,HMGB1經氣管內給藥即可誘導ALI,引起大量炎性細胞釋放和肺水腫[22]。還有實驗表明,HMGB1作為晚期炎性介質在膿毒癥過程中起重要作用,其血清水平與患者病死率呈正相關[17]。動物實驗顯示,HMGB1參與了腸黏膜功能障礙和致死性炎性反應等致病過程,在多種炎癥性疾病中起重要作用[17,21],且其水平還可反映炎癥和組織損傷的嚴重程度[18]。研究證實HMGB1可作為炎癥損傷的治療靶點,抗HMGB1單克隆抗體為各種炎性反應、缺血灌注損傷等的治療提供了新的方向[23]。
內毒素、IL-1和TNF均能刺激巨噬細胞、單核細胞、垂體細胞、NK細胞、樹突狀細胞、內皮細胞和血小板等主動釋放HMGB1[24-25]。在受損和壞死的細胞中,HMGB1也可以被動釋放,持續性損害周圍細胞[26]。研究顯示,HMGB1受體主要包括晚期糖基化終末產物受體(RAGE),TLR2,TLR-4,TLR9,巨噬細胞抗原-1,多配體蛋白聚糖-3,CD24,Siglec-10,CXCR4和T細胞免疫球蛋白粘蛋白3等[19,27-28]。有研究認為,TLR-4是HMGB1的主要受體,它可以促進巨噬細胞活化,細胞因子的釋放和組織損傷[20,29]。HMGB1結合TLR-4導致了NF-κB表達的上調及細胞因子的釋放[20]。HMGB1在嗜中性粒細胞和巨噬細胞中通過TLR4-MyD88-NF-κB信號通路,參與呼吸系統的炎性反應過程[30-32]。也有研究認為,HMGB1通過激活多種信號通路參與機體炎性反應,如激活絲裂原活化蛋白激酶信號通路,使NF-κB易位,促進TNF-α、轉化生長因子-β、血管內皮生長因子(VEGF)等炎性因子的表達,引發炎性反應[20,33-34]。這些途徑可導致炎性級聯反應,促進炎性介質TNF-α、單核細胞趨化蛋白-1、IL-6及IL-8等的釋放,從而進一步促進HMGB1的釋放,加重組織損傷。且HMGB1還與細胞分化、細胞增殖和凋亡、細胞遷移等密切相關[18]。本實驗PQ組HMGB1、TLR-4、MyD88、NF-κB P65、TNF-α水平高于NS組,推測PQ刺激HMGB1釋放并經TLR4-MyD88-NF-κB信號通路,參與肺泡上皮損傷過程。
Mollica等[35]認為,甘草酸亦可抑制HMGB1活性和HMGB1易位、分泌,這或許是其抗炎的主要作用機制。甘草酸并不影響HMGB1釋放,而是直接抑制其活性[23]。研究表明,甘草酸以適度親和力(Kd值4.03 mmol/L)結合HMGB1,但不結合血清可溶性晚期糖基化終末產物受體(sRAGE)。甘草酸可抑制HMGB1與sRAGE的結合,半抑制濃度類似HMGB1的甘草甜素Kd值。故與HMGB1結合的甘草甜素可抑制HMGB1與sRAGE的結合,致RAGE信號傳導減少。進一步實驗顯示,甘草甜素與HMGB1分子的A-和B-盒相互作用,經甘草甜素修飾A-和B-框可能強烈干擾與RAGE結合[36-37]。在抗HMGB1單克隆抗體處理的情況下,甘草酸可抑制HMGB1的易位,提示存在著HMGB1釋放的循環,誘導其自身易位,并進一步促進HMGB1釋放,此循環可被甘草酸素抑制。因甘草甜素抑制HMGB1與sRAGE結合,推測抑制RAGE信號傳導可能反過來導致甘草酸對HMGB1易位的抑制。研究證實,甘草酸與HMGB1的直接結合并抑制HMGB1的易位,表明甘草酸可抑制HMGB1分泌[37]。本實驗中DG預治療能部分抑制HMGB1水平表達,考慮DG有與HMGB1相似的抗炎作用。
本研究觀察到AECⅡ在PQ誘導24 h后HMGB1 mRNA表達顯著增強,而DG預治療能抑制HMGB1 mRNA過度表達,對肺泡上皮細胞損傷有一定保護作用,揭示HMGB1與PQ中毒致ALI有一定關系,DG可通過調節信號通路抑制炎性反應和預防PQ中毒所致的ALI。
[1] Dinis-Oliveira R J, Duarte J A, Sanchez-Navarro A,etal. Paraquat poisonings: mechanisms of lung toxicity, clinical features, and treatment[J].Crit Rev Toxicol, 2008,38(1):13-71.
[2] 胡鳳華,曲東,李杰,等.百草枯中毒1例[J].中國小兒急救醫學,2007,14(4):369.
[3] 邱澤武.百草枯中毒的診斷與治療[J].中國臨床醫生,2012,40(8):3-5.
[4] Haagsman H P, Schuurmans E A, Batenburg J J,etal. Phospholipid synthesis in isolated alveolar type Ⅱ cells exposed in vitro to paraquat and hyperoxia[J].Biochem J, 1987,245(1):119-126.
[5] 呂方方,魏路清.急性百草枯中毒致肺損傷的發病機制及治療[J].武警醫學院學報,2011,20(7):586-589.
[6] Wu P, Zhang Y, Liu Y,etal. Effects of glycyrrhizin on production of vascular aldosterone and corticosterone[J].Horm Res, 1999,51(4):189-192.
[7] Asl M N, Hosseinzadeh H. Review of pharmacological effects of Glycyrrhiza sp. and its bioactive compounds[J].Phytother Res, 2008,22(6):709-724.
[8] 李浩,張劍鋒,張偉,等.甘草酸二銨對百草枯中毒致急性肺損傷大鼠TLR-4表達的影響[J].蛇志,2014,26(1):1-3,15.
[9] 張偉,張劍鋒,李浩,等.甘草酸二銨對百草枯致急性腎損傷大鼠IL-17表達的影響[J].蛇志,2015,27(2):103-105,120.
[10]張偉,張劍鋒,李浩,等.甘草酸二銨對百草枯中毒大鼠腎組織TOLL樣受體4表達的影響[J].中華急診醫學雜志,2015,24(11):1214-1219.
[11]Dinis-Oliveira R J, De Jesus Valle M J, Bastos M L,etal. Kinetics of paraquat in the isolated rat lung: Influence of sodium depletion[J].Xenobiotica, 2006,36(8):724-737.
[12]Chen C M, Lua A C. Lung toxicity of paraquat in the rat[J].J Toxicol Environ Health A, 2000,60(7):477-487.
[13]Smith P, Heath D. The ultrastructure and time sequence of the early stages of paraquat lung in rats[J].J Pathol, 1974,114(4):177-184.
[14]Dearden L C, Fairshter R D, Morrison J T,etal. Ultrastructural evidence of pulmonary capillary endothelial damage from paraquat[J].Toxicology, 1982,24(3-4):211-222.
[15]American Thoracic Society. Idiopathic pulmonary fibrosis: diagnosis and treatment. International consensus statement. American Thoracic Society (ATS), and the European Respiratory Society (ERS)[J].Am J Respir Crit Care Med, 2000,161(2 Pt 1):646-664.
[16]Lin X, Yang H, Sakuragi T,etal. Alpha-chemokine receptor blockade reduces high mobility group box 1 protein-induced lung inflammation and injury and improves survival in sepsis[J].Am J Physiol Lung Cell Mol Physiol, 2005,289(4):L583-L590.
[17]Wang H, Yang H, Czura C J,etal. HMGB1 as a late mediator of lethal systemic inflammation[J].Am J Respir Crit Care Med, 2001,164(10 Pt 1):1768-1773.
[18]Ferhani N, Letuve S, Kozhich A,etal. Expression of high-mobility group box 1 and of receptor for advanced glycation end products in chronic obstructive pulmonary disease[J].Am J Respir Crit Care Med, 2010,181(9):917-927.
[19]Fiuza C, Bustin M, Talwar S,etal. Inflammation-promoting activity of HMGB1 on human microvascular endothelial cells[J].Blood, 2003,101(7):2652-2660.
[20]Zhang J, Xia J, Zhang Y,etal. HMGB1-TLR4 signaling participates in renal ischemia reperfusion injury and could be attenuated by dexamethasone-mediated inhibition of the ERK/NF-κB pathway[J].Am J Transl Res, 2016,8(10):4054-4067.
[21]Yang H, Wang H, Tracey K J. HMG-1 rediscovered as a cytokine[J].Shock, 2001,15(4):247-253.
[22]Kong X, Zhang C, Jin X,etal. The effect of HMGB1 A box on lung injury in mice with acute pancreatitis[J].Biofactors, 2011,37(4):323-327.
[23]Girard J P. A direct inhibitor of HMGB1 cytokine[J].Chem Biol, 2007,14(4):345-347.
[24]Wang H, Vishnubhakat J M, Bloom O,etal. Proinflammatory cytokines (tumor necrosis factor and interleukin 1) stimulate release of high mobility group protein-1 by pituicytes[J].Surgery, 1999,126(2):389-392.
[25]Yang H, Wang H, Czura C J,etal. HMGB1 as a cytokine and therapeutic target[J].J Endotoxin Res, 2002,8(6):469-472.
[26]Scaffidi P, Misteli T, Bianchi M E. Release of chromatin protein HMGB1 by necrotic cells triggers inflammation[J].Nature, 2002,418(6894):191-195.
[27]Cheng Y, Xiong J, Chen Q,etal. Hypoxia/reoxygenation-induced HMGB1 translocation and release promotes islet proinflammatory cytokine production and early islet graft failure through TLRs signaling[J].Biochim Biophys Acta, 2017,1863(2):354-364.
[28]Thankam F G, Dilisio M F, Dietz N E,etal. TREM-1, HMGB1 and RAGE in the Shoulder Tendon: Dual Mechanisms for Inflammation Based on the Coincidence of Glenohumeral Arthritis[J].PLoS One, 2016,11(10):e0165492.
[29]Wang F C, Pei J X, Zhu J,etal. Overexpression of HMGB1 A-box reduced lipopolysaccharide-induced intestinal inflammation via HMGB1/TLR4 signaling in vitro[J].World J Gastroenterol, 2015,21(25):7764-7776.
[30]Cheng Y, Wang D, Wang B,etal. HMGB1 translocation and release mediate cigarette smoke-induced pulmonary inflammation in mice through a TLR4/MyD88-dependent signaling pathway[J].Mol Biol Cell, 2017,28(1):201-209.
[31]Jiang Z, Zhou Q, Gu C,etal. Depletion of circulating monocytes suppresses IL-17 and HMGB1 expression in mice with LPS-induced acute lung injury[J].Am J Physiol Lung Cell Mol Physiol, 2016:ajplung 00389.2016.
[32]Srikrishna G, Huttunen H J, Johansson L,etal. N -Glycans on the receptor for advanced glycation end products influence amphoterin binding and neurite outgrowth[J].J Neurochem, 2002,80(6):998-1008.
[33]He L, Sun F, Wang Y,etal. HMGB1 exacerbates bronchiolitis obliterans syndrome via RAGE/NF-κB/HPSE signaling to enhance latent TGF-β release from ECM[J].Am J Transl Res, 2016,8(5):1971-1984.
[34]Li J, Huang L, Wang S,etal. Astragaloside Ⅳ attenuates inflammatory reaction via activating immune function of regulatory T-cells inhibited by HMGB1 in mice[J].Pharm Biol, 2016,54(12):3217-3225.
[35]Mollica L, De Marchis F, Spitaleri A,etal. Glycyrrhizin binds to high-mobility group box 1 protein and inhibits its cytokine activities[J].Chem Biol, 2007,14(4):431-441.
[36]Scaffidi P, Misteli T, Bianchi M E. Release of chromatin protein HMGB1 by necrotic cells triggers inflammation[J].Nature, 2010,418(6894):191-195.
[37]Okuma Y, Liu K, Wake H,etal. Glycyrrhizin inhibits traumatic brain injury by reducing HMGB1-RAGE interaction[J].Neuropharmacology, 2014,85:18-26.
Effects of Diammonium Glycyrrhizinate on the Expression of HMGB1 in Alveolar Epithelial Cell with Paraquat
FANG Chen, ZHANG Jian-feng, YU Li, XIANG Li
( Department of Emergency, Second Affiliated Hospital of Guangxi Medical University, Nanning 530000, China)
Objective To investigate the effects of Diammonium Glycyrrhizinate (DG) on the expression of HMGB1 in rat alveolar epithelial cell Ⅱ(AECⅡ )with paraquat (PQ). Methods The AECⅡ was cultured in RPMI-1640 media containing 10% FBS, 100 U/ml penicillin and 100 μg/L streptomycin at 37°C in 5% CO2. The cells were divided into three groups: The NS group was induced 24 h without any drugs, the PQ group was induced 24 h by 1000 μmol/L PQ ,and the DG group was induced 2 h by 0.6 mg/ml DG, then, was induced 24 h by 0.6 mg/ml DG+1000 μmol/L PQ. MTT assay was used to measure the proliferation effect of DG on AEC Ⅱ with PQ.The ELISA assay was applied to measuring the levels of HMGB1, TLR-4,MyD88,NF-κB, TNF-α in the three groups. The gene expressions of HMGB1,TLR-4, MyD88, NF-кB P65 mRNA in the three groups were detected by R T-PCR.Results The highest survival rate of AECⅡ induced 24 h by 1000 μmol/L PQ was in the group of 0.6 mg/ml DG, the lowest survival rate of AECⅡ induced 24 h by 1000 μmol/L PQ was in the group of 0 mg/ml DG. The levels of HMGB1, TLR4, MyD88, NF-кB P65, TNF-α in PQ and DG group were higher than those in NS group. While, the levels of HMGB1, TLR-4, MyD88, NF-кB P65, TNF-α in DG group were lower than those in PQ group (P<0.01). The expression of HMGB1, TLR-4, MyD88, NF-кB P65, TNF-α mRNA in PQ and DG group were higher than those in NS group.The expression of HMGB1, TLR4,Myd88,NF-кB P65,TNF-αmRNA in DG group were lower than those in PQ group(P<0.01). Conclusion DG can attenuate the injury in rat alveolar epithelial cells caused by paraquat poisoning. And it can decrease the expressions of HMGB1, TLR-4, MyD88, NF-кB and TNF-α.
Diammonium glycyrrhizinate; High mobility group proteins; Paraquat
國家自然科學基金項目(81360290);廣西自然科學基金項目(2014GXNSFAA118195)
530000 南寧,廣西醫科大學第二附屬醫院急診科
張劍鋒,電話:13977105663
R341.31
A
1002-3429(2017)04-0099-05
10.3969/j.issn.1002-3429.2017.04.035
2016-12-13 修回時間:2017-02-11)

