紅外光譜研究超聲促聚集作用對大豆蛋白-磷脂結構與功能的影響
畢 爽,張巧智,丁 儉,隋曉楠,王中江,齊寶坤,江連洲,李 楊*
(東北農業大學食品學院,黑龍江 哈爾濱 150030)
紅外光譜研究超聲促聚集作用對大豆蛋白-磷脂結構與功能的影響
畢 爽,張巧智,丁 儉,隋曉楠,王中江,齊寶坤,江連洲,李 楊*
(東北農業大學食品學院,黑龍江 哈爾濱 150030)
大豆分離蛋白和大豆卵磷脂在中性條件下(pH 7.0)復合后,可自發組成蛋白質-磷脂復合體系,但仍有部分未自組裝的蛋白質和磷脂存在于溶液中。為實現蛋白質-磷脂最大程度復合,解析復合體系功能性質與大豆蛋白二級結構間的構效關系,本研究采用“超聲改性-結構變化-功能表達”的研究理念,采用傅里葉變換紅外光譜法研究體系結構變化,測定持水性、持油性、凝膠質地剖面并分析其功能性質。結果表明:超聲處理會顯著改善大豆蛋白-磷脂復合體系的功能性質,超聲時間較短時,持水性、持油性等功能性質隨功率的增加先升高后降低;超聲時間較長時,功能性質隨功率的增加持續降低。傅里葉變換紅外光譜分析發現低、中功率條件下,大豆蛋白二級結構中β-折疊相對含量較多而α-螺旋結構相對含量較少,說明大豆蛋白與磷脂間的交互作用更明顯。超聲波作用下復合體系凝膠質地剖面分析表明,功能性質與蛋白質的二級結構改變具有一定的關聯性。以上結果說明,適當的超聲處理有助于改變大豆蛋白-磷脂復合體系的結構并提升其功能性質。
大豆蛋白;卵磷脂;功能性質;結構性質;傅里葉變換紅外光譜
引文格式:
畢爽, 張巧智, 丁儉, 等. 紅外光譜研究超聲促聚集作用對大豆蛋白-磷脂結構與功能的影響[J]. 食品科學, 2017, 38(11): 18-24. DOI:10.7506/spkx1002-6630-201711004. http://www.spkx.net.cn
BI Shuang, ZHANG Qiaozhi, DING Jian, et al. Infrared spectroscopic analysis of the effect of ultrasound-promoted aggregation behavior on structural and functional properties of soybean protein-lecithin system[J]. Food Science, 2017, 38(11): 18-24. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201711004. http://www.spkx.net.cn
大豆蛋白是一種優質的全價植物蛋白,可替代動物蛋白[1]。但其難以同時滿足加工時的特殊需要,所以應做出適當的改性[2]。在過去幾年中,蛋白質的改性技術研究主要集中在物理改性和化學改性[3-4]。尋找一種簡單、營養、高效的天然改性技術一直是研究熱點,如引入生物小分子使其與蛋白質發生相互作用,復合體系的產生對大豆分離蛋白的功能性質具有重要影響。
大豆卵磷脂作為一種兩性離子表面活性劑,可以通過結合的方式使蛋白質的表面活性發生改變,且蛋白質與磷脂之間的交互作用會影響大豆蛋白的功能性質。至今人們已對大豆蛋白-磷脂交互作用方式進行了部分研究,但未能清晰地解釋超聲處理等物理加工方式對蛋白質-磷脂復合體系的影響,更缺少對其結構及功能性質間構效關系的研究。磷脂與蛋白會通過靜電作用和疏水作用結合形成復合物[5],環境因素能夠影響復合體系的性質,如pH值可以修飾蛋白質和磷脂復合物的表面活性,同時改變液滴之間的流體動力學作用;NaCl濃度的增加導致乳清蛋白-磷脂乳液粒徑增大,易造成油滴聚集降低乳液穩定性[6]。但是物理改性技術如超聲波處理,對蛋白質-磷脂復合體系功能性質的影響研究目前仍鮮見報道。
因此,本實驗重點研究超聲功率和超聲時間對大豆蛋白-磷脂復合體系結構和功能性質的影響。采用低、中、高3 種超聲功率(150、300、450 W)和短時、長時2 種超聲時間(12、24 min)作為實驗條件,并對復合體系結構性質和功能特性進行了分析。實驗結果為超聲技術運用于加工專用型大豆蛋白-磷脂復合產品提供了一定參考。
1 材料與方法
1.1 材料與試劑
大豆分離蛋白 東北農業大學糧油加工實驗室自制;大豆卵磷脂 德國Sigma公司;大豆油 山東魯花集團商貿有限公司。
十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)配制試劑盒 北京索寶來試劑公司;鹽酸、氫氧化鈉、磷酸二氫鈉、磷酸氫二鈉 北京新光化工試劑廠。所有試劑均為國產分析純。
1.2 儀器與設備
超聲波細胞破碎儀 寧波新芝生物科技股份有限公司;5430小型高速離心機 德國Eppendorf公司;TA-XT2質構儀 英國Stable Micro System公司;MAGNA-IR560傅里葉變換紅外光譜(Fourier transform infrared spectrum,FT-IR)儀 美國尼高麗公司;SDS-PAGE儀 東方電泳設備有限公司。
1.3 方法
1.3.1 大豆分離蛋白的制備
新鮮大豆磨粉后與正己烷以1∶3(m/V)的比例混合,在 40 ℃條件下攪拌2 h 脫脂3 次。將脫脂豆粉按1∶10(m/V)的比例與水混合,采用2 mol/L的NaOH溶液調節pH值至8.5,攪拌后在4 ℃條件下10 000×g離心20 min,取上清液再用2 mol/L HCl調節pH值至4.5。靜置后在4 ℃條件下6 000×g離心20 min,沉淀水洗2 次后分散于水中并用2 mol/L NaOH調節pH值至7.0。冷凍干燥后粉碎得大豆分離蛋白[7]。
1.3.2 超聲制備大豆蛋白-磷脂復合體系
將大豆分離蛋白與大豆卵磷脂以質量比1∶10混合于50 mL錐形瓶中,室溫條件下不斷攪拌2 h。超聲處理參考Hu Hao等[8]的方法。將超聲波探頭置于復合體系液面下,按表1條件依次超聲。為保持溫度一致,每5 min向冰水浴中加入冰塊。超聲處理后冷凍干燥得大豆蛋白-磷脂復合體系樣品。

表1 超聲處理制備大豆蛋白-磷脂復合體系條件Table 1 Ultrasonic treatments applied on soybean protein-lecithin complex
1.3.3 大豆蛋白-磷脂凝膠持油性測定
將超聲處理的大豆蛋白-磷脂復合體系樣品制備成10 g/100 mL的分散液。90 ℃條件下加熱20 min后冷卻至室溫,形成蛋白質-磷脂凝膠,4 ℃的條件下冷藏24 h以完全形成凝膠。
參考Predroche等[9]的方法。取1 g大豆蛋白-磷脂凝膠樣品加入12 mL大豆油混合。室溫放置30 min使樣品充分被大豆油浸潤,4 500 r/min離心20 min,取沉淀稱質量,持油性的計算方法見式(1)。
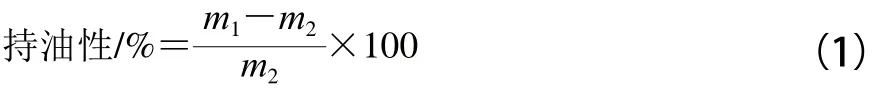
式中:m1為樣品離心后沉淀的質量/g;m2為樣品的質量/g。
1.3.4 大豆蛋白-磷脂凝膠持水性測定
將凝膠樣品放在5 mL的離心管中,室溫6 000×g離心20 min,將試管倒轉,甩去多余的水分移出,分別將離心前與離心后的試管稱質量[10],持水性的計算見式(2)。
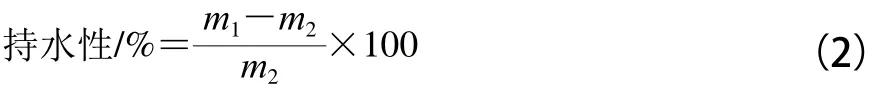
式中:m1為樣品離心前與離心管的總質量/g;m2為樣品離心除水后與離心管的總質量/g。
1.3.5 大豆蛋白-磷脂凝膠質構測定
采用TA-XT2型質構儀進行測定。使用P/0.5探頭,探頭下行速率為1 mm/s,進入凝膠過程中的速率為1 mm/s,下行力為7 g,壓縮變形為樣品高度的30%,室溫測定,每個樣品重復3 次測定,取平均值作為最終結果[11]。
1.3.6 FT-IR測定
采用KBr壓片法,稱取凝膠樣品1 mg,加入溴化鉀100 mg,壓片后進行測定。在室溫條件下,設定掃描波數譜段范圍為400~4 000 cm-1,分辨率設定為4 cm-1,波數精度為0.01 cm-1條件下掃描64 次,譜圖利用Peakfit Version軟件進行處理。平滑處理后估算出子峰的位置和個數,根據各子峰與二級結構對應關系,利用積分面積計算各二級結構組分的相對百分含量[12]。
1.3.7 SDS-PAGE測定
參考Laemmli[13]的測定方法,分離膠體積分數12%,濃縮膠體積分數5%,樣品質量濃度為1 mg/mL,與上樣緩沖液在95 ℃條件下加熱5 min,上樣量為10 μL。電泳過程先恒壓為80 V,跑至分離膠時為120 V,結束后先染色再脫色,標準蛋白采用市售彩虹Marker。
2 結果與分析
2.1 大豆蛋白-磷脂凝膠持油性分析
由圖1可知,未經超聲處理的樣品持油性為32.1%,在較短超聲時間下,樣品的持油性隨著超聲功率的升高先增加后降低。延長超聲時間至24 min后,樣品的持油性在超聲功率為150 W時達到最大(52.7%),相比于未超聲樣品持油率增加64.2%,這是因為在超聲波的機械剪切作用下,蛋白質空間結構打開,暴露的疏水基團與磷脂發生疏水相互作用,提升了復合體系凝膠的親油特性[14]。然而,隨著超聲功率進一步增加,大豆蛋白-磷脂凝膠樣品的持油率又有所下降。說明超聲功率過大的情況下,大豆蛋白發生一定程度的聚集,形成的聚集體由可溶性轉為不溶性,與磷脂間的疏水相互作用減弱。疏水基團包埋,降低了復合體系凝膠的親油性[15]。
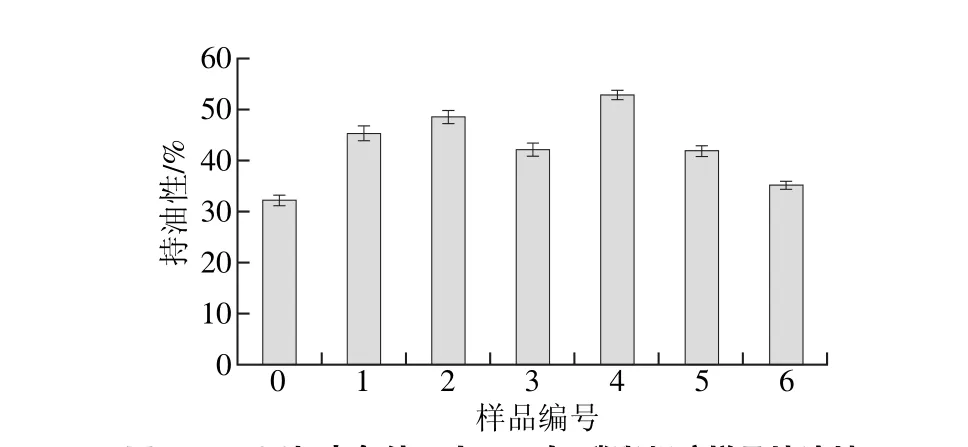
圖1 不同超聲條件下大豆蛋白-磷脂凝膠樣品持油性Fig. 1 Oil-holding capacity of soybean protein isolate-lecithin gels irradiated under different ultrasonic conditions
2.2 大豆蛋白-磷脂凝膠持水性分析

圖2 不同超聲條件下大豆蛋白-磷脂凝膠樣品持水性Fig. 2 Water-holding capacity of soybean protein isolate-lecithin gels irradiated under different ultrasonic conditions
由圖2可知,與未超聲樣品相比,經過不同程度的超聲處理后,大豆蛋白-磷脂凝膠的持水性明顯改善。持水性是重要的凝膠性質,提供凝膠網絡結構吸收水分和保持水分的能力,同時也可表征樣品凝膠內部結構的粗糙程度[16]。Wu Wei等[17]研究表明大豆蛋白凝膠持水性受蛋白質溶解性和粒徑大小的影響。當超聲時間較短時,凝膠樣品持水性隨超聲功率的增加而先升高后降低,這可能是由于超聲波的空化與剪切作用提高了蛋白質的溶解性并減小蛋白質粒子的顆粒直徑,可溶性大豆蛋白與磷脂的交互作用更加明顯。同時超聲波處理導致大豆蛋白的疏水基團暴露,與磷脂分子的疏水尾部發生疏水相互作用[5],形成的密集凝膠網絡結構有助于結合水分。但當超聲時間較長時,高功率超聲作用下粒徑及不溶性聚集體含量增加,由于靜電排斥作用,大豆蛋白與磷脂間的作用減弱,無法發生大范圍的交聯,造成一些大分子的不溶性聚集體出現在凝膠結構中,降低了大豆蛋白-磷脂凝膠的持水性[18]。
2.3 大豆蛋白-磷脂凝膠質構分析
凝膠質地剖面分析(texture profile analysis,TPA)實驗模擬人體口腔的咀嚼運動,樣品進過兩次壓縮,得到力-時間的關系曲線。圖3是典型的蛋白質凝膠質構分析曲線,第一個峰值f2代表凝膠的硬度;t2與t1之比代表凝膠彈性;S3+S4與S1+S2之比代表凝膠的內聚性;S2與S1之比代表回彈性[19]。
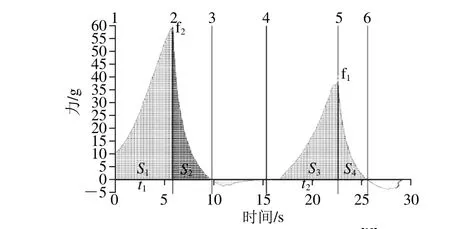
圖3 典型的蛋白凝膠質構特性曲線[19]Fig. 3 Typical texture curves of protein gels[19]
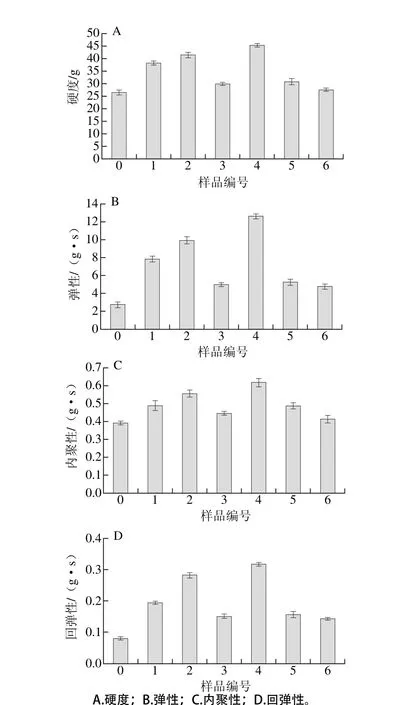
圖4 不同超聲條件下大豆蛋白-磷脂凝膠質構特性Fig. 4 Texture properties of SPI-lecithin gels irradiated under different ultrasonic conditions
如圖4所示,超聲處理后凝膠樣品的硬度、彈性、內聚性以及回彈性較未處理的樣品均有所提高,且不同凝膠樣品間變化較為顯著。超聲時間為12 min時,中強度超聲功率(300 W)條件下大豆蛋白-磷脂凝膠樣品的硬度較高,當超聲時間為24 min時,低強度超聲功率(150 W)條件下樣品的硬度顯著高于其他樣品(P<0.05)。這可能是由于超聲時間與超聲功率的協同作用能量適宜,促進大豆蛋白與卵磷脂的溶解,此時體系內形成的聚集體是可溶性的,粒徑較小。超聲處理有助于蛋白質結構展開,促進與磷脂間的交互作用,形成致密的凝膠結構以增大凝膠的彈性[20]。但當超聲能量輸入進一步增加,蛋白質發生重聚集,形成不溶性的聚集體,破壞凝膠形成有序的網狀結構。說明高功率條件下蛋白質分子柔性被破壞,降低其與小分子生物活性物質的相互作用,致使凝膠表現出硬度低、易破裂及彈性差等現象[21]。為了進一步探究樣品功能性質與結構之間的構效關系,本實驗采用光譜學方法及凝膠電泳分析蛋白質-磷脂凝膠樣品的結構。
2.4 FT-IR分析
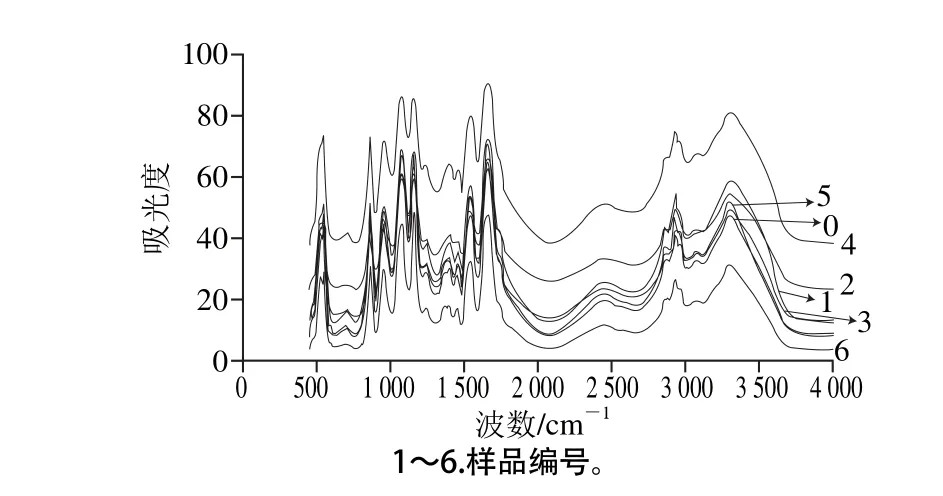
圖5 不同超聲條件下樣品中大豆蛋白FT-IR分析Fig. 5 FT-IR spectra of SPI irradiated under different ultrasonic conditions
圖5 所示為不同超聲條件下樣品中大豆蛋白的FT-IR圖。FT-IR圖可提供蛋白質酰胺Ⅰ帶、酰胺Ⅱ帶、酰胺Ⅲ帶信息以及蛋白質結構中的C—C振動和碳氧糖苷鍵振動等信息[22]。FT-IR的研究可以定量給出樣品中蛋白質的二級結構。根據已有研究,蛋白質二級結構與各子峰間的對應關系為:α-螺旋結構對應波數1 646~1 664 cm-1;β-折疊結構對應波數1 615~1 637 cm-1和1 682~1 700 cm-1;β-轉角結構對應波數1 664~1 681 cm-1;無規卷曲結構對應波數1 637~1 645 cm-1[23]。
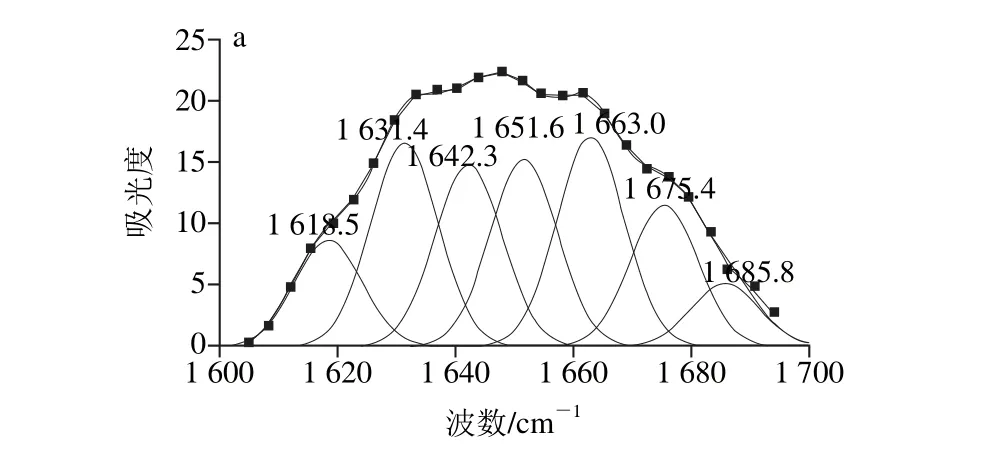

帶的擬合圖譜Fig. 6 Second-derivative FT-IR spectra in the amide Ⅰ region and Gaussian curve fitting for SPI irradiated under different ultrasonic conditions圖6 不同超聲條件下樣品中大豆蛋白酰胺Ⅰ
將不同超聲條件下樣品中大豆蛋白的酰胺Ⅰ帶紅外譜圖做二階導數,采用Gauss面積法擬合,通過峰位歸屬確定二級結構種類和含量,計算結果見表2。
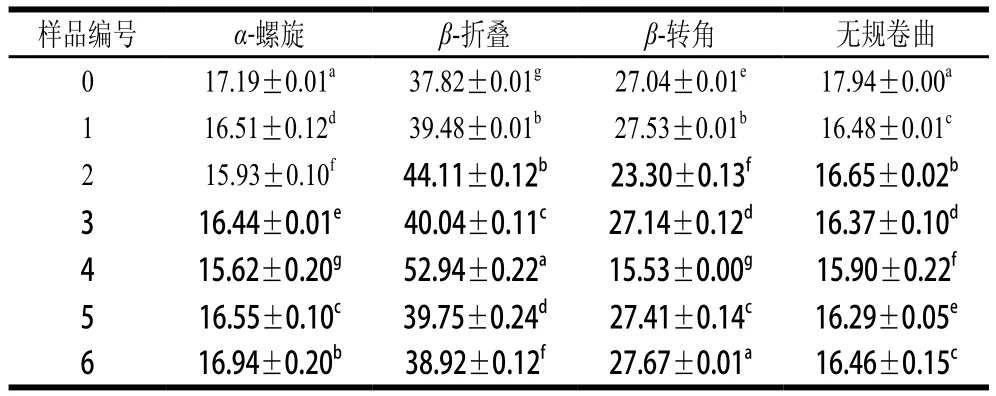
表2 不同超聲條件下樣品中大豆蛋白的二級結構相對含量Table 2 Contents of secondary structures in SPI irradiated under different ultrasonic conditions
低、中功率時蛋白質-磷脂凝膠樣品中α-螺旋及無規卷曲結構相對含量較低,β-折疊結構相對含量較高,尤其是當150 W功率超聲24 min時(4號樣品)。這與Li Chen等[24]的研究一致,可能是大豆卵磷脂的疏水尾部結合到了α-螺旋結構中的疏水性氨基酸區域,從而使蛋白質分子展開改變了體系中二級結構的組成。高功率下蛋白質分子由于空穴效應運動加速,會發生一定程度的聚集,降低了磷脂與蛋白的疏水相互作用。當超聲功率為450 W時,樣品中的α-螺旋結構相對含量呈現出明顯的增加趨勢,這與Hu Hao等[8]研究結果一致,由于蛋白質的二級結構受蛋白質分子與其他分子交互作用的影響,上述結果說明超聲波破壞了這些作用,導致二級結構變化。相似地,Chandrapala等[25]也指出較高的超聲功率(20 kHz,450 W)導致蛋白質出現β-折疊結構向α-螺旋結構轉移的現象。450 W超聲條件下,當超聲時間延長至24 min時,α-螺旋結構相對含量變化更加明顯。因此,形成凝膠結構無序且分布不均勻,凝膠硬度及彈性較差。
2.5 SDS-PAGE結果
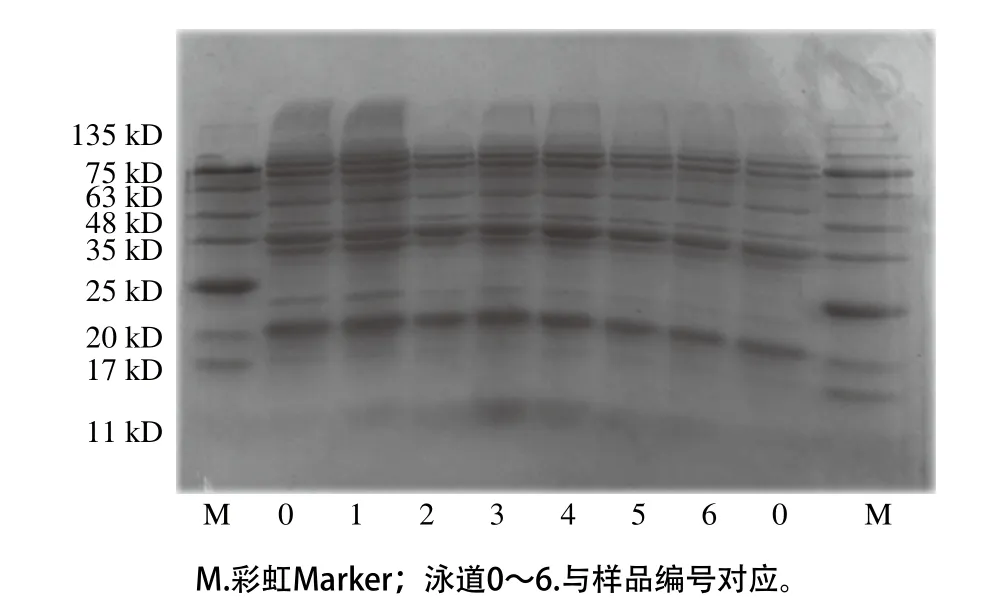
圖7 不同超聲條件下樣品中大豆蛋白的SDS-PAGE圖Fig. 7 SDS-PAGE profiles of SPI irradiated under different ultrasonic conditions
由圖7可知,未處理樣品SDS-PAGE圖清晰地顯示出大豆蛋白各亞基的條帶。超聲處理后大豆蛋白的條帶并無顯著變化,表明超聲處理未改變蛋白質的四級結構,與Karki[26]、Zhang Qiuting[27]等研究結果相同。進一步說明非共價鍵是引起蛋白分子聚集的主要因素,如大豆蛋白與磷脂間的靜電作用和疏水作用[28-30]。
本實驗具體分析了大豆蛋白-磷脂復合體系功能性質隨超聲條件變化的規律,以及構象變化對復合體系功能性質的影響。持水、持油性質和凝膠TPA是復合體系重要的功能性質,與疏水基團的暴露、蛋白質二級結構組成及構象變化息息相關。因此,采用FT-IR法分析復合體系構象變化有利于解析超聲波對復合體系構象、功能性質的影響規律。
3 結 論
本實驗選用不同超聲功率和時間處理蛋白-磷脂復合體系,分析其對體系功能性質的影響,并采用FT-IR分析體系功能與結構的構效關系。得到主要結論如下:1)經過超聲處理后樣品的持油、持水能力都有一定程度的提升。低(150 W)、中(300 W)功率超聲條件下,樣品凝膠的硬度、彈性以及內聚性等性質較好。高功率(450 W)處理致使樣品功能性質下降,且隨著時間的延長更加明顯。2)當大豆蛋白-磷脂復合體系經過150 W,24 min超聲處理時,復合體系的功能性質最佳。通過FT-IR分析發現,大豆蛋白-磷脂復合體系構象上的變化是影響其持水性、持油性、凝膠TPA性質的主要原因。3)FT-IR結果發現低(150 W)、中(300 W)功率超聲處理樣品中α-螺旋及無規卷曲結構相對含量降低,β-折疊相對含量上升,大豆卵磷脂的疏水尾部結合到了α-螺旋結構中的疏水性氨基酸區域,改變了二級結構組成。高功率條件下蛋白質分子由于空穴效應運動加速,會發生一定程度的聚集,降低了磷脂與蛋白的疏水相互作用,因此復合體系功能性質較差,形成的凝膠硬度及彈性低。樣品的SDS-PAGE結果無明顯改變,進一步說明復合體系功能性質的改變與蛋白質二級結構變化有關,而與四級結構變化無關。該結果為超聲波技術運用于加工專用型大豆蛋白-磷脂復合產品提供了一定的理論依據。
[1] MA L, LI B, HAN F, et al. Evaluation of the chemical quality traits of soybean seeds, as related to sensory attributes of soymilk[J]. Food Chemistry, 2015, 173(5): 694-701. DOI:10.1016/ j.foodchem.2014.10.096.
[2] KATO A, OSAKA y, MATSUDOMI N, et al. Changes in the emulsifying and foaming properties of proteins during heat denaturation[J]. Agricultural and Biological Chemistry, 1983, 47(1): 33-37. DOI:10.1080/00021369.1983.10865579.
[3] WANG X S, TANG C H, LI B S, et al. Effects of high-pressure treatment on some physicochemical and functional properties of soy protein isolates[J]. Food Hydrocolloids, 2008, 22(4): 560-567. DOI:10.1016/j.foodhyd.2007.01.027.
[4] ZHANG Jinbo, WU Nannan, yANG Xiaoquan, et al. Improvement of emulsifying properties of Maillard reaction products from β-conglycinin and dextran using controlled enzymatic hydrolysis[J]. Food Hydrocolloids, 2012, 28(2): 301-312. DOI:10.1016/ j.foodhyd.2012.01.006.
[5] SCURIATTI M, TOMAS M, WANGNER J. Influence of soybean protein isolates-phosphatidycholine interaction on the stability on oilin-water emulsions[J]. Journal of the American Oil Chemists’ Society, 2003, 80(11): 1093-1100. DOI:10.1007/s11746-003-0825-7.
[6] SUNDER A, SCHERZE I, MUSCHIOLIK G. Physico-chemical characteristics of oil-in-water emulsions based on whey proteinphospholipid mixtures[J]. Colloids and Surfaces B: Biointerfaces, 2001, 21(1): 75-85. DOI:10.1016/S0927-7765(01)00186-2.
[7] WOLF W J. Soybean proteins. Their functional, chemical, and physical properties[J]. Journal of Agricultural and Food Chemistry, 1970, 18(6): 969-976. DOI:10.1021/jf60172a025.
[8] HU Hao, WU Jiahui, LI-CHAN E C, et al. Effects of ultrasound on structural and physical properties of soy protein isolate (SPI) dispersions[J]. Food Hydrocolloids, 2013, 30(2): 647-655. DOI:10.1016/j.foodhyd.2012.08.001.
[9] PREDROCHE J, yUST M M, LQARI H, et al. Brassica carinata protein isolates: chemical composition, protein characterization and improvement of functional properties by protein hydrolysis[J]. Food Chemistry, 2004, 88(3): 337-346. DOI:10.1016/ j.foodchem.2004.01.045.
[10] TANG C H, WANG X y, yANG X Q, et al. Formation of soluble aggregates from insoluble commercial soy protein isolate by means of ultrasonic treatment and their gelling properties[J]. Journal of Food Engineering, 2009, 92(4): 432-437. DOI:10.1016/ j.ijbiomac.2006.06.013.
[11] ETTALIBI M, BARATTI J C. Purif i cation, properties and comparison of invertase, exoinulinases and endoinulinases of Aspergillus fi cuum[J]. Applied Microbiology and Biotechnology, 1987, 26(1): 13-20.
[12] SUREWICZ W K, MANTSCH H H. New insight into protein secondary structure from resolution-enhanced infrared spectra[J]. Biochimica et Biophysica Acta (BBA)-Protein Structure and Molecular Enzymology, 1988, 952: 115-130.
[13] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227(52): 680-685.
[14] 張海華, 朱科學, 周惠明. 超聲波對小麥面筋蛋白結構的影響[J]. 中國農業科學, 2010, 43(22): 4687-4693.
[15] 陶蔚孫, 李惟, 姜涌明. 蛋白質分子基礎[J]. 北京: 高等教育出版社, 1986: 33-36.
[16] LAKEMOND C M, de JONGH H H, PAQUES M, et al. Gelation of soy glycinin; inf l uence of pH and ionic strength on network structure in relation to protein conformation[J]. Food Hydrocolloids, 2003, 17(3): 365-377. DOI:10.1016/S0268-005X(02)00100-5.
[17] WU Wei, HUA yufei, LIN Qinlu, et al. Effects of oxidative modif i cation on thermal aggregation and gel properties of soy protein by peroxyl radicals[J]. International Journal of Food Science and Technology, 2011, 46(9): 1891-1897. DOI:10.1007/s13197-011-0533-7.
[18] 李云, 華欲飛. 大豆蛋白聚集及共混凝膠性質研究[D]. 無錫: 江南大學, 2007: 27-33.
[19] 王顯生, 楊曉泉, 高文瑞, 等. 不同亞基變異類型的大豆分離蛋白凝膠質構特性的研究[J]. 中國糧油學報, 2006, 21(3): 116-121.
[20] ALTING A C, HAMER R J, de KRUIF C G, et al. Number of thiol groups rather than the size of the aggregates determines the hardness of cold set whey protein gels[J]. Food Hydrocolloids, 2003, 17(4): 469-479. DOI:10.1016/S0268-005X(03)00023-7.
[21] HOU D H J, CHANG S K C. Structural characteristics of purified glycinin from soybeans stored under various conditions[J]. Journal of Agricultural and Food Chemistry, 2004, 52(26): 3792-3800. DOI:10.1021/jf049430p.
[22] BARTH A. Infrared spectroscopy of proteins[J]. Biochimica et Biophysica Acta, 2007, 1767: 1073-1101. DOI:10.1016/ j.bbabio.2007.06.004.
[23] NGUYEN J, BALDWIN M A, COHEN F E, et al. Prion protein peptides induce alpha-helix to beta-sheet conformational transitions[J]. Biochemistry, 1995, 34(13): 4186-4192.
[24] LI Chen, HUANG Xingjain, PENG Qiang, et al. Physicochemical properties of peanut protein isolate-glucomannan conjugates prepared by ultrasonic treatment[J]. Ultrasonics Sonochemistry, 2014, 21(5): 1722-1727. DOI:10.1016/j.ultsonch.2014.03.018.
[25] CHANDRAPALA J, OLIVER C, KENTISH S, et al. Ultrasonics in food processing[J]. Ultrasonics Sonochemistry, 2012, 19(5): 975-983. DOI:10.1016/j.tifs.2010.04.003.
[26] KARKI B, LAMSAL B P, GREWELL D, et al. Functional properties of soy protein isolates produced from ultrasonicated defatted soy fl akes[J]. Journal of the American Oil Chemists’ Society, 2009, 86(10): 1021-1028.
[27] ZHANG Qiuting, TU Zongcai, XIAO Hui, et al. Inf l uence of ultrasonic treatment on the structure and emulsifying properties of peanut protein isolate[J]. Food and Bioproducts Processing, 2014, 92(1): 30-37. DOI:10.1016/j.fbp.2013.07.006.
[28] yANJUN S, JIANHANG C, SHUWEN Z, et al. Effect of power ultrasound pre-treatment on the physical and functional properties of reconstituted milk protein concentrate[J]. Journal of Food Engineering, 2014, 124: 11-18. DOI:10.1016/j.jfoodeng.2013.09.013.
[29] THIVILLIERS F, LAURICHESSES E, SAADAOUI H, et al. Thermally induced gelling of oil-in water emulsions comprising partially crystallized droplets: the impact of interfacial crystals[J]. Langmuir, 2008, 24(23): 13364-13375. DOI:10.1021/la802521f.
[30] 畢爽, 齊寶坤, 隋曉楠, 等. 超聲處理對黑豆蛋白結構和功能性質的影響[J]. 中國食品學報, 2016, 16(6): 153-160.
Infrared Spectroscopic Analysis of the Effect of Ultrasound-Promoted Aggregation Behavior on Structural and Functional Properties of Soybean Protein-Lecithin System
BI Shuang, ZHANG Qiaozhi, DING Jian, SUI Xiaonan, WANG Zhongjiang, QI Baokun, JIANG Lianzhou, LI Yang*
(College of Food Science, Northeast Agricultural University, Harbin 150030, China)
Soybean protein isolate (SPI) and lecithin can be self-assembled into a complex system at neutral condition (pH 7.0), while the unassembled compounds are still present in the solution. In an effort to achieve maximum complexation between SPI and lecithin and to elucidate the relationship between the functional properties of the complex system and the secondary structure of soybean proteins, we examined the structural variability of the system by Fourier transform infrared spectroscopy and measured its water-holding capacity, oil-holding capacity, gel texture characteristics and functional properties under ultrasound irradiation. The results showed that ultrasonic treatment significantly improved functional properties of the soybean protein-lecithin complex. Water-holding capacity and oil-holding capacity increased firstly then decreased with increasing ultrasonic power after a short irradiation time, but these functional properties continuously decreased with increasing ultrasonic power after a long irradiation time. Fourier transform infrared spectroscopic analysis revealed that the secondary structure of SPI contained a lower content of α-helix and a higher content of β-structure after ultrasonic irradiation at low and medium powers, indicating stronger protein-lecithin interactions. There was a certain relationship between the gel texture characteristics of the complex system and the secondary structure of SPI. The structure of soybean protein-lecithin system could be changed by proper ultrasonic treatment, thus improving its functional properties.
soybean protein; lecithin; functional properties; structural properties; Fourier transform infrared spectroscopy
10.7506/spkx1002-6630-201711004
TS214.9
A
1002-6630(2017)11-0018-07
2016-03-17
國家自然科學基金青年科學基金項目(31301501);國家自然科學基金面上項目(31571876);國家高技術研究發展計劃(863計劃)項目(2013AA102104);黑龍江省普通本科高等學校青年創新人才培養計劃項目(UNPYSCT-2015011)
畢爽(1992-),女,碩士研究生,研究方向為糧食、油脂及植物蛋白工程。E-mail:13163436989@163.com
*通信作者:李楊(1979-),男,副教授,博士,研究方向為糧食、油脂及植物蛋白工程。E-mail:liyanghuangyu@163.com

