鈀催化吲哚的去芳香化雙芳基化
賈義霞,李英龍,劉人榮
(浙江工業大學 化學工程學院,浙江 杭州 310014)
鈀催化吲哚的去芳香化雙芳基化
賈義霞,李英龍,劉人榮
(浙江工業大學 化學工程學院,浙江 杭州 310014)
以鈀為催化劑,三環己基膦為配體,芳基硼酸為芳基化試劑,通過吲哚的分子內Heck/Suzuki串聯反應實現了吲哚的雙官能團化,為合成結構多樣性的吲哚啉衍生物提供了一種高效、快捷的方法.通過簡單起始原料出發,高產率、高對映選擇性地合成了一系列的含有連續叔碳/季碳中心的吲哚林化合物.并系統地研究了反應的溶劑、堿和配體對反應的影響以及底物中各種給電子或吸電子基團對產物收率的影響.重要的是,通過該反應可以順利實現克級規模制備,體現了方法的優越性及可靠性.
鈀催化;吲哚;芳基化;去芳構化;串聯反應
吲哚啉廣泛存在于具有生物活性天然產物以及藥物活性分子中,并常用作醫藥或農藥合成的中間體,近年來一直受到化學家們的廣泛關注[1-4].大多數已報道的合成吲哚啉方法往往需要多步合成才能得以實現,發展高效、快速構建吲哚啉的合成方法具有重要意義[5].近年來,過渡金屬催化的吲哚去芳構化反應已經成為合成具有吲哚啉骨架類化合物的一種重要方法[6].2011年,Bedford小組利用鈀催化的偶聯反應實現了2-氨基-1,3-二甲基吲哚的去芳構化[7].2012年,You小組報道了鈀催化的3-取代吲哚的去芳構化反應,以最高93%的收率獲得去芳構化產物[8].2015年,筆者課題組報道了Pd催化的N-取代吲哚的不對稱去芳構化反應[9],基于受阻的碳-氫活化的策略首次實現了吲哚的去芳構化還原Heck反應,合成了具有季碳手性中心的吲哚啉類化合物.隨后,Lautens課題組以氰化鋅為氰基化試劑,首次實現了吲哚2,3-位的去芳構化雙官能化反應[10].梁永民小組[11]和筆者小組[12]也分別通過脫羧偶聯和sonogashira偶聯反應對芐基鈀中間體進行捕獲,實現了吲哚2,3-位的去芳構化/炔基化反應.最近,Lautens小組又進一步采用芳基硼酸酯為試劑對反應中形成的芐基鈀中間體進行捕獲,高非對映選擇性地完成了吲哚去芳基化/Suzuki偶聯串聯反應[13].在Lautens課題組進行研究的同時,筆者也對吲哚的2,3-位去芳構化雙官能化反應進行研究,與Lautens課題組不同的是筆者采用更便宜的芳基硼酸為底物,以及更簡單的醋酸鈀/三環己基膦為催化劑,通過吲哚的分子內去Heck/Suzuki串聯反應高非對映選擇性地實現了吲哚的雙官能團化.
1 實驗部分
1.1 實驗試劑及儀器
儀器:Bruker Advance Ш 500 MHz型核磁共振儀(TMS作為內標,CDCl3作為溶劑)柱色譜為柱層析硅膠(用200~300目硅膠,青島海洋化工),所有反應均在常規玻璃儀器中進行,采用磁力攪拌.
主要試劑:各類含不同取代基的吲哚、不同取代的鄰溴苯甲酸、苯硼酸、醋酸鈀、膦配體及各類有機溶劑等(所用試劑均為市售分析純或者化學純).
1.2 實驗方法
鈀催化Heck/Suzuki串聯反應對吲哚去芳香化雙官能化反應的典型操作步驟:在安培管中依次加入0.2 mmol的取代吲哚底物Ⅰa,0.4 mmol的苯硼酸Ⅱa,0.4 mmol的K2CO3,摩爾分數為5%的Pd(OAc)2和摩爾分數為10%的配體PCy3·HBF4,氮氣保護下,注射器加入2 mL的新蒸餾的溶劑,100 ℃下反應12 h.反應結束后粗產品用層析柱分離得到目標產物,其中層析柱分離時使用的淋洗液為V(乙酸乙酯)∶V(石油醚,60~90 ℃)=1∶10.
部分產物表征如下:
10b-甲基-11-(苯基)-10b,11-二氫-6H-吲哚并[2,1-a]吲哚-6-酮(Ⅲaa):白色固體,產率86%,Mp=176~177 ℃,1H NMR(500 MHz, CDCl3)δ7.83(d,J=8.0 Hz, 1H),7.69(d,J=7.5 Hz, 1H),7.41(t,J=7.5 Hz, 1H),7.25(dd,J=12.0,8.5 Hz,2H),7.18(d,J=7.5 Hz,1H),7.13(d,J=7.5 Hz,1H),7.06(d,J=7.5 Hz,1H),6.88~6.96(m,3H),6.55(d,J=7.0 Hz,2H),4.36(s,1H),1.76(s,3H).13C NMR(125 MHz, CDCl3)δ168.5,140.7,139.2,138.9,132.8,131.9,128.7,128.2,128.0,127.6,126.8,126.6,125.0,124.2,123.0,117.1,76.0,57.1,28.4.HRMSm/z(ESI+): Calculated for C22H17NO ([M+H]+):312.138 8, Found 312.138 3.
9-甲氧基-10b-甲基-11-(苯基)-10b,11-二氫-6H-吲哚并[2,1-a]吲哚-6-酮(Ⅲba):白色固體,產率94%,Mp=135-136 ℃,94% yield;1H NMR (500 MHz, CDCl3)δ7.84 (d,J=7.9 Hz,1H),7.42(td,J=7.5,1.0 Hz,1H),7.17~7.20 (m,2H),7.14(td,J=7.0,1.0 Hz,1H),6.94~6.99(m,4H),6.85(dd,J=8.5,2.5 Hz,1H),6.55~6.58(m,2H),4.35(s,1H),3.76(s,3H),1.75(s,3H).13C NMR(125 MHz, CDCl3)δ168.4,159.8,141.1,140.8,139.2,139.0,134.2,128.6,128.2,127.6,126.8,126.6,1 250,123.8,120.4,117.0,106.7,75.6,57.0,55.5,28.5. HRMSm/z(ESI+): Calculated for C23H19NO2([M+H]+):342.149 4, Found 342.148 7.
9,10b-二甲基-11-(苯基)-10b,11-二氫-6H-吲哚并[2,1-a]吲哚-6-酮(Ⅲca):白色固體,產率94%,Mp=172~173 ℃,94% yield;1H NMR(500 MHz, CDCl3)δ7.83(d,J=8.0 Hz,1H),7.58(d,J=7.5 Hz,1H),7.41(td,J=7.5,1.0 Hz,1H),7.17~7.21(m,1H),7.13(td,J=7.5,1.0 Hz,1H),7.05 (dd,J=8.0,0.5 Hz,1H),6.92~6.98 (m,3H),6.86(s,1H),6.55~6.59(m,2H),4.35(s,1H),2.26(s,3H),1.76(s,3H).13C NMR (125 MHz, CDCl3)δ168.7,149.1,142.7,140.8,139.4,138.8,130.3,129.1,128.6,128.1,127.6,126.8,126.5,124.9,124.0,123.6,117.0,75.7,57.1,28.5,21.8. HRMSm/z(ESI+): Calculated for C23H19NO([M+H]+):326.154 5, Found 326.154 2.
9-氟-10b-甲基-11-(苯基)-10b,11-二氫-6H-吲哚并[2,1-a]吲哚-6-酮(Ⅲda):Mp=193~194 ℃,產率68%;1H NMR (500 MHz, CDCl3)δ7.84(d,J=8.0 Hz,1H),7.42~7.46(m,1H),7.36(dd,J=7.5,2.5 Hz,1H),7.21(dd,J=7.0,0.5 Hz,1H),7.15~7.18(m,1H),7.05(dd,J=8.0,4.5 Hz,1H),6.95~7.01(m,4H),6.56(dd,J=7.5,1.5 Hz,2H),4.37(s,1H),1.77(s,3H).13C NMR(125 MHz,CDCl3)δ167.2,167.1,162.6(d,J=246.3 Hz),144.2(d,J=2.4 Hz),140.5,138.9(d,J=19.8 Hz),135.0(d,J=8.4 Hz),128.8,128.4,127.5,127.0,126.6,125.3,124.5(d,J=8.4 Hz),119.5(d,J=24.0 Hz),117.1,110.8(d,J=25.0 Hz),75.7,57.1,28.4. HRMSm/z(ESI+): Calculated for C22H16FNO([M+H]+):330.129 4, Found 330.129 0.
10,10b-二甲基-11-(苯基)-10b,11-二氫-6H-吲哚并[2,1-a]吲哚-6-酮(Ⅲea):Mp=180~181 ℃,產率49%;1H NMR(500 MHz, CDCl3)δ7.86(d,J=7.5 Hz,1H),7.66(d,J=7.5 Hz,1H),7.39(td,J=7.5,1.0 Hz,1H),7.23(t,J=7.5 Hz,1H),7.16(d,J=7.5 Hz,1H),7.08~7.11(m,2H),6.94~6.97(m,3H),6.64~6.67(m,2H),4.39(s,1H),2.27(s,3H),1.81(s,3H).13C NMR(125 MHz, CDCl3)δ167.7,146.3,140.9,140.0,138.0,134.0,133.7,132.5,128.6,128.5,128.0,127.3,126.9,126.3,124.9,122.0,117.0,76.2,56.7,26.5,19.1. HRMSm/z(ESI+): Calculated for C23H19NO([M+H]+):326.154 5, Found 326.154 0.
8,9-二甲氧基-10b-甲基-11-(苯基)-10b,11-二氫-6H-吲哚并[2,1-a]吲哚-6-酮(Ⅲfa):Mp=180~181 ℃,產率96%;1H NMR(500 MHz, CDCl3)δ7.80(d,J=8.0 Hz,1H),7.40(t,J=7.5 Hz,1H),7.14~7.18(m,2H),7.12(d,J=7.5 Hz,1H),6.97(d,J=7.0 Hz,3H),6.59(d,J=6.5 Hz,2H),6.44(s,1H),4.34(s,1H),3.85(s,3H),3.77(s,3H),1.76(s,3H).13C NMR(125 MHz, CDCl3)δ169.1,152.8,149.5,143.1,141.0,139.6,138.5,128.6,128.1,127.8,126.9,126.5,124.8,124.7,116.8 105.4,105.2,75.4,57.07(s),56.1,56.0,28.7. HRMSm/z(ESI+): Calculated for C24H21NO3([M+H]+):372.160 0, Found 372.162 1.
2 結果與討論
2.1 反應條件優化
采用吲哚衍生物Ⅰa和苯硼酸Ⅱa作為模型底物,來研究吲哚與苯硼酸的去芳構化串聯反應.以摩爾分數為5%的Pd(OAc)2作為催化劑,摩爾分數為10%的PPh3作為配體,2當量的K2CO3作為堿,在甲苯溶劑中100 ℃下進行12 h反應后,能夠以66%的收率得到單一構型的去芳構化目標產物Ⅲa(表1,序號1).受此鼓舞,首先對反應條件中的溶劑進行篩選,其反應式為
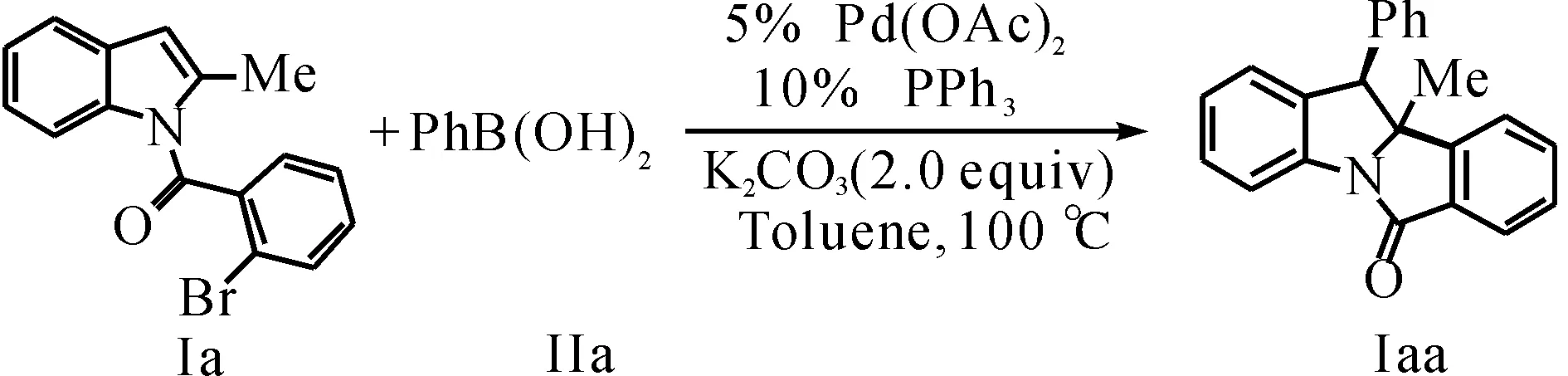
表1 溶劑對產率的影響

序號12345溶劑TolueneDMFTHFMeOHMeCN產率/%664353—78
2.1.1 溶劑對產率的影響
當以DMF和THF作為反應溶劑時,雖然反應也能順利發生,但產率有所降低(表1,序號2,3).而以MeOH作為溶劑時,反應幾乎不能檢測到產物(表1,序號4).最后,當使用MeCN作為溶劑時,反應產率可以得到較大提升,以78%收率得到目標產物.
2.1.2 堿對產率的影響
接下來,以MeCN為溶劑對反應的堿進行考察.如表2所示,以K3PO4為堿時能夠得到與K2CO3幾乎相當的結果.采用有機堿Et3N以及堿性更弱的NaHCO3為堿時,反應產率顯著降低.而采用更強堿性的Cs2CO3為堿時,反應幾乎得不到產物.
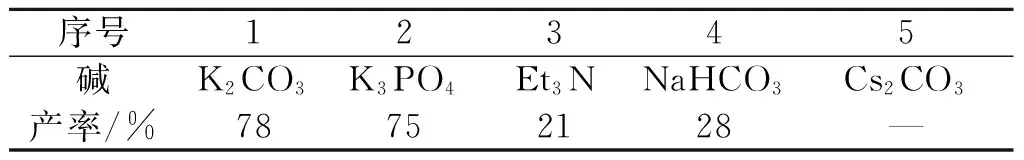
表2 堿對產率的影響
2.1.3 配體對產率的影響
以MeCN為溶劑,K2CO3作堿,對反應的配體進行考察.如表3所示,當使用雙齒配體dppm或dppb作為配體時,產率有所下降.而使用大位阻富電子的PCy3為配體時,能以最高86%的收率得到目標產物,而以PtBu3·HBF4為配體時,產率僅有18%.
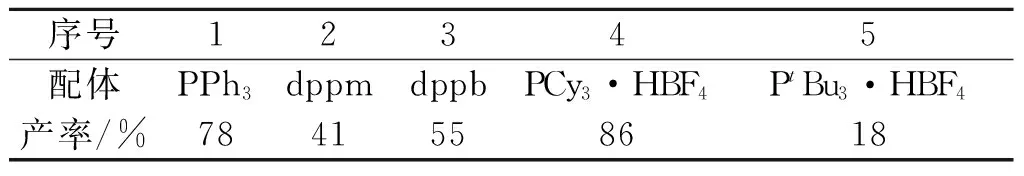
表3 配體對產率的影響
2.2 底物拓展
在上述最優反應條件下,首先對吲哚底物的普適性進行了考察.底物Ⅰ的拓展結構式(yield表示收率,dr表示非對映異構體比值)為
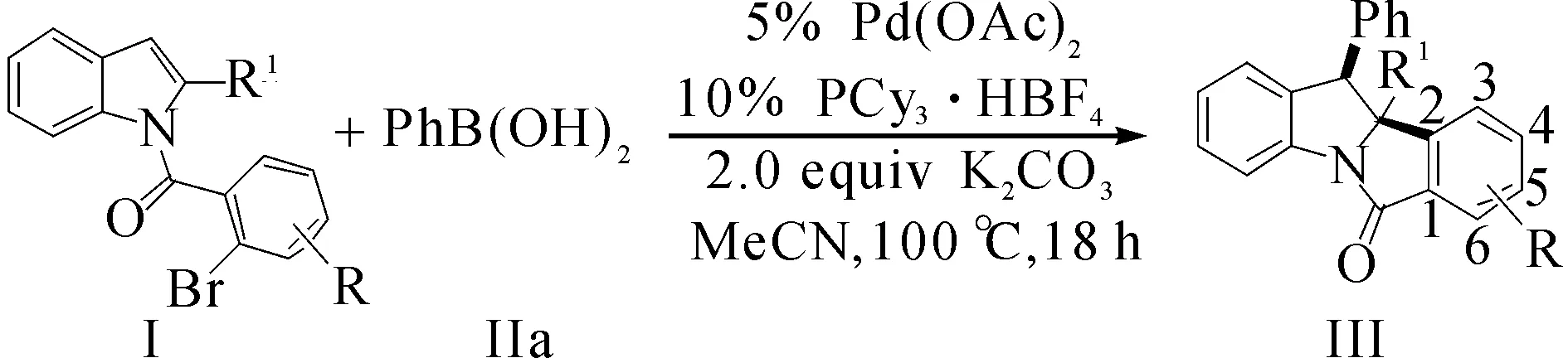
吲哚底物含溴芳環上不論含有富電子還是吸電子取代基,均能以良好到優異的產率得到去芳構化串聯反應產物.相對而言,含有給電子基團的底物較吸電子取代基底物產率更高(Ⅲfa vs Ⅲda).當芳環上含有位阻更大的鄰位取代基時,反應產率大幅降低(Ⅲea).除此之外,吲哚2位上的取代基為芳香取代基時,同樣能以較高收率得到目標產物(Ⅲga~Ⅲia),產率較烷基取代底物略有下降.
接下來,對芳基硼酸底物進行考察.底物2的拓展結構式(yield表示收率,dr表示非對映異構體比值)為
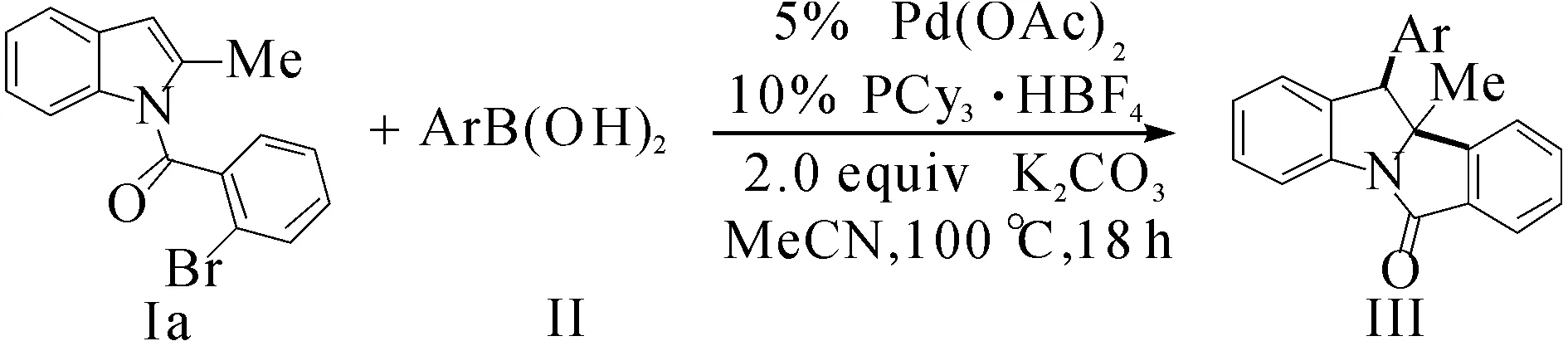
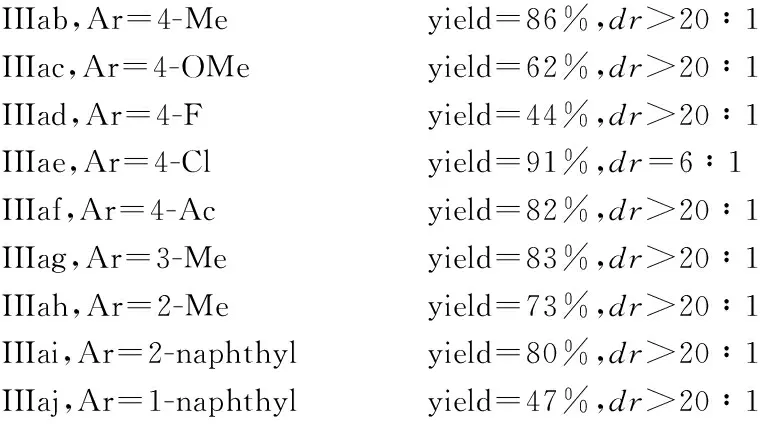
在標準條件下,各種鄰位、對位和間位取代的芳基硼酸均能以良好到優秀的收率得到去芳構化目標產物.含有強給電子(Ⅱc)或強吸電子基團硼酸(Ⅱd)都使反應產率有較大幅度下降.當以對氯硼酸作為底物時,反應的非對映選擇性較差,只能得到非對映選擇性為6∶1的去芳香化產物Ⅲea.總體上講,含有鄰位取代基的芳基硼酸較相應間位或對位產率有較大幅度降低(Ⅲah vs Ⅲai)和(Ⅲaj vs Ⅲab and Ⅲag).
3 結 論
以醋酸鈀鈀為催化劑,芳基硼酸為芳基化試劑,通過吲哚的分子內去芳構化/芳基化串聯反應實現了吲哚的雙官能團化,高非對映選擇性地合成了一系列含有連續季碳和叔碳中心的2,3-二取代吲哚啉化合物.該反應條件溫和、底物適用范圍較好.
[1] 沈曉燕,高建榮,韓亮,等.MCM-41的磺酸官能化及催化性能研究[J].浙江工業大學學報,2011,39(6):605-608.
[2] 劉運奎,江波,婁紹杰,等.鈀催化的喹喔啉基導向的鄰位碳-氫鍵乙酸化反應[J].浙江工業大學學報,2013,41(1):1-5.
[3] 高建榮,龔淵,金紅衛,等.一種合成氮丙啶衍生物的新方法[J].浙江工業大學學報,2014,42(1):77-80.
[4] DALPOZZO R, BARTOLI G, BENCIVENNI G. Recent advances in organocatalytic methods for the synthesis of disubstituted 2-and 3-indolinones[J]. Chemical society reviews,2012,41,7247-7290.
[5] IYENGAR R, SCHILDKNEGT K, MORTON M, et al. Revisiting a classic approach to the aspido-sperma alkaloids: an intramolecular schmidt reaction mediated synthesis of (+)-aspi-dospermidine[J]. Journal of organic chemistry,2005,70(26):10645-10652.
[6] PAPE A R, KALIAPPAN K P, KUNDIG E P. Transition-metal-mediated dearomatization re-actions[J]. Chemical reviews,2000,100(8):2917-2940.
[7] BEDFORD R B, BUTTS C P, HADDOW M F, et al. Reactive 4a-alkyl-4aH-carbazoles by catalytic dearomatisation, and their unusual dimerisation and dealkylation reactions[J]. Chemical communications,2009,32(32):4832-4834.
[8] WU K J, DAI L X, YOU S L. Palladium(0)-catalyzed dearomative arylation of indoles: convenient access to spiroindolenine derivatives[J]. Organic letters,2012,14(14):3772-3775.
[9] SHEN C, LIU R R, FAN R J, et al. Enantioselective arylative dearomatization of indoles via Pd-catalyzed intramolecular reductive Heck reactions[J]. Journal of the american chemical society,2015,137(15):4936-4939.
[10] PETRONE D A, YEN A, ZEIDAN N, et al. Dearomative indole bisfunctionalization via a di-astereoselective palladium-catalyzed arylcya-nation[J]. Organic letters,2015,17(19):4838-4841.
[11] CHEN S, WU X X, WANG J, et al. Palladium-catalyzed intramolecular dearomatization of indoles via decarboxylative alkynyl termi-nation[J]. Organic letters,2016,18(16):4016-4019.
[12] LIU R R, XU T F, WANG Y G, et al. Palladium-catalyzed dearomative arylalkynylation of indoles[J]. Chemical communications,2016,52(94):13664-13667.
(責任編輯:陳石平)
Palladium-catalyzed dearomative diarylation of indole
JIA Yixia, LI Yinglong, LIU Renrong
(College of Chemical Engineering, Zhejiang University of Technology, Hangzhou 310014, China)
A novel Pd-catalyzed bisfunctionalization of indoles that proceeds via an intramolecular dearomatization/arylation cascade reaction is developed by employing Pd(OAc)2as a catalyst, PCy3as a ligand and phenylboronic acid as an arylative reagent, which provides a straightforward and efficient access to structural diversely indolines. A series of indolines bearing vicinal tertiary and quaternary stereocenters can be obtained in excellent yields and derived from easily available starting materials. A set of solvents, bases and ligands were screened to enhance the yield. The effect of substituents was also examined. Importantly, this protocol was amenable to gram-scale synthesis, showing the practicality of this reaction.
palladium-catalyzed; indole; arylation; dearomatization; cascade reaction
2016-11-01
國家自然科學基金資助項目(21372202)
賈義霞(1976—),男,江蘇泰州人,教授,博士,研究方向為不對稱合成,E-mail:yxjia@zjut.edu.cn.
O62
A
1006-4303(2017)04-0387-04

