基于ISSR的日本落葉松2代優樹遺傳多樣性研究
汪成成 ,馮 健,姜 韜 ,王月嬋 ,黃 夏
(1.遼寧省林業科學研究院,遼寧 沈陽 110032;2.遼寧省林業調查規劃院)
日本落葉松[Larix kaempferi(Lamb.)Carr.]系松科落葉松屬喬木,因其適應性強、生長迅速、成林快、木材用途廣,已成為我國北方地區及南方亞高山地區引種最為成功的造林樹種之一。日本落葉松苗木主要靠播種繁殖,種子主要是從種子園或母樹林獲得。我國早在1963年就開始了日本落葉松優樹選擇和初級種子園營建工作,當時的初級種子園是利用根據表型選擇的優株營建成。由于選優林地生態環境條件較復雜,所選優樹又未經過子代測定就全部納入種子園的營建中,造成了較高的誤選率,并不可避免地影響了種子園的遺傳多樣性。由于組成種子園優樹的不同,僅以依靠子代測驗來評估種子園的遺傳增益就不能真實地體現種子園的總體遺傳多樣性,這不利于種質資源的保護和遺傳改良[1-2]。本研究旨在通過ISSR分子標記技術來分析日本落葉松2代優樹親本的遺傳多樣性。
ISSR分子標記技術是由ZIETKIEWICZ等[3]于1994年創建的一種以PCR擴增為基礎的新型分子標記技術,其采用 SSR(simple sequence repeats)對簡單重復序列間的遺傳信息進行多態性擴增。因其簡便迅速、多態性高、重復性好的優點被廣泛應用于動植物的品種鑒定[4-5]、DNA指紋圖譜構建[6-7]、物種分類以及種質資源多樣性研究[8-11]等領域,目前未見應用在日本落葉松上的報道。針對以上情況,本研究欲利用ISSR分子標記的方法對80株日本落葉松2代優樹親本的遺傳多樣性進行分析,以求在日本落葉松2代種子園的建成中,有較高的遺傳增益和遺傳多樣性。
1 材料與方法
1.1 試驗樣品
本次試驗的80個不同的日本落葉松2代優樹親本無性系樣品均采自遼寧省撫順市清原縣大孤家國營林場,樣品采集時間為2015年7月20日,每個無性系均選擇樹體健壯的植株,取樹冠中部針葉,每個樣品約5g,采集后立即用錫紙包裹,在錫紙上寫好編號,編號采用隨機的方式編寫,最后投入液氮罐帶回實驗室,于-80℃超低溫冰箱中保存備用。80個供試材料的基本情況見表1。
1.2 DNA的提取與檢測
DNA的提取采用改良CTAB法[12-15],DNA質量的檢測是用0.8%瓊脂糖凝膠電泳和紫外分光光度計,取部分基因組DNA稀釋到50ng·μL-1,保存于-20℃的冰箱內備用。
1.3 ISSR反應體系的優化建立及引物篩選
試驗所用的引物是從加拿大英屬哥倫比亞大學(UBC)網站公布的96個ISSR引物中篩選出的,將篩選的引物在日本落葉松樣本的ISSR反應體系和反應程序中擴增,建立了一套適合日本落葉松的ISSR反應體系和反應程序,即ISSR-PCR反應體系為 25 μL,其中模板 DNA 2 μL,引物 0.5 μL,dNTPs 0.5 μL,10×PCR buffer 2.5 μL,Taq 酶 0.5 μL,ddH2O 19 μL。ISSR的 PCR程序為 95℃預變性 5 min;95℃變性 30s,50 ℃退火 45s,72 ℃延伸 2 min,循環45次;最后72℃延伸10 min,4℃保存。

表1 日本落葉松的供試材料Table1 The test materials of Larix kaempferi(Lamb.)Carr.

續表1
1.4 ISSR擴增及電泳檢測
ISSR-PCR擴增在DG-III雙穩數顯電泳儀上進行,PCR擴增產物采用8%非變性聚丙烯酰胺凝膠電泳,電泳結果用凝膠成像儀檢測并照相、分析。
1.5 數據處理
統計每一引物對供試材料所擴增的清晰可辨的總帶數,按擴增條帶在相對遷移位置的有或無賦值,“有”記為“1”,“無”記為“0”,構建二維數據矩陣。根據ISSR擴增的結果,利用NTSYS-pc version2.1軟件對統計的“0/1”數據矩陣進行分析,得到Dice相似性系數,并利用UPGMA法進行聚類分析,構建樹狀圖[16]。
2 結果與分析
2.1 ISSR標記的遺傳多態性分析
從96個ISSR引物中篩選出重復性好、特異性高、擴增效果好的引物8個(表2),對80份日本落葉松進行PCR擴增,所擴增的片段大部分集中在200~1000bp,其中引物807的擴增圖譜見圖1~圖3。8個ISSR引物擴增統計結果見表3。8個ISSR引物共擴增出281條DNA條帶,全部為多態性條帶,多態性百分率為100%,平均每條引物擴增的多態性條帶數為35.1。
2.2 基于ISSR標記的遺傳相似系數分析
利用NTSYS-pc version2.1軟件對擴增結果進行相似系數計算,得到相似性系數矩陣。ISSR擴增結果的遺傳相似性在0.8479~0.9142之間,變幅為0.0663,。其中編號為C46和C94的遺傳相似系數最低為0.8479(圖4),表明二者親緣關系最遠;編號為C96和C97的遺傳相似系數最高為0.9142(圖5),表明二者親緣關系最近。從相似性系數可以看出,變幅較小,說明所選的材料差異不明顯。

表2 ISSR引物代號及序列Table2 List of ISSR forward primers and their sequence
2.3 基于ISSR標記的聚類分析
基于日本落葉松ISSR遺傳相似性系數,利用UPGMA法進行聚類,獲得聚類樹狀圖(圖6)。當相似性系數在0.856時,將80個日本落葉松親本樣本劃分為5個類群。類群Ⅰ包括65個樣本,在相似性系數為0.8635時該類群可以分為5個亞類群。其中亞類群Ⅰ-1包括8個樣本材料;亞類群Ⅰ-2只有編號為C30這1個樣本材料;亞類群Ⅰ-3包括29個樣本材料;亞類群Ⅰ-4包括6個樣本材料;亞類群Ⅰ-5包括21個樣本材料。類群Ⅱ包括11個樣本材料,類群Ⅲ只有編號為C61和C64這2個樣本材料;類群Ⅳ和類群Ⅴ分別只有1個樣本材料。類群Ⅰ中樣本材料占總樣本的81.25%,說明這一類群中的日本落葉松無性系親本遺傳基礎較為狹窄,大部分親本間親緣關系較近。.
3 結論與討論
近年來,隨著分子生物學的發展,ISSR分子標記技術已經廣泛應用于分類學、品種鑒定、種群遺傳學研究和構建遺傳連鎖圖譜等生物學領域。因其具有快速、可靠、可以提供有關基因組豐富信息的DNA等特點,許多學者將其應用到植物的遺傳多樣性研究上。劉桂豐等[17]分析了分布在國內外的12種五針松的的親緣關系,共檢測出117個位點,其中多態位點百分率在9.40%~33.33%之間,利用ISSR分子標記構建的12種五針松的遺傳關系聚類圖,在閾值0.358時將12種五針松分為2個類群。那冬晨等[18]利用ISSR標記對17個興安落葉松種源的170個樣本進行了遺傳多樣性分析,并根據地理距離和遺傳距離對興安落葉松進行了種源間的劃分。李巖[19]應用ISSR分子標記技術分析了涼水國家自然保護區的天然紅松種群在時間尺度上的遺傳多樣性變化和遺傳分化。隨機選取的15個ISSR引物共檢測出104個位點,其中多態位點85個,多態位點比率為81.73%,Shannon指數得出齡級間遺傳變異為11.96%,Nei指數得出齡級間遺傳分化為11.03%。趙秀香等[20]以煙草靶斑病菌基因組DNA為模板,對采自東北三省煙區的20個煙草靶斑病菌菌株進行ISSR分析,共擴增出132條帶,多態條帶比率為73.48%,在相似系數0.74處將其劃分為3個類群,結果表明遺傳聚類組群與菌株的地理來源具有一定的相關性,而與菌株的致病性無明顯的相關性。前人的研究結果均表明,ISSR分子標記技術能有效揭示品種遺傳多樣性,本研究首次將ISSR分子標記技術應用到日本落葉松2代優樹遺傳多樣性的研究中,分析結果較理想,達到了區分2代優樹之間的親源關系,為日本落葉松2代種子園的營建工作提供了幫助,為日本落葉松種質資源的開發和利用、新品種的選育和生產提供了理論依據。

圖1 引物807對C21~C40號日本落葉松DNA的擴增結果Figure 1 Results of amplification using 807 primer for DNAC21-C40

圖2 引物807對C41~C70號日本落葉松DNA的擴增結果Figure 2 Results of amplification using 807 primer for DNAC 41-C70
圖3 引物807對C71~C100號日本落葉松DNA的擴增結果Figure 3 Results of amplification using 807 primer for DNA C71-C100

表3 ISSR引物擴增帶數及多態性帶數Table3 The numbers of primer amplification and polymorphism

圖4 ISSR標記的包含編號C46和C94的部分供試材料之間的相似性系數Figure 4 Genetic similarity of part of materials include C46 and C94 based on ISSR

圖5 ISSR標記的包含編號C96和C97的部分供試材料之間的相似性系數Figure 5 Genetic similarity of part of materials include C96 and C97 based on ISSR
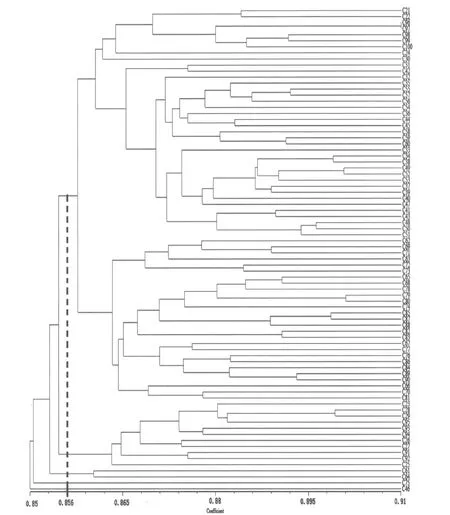
圖6 80份日本落葉松ISSR聚類圖Figure 6 The map of cIuster analysis for 80 Larix kaempferi(Lamb.)Carr.by ISSR
通過利用ISSR分子標記技術分析日本落葉松2代優樹間的遺傳多樣性,結果表明,篩選出的8個引物對80個樣品共擴增出281條DNA條帶,全部為多態性條帶,品種間的遺傳相似性系數在0.8479~0.9142之間,遺傳多樣性不夠豐富。利用UPGMA法進行聚類,在相似系數為0.856時,可將80個日本落葉松種質材料劃分為5個類群。聚類基本符合與子一代的親緣關系,類群間遺傳基礎較狹窄,親緣關系較近。
[1]樸楚炳,張萬雄,劉 君.興安落葉松天然優良林分改造為母樹林的研究初報[J].林業科技,1991,16(3):17-23.
[2]張源潤,周全良,梅曙光,等.華北落葉松無性系種子園子代測定研究[J].寧夏農學院學報,2004,25(4):8-11.
[3]ZIETKIEWICZ E,RAFALSKI A,LABUDA D.Genome fingerprinting by simple sequence repeat(SSR)-anchored polymer action amplification[J].Genomics,1994,20:176-183.
[4]鄭宵蓓,陳科力,尹文仲,等.鄂西高產半夏脂溶性成分的 GC-MS 分析[J].中藥材,2007,30(6):665-667.
[5]孫淑霞,李 靖,陳 棟,等.ISSR分子標記技術在桃品種鑒定中的應用[J].中國農學通報,2011,27(04):173-177.
[6]魏臻武.利用SSR,ISSR和RAPD技術構建苜蓿基因組 DNA 指紋圖譜[J].草業學報,2004,13(3):62-67.
[7]葛亞英,張 飛,沈曉嵐,等.麗穗鳳梨 ISSR 遺傳多樣性分析與指紋圖譜構建[J].中國農業科學,2012,45(4):726-733.
[8]馮亮亮,唐 紅,李 毅,等.甘肅紅砂不同種群遺傳多樣性的 ISSR 分析[J].草業學報,2011,20(1):125-130.
[9]MATLAGA D,KAROLY K.Long-term grazing effects on genetic variation in Idaho fescue[J].Range Management,2004,57:275-278.
[10]雒新艷,王 晨,戴思蘭,等.基于ISSR標記的大菊品種資源遺傳多樣性分析 [J].中國農業科學,2013,46(11):2394-2402.
[11]曾 亮,袁慶華,王 方,等.冰草屬植物種質資源遺傳多樣性的 ISSR 分析[J].草業學報,2013,2:260-267.
[12]WANG X D,WANG Z P,ZOU Y P.An improved procedure for the isolation of nuclear DNA isolation from leaves of wild grapevine dried with silica-gel[J].Plant Mol.Biol.Rep.,1996,14(4):369-373.
[13]王關林,方宏筠.植物基因工程原理與技術[M].北京:高等教育出版社,1998.
[14]胡鳳榮,任 翠,鮑仁蕾,等.風信子DNA不同提取方法的效果比較 [J].沈陽農業大學學報,2011,42(5):570-573.
[15]POREBSKI S,BAILEY L G,BAUM B R.Modification of a CTAB DNA extraction protocol for plants containing high polysaccharide and polyphenol components[J].Plant Molecular Biology Reporter,1997,15(1):8-15.
[16]NEI M,KUMAR S.MoIecular Evolution and Phylogenctics [M].New York:Oxford University Press,2000:87-96.
[17]LIU GF,DONG JX,JIANG Y ET AL.Analysis of genetic relationship in12 species of Section Strobus with ISSR markers [J].Journal of Forestry Research,2005,16(3):213-215.
[18]那冬晨,楊傳平,姜 靜,等.利用ISSR標記分析興安落葉松種源的遺傳多樣性[J].林業科技,2006,31(1):1-4.
[19]李 巖.天然紅松遺傳多樣性在時間尺度上變化的RAPD和ISSR分析[D].大連:遼寧師范大學,2005.
[20]趙秀香,蘇燕妮,伏 穎,等.煙草靶斑病菌(Rhizoctonia solani)ISSR反應體系的優化及遺傳多樣性分析[J].沈陽農業大學學報,2016,47(1):97-102.

