降檸檬酸菌株的篩選及鑒定
張 鐸
毛 勇4
毛 健1,2,3,5,6
劉雙平1,2,3,5,6
周志磊1,2,3,5,6
(1. 江南大學糧食發酵工藝與技術國家工程實驗室,江蘇 無錫 214122;2. 江南大學食品學院,江蘇 無錫 214122;3. 江南大學食品安全與營養協同創新中心,江蘇 無錫 214122;4. 中國酒業協會,北京 100831;5. 國家黃酒工程技術研究中心,浙江 紹興 312000;6. 江南大學﹝如皋﹞食品生物技術研究所,江蘇 如皋 226500)
降檸檬酸菌株的篩選及鑒定
張 鐸1,2,3
毛 勇4
毛 健1,2,3,5,6
劉雙平1,2,3,5,6
周志磊1,2,3,5,6
(1. 江南大學糧食發酵工藝與技術國家工程實驗室,江蘇 無錫 214122;2. 江南大學食品學院,江蘇 無錫 214122;3. 江南大學食品安全與營養協同創新中心,江蘇 無錫 214122;4. 中國酒業協會,北京 100831;5. 國家黃酒工程技術研究中心,浙江 紹興 312000;6. 江南大學﹝如皋﹞食品生物技術研究所,江蘇 如皋 226500)
為篩選具有降檸檬酸能力的酵母菌株,對一檸檬酸廠廢水廢渣中的微生物進行培養分離純化保藏,共獲得具有耐檸檬酸的菌株15株。對15株菌株的降檸檬酸能力進行測試,發現5株菌的降檸檬酸能力較強,發酵5 d可降解檸檬酸培養基中70%以上的檸檬酸。測定5株菌的酒精耐受性,菌株NS2、NL2的酒精耐受能力較強。觀察該兩株菌的形態學及生理生化特性,將NS2鑒定為畢赤酵母菌,NL2鑒定為熱帶假絲酵母菌。進一步通過分子生物手段進行18S rDNA PCR測序分析,將NS2鑒定為Pichiakudriavzevii,NL2鑒定為Candidatropicalis。研究成果可為今后應用生物降酸法降低山楂酒等果酒中有機酸含量提供指導。
酵母菌;降酸;畢赤酵母菌;篩選;測序;鑒定
山楂(CrataeguspinnatifidaBunge)屬薔薇科山楂屬,又名山里果、山里紅,是中國北方地區重要的栽培水果[1]。由于其豐富的營養價值和酸甜可口的風味特點,山楂也常用于釀造果酒。酸度是果酒的釀造過程中的重要指標之一,適量的有機酸有助于豐富果酒風味,營造出清爽可口的口感,同時降低酒體中的pH,起到抑制雜菌生長的作用。但有機酸含量過高則會產生酒體酸澀,難以入口等[2]。發酵型果酒的有機酸主要來自于發酵原料,研究[3]發現不同種類果酒中所含有機酸不同,主要為酒石酸、蘋果酸和檸檬酸。葡萄酒中的有機酸主要為酒石酸[4],蘋果酒中富含大量蘋果酸[5],而山楂酒、橙酒等果酒中的有機酸主要為檸檬酸[6]。目前傳統的果酒降酸方法主要分為物理降酸法如離子交換樹降酸法[7]、電滲析降酸法[8-9]、低溫冷凍降酸法等和化學降酸法[10],以及生物降酸法[11]等。這些降酸方法各有優劣,有研究[12]表明冷凍降酸法不添加其他物質,對葡萄酒原有的風味營養影響較小,但降酸幅度較小,一般可以降低葡萄酒中0.5~2.0 g/L的酒石酸。有報道[13]采用電滲析降酸法對楊梅果酒進行降酸處理,可以降低約42%的可滴定酸,但其是一個連續的降酸過程,動力消耗大,成本高。化學降酸法的原理是利用偏堿性鹽與酒體中的有機酸反應從而達到降酸目的,常用的降酸劑有Na2CO3、K2CO3、KHCO3等,其降酸效果較為明顯[14]。但由于引入了化學添加劑,會導致果酒酒體渾濁,產生苦澀口味等不利影響。生物降酸法中最常見的為蘋果酸—乳酸發酵,這種方法普遍應用于葡萄酒的后酵階段[15],不僅能顯著降低酸度,還可以改善酒體風味,提升葡萄酒的品質[16]。山楂酒中的檸檬酸含量過高,亟需解決,目前山楂酒的化學降酸法研究報道較多,而利用生物降酸法降低檸檬酸含量的研究報道相對較少,王立芳等[17]研究獲得一株陸生伊薩酵母(Isstchenkiaterricola),在蘋果酸和檸檬酸為唯一碳源的培養基中可降解79.9%的蘋果酸和73.1%的檸檬酸,但未繼續探究菌株在果酒中的實際降酸效果。由于生物降酸避免了化學試劑的加入,在顯著降低酸度的同時還可以部分改善果酒品質,符合消費者追求天然的、無添加劑的消費心理。本研究擬通過以檸檬酸為唯一碳源的培養基培養篩選可降解檸檬酸的菌株,旨在今后可以應用于發酵山楂酒降酸工藝。
1 材料與方法
1.1 材料與儀器
1.1.1 材料與試劑
檸檬酸廢水廢渣樣品:取自江蘇省宜興市一檸檬酸廠;
dNTP、瓊脂糖等分子生物試劑:加拿大BBI公司;
其他試劑為國產分析純;
YPD培養基:20 g葡萄糖,20 g魚粉蛋白胨,20 g酵母提取物,自然pH,溶于1 L蒸餾水中;
WL培養基:酵母提取物4 g,胰蛋白胨5 g,葡萄糖50 g,磷酸氫二鉀0.55 g,氯化鉀0.425 g,氯化鈣0.125 g,硫酸鎂0.125 g,氯化鐵0.002 5 g,硫酸錳0.002 5 g,溴甲酚綠0.022 g,pH 6.5,溶于1 L蒸餾水中;
檸檬酸液體培養基:酵母提取物2.5 g,魚粉蛋白胨2.5 g,磷酸二氫鉀 0.55 g,氯化鈣 0.125 g,硫酸鎂 0.125 g,硫酸錳0.002 5 g,檸檬酸12 g,pH 2.8,溶于1 L蒸餾水中。固體培養基則在上述配方基礎上加入20 g/L的瓊脂,121 ℃高壓滅菌20 min[18]。
1.1.2 主要儀器設備
臺式高速冷凍離心機:5810R型,德國 Eppendorf 公司;
恒溫水浴鍋:HH-S2型,江蘇金壇市環宇科學儀器廠;
pH計:FE20k型,梅特勒-托利多儀器有限公司;
鼓風干燥箱:DGG-9240B型,上海森信實驗儀器有限公司;
電子天平:EL3002型,梅特勒-托利多儀器(上海)有限公司;
立式壓力蒸氣滅菌鍋:YXQ-LS-50SII型,上海博迅實業有限公司;
PCR儀:ProFlex型,美國 Life 公司;
電泳儀:DYY-6C型,北京六一儀器廠;
凝膠成像儀:Gel Doc XR型,美國伯樂公司;
紫外分光光度計:UV-2100型,尤尼科(上海)儀器有限公司。
1.2 方法
1.2.1 菌株的分離純化
(1) 采樣富集培養:從檸檬酸廠生產過程中采集廢渣樣品4份分別記為S1、S2、S3、S4,廢水樣品4份,分別記為L1、L2、L3、L4。取4份廢渣樣品各1 g,分別接入50 mL YPD培養基中,吸取廢水樣品各1 mL,分別接入50 mL YPD培養基中,放置于恒溫搖床中培養48 h,培養條件30 ℃,搖床轉速150 r/min。
(2) 檸檬酸培養基篩選培養:若菌株具有降解檸檬酸的能力,其在檸檬酸培養基中必定可以生長,吸取富集培養液2 mL,分別接種于50 mL檸檬酸培養基,放置于恒溫搖床培養48 h,培養條件30 ℃,搖床轉速150 r/min。
(3) 菌株的分離純化培養:將8個錐形瓶中的菌液分別進行梯度稀釋后涂布于WL平板培養基上,梯度稀釋的比例分別為10-3,10-4,10-5,10-6,10-7。置于恒溫培養箱中培養,培養條件30 ℃,48 h。挑取培養基上疑似酵母菌的菌株劃線接種于平板培養基中,繼續挑取單菌落重復平板劃線培養。
1.2.2 菌株保藏 將菌株平板劃線純化培養2代后,挑取單菌落接入50 mL YPD液體培養基中,恒溫搖床培養36 h,靜置10 min,移液槍吸取1 mL培養基底部較濃菌液于規格為2 mL的甘油保藏管中,再加入已滅菌的30%甘油1 mL,旋緊管蓋后振蕩混勻,注明菌株名稱和保藏日期,置于菌種保藏盒,上述操作均在超凈臺無菌完成。將菌種保藏盒放入-80 ℃超低溫冰箱保藏。
1.2.3 降檸檬酸菌株篩選
(1) 菌株降檸檬酸能力試驗:活化菌株接種于檸檬酸液體培養基,置于恒溫培養箱中培養,培養條件30 ℃,培養時間5 d,培養結束后測定檸檬酸濃度,比較菌株降解檸檬酸能力。測定方法采用滴定法,以檸檬酸計。
(2) 菌株酒精耐受性試驗:將活化好的種子液以4%的接種量接種于50 mL 含有5 g/L檸檬酸的YPD液體培養基中,分別加入無水乙醇,調整初始酒精體積分數為0%~10%,30 ℃培養5 d,利用紫外分光光度計在600 nm波長處測定吸光度,每組做3個平行樣。
1.2.4 菌株形態學鑒定 對酵母菌進行平板培養及鏡檢,觀察菌株形態學特征。
(1) 菌落培養特征:將菌株活化后挑取單菌落劃線接種于YPD平板培養基,置于恒溫培養箱中培養,培養條件30 ℃,培養時間2~3 d,觀察平板培養基上菌落形態。
(2) 液體培養基培養特征:將菌株活化后挑取單菌落接種于50 mL YPD液體培養基,置于恒溫搖床培養,培養溫度30 ℃,搖床轉速150 r/min,培養時間2~3 d,觀察液體培養基中菌體培養狀態。
(3) 細胞鏡檢:使用顯微鏡觀察40×10倍下細胞形態。
1.2.5 菌株生理生化鑒定
(1) 糖發酵試驗:鑒定所需發酵的碳源為葡萄糖、麥芽糖、乳糖、蔗糖、D-半乳糖。分別將碳源加入含有杜氏發酵管的氮源基礎培養基中,添加量為0.5%,過濾除菌(0.20 μm)。活化菌株NS2后分別接入不同碳源培養基中,放置于恒溫培養箱中培養,培養溫度25 ℃,每2 d觀察一次,連續觀察2周,于4周后再次觀察。主要觀察杜氏小管中是否產生氣體從而判斷能否發酵該種碳源,若有氣泡則記為陽性,若無氣泡則記為陰性,每種碳源做3次重復[19]19[20]15。
(2) 碳源同化試驗:葡萄糖、乳糖、蔗糖、D-半乳糖、可溶性淀粉、麥芽糖、甘油、甲醇、乙醇、肌醇、甘露醇、檸檬酸、琥珀酸15種碳源。分別將碳源加入氮源基礎培養基中,添加量0.5%,另取一不添加碳源的基礎培養基作為對照,過濾除菌(0.20 μm)。在YPD液體培養基中活化菌株NS2,取滅菌離心管,倒入培養液離心獲得菌沉淀,離心條件10 000×g,5 min。以無菌水洗滌沉淀,重復2次,加入無菌水制得菌懸液。將菌懸液接種于上述培養基中,接種量5%,置于恒溫培養箱中培養3周,培養溫度25 ℃。每周觀察一次,將試管振蕩均勻仔細觀察菌液是否渾濁,若渾濁則記為陽性,若澄清則記為陰性[19]18[20]15。
(3) 氮源同化試驗:鑒定為硝酸鉀、硝酸鈉、硝酸銨、尿素,試驗操作與碳源同化試驗相同,因為pH值小于6時形成的亞硝酸對酵母存在毒性,因此調節初始pH至6.5[19]19[20]15-16。
1.2.6 菌株分子生物鑒定
(1) 菌株DNA提取:吸取1.5 mL菌液于2 mL EP管中,10 000×g離心10 min;收集沉淀,加2 mL ddH2O混懸均勻;10 000×g離心2 min,得菌沉淀,重復1次。用細胞破碎儀破碎,每破碎15 s后將EP管置于冰水浴60 s,重復5次。加1.5 mL ddH2O混懸均勻,10 000×g離心10 min,得菌沉淀。菌沉淀中加入0.5 mL DNA抽提液(100 mmol/L Tris-HCl pH 8.0,100 mmol/L EDTA,pH 8.0,100 mmol/L Na3PO4,1.5 mol/L NaCl)混懸,37 ℃條件下靜置30 min;加入125 μL 10% SDS后,立即加入5 μL 蛋白酶K(濃度為20 mg/mL),混均后65 ℃水浴1 h,每隔15 min上下顛倒混均樣品;加入700 μL CTAB緩沖液,混均后65 ℃水浴1 h,每隔15 min上下顛倒混均樣品。
所得樣品用等體積的氯仿—異戊醇(體積比24∶1)混均后于4 ℃條件下,12 000×g離心10 min,抽提2~3次;以0.6倍體積的異丙醇于-20 ℃沉淀1 h;4 ℃,12 000×g離心10 min,收集核酸沉淀;加入1 mL 70%的乙醇于4 ℃條件下,12 000×g離心10 min,洗滌沉淀2~3次,倒扣去除過量水分,于37 ℃干燥DNA約5 min;加50 μL ddH2O溶解沉淀,加入終濃度為0.5 μL/mL的RNA酶,并在37 ℃下水浴消化30~60 min,以去除RNA;得到的DNA樣品置于-20 ℃ 冰箱保存備用。
(2) PCR檢測方法:將得到的菌株DNA進行Touch down PCR擴增,對菌株的18S rDNA區進行PCR擴增,真菌采用張霞等[21]在相關研究中所使用的通用引物,上游引物為NS1:5’-GTAGTCATATGCTTGTCTC-3’,下游引物為NS8:5’-TCCGCAGGTTCACCTACGCGA-3’,擴增的片段大小約為1 700 bp。PCR體系為(50 μL):Taq PCR master mix 25 μL,上下引物各0.5 μL,模板2.5 μL,補無菌水至50 μL。相應 PCR 反應條件為:95 ℃預變性 5 min;94 ℃變性30 s,60 ℃退火30 s,72 ℃延伸2 min(Touch down PCR,10個循環,每個循環降低1 ℃);94 ℃變性30 s,58 ℃退火30 s,72 ℃延伸2 min(共20個循環);72 ℃終延伸7 min[22]。
(3) 電泳檢測:接通電泳儀,設定電流45 mA,電壓80 V,當指示染料前沿遷移至膠體的2/3處停止電泳,整個電泳持續約30 min,跑膠驗證。
(4) PCR產物檢測:將PCR產物送至南京金斯瑞生物技術有限公司測序,比對測序結果對微生物進行鑒定。
2 結果與分析
2.1 降檸檬酸酵母的篩選
2.1.1 降酸酵母菌的篩選與保藏 通過對檸檬酸廠廢水廢渣中菌株的富集培養,分離純化,共得到可在檸檬酸培養基中生長的疑似酵母菌15株。按1.2.2中方法對這些菌株進行保藏。
2.1.2 降酸菌株在檸檬酸培養基中的篩選 配制檸檬酸液體培養基,以檸檬酸為唯一碳源培養菌株,篩選具有較強降檸檬酸能力的菌株,測得檸檬酸培養基中檸檬酸初始含量為11.3 g/L。對15株保藏菌株進行平板活化,另取兩株商業釀酒酵母菌作為對照。挑取平板單菌落接入50 mL YPD液體培養基中培養,獲得種子培養基,將種子培養基接入檸檬酸培養基,接種量4%。恒溫搖床培養5 d,培養條件30 ℃,150 r/min。發酵結束后培養基的殘余檸檬酸含量見圖1。
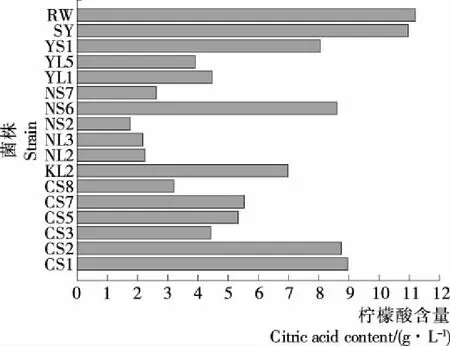
圖1 菌株的檸檬酸降解能力Figure 1 The capability of reducing citric acid
由圖1可知,各個菌株的降檸檬酸能力強弱不一。菌株NS2、NS7、NL2、NL3、CS8具有較強的檸檬酸降解能力,發酵5 d后可降解培養基中70%以上的檸檬酸,其余菌株的降檸檬酸能力相對較弱,而商業釀酒酵母菌RW和SY在該條件下生長受到明顯抑制,難以降解利用檸檬酸。其中菌株NS2的降檸檬酸能力最強,在發酵5 d后檸檬酸含量從11.2 g/L 下降到1.76 g/L,降解培養基中約84%的檸檬酸,對降檸檬酸能力較強的菌株NS2、NS7、NL2、NL3、CS8進行進一步研究。
2.2 菌株酒精耐受性試驗
由于菌株需應用于山楂酒釀造中,因此需要對菌株的酒精耐受性進行試驗,確定菌株的酒精耐受能力后選取具有較強酒精耐受性的菌株,將其應用于山楂酒釀造的適當階段。
由圖2可知,5株菌株對酒精耐受性有所差異。在酒精度為0%vol時,5株菌的生長情況均良好,但隨著酒精度的升高,菌液濃度逐漸下降。酒精度在1%~4%vol時,5株菌均可以生長,其中NS2酒精耐受能力最強,NL2次之,這兩株菌生長情況良好,其余3株菌的生長則受到明顯抑制。當酒精度上升到5%vol時,5株菌的菌液濃度均處在較低水平,當酒精度達到6%vol時,菌株都已經難以生長。可以看出菌株NS2、NL2的酒精耐受能力相對較強,可以耐受0%~4%vol的酒精度。初步判斷這5株菌均非釀酒酵母,選取酒精耐受能力相對較強的NS2、NL2進行培養觀察鑒定。

圖2 菌株酒精度耐受性測試結果Figure 2 The stress resistance of ethanol
2.3 菌株形態學鑒定
酵母菌的菌落培養特征與個體形態特征,是酵母菌種鑒定的重要依據之一[23]7-8。
2.3.1 菌落培養特征 菌株NS2的菌落大而厚,表面不光滑,具有細微褶皺,菌落邊緣呈細小的鋸齒狀;菌落顏色呈乳白色,正反面及內外顏色一致;易用針挑起,菌落質地均勻。菌株NL2的菌落呈圓形,大且中間略有凸起,菌落邊緣呈鋸齒狀,顏色呈白色,質地均勻。
2.3.2 液體培養基培養特征 兩株菌的菌液均明顯渾濁,靜置后表面均形成一層較薄的白色醭膜。
2.3.3 個體形態特征 對菌株進行40×10倍顯微鏡鏡檢,鏡檢結果見圖3。
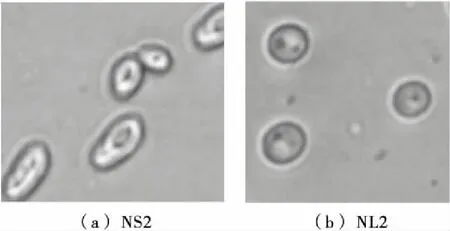
圖3 菌株NS2、NL2的細胞形態Figure 3 The Cell morphology ( × 400) of the strain NS2 and NL2
菌株NS2的細胞形態為橢圓形,細胞大小(長×寬)約為 3.0~4.5 μm×3.5~6.0 μm;菌株NL2的細胞形態為圓形,細胞大小(長×寬)約為4~5 μm×4~5 μm。
2.4 菌株生理生化試驗
2.4.1 糖發酵試驗結果 一半以上的酵母菌在半厭氧條件下至少可以發酵D-葡萄糖,若菌株可以利用該化合物,則菌株可以通過無氧機制對糖類化合物進行分解代謝,釋放氣體。通過尋找收集形成的CO2氣體可以鑒定菌株對該發酵糖的利用能力[23]25-26。菌株NS2、NL2的糖發酵試驗結果見表1。

表1 糖發酵試驗結果?Table 1 The ability of the strains to ferment sugars
? “+”表示陽性,“-”表示陰性。
2.4.2 碳源同化試驗 不同酵母菌對某種有機化合物作為單一碳源的利用能力存在差異,通過這些差異可以在一定程度上區分不同酵母菌。這些化合物包括糖類、多羥糖醇和有機酸類。碳源同化試驗即為鑒定酵母菌在好氧環境下利用這些化合物的能力[23]20-24。菌株NS2、NL2碳源同化試驗結果見表2。
2.4.3 氮源同化試驗 有研究[23]24-25發現大約有1/4的酵母菌可以利用硝酸鹽及其他含氮化合物,因此氮源同化試驗對于鑒定酵母具有重要的應用價值。菌株NS2、NL2的氮源同化試驗見表3。

表2 碳源同化試驗?Table 2 Carbon Assimilation of the strains
? “+”表示陽性,“-”表示陰性。

表3 氮源同化試驗?Table 3 Nitrogen Assimilation of the strains
? “+”表示陽性,“-”表示陰性。
綜合以上試驗結果對菌株NS2、NL2的形態學特征及生理生化進行分析比對,對照文獻[23]34-44中對于酵母菌的描述,菌株NS2符合畢赤酵母菌的生理生化及形態學特征,菌株NL2符合熱帶假絲酵母的生理生化及形態學特征,因此初步判斷這兩株菌分別為畢赤酵母菌、熱帶假絲酵母菌。
2.5 菌株分子生物學鑒定
按1.2.6中方法提取菌株的DNA,進行18S rDNA PCR擴增,電泳圖見圖4,兩株菌的PCR產物均在1 700 bp處有明亮條帶,判斷得到的產物為目的產物。

圖4 菌株NS2和NL2的18S rDNA PCR擴增電泳圖Figure 4 Result of 18S rDNA PCR amplify of NS2 and NL2
將擴增產物送至金斯瑞公司測序,NS2、NL2的測序結果見附錄1。菌株NS2、NL2經PCR擴增獲得的18S rDNA序列全長為1 700 bp左右,在NCBI中BLAST比對進行序列同源性分析,菌株NS2的18S序列與Pichiasp.的18S序列同源性最高,相似性達99%。根據18S序列使用MAGE軟件的Neighbor-Joining法構建系統發育樹,見圖5。由圖5可知,NS2與庫德里阿茲威畢赤酵母(Pichiakudriavzevii)親緣關系最近,同源性極高,因此將菌株NS2鑒定為Pichiakudriavzevii。
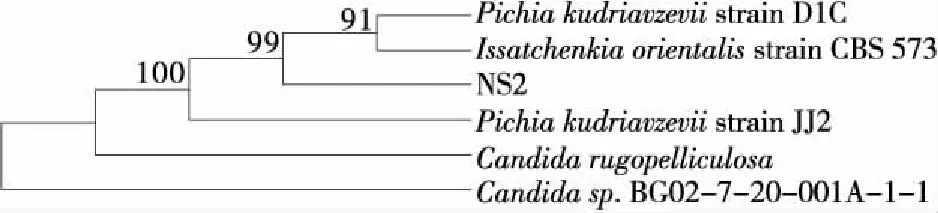
圖5 基于菌株NS2的18S rDNA序列同源性構建 的系統發育樹Figure 5 Phylogenetic tree of NS2 based on 18S rDNA sequences
菌株NL2的18S序列與Candidasp.的18S序列同源性最高,相似性達99%。根據18S序列使用MAGE軟件的Neighbor-Joining法構建系統發育樹,見圖6。由圖6可知,NL2與熱帶假絲酵母(Candidatropicalis)親緣關系最近,同源性極高,因此將菌株NL2鑒定為Candidatropicalis。
3 結論
本研究從檸檬酸廢水廢渣中分離培養純化獲得15株耐檸檬酸菌株,測定降檸檬酸能力發現其中5株菌株具有較強的降檸檬酸能力,發酵5 d后檸檬酸含量從11.3 g/L下降到1.8~2.8 g/L,降解了培養基中70%以上的檸檬酸。測試這5株菌的酒精耐受性,發現菌株NS2和NL2的酒精耐受能力相對較強,最高可以耐受4%vol的酒精度,可以考慮將其應用于山楂酒釀造初期階段。對這兩株菌進行形態學觀察和生理生化性質分析,結合分子生物學手段初步鑒定菌株NS2為Pichiakudriavzevii,菌株NL2為Candidatropicalis,為今后研究生物降酸法降低山楂酒中檸檬酸提供了理論支持。

圖6 基于菌株NL2的18S rDNA序列同源性構建的 系統發育樹Figure 6 Phylogenetic tree of NL2 based on 18S rDNA sequences
[1] ZHU Ru-gang, SUN Yan-di, LI Tuo-ping, et al. Comparative effects of hawthorn (Crataegus pinnatifida Bunge) pectin and pectin hydrolyzates on the cholesterol homeostasis of hamsters fed high-cholesterol diets[J]. Chemico-Biological Interactions, 2015, 238: 42-47.
[2] 文連奎, 趙薇, 張微, 等. 果酒降酸技術研究進展[J]. 食品科學, 2010, 31(11): 325-328.
[3] 張方艷, 蒲彪, 陳安均. 果酒降酸方法的研究現狀[J]. 食品工業科技, 2014, 35(1): 390-393.
[4] 莫燕霞, 殷居易, 顧曉俊, 等. 葡萄酒有機酸研究現狀及應用展望[J]. 食品工業科技, 2015, 36(6): 380-384.
[5] 孫慧燁. 不同方法降解蘋果酒中有機酸的比較和優化[D]. 楊凌: 西北農林科技大學, 2015: 13-14.
[6] 梁國偉, 徐亮, 張寶榮, 等. 山楂酒釀造工藝研究及山楂酒中有機酸的HPLC測定[J]. 釀酒科技, 2009(7): 106-108.
[7] 胡楠, 劉曉蘭, 鄭喜群, 等. 發酵型五味子果酒離子交換樹脂降酸工藝研究[J]. 食品與機械, 2013, 29(5): 29-32.
[8] VERA E, RUALES J, DORNIER M, et al. Deacidification of clarified passion fruit juice using different configurations of electrodialysis[J]. Journal of Chemical Technology & Biotechno-logy, 2003, 78(8): 918-925.
[9] FIDALEO M, MORESI M. Electrodialysis Applications in The Food Industry[J]. Advances in Food & Nutrition Research, 2006, 51(51): 265-360.
[10] VERA E, RUALES J, DORNIER M, et al. Comparison of different methods for deacidification of clarified passion fruit juice[J]. Journal of Food Engineering, 2003, 59(4): 361-367.
[11] VILJAKAINEN S K, LAAKSO S V. The use of malolactic Oenococcus oeni (ATCC 39401) for deacidification of media containing glucose, malic acid and citric acid[J]. European Food Research and Technology, 2000, 211(6): 438-442.
[12] 陳繼峰, 楊美容, 李紹華. 葡萄酒釀造過程中調酸方法研究[J]. 釀酒, 2005, 32(1): 35-39.
[13] 季建生. 干型楊梅果酒降酸的研究[J]. 釀酒科技, 2008(7): 73-75.
[14] 趙燕, 任美燕, 李帥. 獼猴桃果酒降酸研究[J]. 糧食科技與經濟, 2012, 37(1): 55-57.
[15] MILLER B J, FRANZ C M, CHO G S, et al. Expression of the malolactic enzyme gene (mle) from Lactobacillus plantarum under winemaking conditions[J]. Current Microbiology, 2011, 62(6): 1 682-1 688.
[16] GAO Chong-xiao, FLEET G H. The degradation of malic acid by high density cell suspensions of Leuconostoc oenos[J]. Journal of Applied Microbiology, 2010, 76(6): 632-637.
[17] 王立芳. 一株可降解L-蘋果酸和檸檬酸菌株的鑒定及降解特性研究[D]. 長春: 吉林農業大學, 2011: 37-38.
[18] MAIO S D, POLIZZOTTO G, PLANETA D, et al. A method to discriminate between the Candida stellata and Saccharomyces cerevisiae in mixed fermentation on WLD and lysine agar media[J]. South African Journal for Enology & Viticulture, 2011, 32(1): 35-41.
[19] 薛軍俠. 釀酒酵母的篩選鑒定及耐受性初步研究[D]. 楊凌: 西北農林科技大學, 2007.
[20] 韓陽. 高產酒精酵母的篩選鑒定及生長和發酵特性研究[D]. 哈爾濱: 哈爾濱工業大學, 2007.
[21] 張霞, 武志芳, 張勝潮, 等. 貴州濃香型白酒大曲中霉菌的18S rDNA系統發育分析[J]. 應用與環境生物學報, 2011, 17(3): 334-337.
[22] 薛景波. 黃酒接種生麥曲微生物群落結構及分離培養微生物的產酶、產香性質分析[D]. 無錫: 江南大學, 2016: 12-13.
[23] 巴尼特. 酵母菌的特征與鑒定手冊[M]. 青島: 青島海洋大學出版社, 1991.
Study on isolation and identification of reducing citric acid strains
ZHANGDuo1,2,3
MAOYong4
MAOJian1,2,3,5,6
LIUShuang-ping1,2,3,5,6
ZHOUZhi-lei1,2,3,5,6
(1.NationalEngineeringLaboratoryforCerealFermentationTechnology,JiangnanUniversity,Wuxi,Jiangsu214122,China; 2.SchoolofFoodScienceandTechnology,JiangnanUniversity,Wuxi,Jiangsu214122,China; 3.SynergeticInnovationCenterofFoodSafetyandNutrition,JiangnanUniversity,Wuxi,Jiangsu214122,China; 4.ChinaAlcoholicDrinksAssociation,Beijing100831,China; 5.NationalEngineeringResearchCenterofChineseRiceWine,Shaoxing,Zhejiang312000,China; 6.JiangnanUniversityandRugaoInstituteofFoodTechnology,Rugao,Jiangsu225004,China)
In order to screen the strains which have the capability of reducing the citric acid, 15 strains of yeasts were isolated from the materials of waste water and waste residue. The waste water and residue were collected in the citric acid factory. The yeasts were screened based on the capability of fermenting the citric acid. It was found that the 5 strains had good capability of reducing the citric acid. They could reduce at least 70% citric acid of the culture medium after 5 d fermentation. The 5 strains were tested the stress resistance of ethanol. The strain NS2 and NL2 have strong stress resistance. The morphological and physiology characteristics of NS2 and NL2 were measured by microscopic observation, assimilation of carbon and nitrogen. Then the two strains were identified by 18S rDNA sequencing and the phylogenetic analysis. In the end, NS2 was identified asPichiakudriavzevii, NL2 was identified asCandidatropicalis. They can be used in the technology of acid reduction in the hawthorn wine in the future.
Yeast; Acid Reduction;Pichia; Screen; Sequencing; Identification
國家自然科學基金-面上項目(編號:31571823);江蘇省自然科學基金-面上研究項目(編號: BK20161293);2015年度區科技重點研發計劃項目(鎮江市丹徒區,編號:NY2015009)
張鐸,男,江南大學在讀碩士研究生。
毛健(1970—),男,江南大學教授,博士研究生導師,博士。E-mail:maojian@jiangnan.edu.cn
2017—03—10
10.13652/j.issn.1003-5788.2017.05.001

