在元素化合物教學中發(fā)展學生的核心素養(yǎng)
章從建
【編者按】
為全面貫徹黨的十八大和十八屆三中全會精神,深入實施教育規(guī)劃綱要,2014年4月,教育部印發(fā)《關于全面深化課程改革落實立德樹人根本任務的意見》,提出“將研究制訂學生發(fā)展核心素養(yǎng)體系,明確學生應具備的適應終身發(fā)展和社會發(fā)展需要的必備品格和關鍵能力”。2014年年底前啟動的普通高中課程標準修訂工作,將提煉和確定學科核心素養(yǎng)作為修訂工作的主要內容之一。隨后,關于核心素養(yǎng)的研究大量展開,相關研究成果也相繼面世。隨著研究的深入,更多的研究者開始著眼于如何在具體教學中發(fā)展學生的核心素養(yǎng)。本期聚焦精選了五篇來稿,分別探討在化學、數(shù)學、英語、物理等學科的具體教學中實現(xiàn)核心素養(yǎng)的培養(yǎng)途徑,以期幫助一線教師更好地理解核心素養(yǎng)。
摘 要:從化學學科核心素養(yǎng)角度著手,在“二氧化硫的性質和作用”課堂教學中進行學科的變化觀、實驗觀、環(huán)保觀、對比觀等思維的培養(yǎng),形成積極、主動的思維去發(fā)現(xiàn)問題,并找到切實可行的解決問題的方案。
關鍵詞:核心素養(yǎng);二氧化硫的性質;教學反思
伴隨著高中化學課程標準的修訂,“立德樹人”的根本任務的確立,要求學生在學習中形成學科的核心素養(yǎng)觀,要求教師在教學中能幫助學生形成能體現(xiàn)學科自身本質特征,具有學科性質的核心素養(yǎng)觀[1]。元素化合物是化學學科知識體系的基礎,對于學生學科核心素養(yǎng)的養(yǎng)成有重要的作用。以“二氧化硫的性質和作用”教學為例,從元素化合物的角度展開,進行化學學科核心素養(yǎng)培養(yǎng)的教學設計,實驗探究教學。
一、 基于學科核心素養(yǎng)設計元素化合物教學
(一)學科核心素養(yǎng)
化學學科核心素養(yǎng)包含了“宏觀辨析與微觀探析”“變化觀念與平衡思想”“證據(jù)推理與模型認識”“實驗探究與創(chuàng)新意識”“科學精神與社會責任”五個要素。化學核心素養(yǎng)是學生在化學認知活動中發(fā)展起來的,并在解決與化學相關問題中表現(xiàn)出的關鍵素養(yǎng),體現(xiàn)了學生從化學視角認知事物,并形成脈絡。化學學科核心素養(yǎng)的形成,不是通過簡單的知識記憶,也不是知識體系的簡單組合。它需要學生在學習過程中以及學習的情境中積極互動,形成主動的思維意識,深入理解化學學科特征、特點的基礎上形成切實有效的解決化學問題的基本方法與思路,在理解與應用中不斷升華、提煉。
(二)基于學科核心素養(yǎng)設計教學
化學學科核心素養(yǎng)的建構,體現(xiàn)在學生能主動運用化學學科的思想方法,多角度、全方位地認識事物,并形成切實可行的思維意識、思維習慣,在化學學科核心素養(yǎng)的指引下,建構豐滿的知識體系,引導學生形成學科知識,認知習慣與方式,從而去解決問題[2]。在元素化合物的學習中,化學學科的核心素養(yǎng)就是:結構決定性質,性質決定用途。這反映了一系列知識體系的內在框架。
“二氧化硫的性質和作用”是蘇教版《化學》1中專題4的開篇之作,通過對前面一系列元素化合物的知識體系的學習,學生具備了一定的分析、對比的能力。教學中,教師通過一系列情境的創(chuàng)設,讓學生去發(fā)現(xiàn)問題,并設計方案去解決問題,從而在問題的解決過程中培養(yǎng)化學學科核心素養(yǎng)。
實驗觀:化學是一門實驗的學科,實驗揭示了事物的本源,實驗帶來了問題的解決,這就要求我們切實地回到實驗中。本節(jié)課設計了“二氧化硫的漂白實驗”“二氧化硫與氯化鋇溶液、雙氧水的實驗”“二氧化硫與高錳酸鉀反應的探究實驗”,以實驗為依據(jù),建構二氧化硫的性質、用途的學科核心素養(yǎng)。
對比觀:對比分析是化學學科的重要的思維分析方法,本節(jié)課創(chuàng)設情境,將二氧化硫的漂白性與次氯酸的漂白性進行對比,將二氧化硫使品紅溶液褪色的機理與二氧化硫使高錳酸鉀溶液褪色的機理進行對比分析。在對比分析中,讓學生去主動探究,通過方案設計、實驗論證,找出主因,從而形成化學學科的核心素養(yǎng)。
環(huán)保觀、平衡觀、探究觀、創(chuàng)新思維在本節(jié)課中也有體現(xiàn)。正是基于這些化學核心素養(yǎng)觀中的教學模式的設計,才能使學生形成知識體系,提高了學生發(fā)現(xiàn)問題、解決問題的能力。
二、“二氧化硫的性質和作用”教學過程
(一)活動引入 點燃激情
教師:回到生活中的化學,展示紅酒圖片,重點突出紅酒配料的成分為SO2,我們知道SO2有毒,紅酒中怎么還會有SO2呢,它的作用是什么呢?性質決定用途,這節(jié)課,我們首先來學習一下SO2的性質。
設計意圖:通過認知的沖突性,激發(fā)學生的探究欲望。開了個好頭,使學生投入到探究的情境中來。
教師:二氧化硫能溶于水中,那么大家能完成化學方程式的書寫嗎?并測定二氧化硫的水溶液的酸堿性嗎?
學生:躍躍欲試,激情被點燃。順利寫出化學方程式,并完成溶液酸堿性的測定。
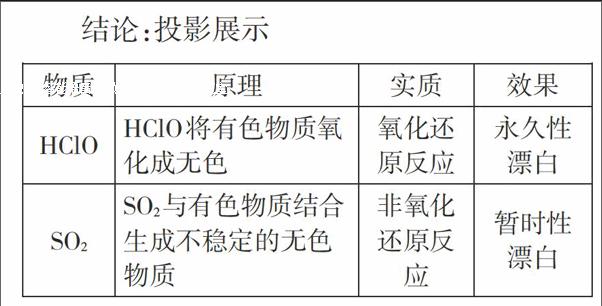
結論:二氧化硫具有酸性氧化物的通性。
設計意圖:進一步通過可操作實驗,激發(fā)學生的學習積極性,并對他們的表現(xiàn)、態(tài)度做出表揚,使學生進入學科核心素養(yǎng)的學習模式中。
(二)問題探究 建立對比觀
教師:設計探究SO2漂白性的實驗方案,并提供改進實驗操作的方法:向試管中加入2mLSO2水溶液,逐滴滴加品紅溶液,振蕩,觀察現(xiàn)象;在試管口套一個小氣球,然后加熱試管,觀察現(xiàn)象。
教師:實驗現(xiàn)象說明了什么?
學生:二氧化硫具有漂白性,并且是不穩(wěn)定的漂白。
教師:展示二氧化硫與石蕊試液的試管,還有二氧化硫與品紅溶液的試管,二氧化硫能漂白指示劑嗎?
學生:二氧化硫能使品紅溶液褪色,但不能漂白指示劑。
教師:回顧在氯氣的學習中,新制的氯水和石蕊試液接觸的現(xiàn)象是什么?
學生:先變紅,后褪色。
教師:原因是什么呢?
學生:變紅是因為H+,褪色是因為HClO具有漂白性。
教師:請大家總結HClO與二氧化硫漂白性的差異。

設計意圖:構建學科素養(yǎng)平臺,建立對比觀,讓學生在理解的前提下,投入到生動的學習情境中,通過實驗探究活動,在解決問題的過程中,構建知識體系,促進學科核心素養(yǎng)能力的提升。
(三)層層推進 再建對比觀和實驗觀
1.二氧化硫與高錳酸鉀溶液的反應
教師:二氧化硫通入到品紅溶液中,體現(xiàn)了二氧化硫的漂白性,那么我們來分析下面這個實驗。
演示:將含二氧化硫的水溶液滴入到含高錳酸鉀溶液的試管中,觀察實驗現(xiàn)象。
教師:發(fā)現(xiàn)高錳酸鉀溶液褪色了,這是二氧化硫的漂白性的體現(xiàn)嗎?
學生:討論分析,產生思維碰撞,提出觀點,溶液再次加熱,如果高錳酸鉀溶液的顏色能恢復,則是漂白性,反之則不是。
驗證:實驗驗證,加熱溶液,顏色不恢復。那么不是因為二氧化硫的漂白性,那是什么呢?
教師:引導分析,請大家從各自物質分析,分析高錳酸鉀具有什么性質,二氧化硫從硫的價態(tài)的角度進行分析。
學生:高錳酸鉀具有強氧化性,二氧化硫容易被氧化,二者發(fā)生了氧化還原反應,生成了硫酸根。
教師:如何設計實驗進行驗證呢?
學生:取樣后,加入BaCl2溶液,產生白色沉淀,則說明SO2被KMnO4氧化成了硫酸根,二氧化硫體現(xiàn)了還原性。
教師:實驗驗證,并請書寫出化學方程式。
學生:準確、迅速地完成了化學方程式的書寫。
設計意圖:學習了二氧化硫的漂白性后,進行二氧化硫與高錳酸鉀溶液的反應實驗,進行對比分析,形成沖擊感,使學生的印象深刻,提高了學習挑戰(zhàn)性,激發(fā)學生的高級思維活動,很好地體現(xiàn)了化學學科核心素養(yǎng)的升華。
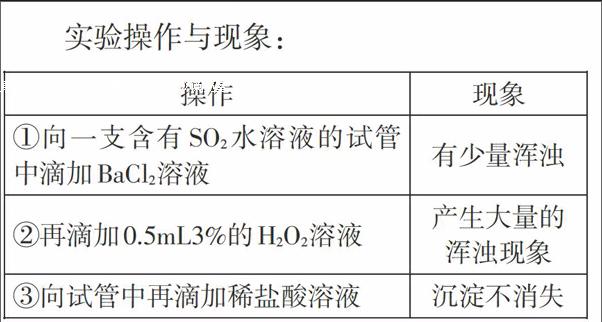
2.SO2與BaCl2、H2O2溶液的反應
實驗操作與現(xiàn)象:
教師:這一系列實驗操作中,透過現(xiàn)象看本質,你得到了什么樣的結論?為什么加入雙氧水后,溶液中產生了大量的渾濁現(xiàn)象?請同學們,從二氧化硫的性質角度進行分析。
學生:H2O2將H2SO3氧化成了硫酸,硫酸與BaCl2反應生成了BaSO4沉淀。
教師:為什么在開始的時候會有少量渾濁?這個渾濁是BaSO3嗎?
學生:不會是BaSO3,如果是BaSO3,應該產生大量的渾濁。
教師:那一開始的渾濁會是什么呢?加強引導分析。引導學生回憶Fe(OH)2的制備中,需要注意的點。
學生:溶液中的部分H2SO3被O2氧化成H2SO4,形成了BaSO4沉淀。
教師:我們的記憶中,BaSO3是難溶物,那么為什么開始的時候,不能形成BaSO3沉淀呢?
教師:這個知識點對于學生來說是難點,應加強引導分析。引導學生書寫化學方程式,找問題。
學生:二氧化硫與BaCl2溶液不反應,是因為不能違背強酸制備弱酸的原理。
結論:H2SO3容易被H2O2氧化成H2SO4。其實二氧化硫還可以被很多具有氧化性的物質氧化,比如Cl2、O2、Fe3+等。
設計意圖:這是一個層層遞進的實驗,通過學生的操作,學生在分析變化過程中,形成認識,為什么不能形成BaSO3沉淀,雙氧水的作用是什么,二氧化硫體現(xiàn)了什么性,通過思維分析、實驗驗證,解決了困惑,建構了學科的實驗觀、變化觀、守恒觀。
(四)直面現(xiàn)實 建構環(huán)保觀
教師:展示一些對比圖片,明確這是酸雨的破壞引起的,那么什么是酸雨,酸雨pH值有什么要求,引起酸雨的物質主要是什么?酸雨對自然環(huán)境有哪些破壞作用?
學生:酸雨的pH值小于5.6,引起酸雨的主要物質是SO2。酸雨使湖泊酸化,影響水生生物的繁殖。酸雨使土壤中鈣、鎂、磷等營養(yǎng)元素溶出并迅速流失,導致土壤肥力下降并酸化,農作物和樹木生長遭到破壞。酸雨使建筑物腐蝕加快。
教師:酸雨對自然環(huán)境破壞非常嚴重,希望大家愛護家園,形成良好的環(huán)保意識。現(xiàn)在有一瓶酸雨,測定pH值為5.5,每隔一段時間測定一次pH值,發(fā)現(xiàn)溶液的pH值變得越來越小,為什么?請同學們結合已學知識分析。
學生:這是由于空氣中的氧氣將酸雨中的H2SO3緩慢氧化成H2SO4,將弱酸緩慢氧化成強酸,酸性變強。
教師:請大家閱讀課本,明確酸雨防治的辦法。酸雨治理中,請大家明確,最終產物中硫的價態(tài)。
設計意圖:通過圖片展示,讓學生體會了酸雨的破壞力,倡導學生的環(huán)保意識,同時設置情境,再次強化了二氧化硫的還原性,對化學的變化觀形成認識,突出了化學學科素養(yǎng)性。
三、 教學體會
本節(jié)課是蘇州教科院組織的“三省四校同課異構教學”中的一節(jié)展示課的設計,立足于“蘇式課堂”,以“核心素養(yǎng),提升有效教學”為指導,從結合實際和觀察現(xiàn)象出發(fā),讓學生通過觀察分析→推測性質→實驗驗證→得出結論,體現(xiàn)探究式學習方式。本節(jié)課以“干紅中SO2的作用”為背景,積極體現(xiàn)化學之美,做到 “以生為本”。利用紅酒中SO2的作用與學生已有SO2的負面印象產生沖擊,激發(fā)其探究欲,并由此引出相關問題,設計展開五個小組活動:①二氧化硫可溶于水且與水反應。設計實驗,通過產生明顯現(xiàn)象說明SO2可溶于水,溶液顯酸性表明SO2與水發(fā)生了化學反應。②在二氧化硫水溶液生成的基礎上設計證明漂白性的實驗,用水溶液代替二氧化硫氣體,并分析漂白原理。③在學了漂白性的基礎上分析二氧化硫和高錳酸鉀溶液的反應,并設問是否為漂白性的體現(xiàn),分析物質的性質,引導學生用實驗驗證。④在前面學習的基礎上,環(huán)環(huán)相扣,分析SO2與BaCl2不能反應卻在混合后有渾濁,推測SO2具有還原性。并利用H2O2溶液實驗驗證SO2的還原性。⑤在酸性氧化物學習的基礎上,通過圖片的形式引入酸雨,讓學生明確酸雨的形成和防治,然后回歸課本,增強了學生的環(huán)保意識。
通過一系列場景的創(chuàng)設,有效激發(fā)學生的學習熱情;將知識問題化,通過化學實驗、分析化學原理、類比遷移等方法使問題得以解決;遵循學生的認知規(guī)律,由淺入深,由現(xiàn)象到本質,使教學目標得以達成。
設計中遵循綠色化學思想,將以往采用SO2氣體進行的實驗,在可能的情況下改為SO2水溶液進行實驗(驗證二氧化硫漂白性實驗中用SO2水溶液代替SO2氣體與品紅溶液反應),并且盡可能在密封的環(huán)境下進行(用飲料瓶存裝二氧化硫水溶液密封等),防止或降低污染。
由于課堂時間有限,知識側重不同,部分知識點在本節(jié)課的設計中沒有呈現(xiàn),而是將其作為課外探究問題提出,有興趣的同學可以結合本節(jié)課的學習方法,課外自主探究,也使知識的學習由課內延伸至課外。
參考文獻:
[1]倪娟.論基于學科觀念的化學概念教學[J].化學教育,2014(1):1-3.
[2]莊德剛.基于學科觀念建構的元素化合物教學[J].中學化學教學參考,2015(5):25-28.

