仙臺病毒核酸測序檢測方法的建立
張歡歡, 余陳歡, 戴方偉, 馬 月, 郎秋蕾, 王 瑜, 應華忠
(1. 浙江省醫學科學院浙江省實驗動物中心, 杭州 310013;
2. 杭州聯川生物技術有限公司, 杭州 310018)
仙臺病毒核酸測序檢測方法的建立
張歡歡1, 余陳歡1, 戴方偉1, 馬 月1, 郎秋蕾2, 王 瑜2, 應華忠1
(1. 浙江省醫學科學院浙江省實驗動物中心, 杭州 310013;
2. 杭州聯川生物技術有限公司, 杭州 310018)
目的 建立仙臺病毒(SeV)的核酸測序檢測方法。方法 根據SeV序列設計覆蓋不同毒株的通用引物,然后優化成測序引物并摸索建庫條件,進行核酸測序和結果分析。結果 獲得1對特異性強的通用引物,序列為: 上游引物5'-GCTGCAAAACGCTGTGGG-3',下游引物5'-TGGRACYTCAGAAAGAATRGG-3'; 建庫條件優化為:第一輪以cDNA為模板用通用引物擴增,第二輪以第一輪產物為模板用測序引物擴增。測序分析可以有效地將SeV與其他微生物區分開,并且精確到TianJin 亞株。結論 建立了SeV核酸測序檢測方法,為后續SeV感染實驗動物的檢驗檢疫提供依據。
仙臺病毒(SeV); 核酸測序; 檢測
仙臺病毒(Sendai virus, SeV), 亦稱副流感病毒1型或血凝病毒(HVJ), 是副粘病毒科的一種單股負鏈RNA病毒[1]。SeV傳染性強、易擴散, 是嚴重危害實驗動物的傳染病之一, 同時也是人類呼吸道感染的重要病源。由于其與人類副流感病毒血細胞吸附第2型(HA-2)病毒同屬副流感病毒I型, 二者間有十分密切的抗原關系[2], 常散發或混合在流感流行中, 可引起嬰幼兒下呼吸道嚴重疾病。嚙齒類動物感染SeV會對其淋巴細胞轉化、致瘤作用及繁殖等產生影響, 從而影響實驗結果; 此外, 動物一旦感染很難清除,嚴重影響幼鼠生長發育并降低成年鼠的繁殖率[3]。
實驗動物病原微生物檢測的國家標準中, 無論是清潔級還是SPF級, SeV都是必檢項目。目前最主要的檢測方法是血清學試驗,但該方法的檢測結果受機體抗體水平影響, 不利于早期疫情控制[4,5]。近年來分子生物學技術廣泛應用于微生物檢測,包括實時定量PCR[6]、多重PCR技術[7]; 其他還有基因芯片[8]和環介導等溫擴增技術(LAMP)等[9],這些方法都能夠快速、準確的進行檢測,但不能有效區分仙臺病毒亞型,對突變型也不能準確判斷。
核酸測序技術在微生物檢測[10]方面具有幾個明顯優點——通量高、周期短、準確率高、操作簡單、成本低。而其最大的優勢是一個測序通道內可放置幾十甚至上百個樣品,不僅降低了單個樣本的檢測成本,更實現了多種微生物同時檢測[11],極大地縮短了實驗動物微生物檢測周期。本研究以此技術為基礎,建立了一種能夠快速檢測SeV亞型的檢測方法。
1 材料與方法
1.1 病毒樣品及處理
SeV(TianJin株),由上海實驗動物中心饋贈; SeV(Fushimi株和52株),由浙江省疾病預防控制中心提供;其余病毒株和沙門氏菌(Salmonella entericaserovar Typhimurium)均為本實驗室保存。樣品采用病毒RNA提取試劑盒提取并反轉錄成cDNA進行后續實驗。
1.2 主要試劑
Viral RNA Kit(美國Omega Bio-Tek公司,R6874),PrimeScriptòRT reagent Kit[寶生物工程(大連)有限公司, DRR037A], Premix Ex TaqTM Hot Start Version[寶生物工程(大連)有限公司, RR030A], DL2000 DNA Marker [寶生物工程(大連)有限公司, 3427], Axygen PCR Clean Up Kit (美國康寧, AP-PCR-500), QubitdsDNA HS Assay Kit(美國Invitrogen公司,Q32851),MiSeq V2 Reagent Kit (美國Illumina公司,MS-102-2002)。
1.3 通用引物選擇及測試
設計擴增區分不同亞株的SeV通用引物,設計原則是通用引物位于基因組保守區,其間序列變化差異較大。然后以SeV以及陰性樣品cDNA樣本為模板進行擴增,測試引物的特異性。
1.4 測序引物優化
在通用引物(正向引物為FP,反向引物為RP)的基礎上,加上接頭序列(Linker)、區分樣本的條形碼序列(Index)以及增加終文庫均一性和豐富度的連接堿基(Heterogeneity Spacer),如圖1所示。該引物可以直接用于建庫。
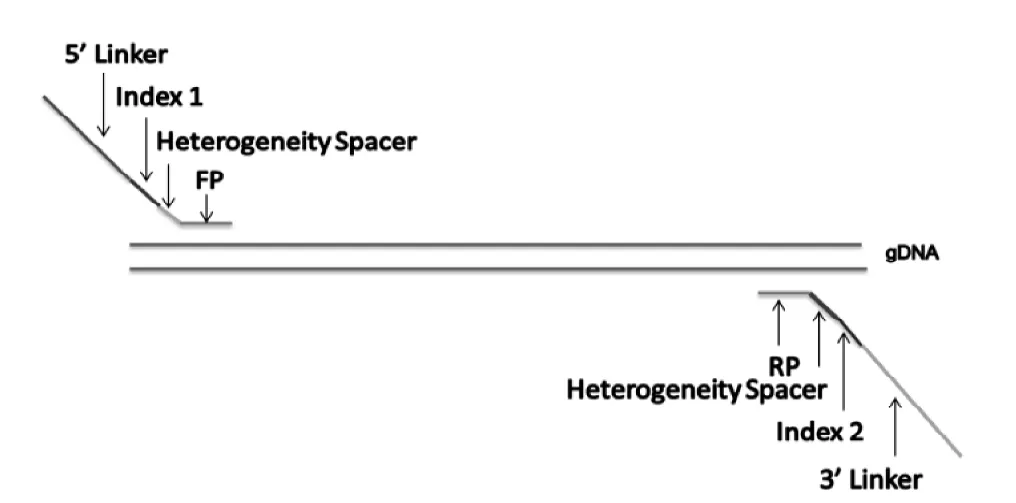
圖1 建庫引物設計示例
1.5 建庫條件摸索
SeV建庫主要從退火溫度進行條件摸索,反轉錄體系RNA模板量為500 ng,建庫PCR體系均為25 mL。采用兩步PCR法: 第一步是用通用引物進行PCR擴增, 循環數為40個, 退火溫度為56℃; 第二步是以第一步的PCR產物作為模板, 用建庫引物進行PCR擴增, 循環數為10個, 退火溫度為58℃。
1.6 核酸測序體系的特異性和敏感性檢測
將各檢測樣本分別核酸提取、建庫。采用Illumina Miseq測序儀進行核酸測序,具體方法如下: Miseq 測序得到的 PE reads 首先根據overla 關系進行拼接,將成對的 reads 拼接成一條序列,同時對reads 質量和 merge 的效果進行質量質控和過濾,去除序列末端的后引物和接頭序列、多堿基N、polyA /T 尾巴及低質量堿基; 去除所得序列的barcode 標簽序列、前引物序列;丟棄長度短于200 bp、模糊堿基數>0、序列平均質量低于20的序列。核酸測序結果與樣本信息進行對比,評價核酸測序體系檢測仙臺病毒特異性和敏感性。
1.7 檢測結果的重復性、特異性及靈敏性分析
為進一步確認其靈敏性和最低檢測限, 提取病毒滴度為100TCID50的SeV細胞培養物中總RNA,測定其濃度為78 ng/mL,進行10倍比稀釋,設置100~10-6的7個稀釋濃度樣品,用所建立的方法進行檢測。并采用文獻[12]RT-PCR的方法進行平行檢測,確定該法的SeV最低檢出量。同時,分別提取實驗小鼠常見病原微生物(沙門氏菌、鼠痘病毒、小鼠肝炎病毒和小鼠肺炎病毒)的總RNA,采用核酸測序方法檢測,確定該法的特異性。
2 結果
2.1 通用引物設計及測試
SeV總基因組序列為15 384 bp,通用引物要盡可能多的覆蓋各種SeV毒株的序列,經過比對,本研究選取的引物序列如表1,其中反向引物包含3個兼并堿基,可以擴增多種SeV。
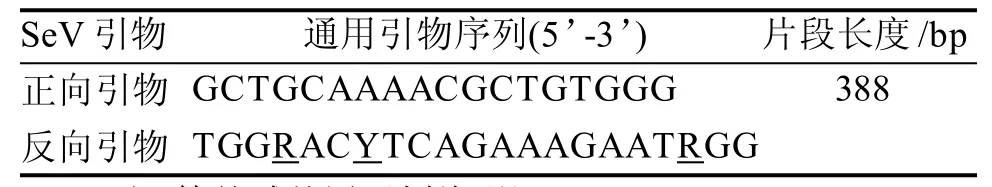
表1 SeV通用引物基本信息
以SeV cDNA和陰性對照為模板, 測試通用引物的擴增效率以及特異性,結果如圖2所示, 僅在SeV樣本擴增到單一條帶, 而在SeV陰性樣品(小鼠肺炎病毒和小鼠肝炎病毒的混合品)中, 無法擴增得到條帶, 證明該通用引物具有非常強的特異性。
2.2 建庫引物設計
本研究SeV建庫引物序列如表2所示。其中,正向引物(YSV-F23)和反向引物(YSV-R19)的條形碼序列(Barcode)不同,而且每個樣品在建庫時都有自己獨特的一對barcode序列,通過相應的Barcode可以將樣品從總文庫中區分。
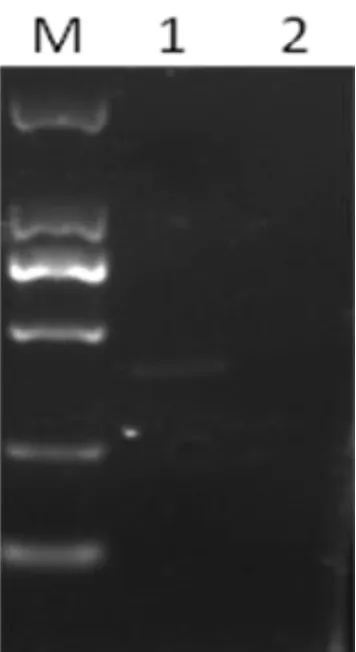
圖2 SeV通用引物測試
2.3 建庫條件摸索
反轉錄后,首先嘗試建庫引物直接擴增,未獲得理想PCR產物。然后優化為兩步PCR法,以此條件進行建庫,擴增到單一條帶,證明該建庫條件可行,結果如圖3。
2.4 測序結果分析
通過barcode的區分, 調出SeV序列, 拼接后共得到91個有效序列, 結果顯示為SeV_Tianjin亞株, 無其他SeV亞株, 也無其他病毒序列。表3中列出了排位前10的數據結果。由于前期采用雙盲實驗, 測序結果與樣品制備方比對后完全一致, 證明該法具有較高的準確性,且可以精準到病毒株亞型的確認。

表2 建庫引物序列信息

圖3 SeV建庫PCR的電泳結果
2.5 檢測結果的重復性、特異性及靈敏性分析
各樣本檢測到的SeV與目的病毒株基本一致,且多次重復,檢測結果均一致(表4)。本研究建立的方法可鑒定出不同來源的SeV病毒株亞型; 且SeV病毒液經105稀釋(即7.8×10-4ng/mL)后,仍能被分析、檢出。采用RT-PCR方法進行平行檢測,該法的SeV最低檢出量僅為0.78 ng/mL(即原液102稀釋),遠遠大于核酸測序方法的SeV最低檢出量,表明核酸測序方法的敏感性明顯高于RT-PCR法。此外,其余病毒株和沙門氏菌作為干擾樣品,以及平行空白試劑作為陰性對照,均不能被檢測,證明該法具有較好的特異性。

表3 SeV部分序列結果
3 討論
病原微生物的快速檢測一直是實驗動物質量控制的重點和難點。隨著近年來各類動物資源的大量開發應用,環境變化以及藥物濫用,一些在動物體內潛藏的病原體發生變異,開始產生人獸感染;而有些已知病原體,發生變異或獲得了新的特性,適應于人體,增加了致病性[13]。盡管目前PCR 技術的普遍應用,已可滿足臨床各種感染性疾病的快速檢測,但是特異性探針設計困難,難以做到逐一檢測,且只能檢測已知病原體。特別是很多新發病原微生物基因組序列信息缺乏或不足,無法檢測新的突變亞型和未知病原體[14,15],因此無法滿足當今快速應對生物安全防御的要求。
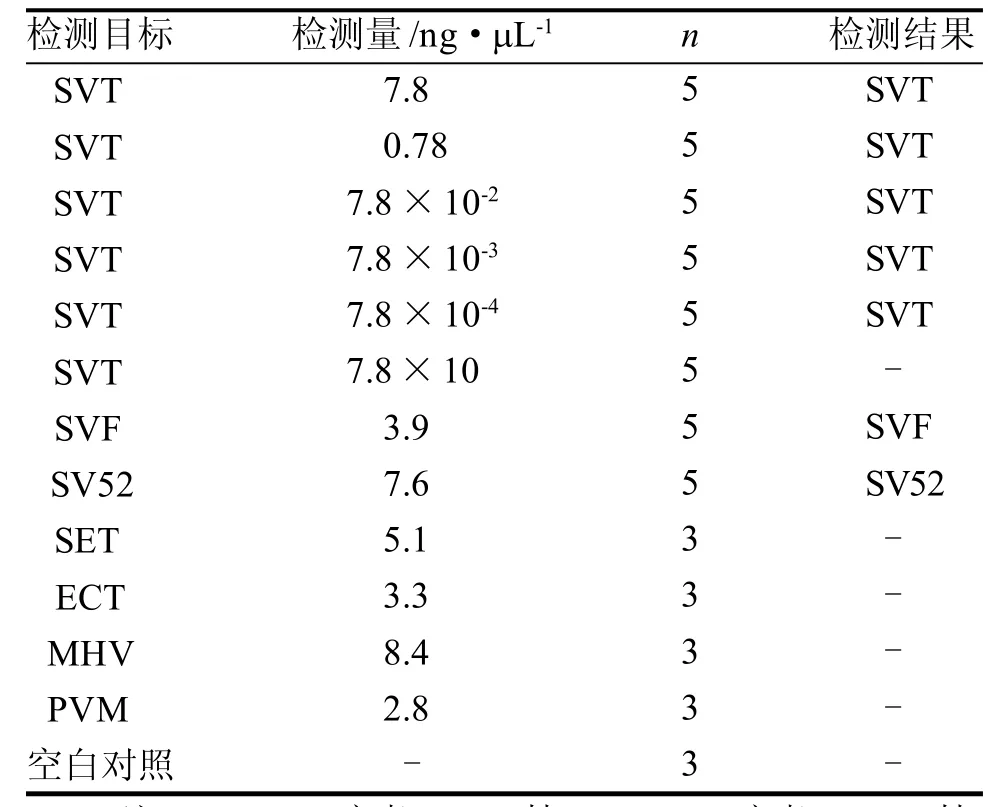
表4 SeV樣本核酸測序檢測結果
本研究建立了一種SeV核酸測序檢測方法。首先,在設計通用引物時,既要求引物位置具有保守性,又要求擴增產物具有區分不同毒株的特異性,綜合以上原則,作者在反向引物內設立了3個兼并堿基,可以與多種模板進行結合,擴增結果也顯示在陰性樣品中無法擴增,具有SeV特異性。其次,建庫條件摸索是一個非常復雜的體系。因為建庫PCR采用的是90~97 bp長度的長鏈引物,這與普通16~25 bp的引物PCR擴增條件會有很多不同,長鏈引物擴增條件比普通引物擴增的條件要苛刻得多。作者在嘗試用建庫引物直接擴增的方法未獲得理想PCR產物后,之后優化為兩步法,并進行退火溫度的條件摸索, 最終確定了建庫條件。這為其他微生物檢測的建庫條件提供了很好的借鑒。
本研究所有SeV樣品、其他病毒株樣本以及42個沙門氏菌樣品均通過雙盲實驗一起上機測序。測序數據分析結果表明, 核酸測序不僅能夠快速檢測SeV, 還能區分到SeV病毒亞株。這一結果也與前期沙門氏菌測序準確率相一致[16], 表明采用核酸測序法可快速、微量、準確地區分不同微生物樣品, 為實驗動物多種病原微生物的同時檢測提供了參考。
[1] Shi L, Chen J, Zhong Q. Inactivated Sendai virus strain Tianjin, a novel genotype of Sendai virus, inhibits growth of murine colon carcinoma through inducing immune responses and apoptosis [J]. J Transl Med, 2013, 11:205.
[2] 張泉, 朱慧霞, 李翎瑜, 等. 仙臺病毒抗腫瘤的研究進展[J].實驗動物與比較醫學, 2014, 34(6):515-518.
[3] 扈榮良. 現代動物病毒學[M]. 北京: 中國農業出版社, 2014:1066-1067.
[4] 向志光, 佟巍, 劉先菊, 等. 小鼠仙臺病毒ELISA抗體檢測規范化試劑盒的研制與應用[J]. 中國比較醫學雜志, 2012, 22(11):41-45.
[5] 王吉, 衛禮, 付瑞, 等. 長爪沙鼠仙臺病毒(SeV)抗體ELISA檢測方法的建立與應用[J]. 實驗動物科學, 2015, 32(6): 39-43.
[6] 熊煒, 林穎崢, 魏曉鋒, 等. 仙臺病毒核酸快速檢測方法的建立和應用[J]. 中國動物傳染病學報, 2014, 22(4):23-28.
[7] Kwon JY, Hong JS, Kim MJ, et al. Simultaneous multiplex PCR detection of seven cucurbit-infecting viruses [J]. J Virol Methods, 2014, 206:133-139.
[8] McLoughlin KS. Microarrays for pathogen detection and analysis [J].Brief Funct Genomics, 2011, 10(6):342-353.
[9] Sasaya T. Detection methods for rice viruses by a reversetranscription loop-mediated isothermal amplification (RTLAMP) [J] . Methods MolBiol, 2015, 1236: 49-59.
[10] Di Bella JM, Bao Y, Gloor GB, et al. High throughput sequencing methods and analysis for microbiome research [J]. J Microbiol Methods, 2013, 95(3):401-414.
[11] Wu L, Wen C, Qin Y et al. Phasing amplicon sequencing on IlluminaMiseq for robust environmental microbial community analysis[J]. BMC Microbiol, 2015, 19(15):125.
[12] 李曉波, 付瑞, 王吉, 等. 仙臺病毒 RT-PCR 檢測方法的建立及灰倉鼠中流行情況調查[J]. 中國比較醫學雜志, 2012, 22(12):18-22.
[13] 馮麗萍, 陶凌云, 馮潔, 等. 2010~2013年上海地區實驗大鼠小鼠病原體感染情況分析[J]. 實驗動物與比較醫學, 2015, 35(5):398-402.
[14] Yeh HY, Yates MV, Chen W, et al. Real-time molecular methods to detect infectious viruses [J]. Semin Cell Dev Biol, 2009, 20(1):49-54.
[15] Boonham N, Kreuze J, Winter S, et al . Methods in virus diagnostics: from ELISA to next generation sequencing [J]. Virus Res, 2014, 186:20-31.
[16] 胡毅翔, 張歡歡, 余陳歡, 等. 基于核酸測序技術的實驗動物沙門氏菌檢測方法的建立與評價[J]. 中國比較醫學雜志, 2016, 26(10):72-78.
Development of Detection Method for Sendai Virus by Nucleic Acid Sequencing
ZHANG Huan-huan1, YU Chen-huan1, DAI Fang-wei1, MA Yue1, LANG Ju-lia2, WANG Yu2, YING Hua-zhong1
(1. Zhejiang Laboratory Animal Centre, Zhejiang Academy of Medical Sciences, Hangzhou 310013, China;
2. LC-bio technology company, Hangzhou 310018, China)
ObjectiveTo develop the method for detection of Sendai virus by nucleic acid sequencing .MethodsGeneral primers according to Sendai virus genome sequences were designed and optimized to sequencing primers. Then the best condition of creating library was established. This method was verified by nucleic acid sequencing and analysis .ResultsA pair of highly specific general primers was designed. The sequences are respectively 5'-GCTGCAAAACGCTGTGGG-3' and 5'-TGGRACYTCAGAAAGAATRGG-3', and the sequencing primers were established by ligated adaptor sequences to the 5'-end of general primers. The established condition of creating library and library products were obtained by the first round amplification using general primers and the second round using sequencing primers. Sendai virus was effectively distinguish from other organisms by nucleic acid sequencing and analysis, and was precised to TianJin strain .ConclusionA detection method was developed for Sendai virus by nucleic acid sequencing, which may be as the base for microbiological detection in laboratory animals.
Sendai virus; Nucleic acid sequencing; Detection
Q95-33
A
1674-5817(2017)03-0204-05
10.3969/j.issn.1674-5817.2017.03.006
2016-11-14
浙江省衛生高層次人才, 浙江省科技廳院所專項(2012F30026, 2016F30001), 浙江省科技廳實驗動物計劃項目(2016C37106)
張歡歡(1985-), 女, 助理研究員, 研究方向: 動物疾病模型。E-mail: zhanghuanhuan2014@126.com
應華忠(1968-), 男, 研究員, 研究方向: 動物疾病模型。E-mail: yhz0101@126.com

