曲古霉素A預處理的hUC-MSCs移植對小鼠腦損傷的神經修復作用*
程 康,馬珊珊#,程 田,邢 衢,黃團結,石振慶,張 濤,劉雯雯,許 玲,關方霞#
1)鄭州大學生命科學學院干細胞研究室 鄭州 450001 2)鄭州大學第一附屬醫院骨科 鄭州 450052
曲古霉素A預處理的hUC-MSCs移植對小鼠腦損傷的神經修復作用*
程 康1),馬珊珊1)#,程 田2),邢 衢1),黃團結1),石振慶1),張 濤1),劉雯雯1),許 玲1),關方霞1)#
1)鄭州大學生命科學學院干細胞研究室 鄭州 450001 2)鄭州大學第一附屬醫院骨科 鄭州 450052
#通信作者:關方霞,女,1969年2月生,博士,教授,研究方向:干細胞與再生醫學,E-mail:guangfangxia@126.com;馬珊珊,女,1984年5月生,博士,副教授,研究方向:干細胞與神經功能修復,E-mail:mashanshan84@163.com
曲古霉素A;人臍帶間充質干細胞;移植;腦損傷;神經修復
目的:探討30 nmol/L曲古霉素A(TSA)預處理的人臍帶間充質干細胞(hUC-MSCs)移植對腦損傷(TBI)小鼠的神經修復和促進作用。方法:利用顱腦打擊器和立體定位儀制作中度腦損傷小鼠模型,并將造模成功的27只小鼠隨機分為Veh組、MSCs組和TSA+ MSCs組;術后3天,PI染色評估各組小鼠腦損傷周圍的細胞壞死情況,術后第1、2、3、7、14、21和28天,采用神經功能缺損程度評分(NDS評分)和糖水偏好實驗評估小鼠神經運動感覺和抑郁情況;術后第28天采用qRT-PCR檢測組蛋白去乙酰化酶1(HDAC1)和神經元特異性相關基因(DCX、MAP2)的表達。結果:與Veh組相比,MSCs組和TSA+MSCs組小鼠腦損傷周圍的壞死細胞數明顯減少,其中TSA+MSCs組降低更為明顯(P<0.001)。術后第1天,各組小鼠的NDS評分差異無統計學意義;從術后第3天開始,TSA+MSCs組小鼠NDS評分低于MSCs組和Veh組(P<0.001);術后第28天,與其他兩組相比,TSA+MSCs組小鼠蔗糖偏嗜度增強、HDAC1表達量降低,MAP2、DCX的表達量增加(P<0.001)。結論:TSA預處理能夠有效促進hUC-MSCs移植對TBI小鼠的神經修復。
創傷性腦損傷(traumatic brain injury,TBI)是由外力作用于頭部造成的嚴重創傷[1]。目前在臨床上對TBI帶來的神經功能的破壞缺乏有效的治療手段。課題組前期研究[2-3]表明,人臍帶間充質干細胞(human umbilical cord mesenchymal stem cells,hUC-MSCs)移植和能產生MSCs的沃頓膠雖然對TBI有一定的治療效果,但干細胞定向分化效率低,致使干細胞移植對TBI的治療不足。乙酰化修飾是研究較為廣泛的一類表觀遺傳學干預手段,乙酰化水平主要由組蛋白去乙酰化酶(histone deacetylase,HDAC)和乙酰化酶(histone acetyltransferase,HAT)共同調控[4]。 組蛋白的乙酰化水平影響突觸活性和神經元的功能,多種神經相關疾病的發生都伴隨HDAC水平的下降。 而使用 HDAC 抑制劑(HDACi)能夠上調HDAC的水平,明顯緩解疾病的癥狀。研究[5]發現HDACi在脊髓損傷模型中可以介導神經保護和神經再生。曲古霉素A(trichostatin A,TSA)是HDAC的抑制劑,研究[6]發現TSA下調HDAC的表達后,神經元分化效率增加,并且在腦損傷后病灶區的乙酰化水平顯著降低[7]。但是,TSA預處理的hUC-MSCs移植對TBI小鼠的神經修復作用尚未見報道,為此,作者進行了如下研究。
1 材料與方法
1.1 主要試劑和材料 hUC-MSCs為課題組前期凍存,DMEM/F12培養基購自寶信生物科技有限公司,胎牛血清購自美國Gemini公司,TSA、PI購自美國Sigma公司,RNA提取試劑盒、反轉錄試劑盒、qRT-PCR試劑盒購自TaKaRa公司,NeuN抗體購自CST公司,熒光二抗CY3購自上海生工生物工程股份有限公司。
1.2 實驗動物 實驗采用清潔級的雄性C57BL/6野生型小鼠,體重20~22g,購自北京維通利華實驗動物技術有限公司,在22 ℃恒溫、相對濕度為60%的條件下進行飼養。
1.3 TBI模型建立和側腦室移植 用體積分數10%的水合氯醛對小鼠進行麻醉,采用自由落體腦皮質損傷模型,在小鼠顱腦右側前囟后1.5 mm、中線旁側1.5 mm處,將直徑3 mm的環形鉆開一個骨窗,確保腦膜完好,利用立體定位儀,將直徑2.5 mm的20 g撞針正對骨窗,從20 cm高度處釋放撞針,撞擊后迅速提起撞針,使用牙科鉆在小鼠顱腦左側前囟后0.5 mm、旁開0.9 mm處開一個直徑為1.0 mm的小孔,深3.1 mm,將處理液通過立體定位儀進行側腦室注射,損傷部位用骨蠟覆蓋,縫合。
1.4 hUC-MSCs的預處理及實驗動物分組 TSA 預處理hUC-MSCs:選取長勢良好的P3代hUC-MSCs ,待細胞密度達到50%,在含有體積分數10%FBS的DMEM/F12培養基中加入終濃度為30 nmol/L的TSA,培養48 h后,倒掉培養基,并用PBS清洗3次,胰酶消化收集細胞。采用隨機數字表法將27只造模成功的C57BL/6野生型小鼠分為生理鹽水組(Veh組),hUC-MSCs移植組(MSCs組)、TSA預處理MSCs組(TSA+MSCs組),每組9只,分別向3組小鼠側腦室注射等劑量的生理鹽水、5×104個MSCs和TSA預處理的5×104個hUC-MSCs。
1.5 各組小鼠大腦損傷部位細胞壞死情況檢測 采用PI染色。各組取3只處理后3 d的小鼠,將PI用生理鹽水稀釋,以0.4 mg/kg劑量腹腔注射。注射后1 h處死,灌注,取腦,冰凍切片,片厚20 μm,用DAPI染細胞核,熒光顯微鏡下觀察結果。200倍視野下,每只小鼠于腦損傷部位選取3個視野,統計PI陽性細胞數。
1.6 各組小鼠神經功能缺損程度(NDS)評分 分別在腦外傷后第1、3、7、14、21和28天檢測小鼠的神經功能缺損狀況[8]。
1.7 糖水偏好實驗 腦外傷21 d后,配制10 g/L蔗糖水,裝入小鼠喂水器中。每組取3只小鼠,每個籠子里放1只小鼠、兩個喂水器,小鼠適應糖水味道3 d后,將其中一個喂水器中的糖水用純水代替,分別進行稱重記錄;腦外傷28 d后,再次稱重記錄,兩次的差值即為小鼠糖水消耗量和純水消耗量,計算小鼠蔗糖偏嗜度。蔗糖偏嗜度=糖水消耗量/(糖水消耗量+純水消耗量)×100%。
1.8 各組小鼠腦組織中HDAC1和神經元特異性相關基因mRNA的表達 腦損傷后28 d,每組小鼠各取3只,使用體積分數10%水合氯醛麻醉后處死,取出腦組織,收集腦損傷側周圍的組織,根據文獻[9]描述進行RNA提取和實時熒光定量PCR檢測。引物序列和大小見表1。實驗結束后,根據融解曲線和擴增曲線,采用比較CT法進行數據分析。
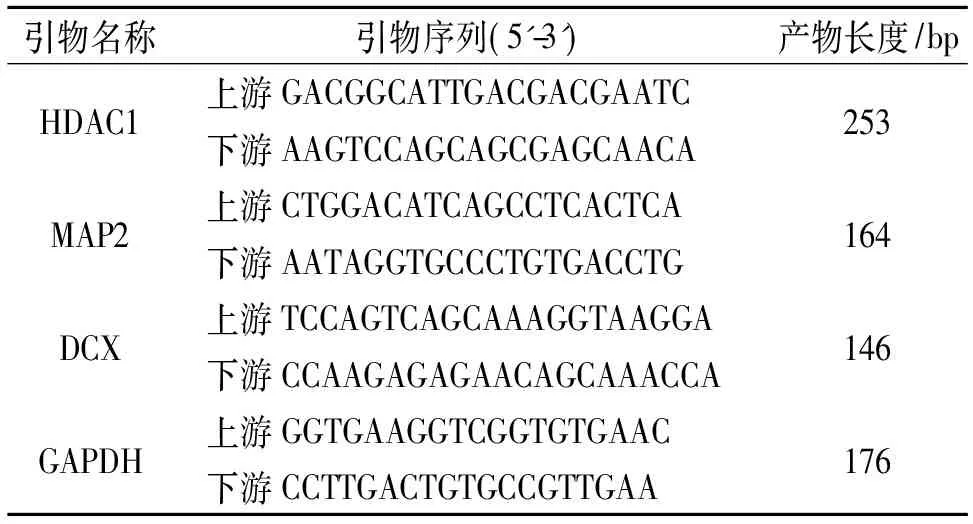
表1 PCR引物序列
1.9 統計學處理 采用SPSS 19.0進行分析,應用單因素方差分析比較各組小鼠腦損傷部位PI陽性細胞數目、小鼠蔗糖偏嗜度、腦組織中HDACI和神經元特異性相關基因表達的差異,應用重復測量數據的方差比較各組小鼠NDS評分的差異,檢驗水準α=0.05。
2 結果
2.1 各組小鼠腦損傷部位細胞壞死檢測結果 PI染色結果見圖1。TSA+MSCs組壞死細胞數目(104.00±5.72)少于MSCs組(139.00±7.48)和Veh組(171.67±10.66),差異有統計學意義(F=33.977,P<0.001);MSCs組壞死細胞數目少于Veh組,差異有統計學意義(P<0.05)。
2.2 各組小鼠NDS評分的比較 見表2。
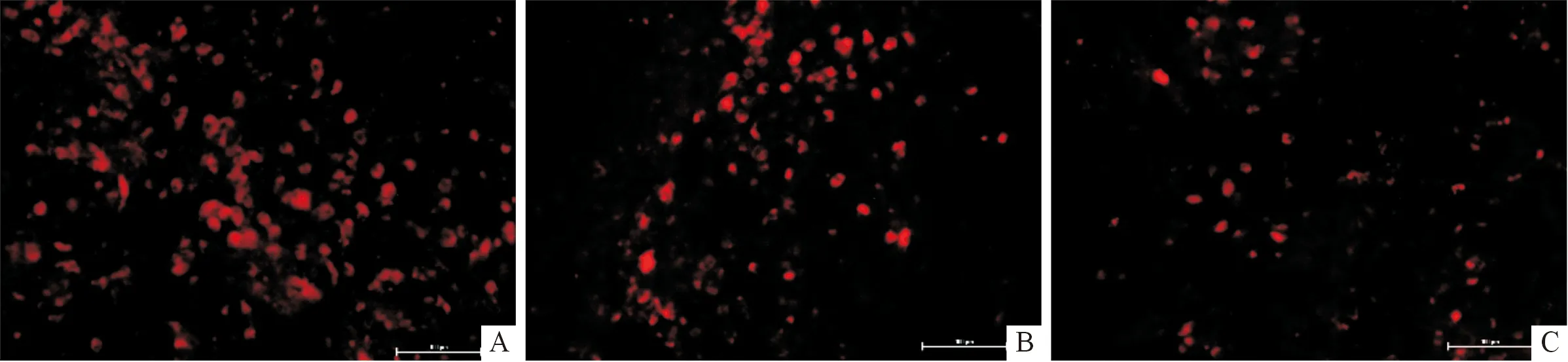
A:Veh組;B:MSC移植組;C:TSA+MSC移植組。圖1 各組小鼠腦損傷部位細胞壞死情況(PI,×200)
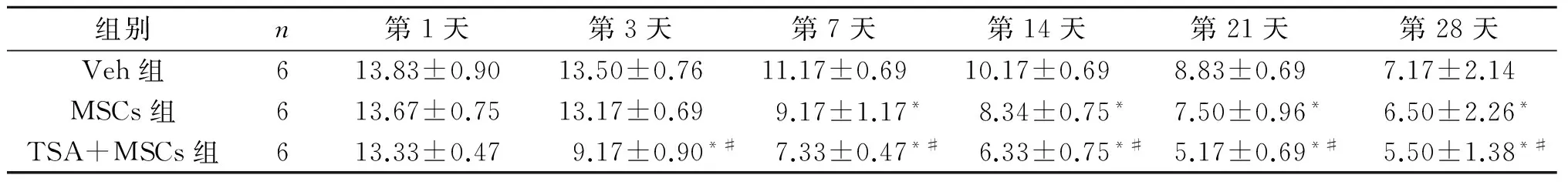
表2 術后各組小鼠NDS評分比較
F組間=227.334,P<0.001;F組內=133.629,P<0.001;F交互=5.828,P<0.001。*:與Veh組相比,P<0.05;#:與MSCs相比,P<0.05。
2.3 各組小鼠糖水偏好實驗結果 TSA+ MSCs組蔗糖偏嗜度[(61.30±5.08)%]明顯高于Veh組[(49.81±1.46)%]和MSCs組[(51.50±2.45)%](F=16.955,P<0.001)。
2.4 各組小鼠HDAC1和神經元特異性相關基因mRNA的表達 見表3。結果顯示,與Veh組相比,MSCs組和TSA+ MSCs組的HDAC1的表達量降低,其中TSA+MSCs組中降低更顯著。TSA+MSCs組MAP2和DCX mRNA相對表達量高于Veh組和MSCs組。

表3 各組小鼠HDAC1和神經元特異性相關基因mRNA的表達
*:與Veh組相比,P<0.05;#:與MSCs組相比,P<0.05。
3 討論
在工業和交通運輸業發展的今天,腦外傷已成為一種傷殘率極高的常見中樞神經類損傷性疾病[10]。腦損傷常常會伴隨神經功能的障礙,為了系統評價干細胞移植對TBI的改善作用,作者采用NDS評分評價各組小鼠的運動感覺功能,用糖水偏好實驗測定小鼠的憂郁情況。結果顯示,術后第1天3組的得分差異無統計學意義,TSA+MSCs組從術后第3天開始,得分小于其他2組,與Veh組相比,MSCs組從術后第7天開始,得分明顯降低。這與之前MSCs移植對TBI有一定的療效的研究一致[11]。蔗糖偏好實驗結果表明,與MSCs組和Veh組相比,TSA+ MSCs組可以顯著增加蔗糖偏嗜度,而MSCs組和Veh組未見明顯差異。上述結果說明TSA+ MSCs組較于MSCs單獨移植,能夠更好地改善TBI小鼠的運動能力,降低小鼠抑郁程度。
腦外傷神經功能缺失主要與神經細胞的凋亡有關,PI可以透過受損的細胞膜對細胞核染色,但是不能穿過活細胞膜。因此作者在術后第3天,通過PI染色顯示大腦損傷周圍的細胞凋亡情況。結果顯示,TSA+MSCs組和MSCs組細胞壞死數明顯少于Veh組,而且TSA+MSCs組細胞壞死數目更少。說明TSA+MSCs組可以減少大腦損傷周圍神經細胞的壞死。
HDAC1是HDAC家族的關鍵成員,qRT-PCR結果顯示,相較于其他組,TSA+MSCs組損傷部位HDAC1的表達量最少。該結果說明TSA預處理可以有效抑制HDAC的表達,進而調控損傷部位乙酰化水平,在神經修復中發揮作用。
腦損傷后神經功能恢復的關鍵是神經細胞的再生。多能干細胞要先分化為神經干細胞,繼續分化為神經前體細胞,繼而分化為成熟的神經細胞[12]。作者的研究結果顯示,術后第28天,TSA+MSCs組中神經元前體細胞和成熟神經元的特異性標記基因DCX和MAP2的表達量明顯高于另外兩組。該結果說明,TSA+MSCs組可以更好地促進損傷部位神經細胞的再生。
綜上所述,TSA預處理通過降低損傷部位HDAC1的表達,增加乙酰化程度,減少神經細胞壞死,促進神經再生,可顯著提高hUC-MSCs移植對腦損傷的神經修復效果。
[1]BOND AM,MING GL,SONG H.Adult mammalian neural stem cells and neurogenesis:five decades later[J].Cell Stem Cell,2015,17(4):385
[2]CHENG T,YANG B,LI D,et al.Wharton’s Jelly transplantation improves neurologic function in a rat model of traumatic brain injury[J].Cell Mol Neurobiol,2015,35(5):641
[3]張文進.人臍帶沃頓膠間充質干細胞移植治療對大鼠腦損傷區微循環的影響[D].鄭州:鄭州大學,2014.
[4]呂建祎.SirT7在RA誘導P19細胞神經分化過程中的功能研究[D].北京:中國協和醫科大學,2010.
[5]CHU T,ZHOU H,LU L,et al.Valproic acid-mediated neuroprotection and neurogenesis after spinal cord injury: from mechanism to clinical potential[J].Regen Med,2015,10(2):193
[6]LIU HL,WU H,WANG YX,et al.Inhibition of class Ⅱ histone deacetylase blocks proliferation and promotes neuronal differentiation of the embryonic rat neural progenitor cells[J].Acta Neurobiol Exp (Wars),2012,72(4):365
[7]YANG XJ, SETO E. HATs and HDACS: from structure,function and regulation to novel strategies for therapy and prevention[J].Oncogene,2007,26(37):5310
[8]GLUSHAKOV AV,ROBBINS SW,BRACY CL,et al.Prostaglandin F2α FP receptor antagonist improves outcomes after experimental traumatic brain injury[J].J Neuroinflammation,2013,10:132
[9]孟楠,馬珊珊,王欣欣,等.氯化鋰聯合hUC-MSCs移植對阿爾茨海默鼠的治療作用[J].鄭州大學學報(醫學版),2016,51(2):157
[10]勵建安.腦外傷康復的現狀與未來發展趨勢[J].中國康復醫學雜志,2011,26(12):1095
[11]GUAN J,ZHU Z,ZHAO RC,et al.Transplantation of human mesenchymal stem cells loaded on collagen scaffolds for the treatment of traumatic brain injury in rats[J].Biomaterials,2013,34(24):5937
[12]武菲,張秋玲.神經干細胞增殖分化研究中的常用標記物[J].中華行為醫學和腦科學雜志,2013,22(3):283
(2016-09-19收稿 責任編輯趙秋民)
hUC-MSCs transplantation improves nerve repairment with TSA pretreatment in a mice model of traumatic brain injury
CHENGKang1),MAShanshan1),CHENGTian2),XINGQu1),HUANGTuanjie1),SHIZhenqing1),ZHANGTao1),LIUWenwen1),XULing1),GUANFangxia1)
1)StemCellLaboratory,SchoolofLifeSciences,ZhengzhouUniversity,Zhengzhou450001 2)DepartmentofOrthopedics,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052
trichostatin A;hUC-MSCs;transplantation;traumatic brain injury;nerve repairmen
Aim: To investigate the neuroprotective effect of human umbilical cord mesenchymal stem cells (hUC-MSCs) transplantation with 30 nmol/L trichostatin A(TSA) pretreatment in a mice model of traumatic brain injury(TBI) .Methods: TBI models were produced by using the head hit, and the 27 mice were randomly allocated into vehicle group, MSCs transplantation group and TSA combined with MSCs transplantation group. After 3 days, PI staining was used to analyze the neuron cell necrosis around the injured site. NDS system and Sucrose preference test were used to evaluate sensory function of mouse nerve and the depression of mice on the 1st,2nd,3rd,7th,14th,21st,and 28th day. The relative expression levels of HDAC1, DCX and MAP2 were detected by qRT-PCR.Results: On the 3rd day after operation, compared with Veh group, the number of necrosis cells in MSCs transplantation group and TSA+MSCs transplantation group were significantly reduced, especially the latter group(P<0.001).There was no significant difference in NDS score among the 3 groups in the 1st day. On 3rd day after operation, the NDS score of TSA+MSCs transplantation group was significantly lower than those of MSCs transplantation group and Veh group(P<0.001). On the 28th day after operation, compared with the other 2 groups, the degree of sucrose preference in the 28 day after surgery was increased, HDAC1 expression was reduced, and the expressions of DCX and MAP2 in TSA+MSCs transplantation were enhanced(P<0.001).Conclusion: TSA pretreatment could effectively improve the nerve repairment of hUC-MSCs transplantation in TBI mice.
10.13705/j.issn.1671-6825.2017.04.003
*國家自然科學基金資助項目 U1404313,81471306和81601078;河南省高校科技創新團隊 15IRTSTHN022;河南省科技創新人才計劃 154200510008;河南省國際人才合作項目 2016GH03,2016GH15
R742