Exchange模型的DCE-MRI定量研究評價肝硬化的價值
張 嵐,鄭 妍,邢 威,程敬亮(.河南中醫藥大學第一附屬醫院磁共振科,河南 鄭州 450000;2.鄭州大學第一附屬醫院磁共振科,河南 鄭州 450052)
Exchange模型的DCE-MRI定量研究評價肝硬化的價值
張 嵐1,鄭 妍1,邢 威1,程敬亮2*
(1.河南中醫藥大學第一附屬醫院磁共振科,河南 鄭州 450000;2.鄭州大學第一附屬醫院磁共振科,河南 鄭州 450052)
目的 探討Exchange模型的動態對比增強磁共振(DCE-MRI)定量研究評價肝硬化的價值。方法 符合納入標準和排除標準的肝硬化代償期和失代償期患者各15例,正常對照組15名,均行肝臟DCE-MRI掃描,采用Exchange模型計算出各組定量參數,包括對比劑容積轉運常數(Ktrans)、速率常數(Kep)、血管外細胞外間隙容積分數(Ve)、血漿容積分數(Vp)、肝動脈灌注指數(HPI)、血容量(BV)、血流量(BF)、對比劑平均通過時間(MTT)。3組定量參數的比較采用單因素方差分析,組間兩兩比較采用LSD-t檢驗。繪制ROC曲線判斷Ktrans、Ve、HPI、MTT對肝硬化的診斷效能。 結果 正常對照組、代償期肝硬化組和失代償期肝硬化組的Ktrans分別為(0.85±0.34)min-1、(0.67±0.36)min-1、(0.39±0.18)min-1,Ve分別為0.47±0.42、0.34±0.13、0.16±0.06,HPI分別為0.35±0.09、0.57±0.17、0.76±0.20,MTT分別為(17.38±15.38)s、(34.26±11.37)s、(57.33±16.73)s,BF值分別為(97.22±36.29)ml/(min·100 g)、(69.30±35.22)ml/(min·100 g)、(24.64±28.24)ml/(min·100 g),差異均有統計學意義(P<0.05),且HPI和MTT的組間兩兩比較差異有統計學意義(P<0.05)。Kep、Vp、BV在3組間比較差異無統計學意義(P>0.05)。Ktrans 和Ve判斷失代償期肝硬化的曲線下面積(AUC)為0.86、0.92,敏感度為90%、90%,特異度為80%、80%;HPI和MTT判斷代償期肝硬化的AUC為0.79、0.76,敏感度為85%、85%,特異度為75%、75%;HPI和MTT判斷失代償期肝硬化的AUC為0.91、0.88,敏感度為95%、90%,特異度為80%、80%。結論 Exchange模型的DCE-MRI定量研究獲得多個定量參數,可反映肝硬化的血流動力學改變及血管微環境變化,評價肝硬化的嚴重程度。
肝硬化;磁共振成像;血流動力學;Exchange模型
肝硬化起病隱匿,進展緩慢,晚期常合并多種并發癥,死亡率高。臨床上對肝硬化的診斷和分期主要依靠實驗室和影像學綜合評判。因此,迫切需要一種精準無創、適合長期隨訪的影像學方法。研究[1]表明,肝硬化的血流動力學改變早于形態學改變,因此檢測肝硬化的血流變化將有助于病情分期、早期診斷和治療。近年,CT灌注成像已用于肝纖維化、肝硬化的診斷和分期,但肝臟具有獨特的雙重血供,病理狀態下肝動、靜脈及門靜脈系統間的血流動力學變化錯綜復雜,使得準確測量其血管灌注成為難點[2]。動態對比增強MRI(dynamic contrast-enhanced MRI, DCE-MRI)基于血流動力學模型分析,模擬出血管內外對比劑的分布情況,通過雙輸入-雙室模型獲得定量參數,準確而客觀地反映肝臟血流灌注狀態和微血管環境,對發現僅有血流動力學改變的病變早期階段及監測病變的進展程度具有重要意義[3]。本研究旨在探討Exchange模型的DCE-MRI定量研究評估肝硬化的可行性,建立用于評價肝硬化的定量指標。
1 資料與方法
1.1一般資料 收集2015年8月—2016年12月于河南中醫藥大學第一附屬醫院消化內科收治的肝硬化住院患者。納入標準:①經臨床、生化、影像學檢查及肝臟穿刺活檢病理證實為肝硬化;②均為肝炎患者;③無肝、脾良惡性占位;④門靜脈及腹主動脈無血栓、斑塊等;⑤無酒精、精神類藥物成癮史。排除標準:中重度脂肪肝,既往脾臟切除史,腎功能不全,患有嚴重心、腦、肺、血液系統疾病。經篩選共30例肝硬化患者被納入本研究,并采用Child-Pugh分級標準[4]對肝硬化患者進行評分(表1),A級為代償期肝硬化組,B級和C級為失代償期肝硬化組。代償期肝硬化組15例,男9例、女6例,年齡35~73歲,平均(48.9±3.7)歲;失代償期肝硬化組15例,男10例、女5例,年齡40~69歲,平均(55.7±4.6)歲。同時選取15名健康志愿者為正常對照組,男8名、女7名,年齡32~60歲,平均(47.4±5.8)歲。本研究獲得本院倫理委員會批準,所有入組者均簽署知情同意書。
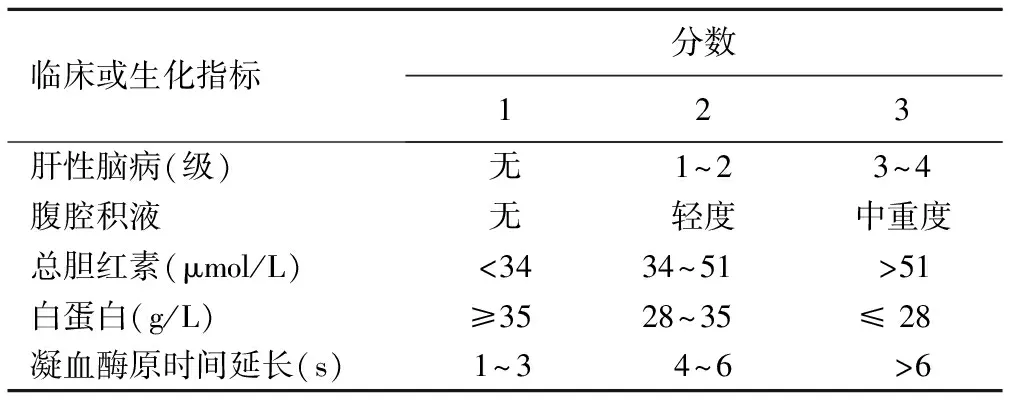
表1 肝硬化患者Child-Pugh分級標準
注:Child-Pugh A級≤6分,Child-Pugh B級 7~9分,Child-Pugh C級≥10分。
1.2儀器與方法 采用Philips Ingenia 3.0T MR掃描儀,腹部8通道線圈。掃描序列:軸位T1WI,TR 10 ms,TE 2.3 ms,層厚5 mm,層間距0.5 mm,FOV 400 mm×352 mm,矩陣160×160,NEX 1次,翻轉角10°;軸位T2WI,TR 880 ms,TE 80 ms,層厚5 mm,層間距0.5 mm,FOV 400 mm×352 mm,矩陣160×160,NEX 1次,翻轉角10°;3D-THRIVE序列,TR 3.8 ms,TE 1.8 ms,層厚4 mm,層間距0.4 mm,FOV 400 mm×400 mm,矩陣160×160,翻轉角10°。前兩期動態掃描后經肘正中靜脈以4 ml/s的流速團注對比劑釓雙胺,劑量0.2 mmol/kg體質量,注射對比劑后以相同速率以20 ml生理鹽水沖洗,連續掃描50期,每期采集30層,每期采集時間6 s。
1.3圖像分析 將原始數據導入Omni Kinetics軟件分析。首先進行三維非剛性運動校正和配準[5](圖1A),然后擬合肝動脈和門靜脈血管輸入函數(vascular input function,VIF)。肝動脈ROI由腹主動脈代替,門靜脈取主干層面,腹主動脈和門靜脈內的對比劑時間-濃度曲線作為肝臟雙血供VIF曲線。選擇Exchange模型計算各組定量參數值,獲取各參數功能性偽彩圖(圖1B~1F)。手動勾畫ROI,分別在門靜脈及門靜脈上、下方層面內的肝左葉、右葉選取4~6個ROI,大小約30 mm2,避開大血管且不能達到肝臟邊緣,每個ROI重復測量3次取平均值。定量參數包括:對比劑容積轉運常數(volume transfer constant of the contrast agent, Ktrans)、速率常數(reverse reflux rate constant, Kep)、細胞外血管外間隙(extracellular extravascular space, EES)、容積分數(volume fraction of EES, Ve)、血漿容積分數(volume fraction of plasma,Vp)、肝動脈灌注指數(hepatic perfusion index,HPI)、血容量(blood volume, BV)、血流量(blood flow, BF)、對比劑平均通過時間(mean transit time, MTT)。
1.4統計學分析 采用SPSS 21.0統計分析軟件。計量資料以±s表示。3組參數值比較采用ANOVA分析,組間兩兩比較采用LSD-t檢驗。采用ROC曲線判斷Ktrans、Ve、HPI、MTT診斷肝硬化的曲線下面積(area under the curve, AUC)及敏感度、特異度。P<0.05為差異有統計學意義。
2 結果
正常對照組、代償期肝硬化組和失代償期肝硬化組Ktrans、Ve依次呈下降趨勢,且失代償期肝硬化組Ktrans與代償期肝硬化組、正常對照組差異有統計學意義(t=2.52,4.14,P<0.05),失代償期肝硬化組Ve與正常對照組差異有統計學意義(t=3.31,P<0.05),與代償期肝硬化組差異無統計學意義(t=1.92,P>0.05)。正常對照組、代償期肝硬化組和失代償期肝硬化組HPI和MTT逐漸升高,且3組間兩兩比較差異均有統計學意義(P均<0.05);BF呈下降趨勢,且失代償期肝硬化組BF較代償期肝硬化組和正常對照組降低(t=3.66,5.94,P<0.05)。3組間的Kep、Vp、BV差異均無統計學意義(P均>0.05),見表2。Ktrans、Ve、HPI、MTT對代償期肝硬化和失代償期肝硬化的診斷效能見表3,圖2、3。
表2 正常對照組、代償期肝硬化組和失代償期肝硬化組定量參數比較(±s)

表2 正常對照組、代償期肝硬化組和失代償期肝硬化組定量參數比較(±s)
組別Ktrans(min-1)Kep(min-1)VeVp代償期肝硬化組(n=15)0.67±0.364.15±2.640.34±0.130.10±0.71失代償期肝硬化組(n=15)0.39±0.18?#3.50±1.170.16±0.06?0.09±0.85正常對照組(n=15)0.85±0.345.57±2.740.47±0.420.12±0.92F值8.713.185.540.92P值0.00070.05170.00730.995組別HPIMTT(s)BF[ml/(min·100g)]BV(ml/100g)代償期肝硬化組(n=15)0.57±0.17?34.26±11.37?69.30±35.2214.27±2.83失代償期肝硬化組(n=15)0.76±0.20?#57.33±16.73?#24.64±28.24?#12.68±3.81正常對照組(n=15)0.35±0.0917.38±15.3897.22±36.2915.66±3.20F值24.628.0317.983.05P值<0.0001<0.0001<0.00010.0578
注:*:與正常對照組比較,P<0.05;#:與代償期肝硬化組比較,P<0.05。

表3 Ktrans、Ve、HPI、MTT對代償期肝硬化和失代償期肝硬化的診斷效能
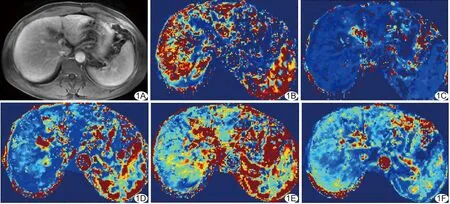
圖1 患者女,45歲,乙型肝炎病史15年 A.肝臟DCE-MRI原始T1WI增強圖像; B~F.分別為肝臟DCE-MRI功能性參數 Ktrans、Ve、HPI、MTT、BF的偽彩圖

圖2 Ktrans和Ve診斷失代償期肝硬化的ROC曲線 以Ktrans=0.41 min-1、Ve=0.28診斷失代償期肝硬化的AUC分別為0.86、0.925,敏感度分別為90%、90%,特異度分別為80%、80% 圖3 HPI和MTT診斷失代償期肝硬化的ROC曲線 以HPI=0.69、MTT=52.80 s診斷失代償期肝硬化的AUC分別為0.915、0.88,敏感度分別為95%、90%,特異度分別為80%、80%
3 討論
DCE-MRI定量研究是基于對比劑進入血管引起組織T1弛豫時間縮短,記錄組織信號強度的變化,跟蹤對比劑隨時間擴散到周圍組織的情況,通過血流動力學模型獲取肝臟血流灌注和血管滲透性等方面的定量數值,從功能學角度了解肝臟的生理功能和病理變化[6]。由于肝臟為肝動脈和門靜脈雙重供血,作為一個雙血供器官必須擬合雙血供VIF獲取肝臟血流動力學變化的信息,才能真實地反映肝臟的病理生理狀態。本研究采用的Exchange模型為雙輸入-雙室模型,雙輸入即肝臟為肝動脈和門靜脈雙重供血;雙室是把肝臟分成2個室,即肝血竇和血管外細胞外間隙。Exchange模型同時得到肝臟的滲透參數和灌注參數,全面地評估肝臟的微循環狀態,定量而客觀地反映肝臟的血流灌注和病理生理改變,從而更適用于肝臟疾病的評估[7]。
Ktrans指對比劑從血管內擴散到血管周圍間隙的速度常數,反映組織內微血管的通透性[8]。Ve是EES對比劑的容積分數,反映EES的大小。隨著肝硬化進展,肝竇毛細血管化加重,釓對比劑從肝血竇自由交換至EES的速率下降,Ktrans降低。因此,利用Ktrans能敏感地檢測到微血管的通透性。肝硬化失代償期時Ve顯著降低,考慮此期大量的肝硬化再生結節形成及肝小葉結構被破壞,導致肝臟正常結構改變,可能使EES減小,引起Ve下降。Ktrans和Ve對失代償期肝硬化的診斷效能較高,提示其可用來監測肝硬化的進展程度。
本研究肝硬化代償期和失代償期HPI明顯升高,且各組間HPI增加均有統計學意義。考慮由于肝細胞壞死,纖維組織增生和再生結節形成,門靜脈回流受阻,動靜脈間形成廣泛交通支,肝動脈血流量在肝臟總循環血流中比例增大。許尚文等[9]認為HPI可作為慢性肝病患者臨床隨訪的一個觀察指標。本研究結果也顯示HPI在肝硬化代償期和失代償期的診斷效能較高,尤其判斷失代償期肝硬化。因此,盡管HPI是一個相對值,但對肝硬化分期診斷有較大價值。MTT指對比劑經動脈流入到靜脈流出所需時間的平均值[10]。由于纖維索條和再生結節的雙重作用,門靜脈和肝靜脈分支狹窄、閉塞,導致對比劑流入至流出時間延長,MTT增加,與Chen等[11]的CT灌注研究結果相一致。Patel等[12]對14例肝硬化患者DCE-MRI研究發現,MTT判斷肝硬化的敏感度為100%,特異度為83%。本研究中MTT判斷代償期和失代償期肝硬化的敏感度為85%和90%,對判斷肝硬化具有較高的臨床應用價值。本研究中代償期肝硬化BF降低不明顯,至失代償期時降低顯著,說明代償期門靜脈灌注量雖然降低,但全肝循環血流量還能維持正常生理機能,這可能與肝臟血管獨特的代償機制及肝臟“自身調節”機制有關[13]。但隨著肝內血管阻力逐步升高,逐步轉變為以肝動脈供血為主,但肝動脈供血的代償性增加并不能完全彌補門靜脈血流量的持續下降,最終結果是反映肝臟總血流的灌注指標BF降低。
本研究的局限性,①樣本量較小,今后需擴大樣本量深入研究;②對原始圖像的三維非剛性運動校正目前尚無統一的標準[14];③Exchange 模型對時間分辨率要求較高,可能過度擬合參數。
綜上所述,基于Exchange模型的DCE-MRI定量研究獲取多個參數,能反映肝硬化的血流動力學改變及血管微環境變化,可對肝硬化進行整體量化評估。
[1] Stankovic Z, Csatari Z, Deibert P, et al. Normal and altered three-dimensional portal venous hemodynamics in patients with liver cirrhosis. Radiology, 2012,262(3):862-873.
[2] 吳國華,殷允娟,侯海燕,等.256層CT全肝灌注評估肝硬化段性功能儲備.中國醫學計算機成像雜志,2015,21(3):246-250.
[3] Shimon A, Claudia C, Guido J, et al. DCE-MRI of the liver: Effect of linear and non-linear conversions on hepatic perfusion quantification and reproducibility. J Magn Reson Imaging, 2014,40(1):90-98.
[4] Child CG, Turcotte JG. Surgery and portal hypertension.Major Probl Clin Surg, 1964,1:1-85.
[5] Wang HS, Cao YE. Correction of arterial input function in dynamic contrast-enhanced MRI of the liver. J Magn Reson Imaging, 2012,36(2):411-421.
[6] 黎美玲,陸健,曹鵬.動態對比增強MRI在肝臟中的應用與研究進展.中國醫學影像技術,2017,33(1):149-152.
[7] 章俞,趙振華,趙麗,等.Extended Tofts 和 Exchange 模型的動態對比增強MRI參數鑒別診斷肝細胞癌和肝轉移瘤的價值.中華放射學雜志,2015,49(9):656-660.
[8] Li ZM, Sun JH, Chen LM, et al. Assessment of liver fibrosis using pharmacokinetic parameters of dynamic contrast-enhanced magnetic resonance imaging. J Magn Reson Imaging, 2016,44(1):98-104.
[9] 許尚文,陳自謙,夏加林,等.3.0 T 磁共振動態增強掃描對乙肝肝纖維化的評估.功能與分子醫學影像學:電子版,2015,4(4):778-784.
[10] 周瑞臣,李偉,李健,等.顱腦CT灌注參數定量分析的準確性. 中國介入影像與治療學,2016,13(8):477-480.
[11] Chen ML, Zeng QY, Huo JW, et al. Assessment of the hepatic microvascular changes in liver cirrhosis by perfusion computed tomography. World J Gastroenterol, 2009,15(28):3532-3537.
[12] Patel J, Sigmund EE, Rusinek H, et al. Diagnosis of cirrhosis with intravoxel incoherent motion diffusion MRI and dynamic contrast-enhanced MRI alone and in combination:Preliminary experience. J Magn Reson Imaging, 2010,31(3):589-600.
[13] Bultman E, Brodsky E, Debra K, et al. Quantitative hepatic perfusion modeling using DCE-MRI with sequential breath-Holds.J Magn Reson Imaging, 2014,39(4):853-865.
[14] 趙麗,趙振華,章俞,等.3D非剛性運動校正在肝腫瘤動態增強MRI中的應用.中國醫學影像學雜志,2016,24(11):820-824.
Value of DCE-MRI quantification study with exchange model in evaluation of liver cirrhosis
ZHANGLan1,ZHENGYan1,XINGWei1,CHENGJingliang2*
(1.DepartmentofMRI,theFirstAffiliatedHospitalofHenanUniversityofTCM,Zhengzhou450000,China; 2.DepartmentofMRI,theFirstAffiliatedHospitalofZhengzhouUniversity,Zhengzhou450052,China)
Objective To investigate the value of dynamic contrast-enhanced MRI (DCE-MRI) quantitation study with exchange model in evaluation of liver cirrhosis. Methods A total of 30 patients with liver cirrhosis confirmed to included and excluded criteria were divided into compensatory cirrhosis group (n=15) and decompensatory cirrhosis group (n=15). And 15 healthy volunteers were served as a control group. All subjects were performed liver DCE-MRI and quantitative parameters of three groups were obtained by exchange model, including volume transfer constant of the contrast agent (Ktrans), reverse reflux rate constant (Kep), volume fraction of EES (Ve), volume fraction of plasma (Vp), arterial perfusion index (HPI), blood volume (BV), blood flow(BF) and mean transit time (MTT). The parameters of three groups were compared byANOVAanalysis andLSDtest for every two groups. The diagnostic efficacy of Ktrans, Ve, HPI, MTT for liver cirrhosis were analyzed by ROC. Results Ktrans, Ve, HPI, MTT and BF values in the control group, compensatory cirrhosis group and decompensatory cirrhosis group were (0.85±0.34) min-1, (0.67±0.36) min-1, (0.39±0.18)min-1; 0.47±0.42, 0.34±0.13, 0.16±0.06; 0.35±0.09, 0.57±0.17, 0.76±0.20; (17.38±15.38)s, (34.26±11.37)s, (57.33±16.73)s; (97.22±36.29)ml/(min·100 g), (69.30±35.22)ml/(min·100 g), (24.64±28.24) ml/(min·100 g), respectively, and showing significant differences among three groups, and significant with HPI and MTT for every two groups (P<0.05). There were no significant differences for Kep, Vp and BV among three groups (P>0.05). According to ROC of Ktrans and Ve for decompensatory liver cirrhosis, AUC were 0.86, 0.92, the sensitivity were 90%, 90% and the specificity were 80%, 80%. According to ROC of HPI and MTT for compensatory liver cirrhosis, AUC were 0.79, 0.76, the sensitivity were 85%, 85% and the specificity were 75%, 75%. According to ROC of HPI and MTT for decompensatory liver cirrhosis, AUC were 0.91, 0.88, the sensitivity were 95%, 90% and the specificity were 80%, 80%. Conclusion DCE-MRI quantitative study with exchange model can obtain multiple parameters, reflect hemodynamic changes and vascular microenvironment and evaluate severity of liver cirrhosis.
Liver cirrhosis; Magnetic resonance imaging; Hemodynamics; Exchange model
河南省科技攻關項目(162102310104)。
張嵐(1977—),女,河南鄭州人,碩士,副主任醫師。研究方向:腹部影像學。E-mail: 13837187787@163.com
程敬亮,鄭州大學第一附屬醫院磁共振科,450052。E-mail: cjr.chjl@vip.163.com
2017-02-05
2017-05-21
10.13929/j.1003-3289.201702007
R575.2; R445.2
A
1003-3289(2017)07-1019-05

