中-低劑量阿托伐他汀對急性心肌缺血性損傷中內皮祖細胞功能的影響
王亮,鐘武,陳睦虎
中-低劑量阿托伐他汀對急性心肌缺血性損傷中內皮祖細胞功能的影響
王亮,鐘武,陳睦虎
目的:通過研究內皮祖細胞(EPC)增殖、遷移、分化及細胞因子的分泌,探討中-低劑量的阿托伐他汀對急性心肌缺血性損傷患者的外周血EPC的影響。
方法:選擇急性ST段抬高型心肌梗死(STEMI)患者80例,根據服用阿托伐他汀的劑量不同,隨機分為觀察組(阿托伐他汀40 mg)和對照組(阿托伐他汀20 mg),每組各40例。采用四唑鹽(MTT)比色法、流式細胞術和酶聯免疫吸附測定的方法,檢測藥物治療前后不同時間點STEMI患者體內循環的EPC細胞數量、增殖能力和細胞因子的分泌。
結果:觀察組和對照組阿托伐他汀治療2周內均使EPC明顯增殖,遷移能力有較大改變。治療期間細胞因子的分泌表現為內皮細胞生長因子(VEGF)、堿性成纖維細胞生長因子(bFGF)、趨化因子4(CXCR4)出現先增加后減少,但沉默調節蛋白1(SIRT1)持續增加。各組數據顯示觀察組和對照組差異無統計學意義。
結論:STEMI患者服用中-低劑量的阿托伐他汀能有效改善EPC的增殖和遷移能力,增加了CXCR4、VEGF、bFGF及SIRT1的表達。
心肌缺血;內皮祖細胞;降血脂藥
(Chinese Circulation Journal, 2017,32:697.)
急性冠狀動脈(冠脈)供血不足導致心臟供氧量減少,從而發生心肌缺血性損傷。在此過程中,不同程度缺血的心肌細胞與正常的心肌細胞之間生化功能和電功能等均發生改變。從而出現心電活動的延遲、紊亂等[1]。正常情況下,機體可通過自身調節,保持心臟正常工作,但是由疾病產生的急性心肌缺血性損傷將導致長期的冠脈供血不足,致使心肌細胞發生不可逆轉的損傷[2]。目前,心肌缺血的患病率呈逐年上升且年輕化趨勢,有效地預防和治療早期心肌缺血顯得尤為重要。內皮祖細胞(EPC)是一類在血液中循環并能分化為血管內皮細胞的前體細胞。EPC主要參與血管內皮細胞修復和血管新生,維持血管內皮的完整性,生成新的血管。近年來,EPC的研究成為醫學研究領域的新熱點,為缺血性心臟病的治療提供了新思路[3]。大量研究表明,他汀類藥物能降低血管氧化應激,改善和恢復內皮功能,調節免疫活性,穩定斑塊,促進缺血組織的新血管生成[4]。本研究觀察阿托伐他汀對急性ST段抬高型心肌梗死(STEMI)患者EPC 增殖、遷移和細胞因子分泌等的影響,進一步明確他汀類藥物的作用機制,為急性心肌缺血性損傷的防治提供有效治療策略。
1 材料與方法
研究對象:選擇2015-02至2015-08期間我院心血管內科收治的STEMI患者80例,依據《2012年歐洲心臟病學會STEMI管理指南》的診斷標準確診,根據所服用阿托伐他汀(商品名:立普妥,美國輝瑞制藥有限公司生產)的劑量不同,分為觀察組(阿托伐他汀40 mg,n=40)和對照組(阿托伐他汀20 mg,n=40)。兩組患者在冠脈血管病變程度、置入支架數、血管病變長度及管腔狹窄程度等方面無差異。所有患者接受經皮冠脈介入治療(PCI),每日按照劑量要求口服阿托伐他汀。入選患者均為初始接受他汀類藥物治療,排除不明原因的丙氨酸氨基轉移酶(ALT)持續性升高或活動性肝病患者以及用藥過程中肌酸激酶(CK)嚴重升高的患者等。
阿托伐他汀對外周血EPC數目的影響:每例患者在治療前、治療后第15、30、60、90、120天6個時間點取外周血20 ml,ficoil 梯度離心。將其鋪在包被有人纖連蛋白(h-FBN,5μg/cm2)的24孔板上,用Lonza EGM-2內皮細胞生長培養基培養,培養4天后細胞換液,除去懸浮的細胞。第7天收集貼壁細胞。用DiL標記的乙酰化低密度脂蛋白(DilacLDL,終濃度2.4 mg/L)37℃孵育1 h,4%多聚甲醛固定10 min,磷酸鹽緩沖液(PBS)清洗。再用異硫氰熒光素(FITC)標記的荊豆凝集素IFITC-UEA-I(終濃度10 mg/L)37℃孵育1 h。PBS(PH=7.4)清洗一遍后在熒光顯微鏡下觀察并計算10個視野(×200)EPC 雙染陽性細胞。
阿托伐他汀對外周血EPC生物學功能的影響:(1)MTT檢測EPC細胞增殖能力:取第7天的貼壁細胞計數,將5×103個細胞接種到包被纖連蛋白的96孔培養板,過夜,每孔加10μl MTT(5 mg/ml),培養4 h后,吸掉上清液,加入二甲基亞砜(150μl/ well),酶標儀上490 nm 波長讀數。(2)Transwell遷移實驗檢測EPC的遷移能力:在下室底部涂上一層纖連蛋白,晾干后,將25μl Lonza EGM-2 培養基添加到內皮細胞生長因子VEGF-165,終濃度為50 ng/μl加入下室。再將2×104個 EPC 懸浮在50μl 培養基中,注入上室。37℃培養24 h后,去掉上室,甲醇固定,Giemsa 染色,隨機選擇3個顯微鏡視野下,觀察EPC的數目。
酶聯免疫吸附測定(ELISA)方法檢測EPC 細胞因子分泌:通過檢測不同劑量的阿托伐他汀對EPC細胞因子趨化因子受體4(CXCR4)、血管內皮生長因子(VEGF)、重組堿性成纖維細胞生長因子(bFGF)、沉默調節蛋白1(SIRT1)分泌的影響,判斷EPC的增殖、內皮修復等情況。時間點設定為服藥前及服藥后第15、30、60、90、120天。VEGF可直接刺激血管內皮細胞移動、增殖及分裂,增加微血管通透性,在體內誘導血管新生。CXCR4是基質細胞衍生因子-1(SDF-1)的受體,高度保守。SDF-1介導趨化反應,其表達量由CXCR4的表達水平決定。CXCR4表達量越高,SDF-1誘導發生EPC 發生的遷移細胞越多。bFGF是堿性成纖維細胞生長因子的異構體,參與內皮細胞的游走和平滑肌細胞的增殖,促進新血管形成,修復損害的內皮細胞。SIRT1與細胞增殖、分化、衰老、凋亡和代謝密切相關,可抵抗內皮細胞的衰老。取專用酶標版,包被一抗后4℃冰箱孵育過夜。洗板后依次加入標準品和樣本。37℃孵育1 h。洗板,每孔加入酶標記的二抗,37℃孵育1 h。洗板,加入底物,與酶反應后顯色30 min,最后加入檸檬酸中止反應。450 nm波長讀數,測吸光值(OD),描繪標準曲線,計算樣本含量。
統計學方法:采用SPSS 13.0軟件包進行統計學處理。計量資料以 ±s 表示。兩組均數間比較采用t檢驗,以P<0.05 為差異有統計學意義。
2 結果
2.1EPC 鑒定結果(圖1)
人纖連蛋白對EPC有特殊的親和力,增加EPC細胞的貼壁。培養7天收集的細胞用Dil-acLDL和FITC-UEA-I雙染,通過倒置熒光顯微鏡觀察到,細胞同時被染成紅色(DiI-AcLDL染色)和綠色(FITC-UEA-I染色),此類細胞為早期分化的EPC。倒置熒光顯微鏡下隨機取15個視野,儀器自動分析統計雙染陽性的細胞,再進行臺盼藍染色,計算總細胞數目,計算雙染陽性細胞占總細胞的比例。結果為約90%的貼壁細胞為EPC。
2.2阿托伐他汀對EPC生物學功能的影響(表2)
MTT 方法檢測EPC的增殖和遷移實驗結果顯示,觀察組與對照組患者術后應用阿托伐他汀治療2周和4周EPC增殖能力均較治療前增強(P<0.01),但兩組比較差異無統計學意義。
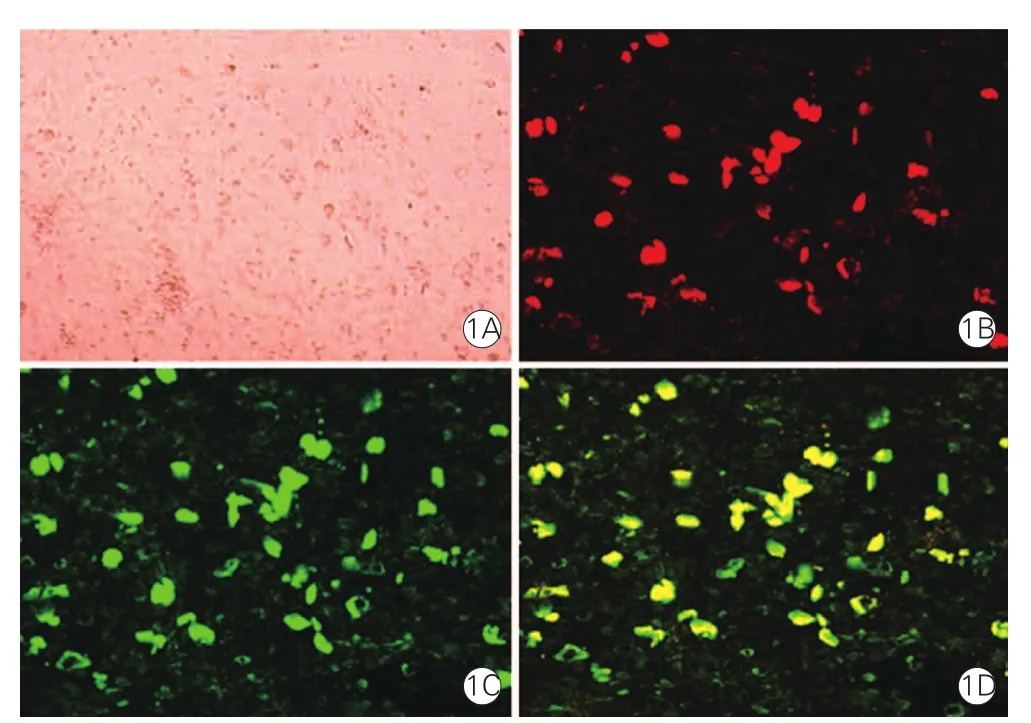
圖1 內皮祖細胞染色鑒定
2.3細胞因子分泌結果(圖2)
CXCR4的分泌濃度在治療30天時達高峰,然后逐漸減少。說明與觀察組比較,對照組細胞遷移及歸巢能力更好。SIRT1不斷增加,且對照組略高于觀察組。VEGF、bFGF分泌量先增加,后減少,在治療60天時濃度曲線達到高峰。考慮這與早期血管內膜急性損傷、調動激活外周循環EPC有關。

表2 兩組EPC增殖和遷移的結果比較(±s)
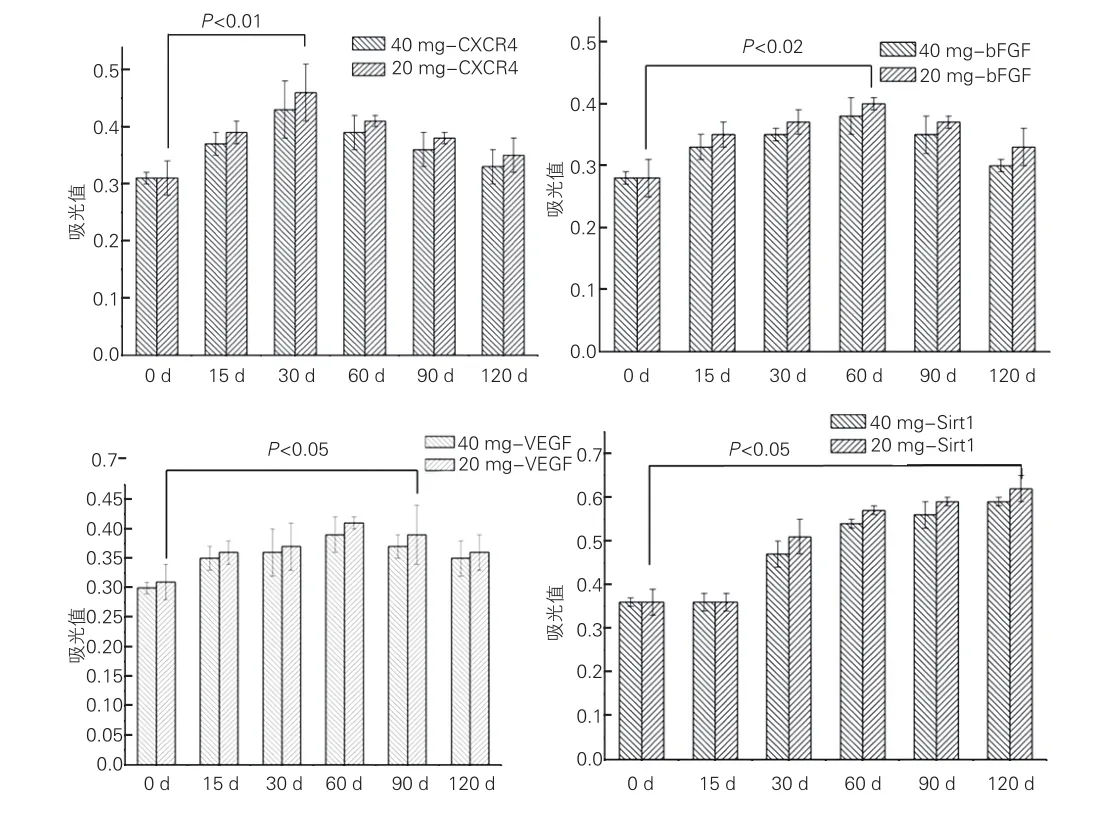
圖2 觀察組(40 mg) 和對照組(20 mg) 趨化因子受體4、血管內皮生長因子、重組堿性成纖維細胞生長因子、沉默調節蛋白1的分泌
3 討論
冠脈介入治療已成為當前治療急性心肌梗死最行之有效的方法之一,但是術后選擇合適的藥物及相應的劑量是防止病變血管發生再狹窄的關鍵。他汀類藥物在降低血脂、恢復血管內皮功能、降低氧化應激、降低血管炎癥、降低血栓形成和調節免疫活性、穩定粥樣斑塊等方面有良好的表現。他汀類是3-羥基-3-甲基戊二酰輔酶A的抑制劑,能使膽固醇的合成減少,清除增加,顯著降低血清總膽固醇(TC)及低密度脂蛋白膽固醇(LDL-C)的濃度,被廣泛應用于臨床和科學研究。眾多研究發現,他汀類藥物在治療過程中能促進EPC的增殖和分化[5-7]。EPC即內皮細胞分化的前身,起源于骨髓,在血液中循環,參與受損的內皮細胞與組織的修復,促進動物缺血組織的新生血管生成[8]。在心肌急性缺血時,EPC能招募骨髓和血液循環系統中的EPC進入缺血區,對損傷的血管內膜進行修復。在修復的過程中,分泌一些細胞因子,誘導新血管的再生,加速血管的內皮化。有研究表明,血液中循環的EPC的數量減少,可用于預測未來的心血管事件[9]。內皮祖細胞在分化過程中可分為早期或晚期EPC。據文獻報道,體外培養原代EPC,4~7 天內出現早期分化的EPC,在21 天后則逐漸發展為晚期分化的EPC[10,11]。早期分化的EPC可能表現在為周圍組織提供營養支持,而晚期EPC則多分化為成熟的內皮細胞,促進血管的修復[12,13]。研究急性心肌梗死患者術后長期服用不同劑量的他汀類藥物體內EPC的增殖及對血管的修復能力的影響,是研究有效延緩血管衰老、增強血管的自修復能力重要途徑。本研究結果顯示,觀察組和對照組阿托伐他汀治療2周較治療前EPC數量明顯增加。同時,CXCR4、bFGF、VEGF分泌量隨不同時間點也表現出先增加后減少的趨勢。表明患者在治療過程中,藥物對EPC先起效較為明顯,但是隨著治療時間的延長,EPC表現出適應性,且受機體的干預逐漸明顯。在治療過程中, SIRT1一直保持增長的趨勢,表現出藥物有抵抗EPC衰老的功能。觀察組與對照組的樣本量不夠大以及檢測的細胞因子種類有限,不能更為全面地分析不同劑量的他汀類藥物對EPC生長和分化的影響。
綜上所述,中-低劑量的阿托伐他汀對急性心肌梗死患者體內EPC增殖分化和細胞因子的分泌都有積極的影響,為防止術后血管再狹窄有著重要的意義。
[1] Sobieraj DM, White CM, Kluger J, et al. Systematic review: comparative effectiveness of adjunctive devices in patients with ST-segment elevation myocardial infarction undergoing percutaneous coronary intervention of native vessels. BMC Cardiovasc Disord, 2011, 11: 1471-2261.
[2] Mamas MA, Fraser D, Fath-Ordoubadic F. The role of thrombectomy and distal protection devices during percutaneous coronary interventions. EuroIntervention, 2008, 4: 115-123.
[3] Hill JM, Zalos G, Halcox JP, et al. Circulating endothelial progenitor cells, vascular function, and cardiovascular risk. N Engl J Med, 2003, 3: 593-600.
[4] Kanda M, Satoh K, Ichihara K. Effects of atorvastatin and pravastatin on glucose tolerance in diabetic rats mildly induced by streptozotocin. Biol Pharm Bull. 2003, 26: 1681-1684.
[5] Ciszewski M, Pregowski J, Teresinska A, et al. Aspiration coronary thrombectomy for acute myocardial infarction improves myocardial salvage index: single center randomized study. Circulation, 2008, 118: S764.
[6] 羅江賓, 王天松, 方明. 斑塊成份對經皮冠狀動脈介入治療術后再狹窄的影響. 中國循環雜志, 2013, 28: 176-178.
[7] Antoniucci D, Valenti R, Migliorini A, et al. Comparison of rheolytic thrombectomy before direct infarct artery stenting versus direct stenting alone in patients undergoing percutaneous coronary intervention for acute myocardial infarction. Am J Cardiol, 2004, 93: 1033-1052.
[8] Paradisi G, Bracaglia M, Basile F, et al. Effect of pravastatin on endothelial function and endothelial progenitor cells in healthy postmenopausal women. Clin Exp Obstet Gynecol, 2012, 3: 153-159.
[9] Schmidt-Lucke C, Fichtlscherer S, Aicher A, et al. Quantification of circulating endothelial progenitor cells using the modified ISHAGE protocol. PLoS One, 2010, 5: e13790.
[10] Sata M, Nishimatsu H, Osuga JI, et al. Statins augment collateral growth in response to ischemia but they do not promote cancer and atherosclerosis. Hypertension, 2004, 4: 1214-1220.
[11] Steinmetz M, Pelster B, Lucanus E, et al. Atorvastatin-induced increase in progenitor cell levels is rather caused by enhanced receptor activator of NF-kappaB ligand (RANKL) cell proliferation than by bone marrow mobilization. J Mol Cell Cardiol, 2013, 6: 32-42.
[12] Antonio N, Fernandes R, Soares A, et al. Reduced levels of circulating endothelial progenitor cells in acute myocardial infarction patients with diabetes or pre-diabetes: accompanying the glycemic continuum. Cardiovasc Diabetol, 2014, 10: 1475-2840.
[13] 趙蓓, 劉利峰, 劉瑛琪, 等. 阿托伐他汀對穩定性心絞痛患者血漿微小核糖核酸-143/145表達水平的影響. 中國循環雜志, 2014, 29: 1039-1043.
Impact of Middle and Low Dose Atorvastatin on Endothelial Progenitor Cell Function in Patients With Acute Myocardial Ischemia Injury
WANG Liang, ZHONG Wu, CHEN Mu-hu.
Department of Emergency, Affiliated Hospital of Southwest Medical University, Luzhou (646000), Gansu, China
Correspondence Author: WANG Liang, Email: ajhl64@163.com
Objective: To explore the impact of middle and low dose atorvastatin on peripheral endothelial progenitor cells (EPCs) in patients with acute myocardial ischemia injury via investigating EPC proliferation, migration, differentiation and secretion of cytokines.
Method: A total of 80 patients with acute ST-segment elevation myocardial infarction (STEMI) were randomly divided into 2 groups: Observation group, the patients received atorvastatin 40 mg and Control group, the patients received atorvastatin 20 mg. n=40 in each group. The number of circulating EPC, EPC proliferation ability and the secretion of cytokines before and at different time points after drug therapy were examined by means of MTT, flow cytometry and ELISA.
Results: The number of EPC was obviously increased with greatly changed migration ability within 2 weeks atorvastatin treatment in both groups. The secretion of cytokines presented that the contents of VEGF, bFGF, CXCR were elevating first followed by reducing thereafter, while the content of SIRT1was continuously increasing during the period of treating. The above parameters were similar between 2 groups.
Conclusion: Middle and low dose atorvastatin could effectively improve EPC proliferation and migration, increase the expressions of CXCR4, VEGF, bFGF and SIRT1 in STEMI patients.
Myocardial ischemia; Endothelial progenitor cells; Lipid-lowering drug
2016-09-19)
(編輯:許菁)
646000四川省瀘州市,西南醫科大學附屬醫院 急診科
王亮 主治醫師 學士 研究方向為急診創傷、急診介入 Email:ajhl64@163.com 通訊作者:王亮
R54
A
1000-3614(2017)07-0697-04
10.3969/j.issn.1000-3614.2017.07.018

