Snail在IgA腎病組織中的表達及其與腎小管上皮-間質轉化的關系
李 靜,高慧敏,王 弦,秦 蓉
Snail在IgA腎病組織中的表達及其與腎小管上皮-間質轉化的關系
李 靜,高慧敏,王 弦,秦 蓉
目的 探討在組織和細胞水平上Snail的表達與腎小管上皮-間質轉化(epithelial-mesenchymal transition, EMT)及腎小管間質纖維化(tubulointerstitial fibrosis, TIF)的關系;觀察轉染Snail基因后人腎小管上皮細胞(HK-2)miRNA表達譜的變化,以深入闡明EMT機制中miRNA的重要性。方法 采用免疫組化法檢測Snail及EMT相關蛋白vimentin、SMA、E-cadherin在40例IgA腎病患者腎穿刺組織中的表達。采用RT-PCR及Western blot法檢測Snail、E-cadherin、vimentin、SMA在HK-2細胞正常對照組、空轉染組、Snail基因轉染組中的表達,進一步借助基因芯片篩選出差異表達的miRNA。結果 免疫組化結果顯示,IgA腎病組織中Snail與vimentin及SMA蛋白的表達呈正相關,與E-cadherin蛋白的表達呈負相關,且TIF程度越高,Snail蛋白表達越強。RT-PCR及Western blot檢測結果顯示,與對照組相比,Snail轉染組Snail、vimentin、SMA在基因和蛋白水平表達均升高,E-cadherin蛋白表達降低,差異具有統計學意義(P<0.05)。基因芯片結果表明,Snail轉染HK-2細胞后,篩選出5個明顯差異表達的miRNA,預測出5 026個可能的潛在靶基因。結論 Snail表達與腎小管EMT及TIF關系密切,可作為新靶點,在EMT防治中起重要作用;差異表達的miRNAs可能參與Snail促進EMT及TIF過程的發生、發展。
腎病;腎小管上皮細胞;Snail;上皮-間質轉化;免疫組織化學;miRNA;基因芯片
腎小管間質纖維化(tubulointerstitial fibrosis, TIF)是各種慢性腎臟疾病進展為終末期腎病的最終共同途徑[1]。研究發現,上皮-間質轉化(epithelial-mesenchymal transition, EMT)是TIF發生、發展的重要機制[2]。EMT是指上皮細胞在外界因素作用下失去上皮特性而獲得間質細胞特性的一種現象,表現為上皮細胞標志物角蛋白、E-cadherin等表達下調,間質細胞標志物α-SMA、vimentin等蛋白表達上調[3]。在EMT過程中,多種信號分子參與其中并發揮重要作用[4],研究發現鋅指轉錄因子Snail家族成員對EMT的發生、發展起重要的促進作用[5]。但Snail在人腎小管上皮細胞EMT過程中作用機制的研究卻鮮有報道。本組前期研究結果表明,miRNA在EMT及TIF過程中發揮著重要作用,目前有極少量研究報道在EMT過程中miRNA的表達譜變化。為進一步探討Snail與腎小管EMT及TIF的關系以及miRNA的調控作用,本實驗采用免疫組化法檢測Snail蛋白及EMT相關蛋白vimentin、SMA、E-cadherin在IgA腎病患者的腎臟組織中的表達,從而探討Snail與EMT和TIF的相關性;同時構建過表達Snail基因的HK-2細胞,應用qPCR、RT-PCR、Western blot等分子生物學技術,在細胞水平研究Snail過表達對EMT相關蛋白vimentin、SMA、E-cadherin表達的影響;并利用基因芯片技術篩選出Snail轉染組HK-2細胞差異表達的miRNA,從miRNAs水平進一步探討Snail基因對腎小管EMT的作用機制。
1 材料與方法
1.1 實驗材料
1.1.1 標本來源與分組 選取40例2010~2014年安徽醫科大學第二附屬醫院病理科經腎穿刺活檢診斷為IgA腎病的腎組織,已排除過敏性紫癜、系統性紅斑狼瘡等繼發性腎小球腎炎。另收集4例正常腎組織作為對照組。根據光鏡下腎小管萎縮和TIF所占皮質部間質總面積的百分比將IgA腎病TIF程度分為3級:(1)輕度:腎小管萎縮和TIF程度不超過皮質部間質總面積的25%;(2)中度:腎小管萎縮和TIF程度占皮質部間質總面積25%~50%;(3)重度:腎小管萎縮和TIF程度超過皮質部間質總面積的50%[6]。對入選的40例IgA腎病組織根據TIF嚴重程度分為輕度病變組12例、中度病變組14例和重度病變組14例。
1.1.2 細胞株和質粒 人腎皮質近曲小管上皮細胞(HK-2、FDCC-HSC145)購于復旦IBS細胞庫;人Snail基因表達質粒由廣州輝駿公司構建。
1.1.3 主要試劑 鼠抗人Snail多克隆抗體(濃縮型),工作濃度(1 ∶50)購自Abcam公司;鼠抗人SMA、vimentin、E-cadherin單克隆抗體(即用型)及PV-6000免疫組化染色試劑盒和DAB顯色試劑盒均購自北京中杉金橋公司。DMEM/F12培養液購自美國Hyclone公司,胎牛血清購自杭州四季青公司,胰酶、RIPA蛋白提取液細胞裂解液購自碧云天公司,質粒小量抽提試劑盒、Trizol RNA抽提試劑盒購自美國Invitrogen公司,DMSO購自美國AMRESCO公司,兔抗人E-cadherin、vimentin、α-SMA抗體、鼠抗人Snail抗體均購自美國Abcam公司,小鼠抗人β-actin抗體、辣根過氧化物酶標記兔抗小鼠IgG二抗、辣根過氧化物酶標記山羊抗兔IgG二抗均購自北京中杉金橋公司。
1.2 方法
1.2.1 免疫組化法檢測腎組織中Snail、vimentin、SMA、E-cadherin的表達及結果判定 標本均經10%中性福爾馬林固定后石蠟包埋,3 μm厚連續切片。采用EnVision兩步法,具體操作步驟按PV-6000試劑盒說明書進行,經DAB顯色,蘇木精復染細胞核,中性樹膠封固。已知陽性組織作為陽性對照,以PBS代替原一抗作為陰性對照進行抗體有效性驗證。Snail、vimentin、SMA及E-cadherin結果判斷:按照染色細胞所占面積百分比進行半定量分析。光鏡下每張切片不包含腎小球和血管的間質區域隨機選取5個高倍鏡視野(×400倍),計算所選區域陽性細胞占整個視野面積的百分比,然后求其平均值作為比較指標。陽性細胞所占面積≤10%為陰性(-),10%~25%為弱陽性(1+),25%~50%為中等陽性(2+),≥50%為強陽性(3+)[3],最終結果將(-~1+)判斷為陰性,(2+~3+)判斷為陽性。
1.2.2 人Snail基因表達載體的構建、鑒定、擴增及提取 構建Snail基因表達載體,并將含有目的片段的重組質粒菌株送與上海生工公司測序鑒定。然后轉化DH-5a感受態細胞,經涂板、挑選、單克隆后擴增;采用質粒小提試劑盒(Invitrogen公司)從大腸桿菌中抽提質粒,操作方法參照說明書;用紫外分光光度儀測定OD260/280比值來計算DNA的濃度及純度,-20 ℃保存。
1.2.3 Snail質粒瞬時轉染及細胞形態學觀察 HK-2細胞常規培養,按每孔1×106個接種在6孔板中,待細胞達70%~80%融合后,在細胞生長狀態良好的情況下進行轉染,轉染步驟參照Lipofectamine 2000說明書。實驗分組:(1)空白對照組:只接種細胞,無轉染質粒,無轉染試劑;(2)空轉染組:無轉染質粒,有轉染試劑;(3)實驗組:轉染Snail質粒。將處理后的細胞置于37 ℃ 5%CO2的培養箱中培養48 h后,采用倒置顯微鏡觀察各組細胞形態的改變。
1.2.4 Western blot 細胞轉染48 h后,加入RIPA裂解液,冰上均質,4 ℃,12 000 r /min,離心10 min,取上清液,4 ∶1加入上樣緩沖液,100 ℃煮沸變性10 min。配制10% SDS-PAGE凝膠,依次加入預染蛋白Marker和待分析樣品后80 V電壓下電泳分離,200 mA電流轉膜1.5 h,5%脫脂奶粉封閉2 h。加入一抗4 ℃搖床孵育過夜。其中抗體濃度β-catenin(1 ∶5 000)、Snail(1 ∶1 000)、vimentin(1 ∶1 000)、α-SMA(1 ∶1 000)、E-cadherin(1 ∶1 000)、二抗(1 ∶10 000)。使用Pierce ECL Western blotting KIT顯色。
1.2.5 qPCR、RT-PCR和miRNA表達譜芯片檢測 細胞轉染48 h后,使用Trizol法提取細胞總RNA并進行逆轉錄。qPCR采用SYBR Green染色法,qPCR反應條件:95 ℃ 10 s,95 ℃ 15 s、60 ℃ 40 s 40個循環。樣本做3個復孔。CT值代表熒光信號到達所設定的閾值時所經歷的循環數,以β-actin作為內參,通過2-△△Ct法計算目的基因Snail的相對表達量。建立25 μL的PCR反應體系:cDNA 模板2 μL、上游引物1 μL、下游引物1 μL、PCR Master Mix 12.5 μL、去離子水8.5 μL。PCR擴增條件:預變性95 ℃ 3 min,變性95 ℃ 30 s、退火30 s(Snail 51 ℃、vimentin 50 ℃、SMA 55 ℃、E-cadherin 54 ℃)、延伸72 ℃ 45 s共進行35個循環,后72 ℃延伸10 min,最后4 ℃終止,-20 ℃保存,PCR產物使用1.5%瓊脂糖凝膠電泳檢測并分析。引物序列如下:β-actin上游5′-TGACGTGGACATCCGCAAAG-3′,下游5′-CTGGAAGGTGGACAGCGAGG-3′;Snail上游5′-TTTACCTTCCAGCAGCCCTA-3′,下游5′-GACAGAGTCCCAGATGAGCA-3′;vimentin上游5′-CCTTGAACGCAAAGTGGAAT-3′,下游5′-TTTGGACATGCTGTTCCTGA-3′;SMA上游5′-GCGTGGCTATTCCTTCGTTA-3′,下游5′-TTCTCAAGGGAGGATGAGGA-3′;E-cadherin上游5′-TGATTCTGCTGCTCTTGCTG-3′,下游5′-CTCTTCTCCGCCTCCTTCTT-3′。同時委托上海伯豪公司對空轉染組和Snail轉染組總RNA進行miRNA芯片分析。
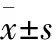
2 結果
2.1 Snail、vimentin、SMA及E-cadherin在IgA腎病組織中的表達 Snail在正常腎小管上皮細胞胞質中有少量表達,當發生TIF時,Snail主要在腎小管上皮細胞及間質纖維細胞和(或)纖維母細胞、少量炎細胞胞質及胞核中表達,且Snail染色強度隨TIF程度加重而增加(圖1);vimentin主要在萎縮的腎小管上皮細胞和基膜、腎小球毛細血管壁和內皮細胞及間質細胞胞質表達(圖2);SMA主要在腎小管上皮細胞、腎小球系膜細胞、血管壁及間質細胞胞質表達(圖3);E-cadherin主要在腎小管上皮細胞的胞膜和胞質表達(圖4)。進一步統計分析表明,Snail、vimentin及SMA蛋白隨TIF程度加重而表達增強;E-cadherin蛋白隨TIF程度加重而表達降低(P<0.05,表1)。Spearman相關性分析表明Snail蛋白與vimentin、SMA蛋白表達呈正相關,與E-cadherin蛋白表達呈負相關(表2)。

①A①B①C②A②B②C③A③B③C④A④B④C
圖1 Snail蛋白在腎小管間質纖維化輕度(A)、中度(B)和重度(C)病變組織中的表達,EnVision兩步法 圖2 vimentin蛋白在腎小管間質纖維化輕度(A)、中度(B)和重度(C)病變組織中的表達,EnVision兩步法 圖3 SMA蛋白在腎小管間質纖維化輕度(A)、中度(B)和重度(C)病變組織中的表達,EnVision兩步法 圖4 E-cadherin蛋白在腎小管間質纖維化輕度(A)、中度(B)和重度(C)病變組織中的表達,EnVision兩步法

表2 Snail與vimentin、SMA、E-cadherin蛋白表達的相關性分析
2.2 重組質粒的鑒定 經測序結果顯示:重組質粒的堿基序列與GenBank中的序列完全一致,表明目的片段成功插入載體質粒。
2.3 Snail基因轉染前后細胞形態學變化 借助倒置相差顯微鏡觀察,空白對照組及空轉染組HK-2細胞形態呈鋪路石樣,Snail基因轉染組中HK-2細胞形態呈紡錘形,間隙增寬,兩者形態上有明顯差別(圖5)。
2.4 Snail、vimentin、SMA及E-cadherin在各組HK-2細胞中的表達
2.4.1 qPCR結果 Snail轉染組中Snail mRNA的相對表達量明顯高于空白對照組及空轉染組(圖6),差異有統計學意義(P<0.01)。
2.4.2 Western blot結果 Snail轉染組中Snail、vimentin及SMA蛋白的表達量明顯高于空白對照組及空轉染組,而E-cadherin蛋白的表達明顯低于空白對照組及空轉染組(圖7、8),差異有統計學意義(P<0.05)。

圖6 腎小管上皮細胞HK-2轉染Snail后Snail mRNA的表達與空白對照組及空轉染組比較,**P<0.01
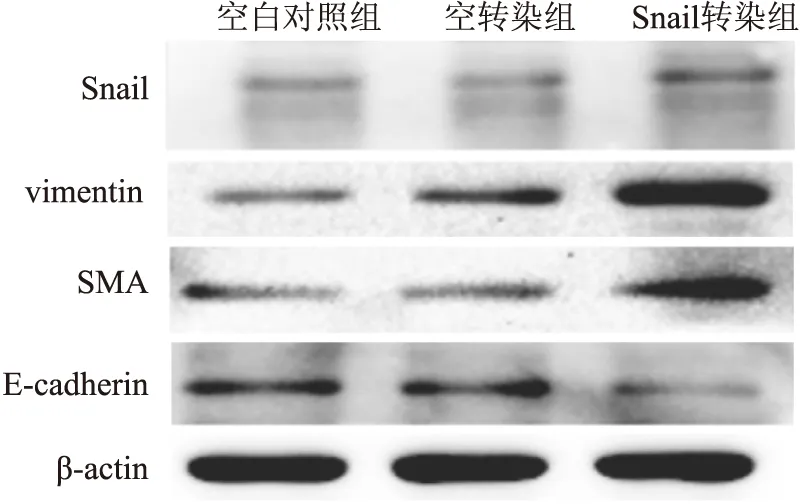
圖7 Western blot法檢測Snail轉染HK-2細胞后Snail、vimentin、SMA及E-cadherin蛋白的表達
2.4.3 RT-PCR結果 Snail轉染組中Snail、vimentin及SMA蛋白的表達量明顯高于空白對照組及空轉染組,而E-cadherin蛋白的表達量明顯低于空白對照組及空轉染組(圖9、10),差異有統計學意義(P<0.05)。
2.5 過表達Snail質粒誘導的miRNA異常表達 為篩選Snail轉染HK-2細胞內miRNA的差異性表達,對空轉染組及Snail轉染組進行基因芯片分析,結果顯示:在兩組細胞中,篩選出24個差異表達的miRNA(fc≤0.7,fc≥1.5)(圖9、10),其中hsa-miR-1268a、hsa-miR-5703及hsa-miR-6165表達水平差異為2≤fc≤3,hsa-miR-5787和hsa-miR-630表達水平差異為fc≥3,且均表現為表達上調(表3)。

表1 Snail、vimentin、SMA及E-cadherin蛋白在IgA腎病組織中的表達
輕度組與中度組比較,#P<0.01;中度組與重度組比較,*P<0.01;輕度組與重度組比較,△P<0.01;中度組與重度組比較,□P=0.663、☆P=0.309
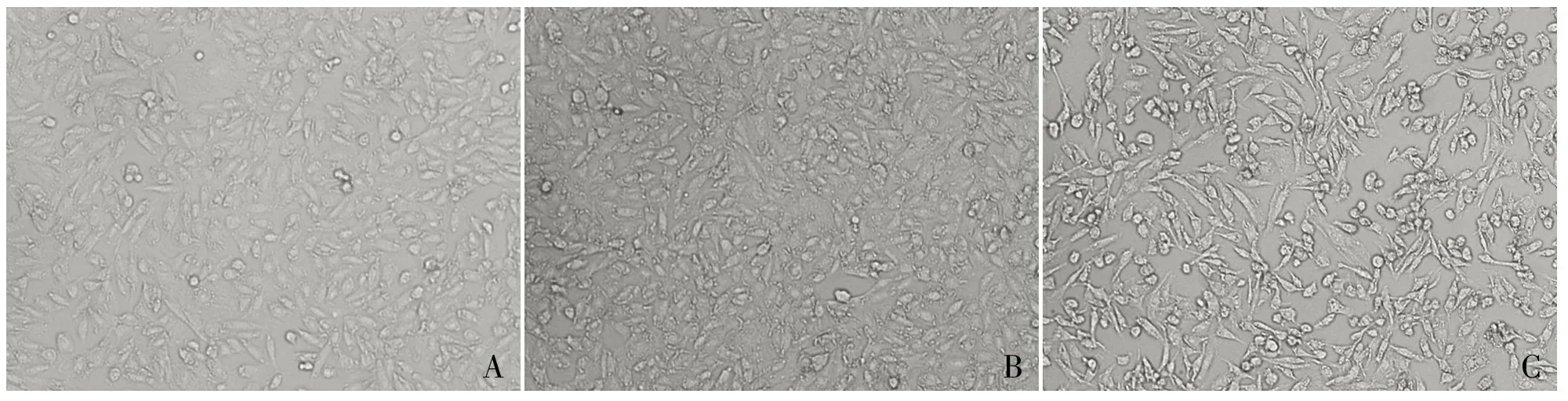
ABC
圖5 Snail轉染HK-2細胞后形態學變化:A.空白對照組;B.空轉染組;C.Snail轉染組
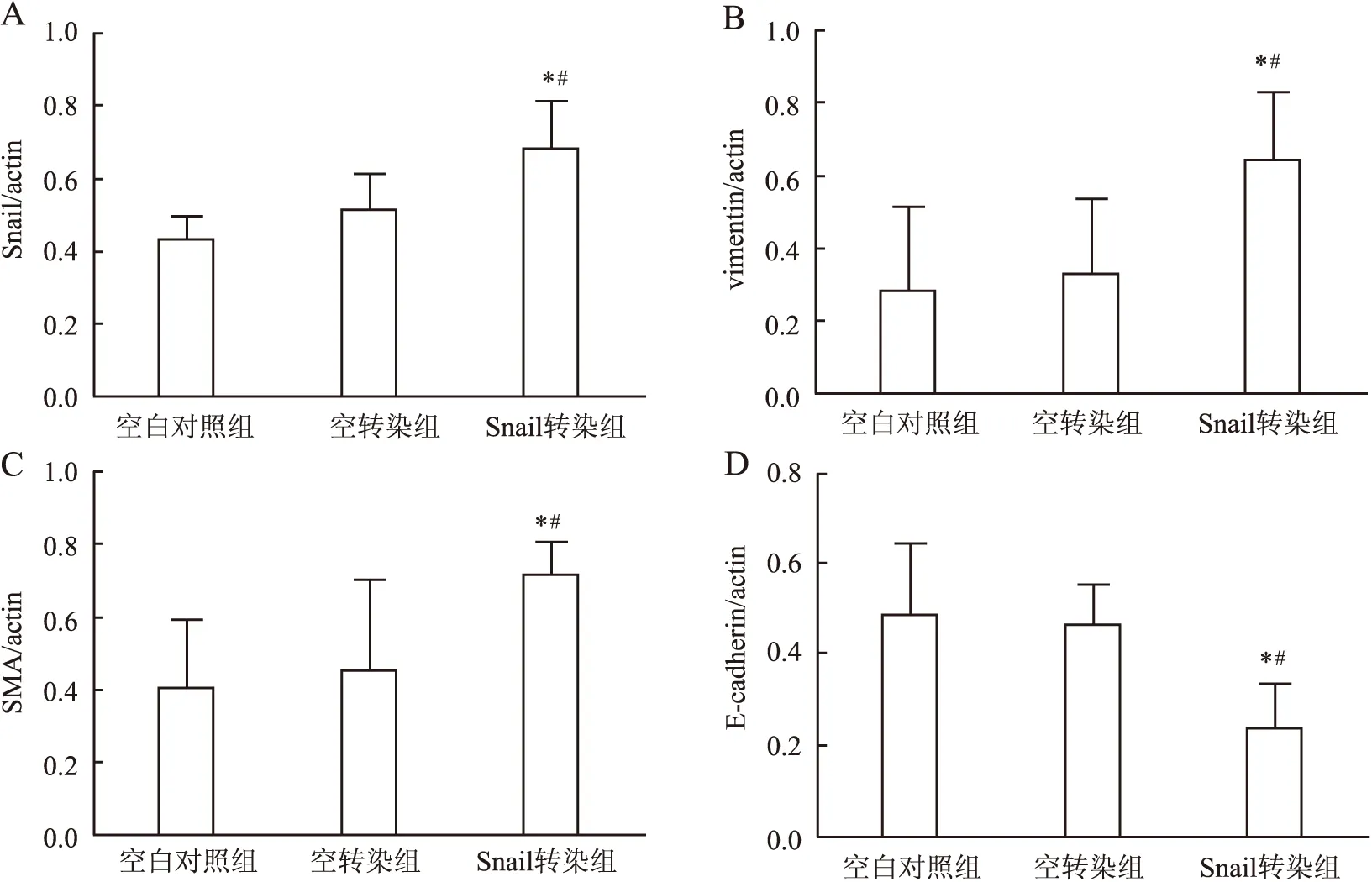
圖8 Snail轉染HK-2細胞后Snail(A)、vimentin(B)、SMA(C)及E-cadherin(D)蛋白的表達與空白對照組比較,*P<0.05;與空轉染組比較,#P<0.05
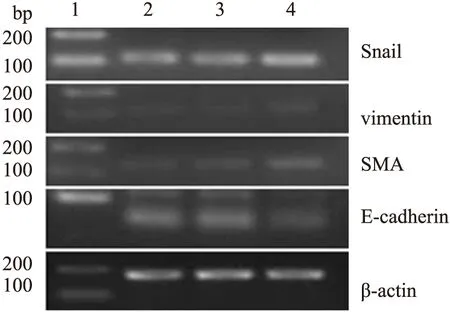
圖9 RT-PCR法檢測Snail轉染HK-2細胞后Snail、vimentin、SMA及E-cadherin mRNA的表達
1.Marker;2.空白對照組;3.空轉染組;4.Snail轉染組
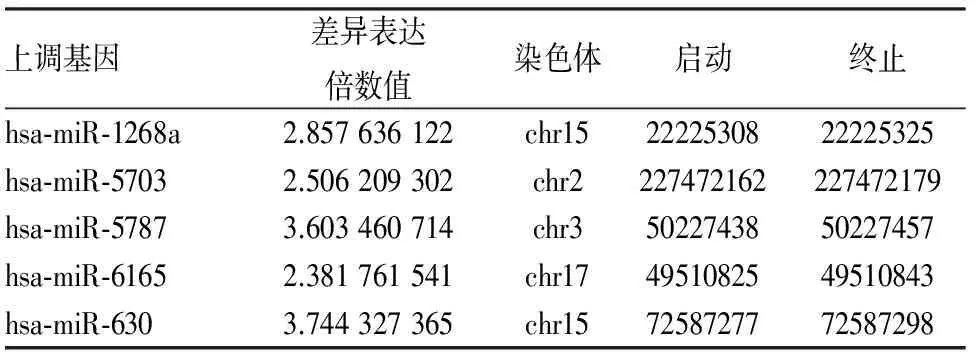
表3 Snail質粒轉染后空轉染組和轉染組內表達差異最明顯的5個miRNA
3 討論
近年來人們對TIF研究日益增多,然而引起TIF的確切機制尚無共識,但EMT在TIF早期卻起到關鍵作用。人Snail蛋白主要表達于胎盤、胚胎中胚層、心肌、肝臟、骨骼肌及某些未分化組織[7],具有調控細胞分化、游動、循環及凋亡作用[8-9]。Boutet等[7]研究發現胚胎期Snail基因參與組織、器官分化,成人Snail基因的激活破壞上皮組織的完整性和穩定性,引起臟器纖維化。大量研究[10-11]發現,Snail作為轉錄因子,與E-cadherin啟動子區結合,調節E-cadherin基因轉錄,進而抑制E-cadherin的表達,破壞細胞間緊密連接,促使細胞發生遷移。Chen等[12]研究結果顯示,Snail基因敲除小鼠在TGF-β高水平表達情況下,EMT過程受到抑制。以上實驗結果表明Snail參與EMT過程。在TIF的過程中同時伴有miRNA表達譜的變化[13],miRNA是一類具有調控作用的內源性非編碼RNA[14],長20~25個核苷酸。既往研究[15]發現,miRNA-200家族特別是miRNA-200b可以通過與E-cadherin基因結合,抑制E-cadherin表達,從而促進EMT過程,此外,miRNA-192[16]、miRNA-21[17]、miRNA-34a[18]等均可通過影響E-cadherin基因表達,調控EMT過程。
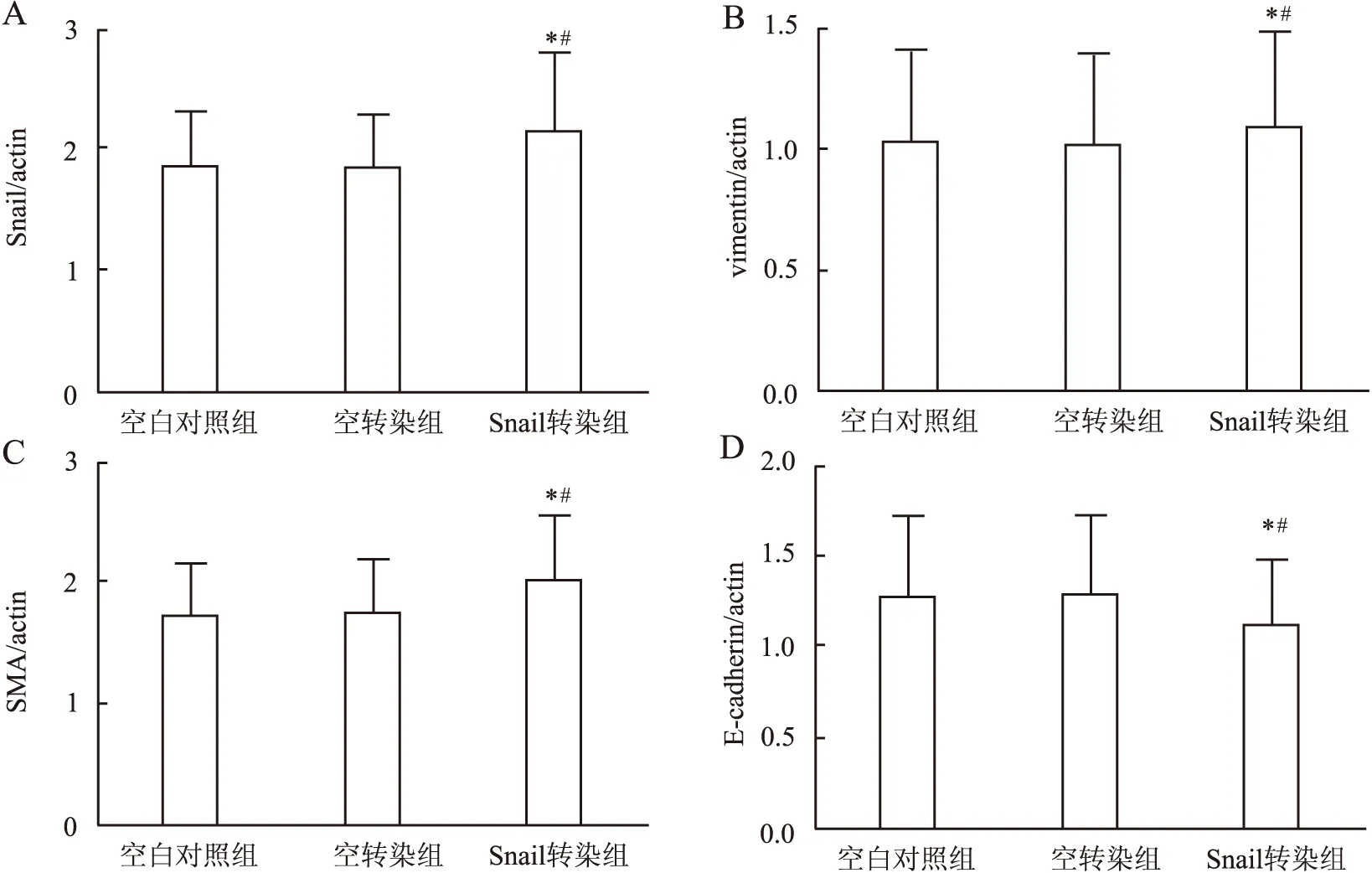
圖10 Snail轉染HK-2細胞后Snail(A)、vimentin(B)、SMA(C)及E-cadherin(D) mRNA的表達與空白對照組相比,*P<0.05;與空轉染組相比,#P<0.05
本實驗以IgA腎病患者的腎穿刺組織為研究對象,發現腎組織中Snail與vimentin及SMA蛋白的表達呈正相關,與E-cadherin蛋白的表達呈負相關;且Snail蛋白表達與TIF呈正相關。其次本實驗構建了Snail基因過表達質粒,轉染體外培養的HK-2細胞,觀察細胞形態發現細胞由上皮樣轉變為長梭形細胞,且在細胞水平進一步驗證Snail高表達可明顯上調vimentin、SMA的表達而下調E-cadherin的表達。以上結果表明Snail參與腎小管上皮細胞EMT的發生、發展過程,并與TIF密切相關。
近年來圍繞TIF相關的miRNA研究比較多,前期研究也表明,miRNA在EMT及TIF過程中發揮重要作用;但目前對EMT過程中miRNA的表達譜變化研究較少,本實驗利用Human miRNA 8×60K v21.0對空轉染組和Snail轉染組的HK-2細胞進行芯片分析,結果表明,Snail轉染組有5個miRNA的表達發生了顯著變化,本實驗進一步針對hsa-miR-1268a、hsa-miR-5703、hsa-miR-5787、hsa-miR-6165和hsa-miR-630進行靶基因預測,通過TargetScan軟件分析,共篩選5 026個靶基因,其中FUT8、LEF-1、MMP-1、MMP-2和MDM-2等靶基因的既往生物學功能研究與EMT及TIF有關。FUT8(α1-6巖藻糖基轉移酶)可以對TGF-βR、E-cadherin、EGFR等進行巖藻糖基化修飾,改變兩者生物學活性,進而參與TIF過程[19]。Snail過表達上調基質金屬蛋白酶(matrix metalloproteinase, MMPS)家族成員MMP-1、MMP-9的表達,從而引發EMT[20]。Shibata等[21]研究發現MMP-7可以通過減少E-cadherin蛋白的表達和上調β-連環蛋白/LEF-1信號傳導而誘導EMT。Medici等[22]研究認為Snail和LEF-1的相互作用參與TGF-β1誘導EMT的過程,進而引起E-cadherin的完全抑制。
總之,Snail可引起腎小管上皮細胞的生物學特性發生改變,EMT的發生、發展是一個復雜的病理過程,在此過程中,Snail處于細胞內各種信號通路的交匯點,參與構成了復雜的細胞內信號傳導系統。因此,Snail作為EMT的潛在標志物,有望成為防治腎臟纖維化的新靶點。但有關Snail及其mRNA的具體調節機制以及Snail與已知的調節因子的相互作用,有待進一步探討。
[1] Zeisberg M, Neilson E G. Mechanisms of tubulointerstitial fibrosis[J]. J Am Soc Nephrol, 2010,21(11):1819-1834.
[2] Nieto M A. Epithelial plasticity: a common theme in embryonic and cancer cells[J]. Science, 2013,342(6159):1234850.
[3] Kim M K, Maeng Y I, Sung W J,etal. The differential expression of TGF-β1, ILK and wnt signaling inducing epithelial to mesenchymal transition in human renal fibrogenesis: an immunohistochemical study[J]. Int J Clin Exp Pathol, 2013,6(9):1747-1758.
[4] 鄭月娥, 李里香. EMT誘導因子的最新研究進展[J]. 臨床與實驗病理學雜志, 2013,29(3):321-324.
[5] Gheldof A, Berx G. Cadherins and epithelial-to-mesenchymal transition[J]. Prog Mol Biol Transl Sci, 2013,116:317-336.
[6] Mezzano S, Droguett A, Burgos M E,etal. Expression of gremlin, a bone morphogenetic protein antagonist, in glomerular crescents of pauci-immune glomerulonephritis[J]. Nephrol Dial Transplant, 2007,22(7):1882-1890.
[7] Boutet A, Esteban M A, Maxwell P H, Nieto M A. Reactivation of Snail genes in renal fibrosis and carcinomas: a process of reversed embryogenesis[J]. Cell Cycle, 2007,6(6):638-642.
[8] Zheng H, Kang Y. Multilayer control of the EMT master regulators[J]. Oncogene, 2014,33(14):1755-1763.
[9] Stock S, Gott C, Grifka J,etal. Snail Modulates proliferation and expression of osteogenic markers of adipose-derived stem cells(ASC)[J]. Cell Physiol Biochem, 2013,31(4-5):703-717.
[10] Dong W, Yongjun L, Nan D,etal. Molecular networks and mechanisms of epithelial-mesenchymal transition regulated by miRNAs in the malignant melanoma cell line[J]. Yi Chuan, 2015,37(7):673-682.
[11] Cao Y W, Wan G X, Sun J P,etal. Implications of the Notch1-Snail/Slug-epithelial to mesenchymal transition axis for lymph node metastasis in infiltrating ductal carcinoma[J]. Kaohsiung J Med Sci, 2015,31(2):70-76.
[12] Chen X H, Liu Z C, Zhang G,etal. TGF-β and EGF induced HLA-I downregulation is associated with epithelial-mesenchymal transition (EMT) through upregulation of snail in prostate cancer cells[J]. Mol Immunol, 2015,65(1):34-42.
[13] 尤小寒, 章慧娣, 蘇 震, 等. 與大鼠腎間質纖維化相關microRNA的初步研究[J]. 中華腎臟病雜志, 2012,28(10):785-789.
[14] Berindan N I, Monroig P C, Pasculli B,etal. MicroRNAome genome: a treasure for cancer diagnosis and therapy[J]. CA Cancer J Clin, 2014,64(5):311-336.
[15] Xiong M, Jiang L, Zhou Y,etal. The miR-200 family regulates TGF-β1-induced renal tubular epithelial to mesenchymal transition through Smad pathway by targeting ZEB1 and ZEB2 expression [J]. Am J Physiol Renal Physiol, 2012,302(3):369-379.
[16] Jenkins R H, Martin J, Phillips A O,etal. Pleiotropy of microRNA-192 in the kidney[J]. Biochem Soc Trans, 2012,40(4):762-767.
[17] Kang W K, Lee J K, Oh S T,etal. Stromal expression of miR-21 in T3-4a colorectal cancer is an independent predictor of early tumor relapse[J]. BMC Gastroenterol, 2015,15(1):1-10.
[18] Du R, Sun W, Xia L,etal. Hypoxia-induced down-regulation of microRNA-34a promotes EMT by targeting the Notch signaling pathway in tubular epithelial cells[J]. PLoS One, 2012,7(2):e30771.
[19] Hu P, Shi B, Geng F,etal. E-cadherin core fucosylation regulates nuclear beta-catenin accumulation in lung cancer cells[J]. Glycoconj J, 2008,25(9):843-850.
[20] Sun L, Diamond M E, Ottaviano A J,etal. Transforming growth factor betal promotes matrix metalloproteinase 9 mediated oral cancer invasion through snail expression[J]. Mol Cancer Res, 2008, 6(1):10-20.
[21] Shibata S, Marushima H, Asakura T,etal. Three-dimensional culture using a radial flow bioreactor induces matrix metalloprotease 7-mediated EMT-like process in tumor cells via TGF beta 1/Smad pathway[J]. Int J Oncol, 2009,34(5):1433-1448.
[22] Medici D, Hay E D, Goodenough D A. Cooperation between snail and LEF-1 transcription factors is essential for TGF-bete1-induced epithelial-mesenchymal transition [J]. Mol Biol Cell, 2006,17(4):1871-1879.
Expression of Snail in IgA nephropathy and its relationship with renal tubular epithelial mesenchymal transition
LI Jing, GAO Hui-min, WANG Xian, QIN Rong
(DepartmentofPathology,AnhuiMedicalUniversity,Hefei230032,China)
Purpose To investigate the relationship between Snail and renal tubular epithelial-mesenchymal transition (EMT) or tubulointerstitial fibrosis (TIF) at tissue and cellular levels and to observe the changes of miRNA profile after transfecting Snail gene into human renal tubular epithelial cells (HK-2), to further elucidate the importance of miRNA in the pathogenesis of renal fibrosis. Methods The expression of Snail and EMT-related proteins vimentin, SMA, E-cadherin was detected by immunohistochemistry in renal tissues of 40 patients with IgA nephropathy. The expression of Snail, E-cadherin and SMA in normal control group, empty transfection group and Snail gene transfection group was detected by Western blot and RT-PCR. Furthermore, differentially expressed miRNAs were screened by gene chip. Results By immunohistochemistry, Snail expression was positively correlated with vimentin and SMA, negatively correlated with E-cadherin in IgA nephropathy. The higher degree of the TIF, the stronger the expression of Snail. Compared with the control group, the expression of Snail, vimentin and SMA in the snail transfected group increased. However, E-cadherin decreased at gene and protein level by the RT-PCR and Western blot (P<0.05). The difference was statistically significant. Five distinctly different miRNAs were screened by gene chip after Snail gene was transfected into HK-2 cells, and then 5 026 potential target genes were predicted. Conclusion Snail expression is closely related with renal tubular epithelial mesenchymal transition and tubulointerstitial fibrosis, and it may be used as a new target in EMT prevention. Differentially expressed miRNAs may be involved in the development of EMT and TIF.
nephropathy; renal tubular epithelial cells; Snail; epithelial-mesenchymal transition; immunohistochemistry; miRNA; gene chip
安徽醫科大學校科研基金(2015xkj121)
安徽醫科大學病理學教研室,合肥 230032
李 靜,女,碩士研究生。E-mail: sunny_xiaoai@163.com 秦 蓉,女,碩士生導師,通訊作者。E-mail: qinrong0717@163.com
時間:2017-6-20 11:18 網絡出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20170620.1117.008.html
R 692
A
1001-7399(2017)06-0629-07
10.13315/j.cnki.cjcep.2017.06.008
接受日期:2017-02-13

