下丘腦室旁核CRH神經元激活在慢性充血性心力衰竭中的交感興奮作用*
郭艷琳, 張華屏, 楊彩紅, 呂 豆, 康玉明
(山西醫科大學 1病理學教研室,2轉化醫學研究中心,3藥理學教研室, 山西 太原 030001;4西安交通大學醫學院病理與病理生理學教研室, 陜西 西安 710061)
下丘腦室旁核CRH神經元激活在慢性充血性心力衰竭中的交感興奮作用*
郭艷琳1△, 張華屏2, 楊彩紅3, 呂 豆1, 康玉明4
(山西醫科大學1病理學教研室,2轉化醫學研究中心,3藥理學教研室, 山西 太原 030001;4西安交通大學醫學院病理與病理生理學教研室, 陜西 西安 710061)
目的: 觀察慢性心衰時下丘腦室旁核(PVN)內促腎上腺皮質激素釋放激素(CRH)表達變化及其與交感神經活動之間的關系。方法: 健康雄性SD大鼠,冠脈結扎制備心衰模型,側腦室插管滲透壓泵持續給藥。假手術組和心衰組給予人工腦脊液0.25 μL/h,心衰給藥組給予CRH抑制劑αh-CRH 15 mg/h。同時,選取健康雄性體內CRH合成不足的Lewis大鼠與同源純種Fischer 344大鼠分別制備心衰模型和假手術對照進行對比研究。4周后,測定左室舒張末壓(LVEDP)、左室內壓最大上升和下降速率(±dp/dtmax)、右心室/體重比(RV/BW)、肺/體重比(lung/BW)、腎交感神經放電活動(RSNA)、血漿去甲腎上腺素(NE)濃度和PVN內CRH陽性神經元數目。血漿促腎上腺皮質激素(ACTH)含量。結果: 與假手術組相比,SD心衰大鼠PVN內CRH陽性神經元數目明顯增加,血漿ACTH濃度升高,RSNA增強,血漿NE濃度增加,LVEDP、lung/BW和RV/BW增加,±dp/dtmax降低;心衰模型后給予αh-CRH可明顯逆轉上述各種變化(P<0.05)。Fisher 344大鼠心衰組和假手術對照相比,PVN內CRH陽性神經元數目明顯增加,血漿ACTH濃度升高,RSNA增強,外周血NE濃度升高,LVEDP、RV/BW和lung/BW增加,±dp/dtmax下降(P<0.05)。但Lewis大鼠心衰組和假手術對照相比,以上各指標改變均不明顯。結論: 慢性心衰時,下丘腦室旁核CRH神經元被激活,激活的CRH神經元可增強外周交感神經活動,加重心功能惡化。
慢性充血性心力衰竭; 下丘腦室旁核; 促腎上腺皮質激素釋放激素-神經元; 交感神經系統; Lewis大鼠; Fisher 344大鼠
慢性充血性心力衰竭[以下簡稱心衰(heart failure,HF)]是一種常見的、預后不良的心血管重癥。持續、過度的交感神經興奮性增強是慢性心衰病人心功能惡化的主要原因之一。下丘腦室旁核(paraventricular nucleus of hypothalamus,PVN)是與神經內分泌活動及自主功能有關的復合體結構。PVN小細胞區神經元投射到腦干和脊髓的自主神經核團,負責包括心血管調節在內的交感神經系統的激活[1]。近期研究發現,心衰大鼠PVN內Fra-LI(中樞神經元激活標記物)和促腎上腺皮質激素釋放激素(corticotropin releasing hormone,CRH)免疫雙標陽性神經元數量明顯增加,CRH釋放增多,外周交感神經活動增強,心功能不斷惡化[2];而且心衰時眾多參與心血管活動調節的活性物質在該區域積聚[3],提示心衰時室旁核內CRH神經元激活,并可能通過增強交感神經興奮性,參與心衰的發生發展。目前這方面的研究較少。本研究的目標是,觀察慢性心衰時PVN內CRH的變化,以及CRH神經元的激活與交感神經活動之間的關系。為了探明以上問題,本實驗分為2部分:(1)采用Sprague-Dawley(SD)大鼠制作心衰模型及假手術對照,并經側腦室滲透壓泵慢性給予CRH競爭性抑制劑α螺旋促腎上腺皮質激素釋放激素(alpha-helical corticotrophin releasing hormone, αh-CRH)或者溶劑對照(vehicle,VEH)人工腦脊液進行干預實驗;(2)采用體內CRH合成不足的Lewis大鼠與同源純種Fischer 344大鼠分別制備心衰模型及假手術對照進行對比研究。
材 料 和 方 法
1 實驗動物
成年健康雄性SD大鼠,體質量(250±30)g,由山西醫科大學實驗動物中心提供。成年健康雄性Lewis大鼠與同源純種Fischer F344大鼠,體質量(200±30)g,由北京維通利華實驗動物技術有限公司提供。
2 主要試劑
兔抗CRH抗體為武漢博士德生物工程有限公司產品;免疫組化SP抗兔試劑盒為福州邁新生物有限公司產品; DAB試劑盒購自北京中杉金橋有限公司;大鼠去甲腎上腺素(norepinephrine, NE)、促腎上腺皮質激素(adrenocorticotropic hormone,ACTH )酶聯免疫吸附實驗(enzyme linked immunosorbent assay,ELISA)試劑盒均購自Bio-Rad;αh-CRH購自Sigma。
3 主要方法
3.1 側腦室插管及心衰模型制備 大鼠給予10% 水合氯醛(3 mL/kg)腹腔注射麻醉后,將頭部固定在腦立體定位儀上,確定插管位置(前囟:1.0 mm、中線:1.5 mm;垂直:3.5 mm)。用顱鉆輕輕穿透顱骨,然后將準備好的套管插入腦中,用牙脫粉在顱外固定插管。術后給予止痛藥。恢復2周后,大鼠給予10%水合氯醛(3 mL/kg)腹腔注射麻醉,口腔內氣管插管,連接動物呼吸機。四肢皮下插入心電監護電極,連接成都泰盟生物機能實驗系統(BL-410S)用于術前及術中心電監測。結扎左冠狀動脈前降支制備心衰模型;假手術組大鼠不實施冠脈結扎。術中監測標準Ⅱ導聯心電圖,出現ST段和/或T波抬高或降低,心臟局部顏色變白、室壁運動減弱等變化作為結扎成功的標志。并于頸背部埋置已充滿藥液的微型滲透泵(Alzet Model #1004;DURECT),而后連接至側腦室插管。術后給予止痛藥。
3.2 血流動力學測定和交感神經電活動記錄 大鼠給予烏拉坦(1.5 g/kg)腹腔注射麻醉,剪開頸部皮膚,分離頸部肌肉,暴露右側頸總動脈,插入自制的直徑約1 mm的抗凝硬塑管至主動脈,硬塑管另一端連接P-50壓力換能器,壓力信號輸入成都儀器廠生物機能實驗系統(BL-RM6240),觀察記錄動脈收縮壓、舒張壓和心率,然后進一步將導管深入到左心室內記錄左室舒張末壓(left ventricular end-diastolic pressure,LVEDP)、左室內壓最大上升速率(maximal rate of rise of left ventricular pressure,+dp/dtmax)和左室內壓最大下降速率(maximal rate of decline of left ventricular pressure,-dp/dtmax)。之后,手術暴露腎臟,游離腎交感神經并將其搭在雙極金屬電極上,記錄電活動,記錄過程中神經及電極浸在硅樹脂封閉液中。首先記錄腎交感神經在安靜狀態下的放電情況。在曲線運行區間,通過靜脈注射硝普鈉(100 μg/kg)[4]誘發腎交感神經放電的最高峰值。將基礎放電電壓與硝普鈉誘發的最高放電值之比作為統計學數據,對各組間腎交感神經活動(renal sympathetic nerve activity,RSNA)情況進行比較。
3.3 解剖學測量 血流動力學測定及腎交感神經電活動記錄結束后剪開胸壁暴露心臟,立即剪取心臟放入冷肝素生理鹽水中以沖洗血液,將心臟在濾紙上瀝干,用眼科剪剪取右心室并稱重,計算右室/體質量比(right ventricular-to-body weight ratio,RV/BW)。肺組織完整取下后用濾紙吸干表面血液并稱其重量,計算肺/體質量比(lung-to-body weight ratio,Lung/BW)。
3.4 酶聯免疫吸附實驗 采用通用型大鼠NE、ACTH ELISA試劑盒檢測大鼠血漿NE、ACTH的含量。檢測按照試劑盒說明書操作。
3.5 免疫組織化學染色 戊巴比妥鈉(30 mg/kg)腹腔注射麻醉大鼠,實施心臟灌流術(生理鹽水和2%多聚甲醛),取完整腦組織置于2%多聚甲醛中后固定5 h,然后轉移至0.01 mol/L磷酸鹽緩沖液配制的30%蔗糖溶液中浸泡2~3 d。固定好的腦組織用OCT混合物包埋,然后迅速冷凍,進行冰凍切片,切片厚度14 μm。免疫組化染色采用高靈敏度的鏈霉菌抗生物素蛋白-過氧化物酶連結(streptavidin-perosidase,S-P)法。顯微鏡下觀察、拍照。每張切片核團部位選取5個高倍視野(×400),對陽性神經元計數,然后取其均值(個/視野)作為結果。
4 動物分組及給藥 第一部分實驗采用SD大鼠:分為假手術組(SHAM+VEH組)、心衰模型組(HF+VEH組)和心衰模型給藥組(HF+αh-CRH組)。所有動物經側腦室滲透壓泵持續給藥4周,假手術組和心衰模型組給溶劑對照人工腦脊液(0.25 μL/h),心衰模型給藥組給CRH拮抗劑αh-CRH (15 mg/h)。實驗結束時,保證各組至少有12只動物存活,每組又隨機分成2組。一組經心臟灌注固定,進行免疫組織化學檢測。另一組監測血流動力學參數及記錄腎交感神經電活動之后,取血進行ELISA檢測,并摘取心臟和肺,計算RV/BW和Lung/BW。
第二部分實驗采用Lewis大鼠和Fisher 344大鼠:Lewis大鼠和Fisher 344大鼠均分別設假手術對照和心衰組,共4組。實驗結束時每組保證至少存活12只。同樣,每組又隨機分成兩組進行標本采集和指標測量(同第一部分實驗)。
5 統計學處理
應用SPSS 13.0統計軟件進行分析處理。數據以均數±標準差(mean±SD)表示,組間比較采用單因素方差分析, 以P<0.05為差異有統計學意義。
結 果
1 SD大鼠實驗結果
1.1 下丘腦室旁核CRH神經元激活指標 下丘腦室旁核內CRH免疫反應陽性染色呈棕黃色或棕褐色,主要定位于室旁核內側小細胞神經元胞漿內。HF+VEH與SHAM+VEH相比,CRH陽性神經元數目顯著增多,血漿ACTH含量升高(P<0.05)。HF+αh-CRH與HF+VEH組相比,CRH陽性神經元數目減少,ACTH含量明顯降低(P<0.05),見圖1。
1.2 交感神經興奮性指標 HF+VEH與SHAM+VEH相比,RSNA明顯增強,血漿NE含量升高(P<0.05)。HF+αh-CRH與HF+VEH組相比,RSNA減弱,NE含量降低(P<0.05),見圖2。
1.3 心功能指標 RV/BW、lung/BW和血流動力學參數LVEDP、±dp/dtmax結果見表1。HF+VEH與SHAM+VEH相比,RV/BW、lung/BW和LVEDP顯著增加, ±dp/dtmax明顯降低(P<0.05);HF+αh-CRH與HF+VEH相比,RV/BW、lung/BW和LVEDP比值降低(P<0.05), ±dp/dtmax增高(P<0.05)。
2 Lewis大鼠和Fisher 344大鼠實驗結果
2.1 下丘腦室旁核CRH神經元激活指標 Fisher 344大鼠,HF+VEH與SHAM+VEH相比,CRH陽性神經元數目顯著增多,血漿ACTH含量明顯升高(P<0.05)。Lewis大鼠,HF+VEH組大鼠與SHAM+VEH組相比,CRH陽性神經元數目及血漿ACTH含量均較低,且兩者之間差異無統計學顯著性,見圖3。
2.2 交感神經興奮性指標 Fisher 344大鼠,HF+VEH與SHAM+VEH相比,RSNA明顯增強,血漿NE含量升高(P<0.05)。Lewis大鼠,HF+VEH組與SHAM+VEH組相比,RSNA和血漿NE含量均無統計學顯著性,見圖4。
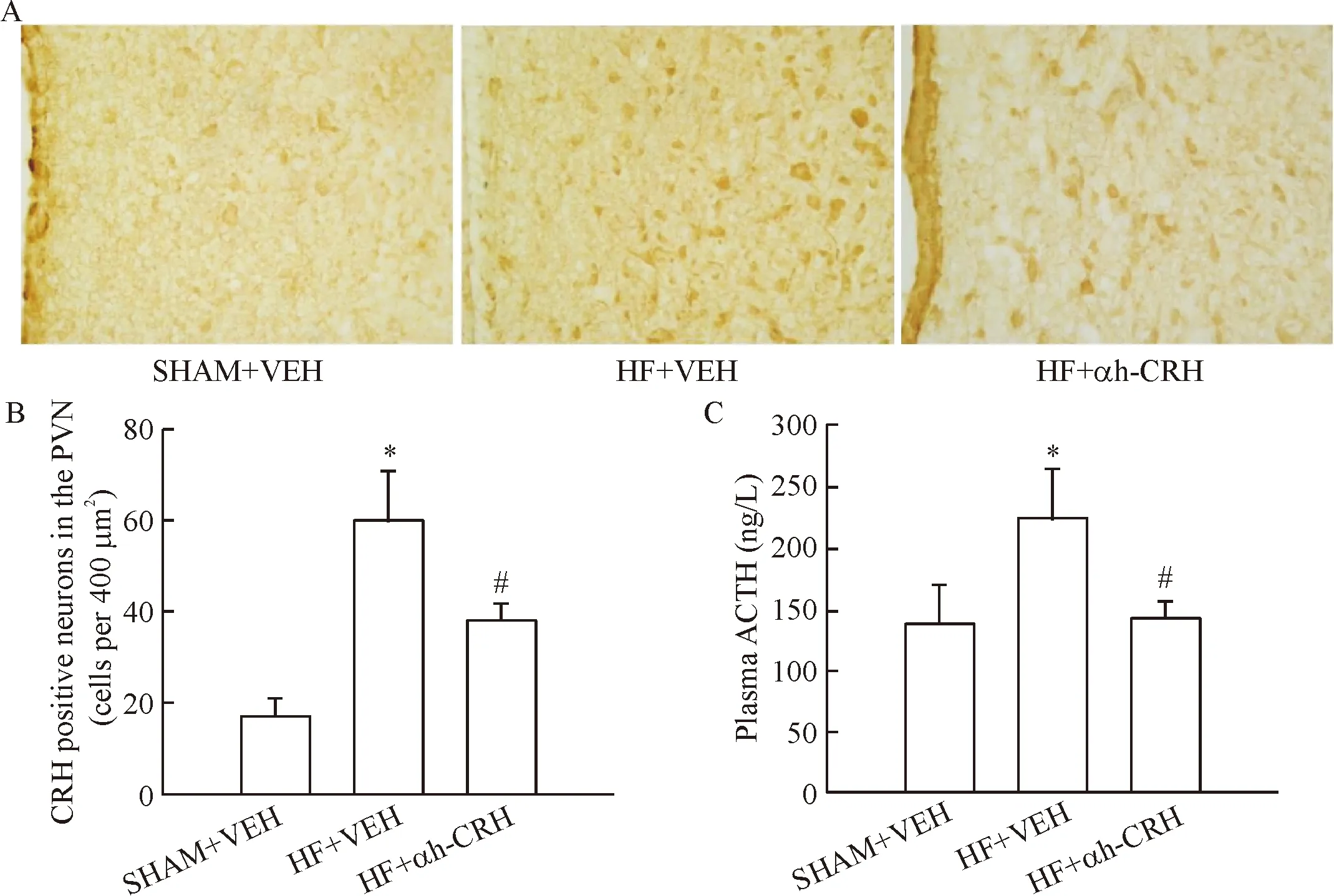
Figure 1.The CRH neuron activation within hypothalamic paraventricular nucleus (PVN) in the SD rats. A: immunohistochemistry for CRH expression in the PVN (DAB staining, ×400); B: the quantitative analysis of CRH positive neurons in the PVN; C: the quantitative analysis of the plasma adrenocorticotrophic hormone (ACTH) levels. Mean±SD.n=6.*P<0.05vsSHAM+VEH;#P<0.05vsHF+VEH.
圖1 SD大鼠下丘腦室旁核CRH神經元激活的結果
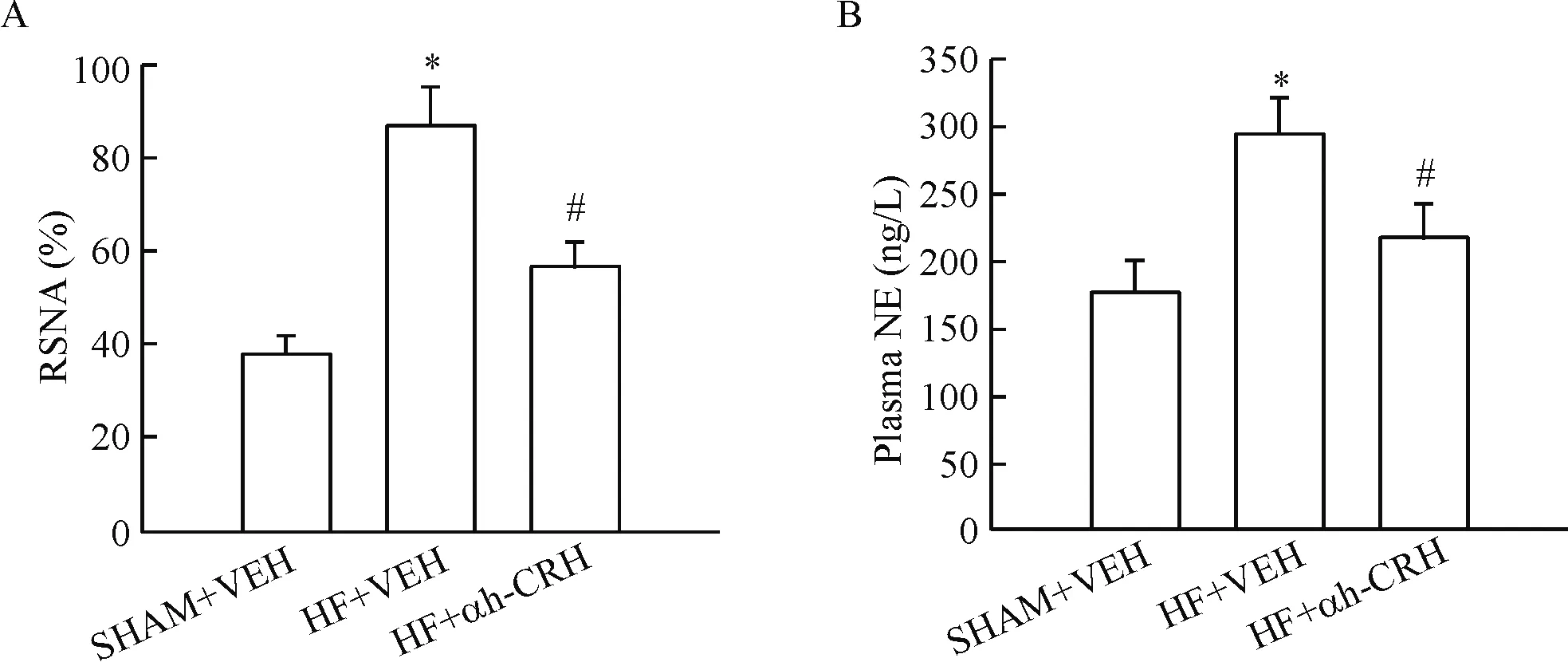
Figure 2.The sympathetic activity of the SD rats. A: the quantitative analysis of the renal sympathetic nerve activity (RSNA); B: the quantitative analysis of the circulating norepinephrine (NE) levels. Mean±SD.n=6.*P<0.05vsSHAM+VEH;#P<0.05vsHF+VEH.
圖2 SD大鼠交感神經興奮性的變化

表1 術后4周SD大鼠心功能指標變化
*P<0.05vsSHAM+VEH;#P<0.05vsHF+VEH.
2.3 心功能指標 Fisher 344大鼠,HF+VEH組大鼠RV/BW、lung/BW和LVEDP顯著高于SHAM+VEH組,±dp/dtmax明顯低于SHAM+VEH組(P<0.05)。Lewis大鼠,HF+VEH組大鼠RV/BW、lung/BW和LVEDP與SHAM+VEH組大鼠相比有所增加,但差異無統計學顯著性, ±dp/dtmax和SHAM+VEH組相比有所降低,差異也不具有統計學顯著性,見表2。
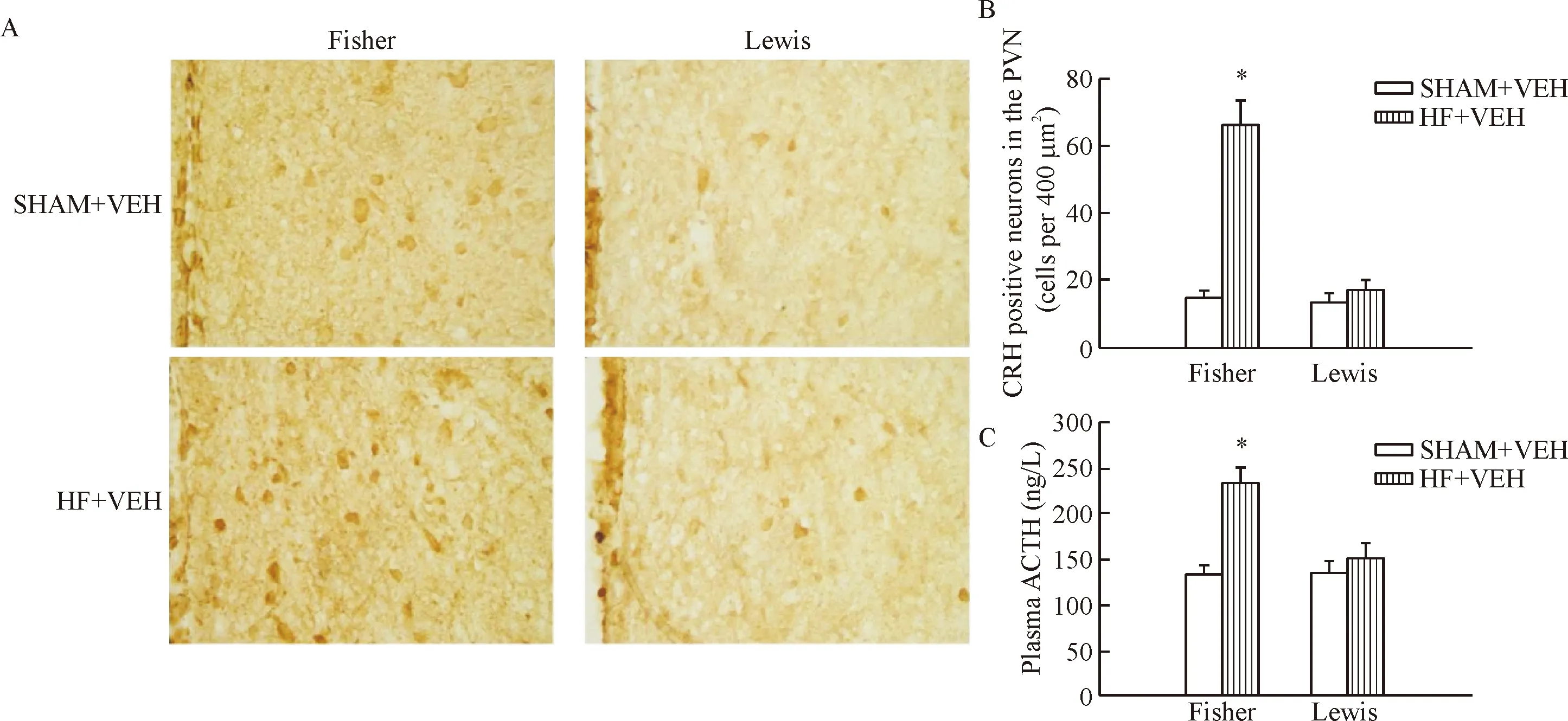
Figure 3.The CRH neuron activation within the hypothalamic paraventricular nucleus (PVN) in the Lewis and Fisher 344 (Fisher) rats. A: immunohistochemistry for CRH expression in the PVN (DAB staining, ×400); B: the quantitative analysis of CRH positive neurons in the PVN; C: the quantitative analysis of the plasma adrenocorticotrophic hormone (ACTH) level. Mean±SD.n=6.*P<0.05vsSHAM+VEH.
圖3 Lewis和Fisher 344大鼠下丘腦室旁核CRH神經元激活的比較研究
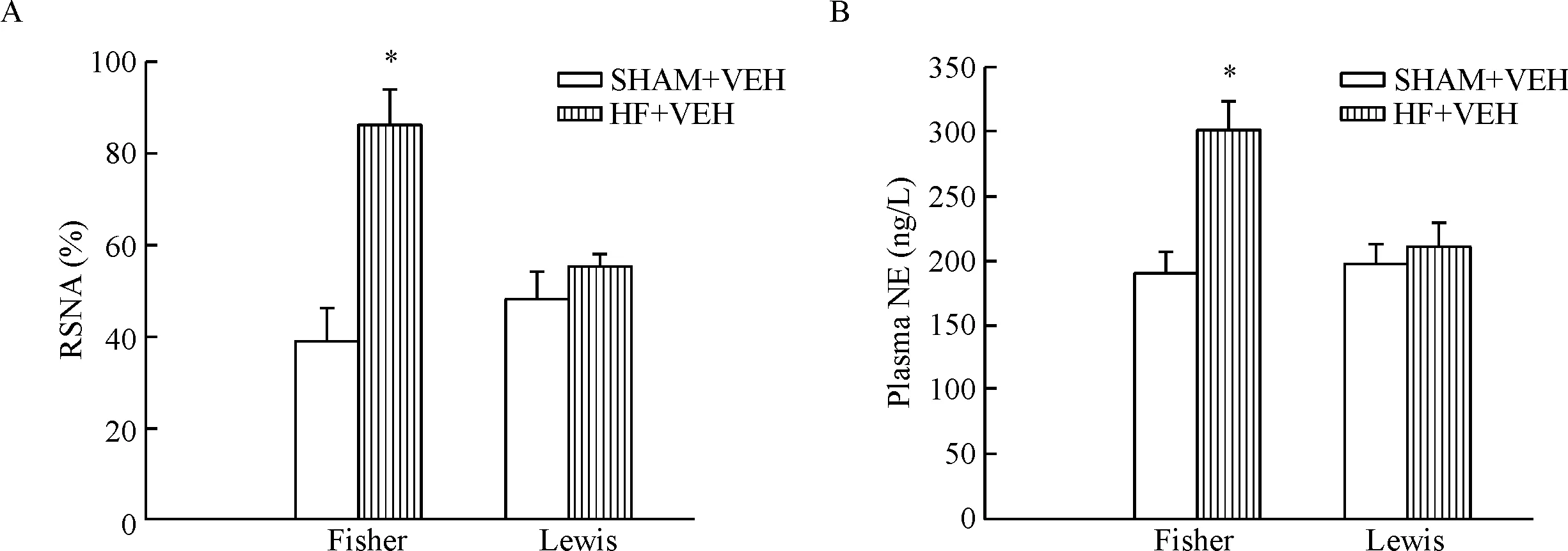
Figure 4.The sympathetic activity of the Lewis and Fisher 344 (Fisher) rats. A: the quantitative analysis of renal sympathetic nerve activity (RSNA). B: the quantitative analysis of circulating norepinephrine (NE) levels. Mean±SD.n=6.*P<0.05vsSHAM+VEH.
圖4 Lewis和Fisher 344大鼠的交感神經興奮性比較

表2 術后4周Lewis和Fisher 344大鼠心功能指標變化
*P<0.05vsSHAM+VEH.
討 論
多年來研究證實,交感神經興奮性增強是心力衰竭發生發展的重要因素。下丘腦室旁核是重要的心血管中樞和交感神經活動整合區。機體受到內外環境因素刺激后,PVN的小細胞神經元分泌多種激素,其中最重要的是CRH。PVN內的大多數CRH神經元投射到正中隆起,調節垂體ACTH的釋放,發揮神經內分泌功能;但還有一些CRH神經元直接投射到延髓頭端腹外側區(rostral ventrolateral medulla,RVLM)和脊髓灰質中間外側柱(intermedio-lateral column,IML),通過調節這些區域的交感節前神經元,發揮調節交感輸出的作用[2]。近期研究表明,給雄性大鼠靜脈注射葡萄糖可激活PVN內CRH神經元,后者可通過激活RVLM的酪氨酸羥化酶(去甲腎上腺素限速酶)神經元,進而激活外周交感神經[5]。本研究結果顯示,慢性心衰時,下丘腦室旁核CRH神經元被激活,外周交感神經活動增強,心功能惡化。心衰模型術后側腦室慢性給予CRH競爭性抑制劑αh-CRH可明顯逆轉以上各種表現。雖然多個研究證實,內源性CRH可以由杏仁核、海馬、藍斑及小腦內的一些神經元釋放,但含CRH的神經元胞體主要位于PVN的小細胞區[6]。
Lewis近交系大鼠是二十世紀五十年代初由Lewis博士從Wistar品系繁育而成。Fisher 344近交系大鼠(簡稱F344大鼠),1920年由哥倫比亞大學腫瘤研究所Curtis育成。Lewis和F344大鼠的下丘腦-垂體-腎上腺皮質(hypothalamic-pituitary-adrenocortical,HPA)軸功能存在組織相容性、遺傳性差別[7]。與F344相比,Lewis大鼠日間皮質醇(corticosterone, CORT)水平變化較鈍[8]。Lewis大鼠對于應激刺激顯示下丘腦反應缺陷,表現為下丘腦室旁核內CRH合成和分泌不足、垂體ACTH釋放降低以及腎上腺皮質產生CORT減少[9-10]。HPA軸功能缺陷,皮質類固醇產生降低,易感自身免疫性疾病。基于Lewis大鼠HPA軸功能缺陷的遺傳性特點,很多研究利用Lewis大鼠成功制備了相關自身免疫性疾病動物模型[11-12]。Lewis大鼠HPA軸不僅對免疫或炎癥刺激表現出低反應性,而且對于外環境中的刺激,比如疼痛性傷害也表現出低反應性[13]。F344大鼠HPA軸具有高反應性[8, 14],應用糖皮質激素受體拮抗劑RU 486或CRH拮抗劑αh-CRH后可使F344大鼠易患嚴重的炎癥性疾病,如類風濕性關節炎等[15]。由于Lewis和F344大鼠存在以上品系的遺傳性差別,因此,本研究中我們采用了Lewis和F344大鼠制作心衰模型及假手術對照來進一步驗證下丘腦室旁核CRH神經元在心力衰竭病理過程中所發揮的作用。
本研究結果顯示,F344心衰模型組大鼠和假手術對照組相比,下丘腦室旁核內CRH免疫陽性神經元數目明顯增多,外周血ACTH升高,伴有腎交感神經放電活動增強和外周血NE增加。相反地,Lewis大鼠心衰模型組和假手術對照組相比,下丘腦室旁核內CRH免疫陽性神經元數目雖略有增加,但不具有統計學意義;外周血ACTH含量的變化與下丘腦室旁核內CRH含量改變相一致。這個結果表明,冠脈結扎制作心衰模型并沒有引起Lewis大鼠下丘腦室旁核CRH神經元顯著性激活,這一點與以往關于Lewis大鼠下丘腦對應激原低反應性的報道相一致。Lewis心衰模型組大鼠除表現出HPA軸低反應性(CRH和ACTH水平)外,RSNA及血漿內NE水平也未出現象F344心衰大鼠一樣的顯著增高。以上結果提示,普通大鼠心衰時PVN內CRH神經元的激活至少部分參與了心衰時交感神經活動的增強。
心衰時交感神經系統的激活可通過多種途徑加重心功能的惡化。本研究中,F344心衰模型組大鼠和相應假手術對照組大鼠相比,除PVN內CRH活性增強(CRH免疫反應陽性神經元數目增多、血漿內ACTH增高)和交感神經活動增強(RSNA增強、血漿內NE增高)外,還伴有左室功能障礙,但以上表現并沒有在心衰模型Lewis大鼠身上出現。以上結果提示,心衰時下丘腦室旁核CRH神經元的激活可能通過增強交感神經活動,進而加重心功能的惡化。
對本部分實驗數據進行分析時還需要注意以下幾個問題:(1)冠脈結扎誘導心衰的Lewis大鼠能夠維持較好的心功能除了可能歸因于低的CRH反應性之外,也可能還有別的因素參與。以往的研究表明[16],Lewis大鼠的心冠狀動脈旋支多從常規的冠脈結扎位點之上分出(83%),因此按傳統結扎位點進行Lewis大鼠的冠脈結扎,支配左室側壁的血供多數可得以很好保留。而且,在Lewis大鼠,供應室間隔血液的室間支多起源于左主干(83%),左前降支結扎后使得大量血液通過室間支進入室間隔。因此,在常規位點對Lewis大鼠進行左冠狀動脈前降支結扎,雖然梗死面積較大,但心功能并不一定出現明顯的下降。(2)研究發現,和F344大鼠相比,Lewis大鼠更容易適應環境的變化[17],對于刺激容易作出快速反應,但對于多種刺激的習慣化也更快[18-19]。(3)Liu等[16]研究發現,Lewis大鼠冠脈結扎后1周時左室功能下降,2周時下降更為明顯,而當4周時心功能有所恢復甚至和假手術對照組相差并不很大,本實驗在冠脈結扎術4周時進行血流動力學及解剖學指標測定,一定程度上不能全面反映冠脈結扎后心功能的變化。
綜上所述,慢性心衰時下丘腦室旁核CRH神經元顯著激活,并可通過增強外周交感神經活動進而促進心功能的惡化。與同源純種Fisher 344大鼠相比,體內CRH合成不足的Lewis大鼠冠脈結扎后不但沒有出現明顯的下丘腦室旁核CRH神經元激活,而且外周交感神經活動增強現象也不明顯,同時心功能也得以很好保持。進一步證實了慢性心衰時下丘腦室旁核CRH神經元激活后可通過增強外周交感神經活動促進心功能惡化。
[1] Pyner S. The paraventricular nucleus and heart failure [J]. Exp Physiol, 2014, 99(2):332-339.
[2] Zhang ZH, Felder RB. Hypothalamic corticotrophin-releasing factor and norepinephrine mediate sympathetic and cardiovascular responses to acute intracarotid injection of tumour necrosis factor-alpha in the rat [J]. J Neuroendocrinol, 2008, 20(8):978-987.
[3] Wei SG, Yu Y, Weiss RM, et al. Endoplasmic reticulum stress increases brain MAPK signaling, inflammation and renin-angiotensin system activity and sympathetic nerve activity in heart failure [J]. Am J Physiol Heart Circ Phy-siol, 2016, 311(4):H871-H880.
[4] Liu JL, Irvine S, Reid IA, et al. Chronic exercise reduces sympathetic nerve activity in rabbits with pacing-induced heart failure: A role for angiotensin II [J]. Circulation, 2000, 102(15):1854-1862.
[5] Bardgett ME, Sharpe AL, Toney GM. Activation of corticotropin-releasing factor receptors in the rostral ventrolateral medulla is required for glucose-induced sympathoexcitation [J]. Am J Physiol Endocrinol Metab, 2014, 307(10):E944-E953.
[6] Korosi A, Baram TZ. The central corticotropin releasing factor system during development and adulthood [J]. Eur J Pharmacol, 2008, 583(2-3):204-214.
[7] Kosten TA, Ambrosio E. HPA axis function and drug addictive behaviors: insights from studies with Lewis and Fischer 344 inbred rats [J]. Psychoneuroendocrinology, 2002, 27(1-2):35-69.
[8] Dhabhar FS, McEwen BS, Spencer RL. Stress response, adrenal steroid receptor levels and corticosteroid-binding globulin levels--a comparison between Sprague-Dawley, Fischer 344 and Lewis rats [J]. Brain Res, 1993, 616(1-2):89-98.
[9] Sternberg EM, Glowa JR, Smith MA, et al. Corticotropin releasing hormone related behavioral and neuroendocrine responses to stress in Lewis and Fischer rats [J]. Brain Res, 1992, 570(1-2):54-60.
[10]壽旗揚, 張利棕, 蔡月琴, 等. Lewis 大鼠腎陽虛體質及其 HPA 軸功能失衡[J]. 中國比較醫學雜志, 2015, 25(9):8-13, 38.
[11]王青青, 苑海濤, 王玉林, 等. 大鼠自身免疫性心肌炎模型的建立 [J]. 中國病理生理雜志, 2007, 23(8):1658-1661.
[12]楊得獎, 葉 強, 王婷婷, 等. 嗅鞘細胞移植對大鼠實驗性自身免疫性腦脊髓炎的影響[J]. 中國病理生理雜志, 2010, 26(3):492-497.
[13]Le Coz GM, Fiatte C, Anton F, et al. Differential neuropathic pain sensitivity and expression of spinal mediators in Lewis and Fischer 344 rats [J]. BMC Neurosci, 2014, 15:35.
[14]Stohr T, Szuran T, Welzl H, et al. Lewis/Fischer rat strain differences in endocrine and behavioural responses to environmental challenge [J]. Pharmacol Biochem Behav, 2000, 67(4):809-819.
[15]Sternberg EM, Hill JM, Chrousos GP, et al. Inflammatory mediator-induced hypothalamic-pituitary-adrenal axis activation is defective in streptococcal cell wall arthritis-susceptible Lewis rats [J]. Proc Natl Acad Sci U S A, 1989, 86(7):2374-2378.
[16]Liu YH, Yang XP, Nass O, et al. Chronic heart failure induced by coronary artery ligation in Lewis inbred rats [J]. Am J Physiol, 1997, 272(2 Pt 2):H722-H727.
[17]Camp DM, Browman KE, Robinson TE. The effects of methamphetamine and cocaine on motor behavior and extracellular dopamine in the ventral striatum of Lewis versus Fischer 344 rats [J]. Brain Res, 1994, 668(1-2):180-193.
[18]Stohr T, Schulte Wermeling D, et al. Rat strain diffe-rences in open-field behavior and the locomotor stimulating and rewarding effects of amphetamine [J]. Pharmacol Biochem Behav, 1998, 59(4):813-818.
[19]Haile CN, Hiroi N, Nestler EJ, et al. Differential beha-vioral responses to cocaine are associated with dynamics of mesolimbic dopamine proteins in Lewis and Fischer 344 rats [J]. Synapse, 2001, 41(3):179-190.
(責任編輯: 林白霜, 余小慧)
Activation of corticotrophin releasing hormone-containing neurons in hypothalamic paraventricular nucleus contributes to sympathoexcitation in rats with congestive heart failure
GUO Yan-lin1, ZHANG Hua-ping2, YANG Cai-hong3, Lü Dou1, KANG Yu-ming4
(1DepartmentofPathology,2TranslationalMedicineResearchCenter,3DepartmentofPharmacology,ShanxiMedicalUniversity,Taiyuan030001,China;4DepartmentofPhysiologyandPathophysiology,Xi'anJiaotongUniversity,Xi'an710061,China.E-mail:gyl0725@sxmu.edu.cn)
AIM: To observe the expression of corticotropin releasing hormone (CRH) within the paraventricular nucleus of hypothalamus (PVN) and to explore the relationship between the activated CRH-containing neurons and sympathetic activity in rats with heart failure (HF). METHODS: Healthy male Sprague-Dawley (SD) rats were subjected to coronary artery ligation to induce HF, and chronic intracerebroventricular (ICV) infusion was performed by osmotic pump for 4 weeks. The rats in sham group and HF group were given vehicle (VEH; artificial cerebrospinal fluid 0.25 μL/h). The rats in HF plus treatment group were treated with CRH competitive inhibitor αh-CRH (15 mg/h). Meanwhile, the Lewis rats and Fischer 344 rats for control study also underwent coronary ligation to induce HF or sham surgery. After 4 weeks, left ventricular end-diastolic pressure (LVEDP) and maximum positive/negative change in pressure over time (±dp/dtmax) were determined. The right ventricular-to-body weight (RV/BW) and lung-to-body weight (lung/BW) ratios were calculated. The renal sympathetic nerve activity (RSNA) was recorded and the plasma norepinephrine (NE) level was measured. The expression of CRH in the PVN combined with the plasma adrenocorticotrophic hormone (ACTH) levels were measured. RESULTS: Compared with the sham-SD rats, the HF-SD rats had a greater number of CRH positive neurons in the PVN (accordingly the plasma ACTH levels were increased), accompanied by decreased ±dp/dtmaxand increased RSNA, plasma NE, LVEDP, lung/BW and RV/BW. However, ICV treatment with αh-CRH attenuated these changes in the HF-SD rats (P<0.05). Compared with the sham-Fisher 344 rats, the HF-Fisher 344 rats also had a greater number of CRH positive neurons in the PVN (accordingly the plasma ACTH levels were increased). In addition, they had significantly increased RSNA and plasma NE level, higher LVEDP, RV/BW and lung/BW, and lower ±dp/dtmax(P<0.05). Compared with the SHAM-Lewis rats, the HF-Lewis rats had not significantly changed in the above parameters. CONCLUSION: In CHF, the CRH-containing neurons in PVN are activated, thus aggravating cardiac function by increasing sympathoexcitation.
Chronic congestive heart failure; Paraventricular nucleus of hypothalamus; Corticotropin releasing hormone-containing neurons; Sympathetic nervous system; Lewis rat; Fisher 344 rat
1000- 4718(2017)07- 1219- 07
2016- 11- 28
2017- 03- 10
山西省自然科學基金資助項目(No. 2014011043-6); 山西醫科大學博士啟動基金項目(No. 03201101); 山西醫科大學基礎醫學院331基礎醫學科技培植基金項目(No. 201412)
R541.6+1; R363
A
10.3969/j.issn.1000- 4718.2017.07.011
雜志網址: http://www.cjpp.net
△通訊作者 Tel: 0351-4135642; E-mail: gyl0725@sxmu.edu.cn

