右美托咪定通過抑制內質網應激反應減輕肺缺血/再灌注小鼠腎損傷*
項冰倩, 高 慧, 樓國強, 郝卯林, 王萬鐵
(溫州醫科大學缺血/再灌注損傷研究所, 浙江 溫州 325035)
右美托咪定通過抑制內質網應激反應減輕肺缺血/再灌注小鼠腎損傷*
項冰倩, 高 慧, 樓國強, 郝卯林△, 王萬鐵△
(溫州醫科大學缺血/再灌注損傷研究所, 浙江 溫州 325035)
目的: 評價右美托咪定(dexmedetomidine,DEX)通過抑制內質網應激反應減輕小鼠肺缺血/再灌注(I/R)誘發腎損傷的機制。方法: 雄性健康SPF級C57BL/6J小鼠50只,體重20~24 g, 8~10周齡,隨機分為5組(n=10):假手術組(sham組)、I/R組、阿替美唑(atipamezole,Atip)組、DEX組和DEX+Atip組。采用小鼠在體左側肺門夾閉30 min再灌注180 min方法制備肺缺血/再灌注損傷(I/R)模型。Atip組、DEX組和DEX+Atip組分別在肺門阻斷前30 min腹腔注射Atip(250 μg/kg)、DEX(20 μg/kg)和DEX+Atip,其余處理同I/R組。再灌注結束后眼眶采血檢測血肌酐與尿素氮濃度,取腎組織光鏡下觀察腎細胞的形態學改變,檢測caspase-3的酶活性,TUNEL法檢測腎細胞凋亡指數,Western blot和RT-PCR檢測c-Jun氨基末端激酶(JNK)、caspase-12、CCAAT/增強子結合蛋白同源蛋白(CHOP)和葡萄糖調節蛋白78(GRP78)的蛋白及mRNA水平。結果: 與假手術組相比,其余組光鏡下腎組織有明顯損傷,血肌酐與尿素氮、腎細胞凋亡指數、caspase-3酶活性、JNK、caspase-12、CHOP和GRP78的蛋白及mRNA水平均升高(P<0.01)。與I/R、Atip組和DEX+Atip組相比,DEX組光鏡下可見腎細胞損傷減輕,血肌酐與尿素氮、腎細胞凋亡指數、caspase-3酶活性、JNK、caspase-12和CHOP表達均有下降,GRP78表達升高,差異有統計學意義(P<0.01)。結論: 右美托咪定預先給藥可減輕小鼠肺缺血/再灌注誘發的腎損傷,其機制可能與激動α2-腎上腺素能受體,抑制內質網過度應激有關。
右美托咪定; 缺血/再灌注損傷; 內質網應激; 細胞凋亡
肺缺血/再灌注(ischemia/reperfusion,I/R)損傷是圍手術期常見并發癥之一,多見于肺溶栓治療、肺移植、心肺聯合移植等手術治療。肺缺血/再灌注損傷常引發急性肺損傷,同時也伴隨遠隔器官的功能障礙和病理性損傷,如心臟、肝臟及腎臟等。腎臟毛細血管豐富,對肺I/R反應中的促炎因子較為敏感,使之容易發生急性腎損傷(acute kidney injury,AKI), 當肺I/R合并腎臟損傷時,可明顯增加死亡率。肺缺血再灌注引起的缺血、缺氧可誘發內質網應激(endoplasmic reticulum stress,ERS),適度的ERS可恢復細胞內環境穩態和維持細胞存活,但過度的ERS則會加重組織損傷。研究表明,內質網應激在缺血再灌注損傷中有重要作用,可誘發細胞凋亡[1-2]。
右美托咪定(dexmedetomidine,DEX)是高選擇性α2-腎上腺素能受體激動藥,我們前期的研究結果表明,肺臟缺血前給予右美托咪定可降低促炎介質和炎性因子,從而減輕肺的缺血/再灌注損傷,具有肺臟保護作用[3]。同時有研究證明右美托咪定對I/R損傷的心臟、腦、肝臟、腸等也具有一定的保護作用[4-8]。但右美托咪定對肺缺血/再灌注致遠隔腎損傷的影響仍有待探討。本實驗旨在研究右美托咪定能否通過抑制內質網應激來減輕小鼠肺缺血/再灌注誘發腎損傷,為臨床防治肺I/R引起的遠隔器官損傷提供新治療思路與方法。
材 料 和 方 法
1 動物
雄性健康SPF級C57BL/6J小鼠50只,體重20~24 g, 8~10周齡,由溫州醫科大學實驗動物中心提供,合格證編號為SYXK(浙)2012-075。
2 主要試劑
氯胺酮(福建古田藥業有限公司);塞拉嗪(吉林長春華牧有限公司);阿替美唑(atipamezole,Atip)和DEX(江蘇恒瑞制藥有限公司);BCA試劑盒和caspase-3活性檢測試劑盒(碧云天生物技術研究所);TUNEL凋亡試劑盒(Roche);本實驗中所用I抗均購自Cell Signaling Technology, II 抗均購自杭州至賢生物科技有限公司。
3 主要方法
3.1 實驗分組 實驗動物按隨機數字表法分為5組(n=10):假手術組(sham組)、肺缺血/再灌注損傷組(I/R組)、肺缺血/再灌注+阿替美唑組(Atip組)、肺缺血/再灌注+右美托咪定組(DEX組)和肺缺血/再灌注+右美托咪定+阿替美唑(DEX+Atip組)。
3.2 肺缺血/再灌注模型的制備 依據文獻采用C57BL/6J小鼠在體左側肺門夾閉制備I/R模型[9]。100 mg/kg氯胺酮+10 mg/kg塞拉嗪聯合腹腔注射進行麻醉,消毒胸頸部皮膚后切開并分離皮下組織和肌肉,暴露氣管行T型切開,氣管插管后接呼吸機行機械通氣,呼吸機參數為吸呼比 2∶3、呼吸頻率120次/分、100%氧濃度、潮氣量0.6~0.8 mL/min。于左胸部3~5肋間處開胸并游離左側肺門,動脈夾阻斷左肺門,30 min后恢復血流再灌注180 min。灌注結束后處死小鼠并取腎組織。Sham組小鼠僅開胸不夾閉肺門,機械通氣210 min; I/R組小鼠左肺門阻斷30 min,再灌注180 min; Atip組、DEX組和DEX+Atip組小鼠分別在肺門阻斷前30 min腹腔注射阿替美唑(250 μg/kg)、右美托咪定(20 μg/kg)和右美托咪定+阿替美唑,其余處理同I/R組。
3.3 光鏡下腎組織的形態學觀察 取出腎組織后,取約0.5 cm3大小腎組織,經4%多聚甲醛固定數天后石蠟包埋切片,HE染色后光鏡下觀察各組標本組織學改變 。
3.4 血清肌酐及尿素氮濃度的檢測 實驗結束后取血液,離心后取血清,用COBAS全自動生化分析儀測定血清肌酐值和尿素氮值。
3.5 TUNEL 法檢測腎細胞凋亡指數 取血結束后處死小鼠,分離出腎臟并用無菌PBS漂洗,經4%多聚甲醛固定,依次經脫水、浸蠟、石蠟包埋、切片、烘烤固定制成腎組織切片,再依次經二甲苯、無水乙醇、95%、90%、85%、80%和75%乙醇脫水、PBS漂洗后加入蛋白酶K溶液去除組織蛋白,蒸餾水漂洗。按TUNEL試劑盒說明書進行操作,光學顯微鏡(×400)下觀察腎細胞凋亡情況。細胞核呈現棕黃色為凋亡細胞。每張切片隨機選擇10個視野并記錄總細胞數和凋亡細胞數,計算凋亡指數(%)=凋亡細胞數÷總細胞數×100%。
3.6 Caspase-3酶活性的檢測 按每3~10 mg腎組織加入100 μL裂解液的比例加入裂解液,冰上研磨成勻漿,轉移到1.5 mL離心管中冰上裂解5 min。4 ℃、20 000 r/min離心10~15 min后轉移上清液,按照caspase-3活性檢測試劑盒操作說明書進行操作,采用分光光度計法檢測腎組織中caspase-3酶活性。
3.7 RT-PCR檢測腎組織c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)、葡萄糖調節蛋白78(glucose-regulated protein 78,GRP78)、caspase-12和CCAAT/增強子結合蛋白同源蛋白(CCAAT/enhancer-binding protein homologous protein, CHOP)的mRNA表達水平 取小鼠腎組織加液氮冰上研磨,以Trizol法提取總RNA并測定RNA濃度,按照RT-PCR試劑盒(Thermo)說明書進行cDNA合成及擴增。PCR參數: 94 ℃ 3 min; 94 ℃ 30 s, 56 ℃ (JNK)、58 ℃ (caspase-12)、54 ℃ (CHOP)、49 ℃ (GRP78) 或58 ℃ (GAPDH) 30 s, 72 ℃ 1 min, 循環33次; 72 ℃ 5 min。RT-PCR以GAPDH為內參照。引物序列見表1。結果用Quantity One分析。以目的基因條帶灰度值和內參照GAPDH條帶灰度值的比值反映其表達水平。
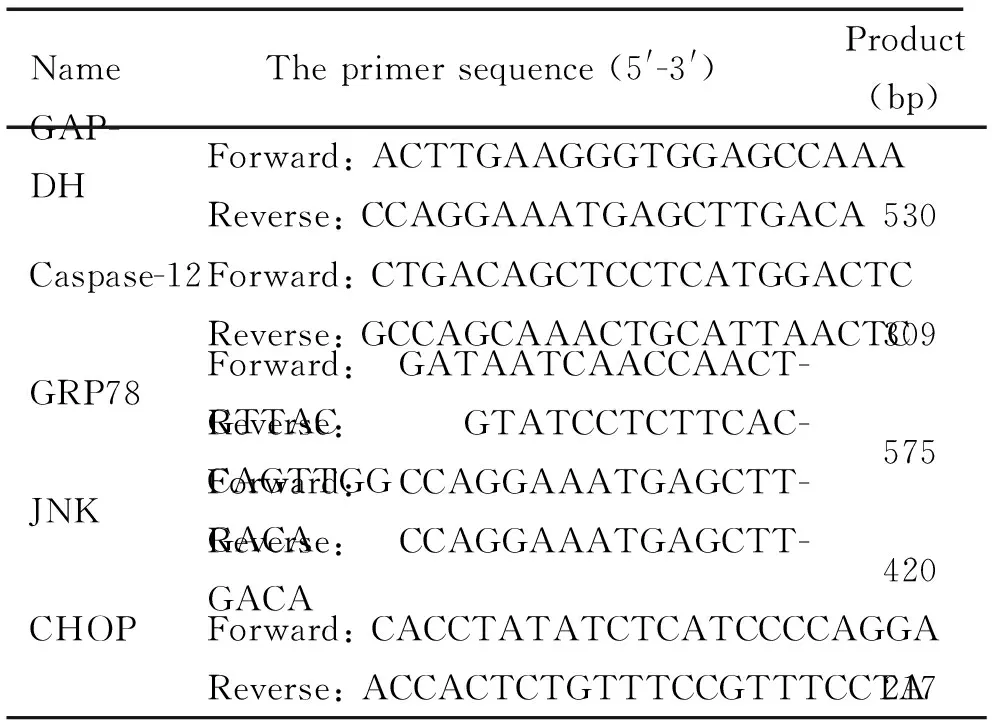
表1 PCR引物序列
3.8 Western blot 檢測腎組織p-JNK、 GRP78、caspase-12和CHOP的蛋白水平 冰上研磨腎組織,加入400 μL RIPA冰中裂解組織20 min,吸取勻漿液4 ℃離心取上清,BCA蛋白定量試劑盒測蛋白濃度并繪標準曲線,隨后100 ℃煮沸10 min使蛋白變性。配膠進行電泳、轉膜,5%脫脂奶粉室溫封閉2 h,TBST漂洗后分別加 I 抗(p-JNK、JNK和GRP78 均以1∶1 000稀釋;GAPDH和caspase-12以1∶500稀釋,CHOP以1∶300稀釋)4 ℃孵育過夜,TBST洗滌3次后加 II抗室溫孵育1 h,再次TBST洗滌,加ECL工作液反應3 min,暗室曝光,Quantity One軟件分析蛋白吸光度值。取目的蛋白條帶吸光度值和內參照條帶吸光度值的比值。計算p-JNK與JNK的比值,以反映p-JNK蛋白的水平。
4 統計學處理
使用SPSS 19.0軟件分析,計量資料行正態性檢驗,實驗數據以均數±標準差(mean±SD)表示。組間比較采用單因素方差分析,多組樣本的均數比較先行方差齊性檢驗,方差齊者,兩兩比較行SNK-q檢驗,方差不齊者行Duunet’s檢驗,以P<0.05為差異有統計學意義。
結 果
1 光鏡下各腎組織形態學變化
光鏡下sham組腎小球和腎小管結構清晰可見,未見明顯異常。I/R組、Atip組和DEX+Atip組的腎小球輪廓基本清楚,腎小管排列較為疏松、紊亂,上皮細胞明顯腫脹,部分出現空泡變性,部分腎小管管腔擴張,間質水腫。DEX組的腎組織損傷減輕,腎小球和腎小管輪廓清晰,上皮細胞水腫程度減輕。見圖1。
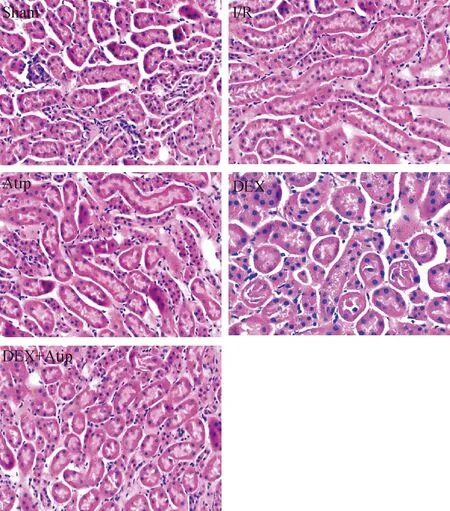
Figure 1.The histological changes of renal tissues in each group (HE staining, ×200).
圖1 光鏡下各組腎組織形態學變化
2 各組血肌酐及尿素氮濃度變化
與sham組相比,其余4組的血清肌酐及尿素氮均有升高(P<0.01);與I/R組相比,Atip組和DEX+Atip組無明顯差異,DEX組血肌酐及尿素氮均有下降(P<0.01)。與Atip組比較,DEX組明顯下降(P<0.01),而DEX+Atip組的差異無統計學顯著性;與DEX組相比,DEX+Atip組的血肌酐及尿素氮水平升高(P<0.01),見表2。
表2 各組血肌酐、尿素氮濃度、腎組織caspase-3酶活性及腎細胞凋亡指數的變化
Table 2.The changes of serum creatinine (SCr), blood urea nitrogen (BUN), renal caspase-3 enzymatic activity and apoptotic index of renal cells (Mean±SD.n=10)

GroupSCr(μmol/L)BUN(mmol/L)Caspase-3enzymaticactivityApoptoticindexofrenalcells(%)Sham22.4±3.47.6±2.039.8±5.57.9±2.5I/R39.8±2.1**19.0±2.2**104.1±8.0**58.9±3.7**Atip39.3±1.919.2±2.6105.5±7.958.5±4.6DEX28.8±2.3##△△13.4±1.8##△△81.7±4.1##△△40.5±3.8##△△DEX+Atip39.1±2.5▲▲19.2±2.4▲▲108.9±8.8▲▲61.1±3.3▲▲
**P<0.01vssham group;##P<0.01vsI/R group;△△P<0.01vsAtip group;▲▲P<0.01vsDEX group.
3 各組腎細胞凋亡指數的變化
與sham組相比,其余4組的腎細胞凋亡率均有升高(P<0.01);與I/R組相比,Atip組和DEX+Atip組差異無統計學顯著性,DEX組的腎細胞凋亡指數下降(P<0.01)。與Atip組比較,DEX組的腎細胞凋亡指數明顯下降(P<0.01),而DEX+Atip組的差異無統計學顯著性;與DEX組相比,DEX+Atip組的腎細胞凋亡指數升高(P<0.01),見圖2、表2。
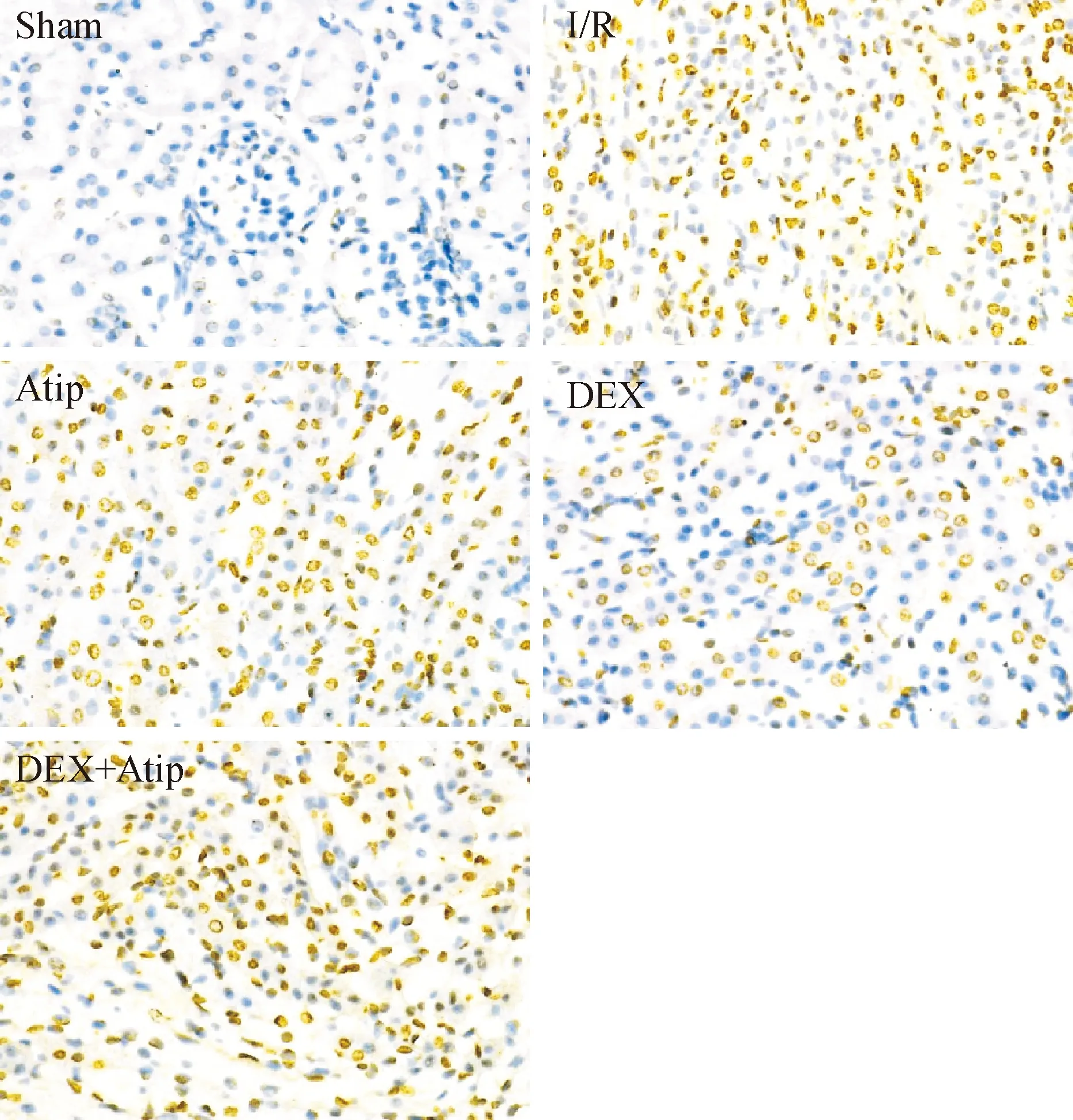
Figure 2.The apoptosis of the renal cells in each group detected by TUNEL (×400)
圖2 TUNEL法檢測各組腎細胞凋亡情況
4 各組腎組織caspase-3酶活性的變化
與sham組相比,其余4組的caspase-3酶活性均有升高(P<0.01); Atip組和DEX+Atip組與I/R組相比差異無統計學顯著性,DEX組的caspase-3酶活性與I/R組相比顯著下降(P<0.01)。與Atip組比較,DEX組的caspase-3酶活性明顯下降(P<0.01),DEX+Atip組與Atip組比較差異無統計學顯著性;與DEX組相比,DEX+Atip組的caspase-3酶活性升高(P<0.01),見表2。
5 各腎組織p-JNK、caspase-12、CHOP和GRP78的蛋白水平
與Sham 相比,其余各組p-JNK、caspase-12、CHOP和GRP78的蛋白水平均明顯升高(P<0.01); Atip組和DEX+Atip組與I/R組相比差異無統計學顯著性,DEX組的p-JNK、caspase-12和CHOP蛋白水平下降(P<0.01),GRP78蛋白水平升高(P<0.01)。與Atip組比較,DEX組的p-JNK、caspase-12和CHOP蛋白水平明顯下降(P<0.01),GRP78蛋白水平升高(P<0.01),DEX+Atip組與Atip組比較差異無統計學顯著性;與DEX組相比,DEX+Atip組的p-JNK、caspase-12和CHOP蛋白水平升高(P<0.01),但GRP78蛋白水平無顯著改變,見圖3~6。
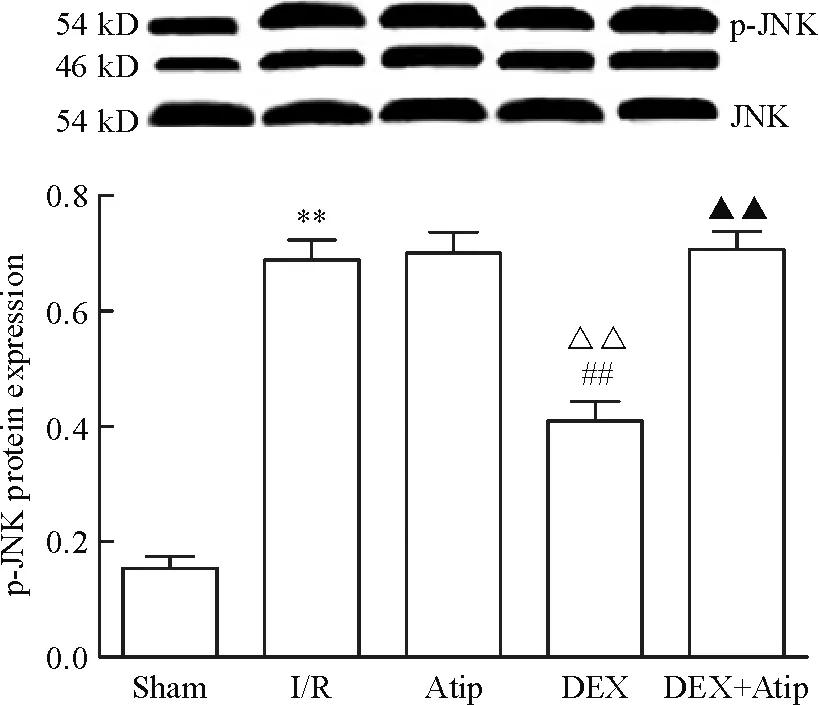
Figure 3.The protein level of p-JNK in each group. Mean±SD.n=10.**P<0.01vssham group;##P<0.01vsI/R group;△△P<0.01vsAtip group;▲▲P<0.01vsDEX group.
圖3 各組p-JNK蛋白水平的比較
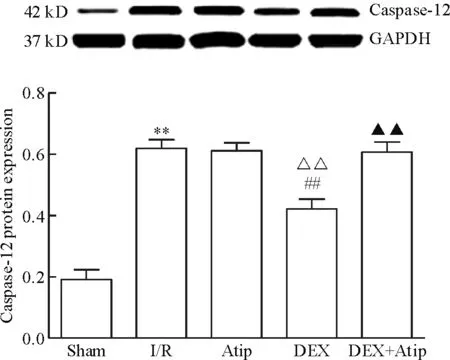
Figure 4.The protein expression level of caspase-12 in each group. Mean±SD.n=10.**P<0.01vssham group;##P<0.01vsI/R group;△△P<0.01vsAtip group;▲▲P<0.01vsDEX group.
圖4 各組caspase-12蛋白表達量的變化
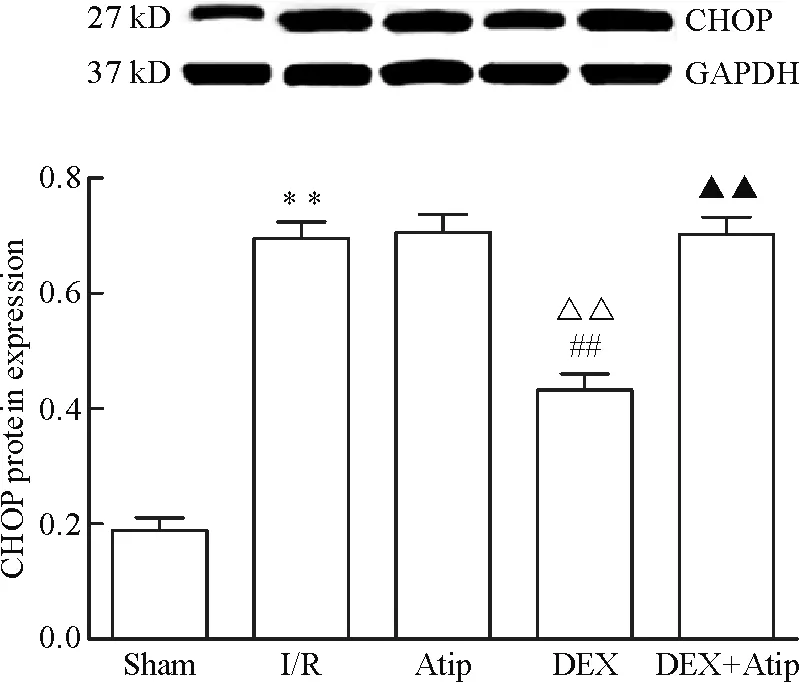
Figure 5.The protein expression level of CHOP in each group. Mean±SD.n=10.**P<0.01vssham group;##P<0.01vsI/R group;△△P<0.01vsAtip group;▲▲P<0.01vsDEX group.
圖5 各組CHOP蛋白表達量的變化
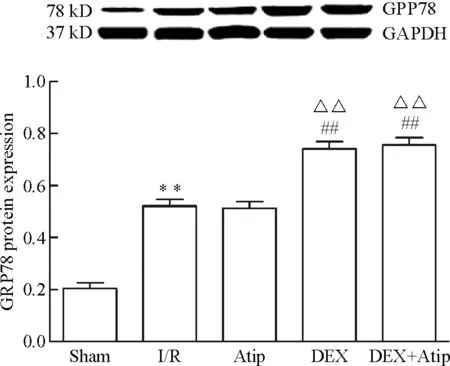
Figure 6.The protein expression of GRP78 in each group. Mean±SD.n=10.**P<0.01vssham group;##P<0.01vsI/R group;△△P<0.01vsAtip group.
圖6 各組GRP78蛋白表達量的變化
6 各腎組織JNK、caspase-12、CHOP和GRP78 mRNA表達水平
與sham相比,其余各組JNK、caspase-12、CHOP和GRP78的mRNA水平均明顯升高(P<0.01); Atip組和DEX+Atip組與I/R組相比的差異無統計學顯著性,DEX組JNK、caspase-12和CHOP的mRNA水平下降(P<0.01),GRP78的mRNA水平升高(P<0.01)。與Atip組比較,DEX組的JNK、caspase-12和CHOP的mRNA水平明顯下降(P<0.01),GRP78的mRNA水平升高(P<0.01),DEX+Atip組與Atip組比較差異無統計學顯著性;與DEX組相比,DEX+Atip組JNK、caspase-12和CHOP的mRNA水平升高(P<0.01),GRP78的mRNA水平無變化,見圖7~10。
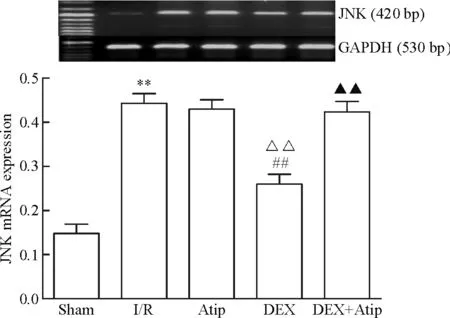
Figure 7.The mRNA expression level of JNK in each group. Mean±SD.n=10.**P<0.01vssham group;##P<0.01vsI/R group;△△P<0.01vsAtip group;▲▲P<0.01vsDEX group.
圖7 各組JNK的mRNA表達水平
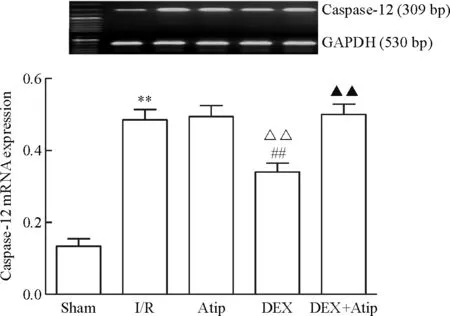
Figure 8.The mRNA expression level of caspase-12 in each group. Mean±SD.n=10.**P<0.01vssham group;##P<0.01vsI/R group;△△P<0.01vsAtip group;▲▲P<0.01vsDEX group.
圖8 各組caspase-12的mRNA表達水平
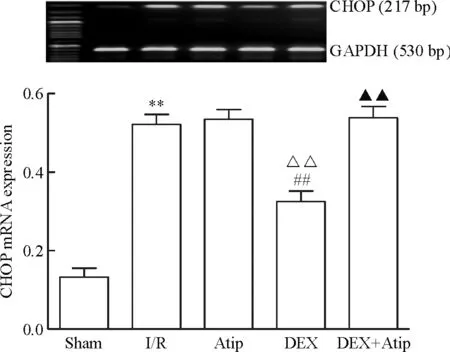
Figure 9.The mRNA expression level of CHOP in each group. Mean±SD.n=10.**P<0.01vssham group;##P<0.01vsI/R group;△△P<0.01vsAtip group;▲▲P<0.01vsDEX group.
圖9 各組CHOP的mRNA表達水平
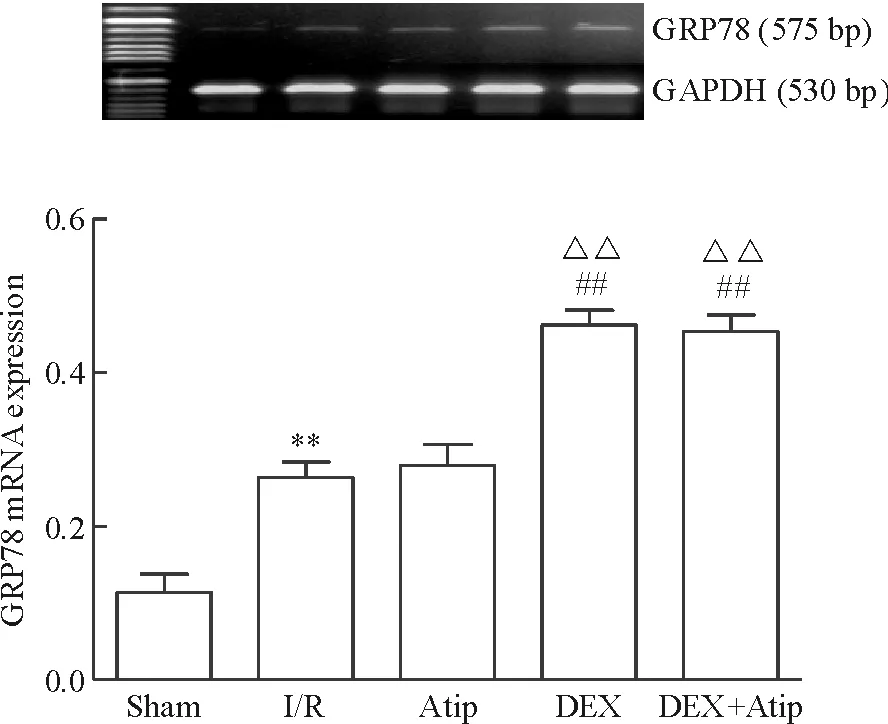
Figure 10.The mRNA expression level of GRP78 in each group. Mean±SD.n=10.**P<0.01vssham group;##P<0.01vsI/R group;△△P<0.01vsAtip group.
圖10 各組GRP78的mRNA表達水平
討 論
右美托咪定為高選擇性α2-腎上腺素能受體激動藥,能夠激活膽堿能抗炎通路,具有抗炎、器官保護作用[10];作用于中樞神經系統的α2-腎上腺素能受體時,可使細胞產生超極化,進而抑制神經元的放電,阻斷了疼痛信號向大腦傳導,產生鎮靜、鎮痛、抗焦慮和抑制交感活動、間接提高迷走神經張力的效應,其它作用還包括抗寒戰、止涎和利尿等[11-12]。常用于血管疾病患者圍手術期的輔助麻醉與鎮靜鎮痛,有很好的圍術期器官保護作用,能有效改善術中缺血對器官的損傷[13]。
器官缺血/再灌注時細胞內信號轉導涉及多條途徑, 其中內質網應激和JNK信號轉導通路在臟器I/R中起重要作用[1]。ATP耗竭、缺血缺氧、氧化應激、葡萄糖/營養物質匱乏等均可引起ERS, 適度的ERS對機體起保護作用,但持續過強ERS將導致細胞凋亡[14-15]。本實驗檢測的4種蛋白JNK、caspas-12、CHOP和GRP78為內質網應激相關蛋白。其中GRP78是一種位于內質網內的鈣離子結合分子伴侶,當細胞受到外界刺激發生ERS時,細胞內會產生大量錯誤折疊或未折疊蛋白蓄積,此時GRP78也會大量表達從而與ER中錯誤折疊和未折疊蛋白結合,維持內環境穩定。因此,GRP78的急速上調被認為是ERS 最敏感的標志物[16-17]。JNK信號轉導通路是MAPKs信號通路中重要的通路之一,與應激誘導型凋亡有關,可被多種細胞外應激激活而引起細胞凋亡。有研究表明,在臟器I/R損傷過程中JNK發生過度激活,而在缺血或再灌注前抑制JNK激活可明顯減少細胞凋亡,減輕臟器I/R損傷[18-20]。Caspase-12廣泛存在于小鼠的各組織中,是ERS的主要凋亡信號分子之一,內質網內鈣離子平衡的失調或者內質網蛋白積累過多都會導致caspase-12的表達,最終導致細胞凋亡的發生[21-22]。CHOP又稱生長停滯及DNA損傷誘導蛋白153(growth arrest and DNA damage-inducible protein 153,GADD153),是一個特異性的內質網應激轉導因子,是促凋亡的重要信號分子,在正常情況下表達水平很低,而在ERS時,其表達量大大增加,被認為是內質網應激的標志物[23-24]。細胞凋亡通過線粒體途徑被激活,釋放線粒體促凋亡蛋白及凋亡誘導因子(apoptosis-inducing factor,AIF)等,激活caspase級聯反應,誘發細胞凋亡,表現為caspase-3凋亡蛋白酶活性升高。
研究結果顯示,與假手術組相比,其余4組JNK、caspase-12、CHOP和GRP78的mRNA及蛋白、caspase-3凋亡蛋白酶、血肌酐和尿素氮以及腎細胞凋亡指數均呈上升趨勢,光鏡下腎小管有不同程度的水腫,腎細胞均有損傷性的變化,說明肺I/R的確引發腎組織發生過度ERS反應,使ERS相關蛋白表達上升,并通過線粒體途徑誘發細胞凋亡引起腎組織的損傷;I/R組和Atip組相比,以上檢測指標均無明顯差異,說明阿替美唑對肺I/R誘發的腎損傷沒有拮抗作用。與I/R組相比,DEX組的JNK、caspase-12、CHOP水平、caspase-3凋亡蛋白酶活性、血肌酐和尿素氮以及腎細胞凋亡指數均有下降,光鏡下腎細胞水腫和損傷性變化減輕,說明DEX可能通過抑制內質網過度應激反應降低JNK、caspase-12和CHOP的水平,同時使腎細胞凋亡數量減少,從而減輕肺I/R誘發的腎損傷,對腎組織起保護作用。而通過DEX組與DEX+Atip組比較,我們發現右美托咪定對腎組織的保護作用能被選擇性α2-腎上腺素受體阻滯劑阿替美唑所阻斷,表現為DA組的JNK、caspase-12、CHOP蛋白水平與caspase-3凋亡蛋白酶活性、血肌酐和尿素氮以及腎細胞凋亡指數均呈上升趨勢,光鏡下腎組織損傷加重,提示右美托咪定減輕肺I/R誘發的腎損傷的作用可能與激動α2-腎上腺素能受體有關。
綜上所述,肺缺血/再灌注前給予右美托咪定可減輕肺缺血/再灌注誘發的腎損傷,其機制可能與其通過激動α2-腎上腺素能受體,抑制內質網過度應激有關。
[1] 郝卯林, 趙 珊, 陳海娥, 等. siRNA沉默過度內質網應激下JNK基因在缺血/再灌注肺損傷中的作用[J]. 中國應用生理學雜志, 2014, 30(1):48-53.
[2] Zhang ZZ, Tong NT, Gong YY, et al. Valproate protects the retina from endoplasmic reticulum stress-induced apoptosis after ischemia-reperfusion injury[J]. Neurosci Lett, 2011, 504(2):88-92.
[3] 羅梓垠, 郭長滿, 項冰倩, 等. 右美托咪定對肺缺血/再灌注損傷小鼠內質網應激相關分子caspase-12表達的影響[J]. 中國應用生理學雜志, 2016, 32(2):164-168.
[4] 張 莉,張 勇,唐 曉,等. 右美托咪定對腎缺血再灌注誘發大鼠心肌損傷的影響[J]. 中華麻醉學雜志, 2014, 34(8):1017-1019.
[5] Ibacache M, Sanchez G, Pedrozo Z, et al. DEX medetomidine preconditioning activates pro-survival kinases and attenuates regional ischemia/reperfusion injury in rat heart[J]. Biochim Biophys Acta, 2012, 1822(4):537-545.
[6] Kili? K, Hanci V, Selek S, et al. The effects of dexmedetomidine on mesenteric arterial occlusion-associated gut ischemia and reperfusion-induced gut and kidney injury in rabbits[J]. J Surg Res, 2012, 178(1):223-232.
[7] Tüfek A, Tokg?z O, Aliosmanoglu I, et al. The protective effects of dexmedetomidine on the liver and remote organs against hepatic ischemia reperfusion injury in rats[J]. Int J Surg, 2013, 11(1):96-100.
[8] Ali K, Metin I, Unal I, et al. An investigation about the inhibition of acute ischemia/reperfusion damage by dexmedetomidine in rat ovarian tissue[J]. Gynecol Endocrinol, 2013, 29(3):222-225.
[9] 萬占海, 張 紅, 冷玉芳, 等. 右美托咪定對大鼠肺缺血再灌注損傷的影響[J].中華麻醉學雜志, 2014, 34(9):1066-1068.
[10]Mantz J, Josserand J, Hamada S. Dexmedetomidine: new insights[J]. Eur J Anaesthesiol, 2011, 28(1):3-6.
[11]崔云鳳, 宋智敏, 周 姝, 等. 右美托咪定輔舒芬太尼用于全麻病人的術后鎮痛[J]. 中國實驗診斷學, 2013, 17(2):321-323.
[12]Luan HF, Zhao ZB, Feng JY, et al. Prevention of etomidate-induced myoclonus during anesthetic induction by pretreatment with dexmedetomidine[J]. Braz J Med Biol Res, 2015, 48(2):186-190.
[13]Gertler R, Brown HC, Mitchell DH, et al. Dexmedetomidine: a novel sedative-analgesic agent[J]. Proc (Bayl Univ Med Cent), 2001, 14(1):13-21.
[14]Yousefi H, Ahmadiasl N, Alihemmati A, et al. Effect of renal ischemian-reperfusion on lung injury and inflammatory responses in male rat[J]. Iran J Basic Med Sci, 2014, 17(10):802-807.
[15] 鄭 倩, 劉 紅, 劉 華, 等. 果糖二磷酸鈉對2型糖尿病大鼠胰島內質網應激時CHOP和JNK表達及胰島細胞凋亡的影響[J]. 中國病理生理雜志, 2012, 28(4):733-737.
[16]Wu H, Tang Q, Yang J, et al. Atorvastain ameliorates myocardial ischemia/reperfusion injury through attenuation of endoplasmic reticulum stress-induced apoptosis[J]. Int J Clin Exp Med, 2014, 7(12):4915-4923.
[17]Ye Z, Wang N, Xia P, et al. Parecoxib suppresses CHOP and Foxo1 nuclear translocation, but increases GRP78 le-vels in a rat model of focal ischemia[J]. Neurochem Res, 2013, 38(4):686-693.
[18]Bogoyevitch MA, Ngoei KR, Zhao TT, et al. c-Jun N-terminal kinase (JNK) signaling: recent advances and challenges[J]. Biochim Biophys Acta, 2010, 1804(3):463-475.
[19]Ishii M, Suzuki Y, Takeshita K, et al. Inhibition of c-Jun NH2-terminal kinase activity improves ischemia/reperfusion injury in rat lungs[J]. J Immunol, 2004, 172(4):2569-2577.
[20]趙 珊, 馬迎春, 劉亞坤, 等. 姜黃素通過抑制內質網應激和JNK通路過度活化減輕小鼠肺缺血再灌注損傷[J]. 中國病理生理雜志, 2013, 29(2):308-313.
[21]Poone GK, Hasseldam H, Munkholm N, et al. The hypothermic influence on CHOP and Ero1-α in an endoplasmic reticulum stress model of cerebral ischemia[J]. Brain Sci, 2015, 5(2):178-187.
[22]Lakshmanan AP, Thandavarayan RA, Palaniyandi SS, et al. Modulation of AT-1R/CHOP-JNK-Caspase12 pathway by olmesartan treatment attenuates ER stress-induced renal apoptosis in streptozotocin-induced diabetic mice[J]. Eur J Pharm Sci, 2011, 44(5):627-634.
[23]Oyadomari S, Mori M. Roles of CHOP/GADD153 in endoplasmic reticulum stress[J]. Cell Death Differ, 2004, 11(4):381-389.
[24]杜錫潮, 韓 冰, 謝汝佳, 等. 肝纖維化大鼠肝臟中內質網應激相關分子CHOP和TRB3的表達變化[J]. 中國病理生理雜志, 2013, 29(5):906-912.
(責任編輯: 林白霜, 羅 森)
Dexmedetomidine reduces renal injury induced by lung ischemia/reperfusion in mice through inhibiting endoplasmic reticulum stress response
XIANG Bing-qian, GAO Hui, LOU Guo-qiang, HAO Mao-lin, WANG Wan-tie
(Ischemia/ReperfusionInjuryResearchInstituteofWenzhouMedicalUniversity,Wenzhou325035,China.E-mail:wwt@wmu.edu.cn)
AIM: To investigate the effect of dexmedetomidine (DEX) on renal injury induced by lung ischemia/reperfusion (I/R) in mice and its relationship with endoplasmic reticulum stress response. METHODS: Healthy SPF male C57BL/6J mice, weighing 20~24 g, aged 8~10 weeks, were randomly divided into 5 groups (n=10 each): sham operation group (sham group), I/R group, atipamezole (Atip) group, DEX group, and DEX+Atip group.Invivolung I/R model was established by occlusion of the left pulmonary artery for 30 min followed by 180 min of reperfusion in the mice. The Atip (250 μg/kg), DEX (20 μg/kg) and DEX+Atip were intraperitoneally infused into the mice before left pulmonary hilus was blocked in Atip group, DEX group and DEX+Atip group, and other operations were the same as I/R group. After experiment, the mice were killed, and the renal tissues were harvested to observe the morphological changes. The enzymatic activity of caspase-3, serum creatinine and blood urea nitrogen, and cell apoptotic index of the renal cells were also analyzed. The expression of c-Jun N-terminal kinase (JNK), caspase-12, CCAAT/enhancer-binding protein homdogous protein (CHOP) and glucose-regulated protein 78 (GRP78) at mRNA and protein levels in the renal tissues was determined by RT-PCR and Western blot. RESULTS: Compared with sham group, the enzymatic activity of caspase-3, serum creatinine and blood urea nitrogen, renal cell apoptotic index, and the mRNA and protein levels of JNK, caspase-12, CHOP and GRP78 in I/R group were significantly increased (P<0.01), and the renal tissues had obvious damage under light microscope. Compared with I/R group, Atip group and DEX+Atip group, the enzymatic activity of caspase-3, serum creatinine and blood urea nitrogen, renal cell apoptotic index, and the mRNA and protein levels of JNK, caspase-12 and CHOP in DEX group were significantly decreased, and the expression level of GRP78 significantly increased (P<0.01). Furthermore, the renal tissue damage was obvious reduced. CONCLUSION: DEX effectively relieves the renal injury induced by lung I/R in mice, which may be associated with exciting α2-adrenergic receptor and inhibiting endoplasmic reticulum stress response.
Dexmedetomidine; Ischemia/reperfusion injury; Endoplasmic reticulum stress; Apoptosis
1000- 4718(2017)07- 1288- 07
2017- 02- 20
2017- 03- 21
浙江省公益技術應用研究項目(No. 2013C33168);浙江省新苗人才計劃項目(No. 2014R413043);溫州市公益性科技計劃項目(No. Y20140652)
R363.2
A
10.3969/j.issn.1000- 4718.2017.07.022
雜志網址: http://www.cjpp.net
△通訊作者 Tel: 0577-86689817; E-mail: wwt@wmu.edu.cn

