穿心蓮內酯對卵巢癌細胞株SKOV-3侵襲與凋亡的影響*
蘇芳靜, 張 斌, 田林燕
(南陽醫學高等專科學校護理系, 河南 南陽 473001)
穿心蓮內酯對卵巢癌細胞株SKOV-3侵襲與凋亡的影響*
蘇芳靜△, 張 斌, 田林燕
(南陽醫學高等專科學校護理系, 河南 南陽 473001)
目的: 觀察穿心蓮內酯對卵巢癌細胞株SKOV-3侵襲與凋亡的影響并探討初步的作用機制。方法: CCK-8法檢測不同濃度(0、5、10、20和40 μmol/L)的穿心蓮內酯對SKOV-3細胞作用不同時間(12、24、36和48 h)后,SKOV-3細胞存活率的變化;Transwell法與TUNEL法分別檢測SKOV-3細胞侵襲能力與凋亡能力的變化;Western blot法檢測p-PI3K、p-Akt與p-mTOR蛋白水平的變化。結果: CCK-8法檢測結果顯示,隨著濃度增加與培養時間延長,穿心蓮內酯對SKOV-3細胞存活率的抑制程度增強;采用20 μmol/L穿心蓮內酯培養SKOV-3細胞36 h后,SKOV-3細胞的侵襲數明顯降低,凋亡數明顯增加(P<0.05),p-PI3K、p-Akt與p-mTOR的蛋白水平明顯降低(P<0.05)。結論: 穿心蓮內酯能夠抑制卵巢癌細胞SKOV-3的活力與侵襲能力,增強凋亡能力,這可能與抑制PI3K/Akt/mTOR信號通路有關。
穿心蓮內酯; 卵巢癌細胞; PI3K/Akt/mTOR信號通路
卵巢惡性腫瘤是婦科腫瘤中最常見的惡性腫瘤之一,其發病率約占婦科惡性腫瘤的15%,可發生于任何年齡段的女性,常見于更年期與絕經期的婦女,發病年齡高峰為50~60歲[1-2]。由于發病部位隱匿,容易擴散轉移,超過50%以上的卵巢癌患者在治療完畢后再次復發,5年生存率較低,約為25%~30%[3]。臨床上卵巢癌的治療主要以手術為主,放化療為輔的綜合治療手段,但由于化療藥物容易產生耐藥性以及毒副作用,卵巢癌細胞對放療射線的敏感性較低,導致臨床的治療效果并不理想。近年來,從中草藥與天然植物中提取安全有效低毒的單體成分用于治療癌癥是腫瘤研究的熱點。
穿心蓮內酯(andrographolide,Ang)是爵床科植物穿心蓮中所含的二萜內酯類化合物,具有祛熱解毒、消炎止痛的功效,對細菌性與病毒性上呼吸道感染具有特殊的療效,具有天然抗生素的美譽[4]。國內學者研究發現穿心蓮內酯衍生物通過阻滯細胞于G0/G1期、下調Bcl-2蛋白表達、激活caspase-9和caspase-3蛋白表達誘導人食管癌Ec9706細胞凋亡,從而抑制Ec9706細胞增殖與克隆形成[5]。本實驗觀察了穿心蓮內酯對卵巢癌細胞株SKOV-3生長與侵襲能力的影響,并探討其具體的作用機制。
材 料 和 方 法
1 細胞來源與試劑
人卵巢癌漿液性乳頭狀囊腺癌細胞株SKOV-3購自中國科學院上海細胞所;穿心蓮內酯購自中國食品藥品檢定研究院,溶解于HBSS緩沖液中備用[6];RPMI-1640培養基購自Gibco;10%胎牛血清購自杭州四季青生物工程材料有限公司;CCK-8試劑盒購自碧云天生物技術有限公司;Transwell小室購自Corning;抗磷脂酰肌醇3-激酶(phosphatidylino-sitol 3-kinase,PI3K)、p-PI3K、Akt、p-Akt、哺乳動物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、p-mTOR和β-actin抗體購自Santa Cruz。
2 方法
2.1 細胞培養與傳代 將SKOV-3細胞株至于含10%胎牛血清的RPMI-1640培養基中,置于37 ℃、5% CO2的恒溫培養箱中孵育,待細胞融合至80%~90%時,用0.25%胰酶消化3 min,進行傳代。
2.2 CCK-8法檢測細胞活力 將處于對數生長期的SKOV-3細胞接種于96孔板,每孔1×105個細胞,置于37 ℃、5% CO2的恒溫培養箱中孵育,當細胞貼壁后,更換培養基,分別加入穿心蓮內酯使最終濃度分別為0、5、10、20和40 μmol/L,每組設6個復孔,每組細胞分別培養12 h、24 h、36 h和48 h后,更換培養基,加入10 μL CCK-8檢測液,繼續孵育1 h,采用酶標儀檢測波長為450 nm各孔的吸光度。
2.3 實驗分組 實驗共分為3組:正常對照(control)組采用正常培養基培養;溶劑(solvent)組加入等劑量溶劑HBSS緩沖液;Ang加藥組(Ang組)給予20 μmol/L穿心蓮內酯培養36 h。
2.4 Transwell小室檢測細胞侵襲能力 將處于對數生長期的SKOV-3細胞接種于預鋪Matrigel、含1%血清的Transwell上室中,每孔5×105個細胞;下室加入含10%血清的培養基,孵育24 h后,棄去培養基,用棉簽輕輕擦拭,將上室至于結晶紫染液中3 min,PBS洗滌,置于顯微鏡下觀察細胞計數,并拍照。
2.5 TUNEL法檢測細胞凋亡 將細胞接種于已滅菌的培養皿中,每孔1×105個,待細胞貼壁后,加入穿心蓮內酯使最終濃度為20 μmol/L,培養36 h。用4%多聚甲醛 4 ℃固定 30 min,0.1% Triton X-100冰浴2 min,分別加入50 μL TUNEL檢測液,繼續置于37 ℃避光孵育 60 min,PBS洗滌,加入DAPI染液(10 mg/L)孵育15 min,抗熒光淬滅劑封片,采用共聚焦激光掃描顯微鏡觀察各組細胞的凋亡情況,統計細胞凋亡率。
2.6 Western blot檢測蛋白表達水平 收集各組細胞,加入細胞裂解緩沖液,提取蛋白,通過分光光度測定儀進行蛋白定量,各組取50 μg蛋白進行凝膠電泳分離,完成后電轉至硝酸纖維素膜,加入含封閉液的器皿中,室溫封閉2 h,加入相應 I抗,4 ℃孵育過夜,PBS洗滌3次,加入對應 II 抗,37 ℃孵育1 h,PBS洗膜3次,避光加入按照說明書比例新鮮配置的ECL發光液,曝光,采用Quantity One圖像分析軟件對實驗結果進行分析。
3 統計學處理
采用SPSS 16.0統計軟件對實驗數據進行分析,實驗數據采用均數±標準差(mean±SD)表示,滿足方差齊性的多組數據采用單因素方差分析,2組數據間的比較采用獨立樣本的t檢驗,以P<0.05為差異有統計意義。
結 果
1 不同濃度穿心蓮內酯對SKOV-3細胞存活率的影響
在同一時點,隨著穿心蓮內酯濃度的增加,SKOV-3細胞的存活率逐漸下降,20 μmol/L與40 μmol/L穿心蓮內酯對細胞存活率的影響與對照組比較差異無統計學意義;同一濃度藥物,隨著孵育時間的延長,SKOV-3細胞的存活率逐漸下降,48 h與36 h相比,存活率的差異無統計學顯著性,見圖1。因此,采用20 μmol/L穿心蓮內酯培養細胞36 h的條件進行后續實驗。
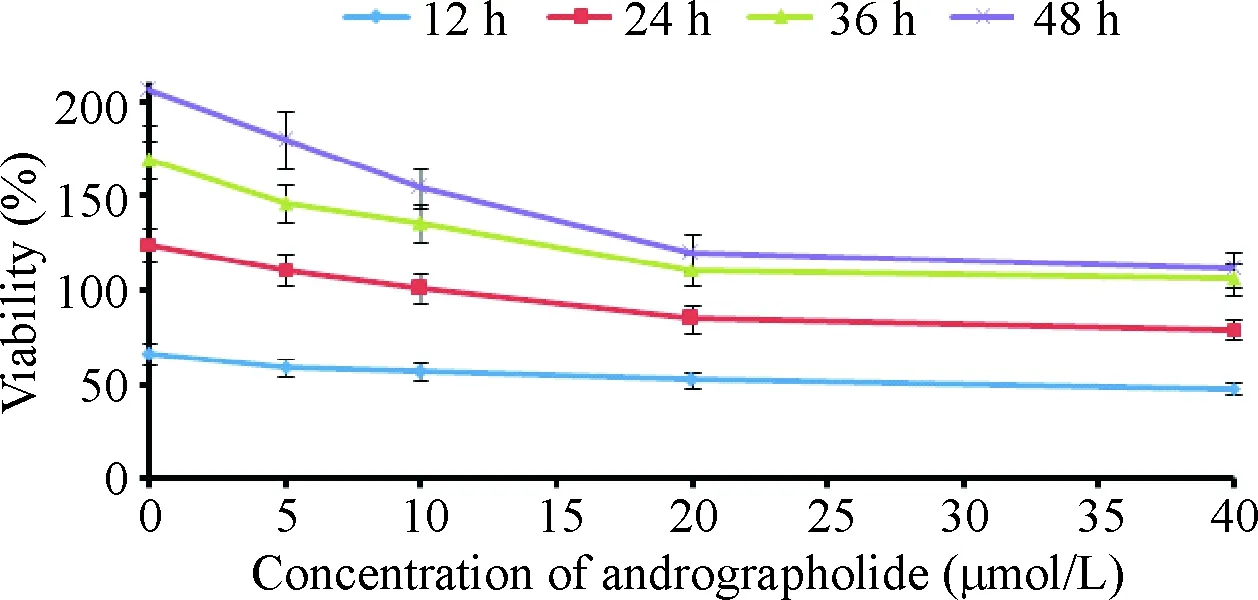
Figure 1.The viability of the SKOV-3 cells after treated with andrographolide. Mean±SD.n=6.
圖1 穿心蓮內酯對SKOV-3細胞存活率的影響
2 穿心蓮內酯對SKOV-3細胞侵襲能力的影響
Transwell侵襲實驗結果如圖2所示。采用20 μmol/L穿心蓮內酯培養SKOV-3細胞36 h后,細胞侵襲數顯著低于正常對照組與溶劑對照組(P<0.05),其中正常對照組和溶劑對照組細胞侵襲數之間的差異無統計學顯著性。
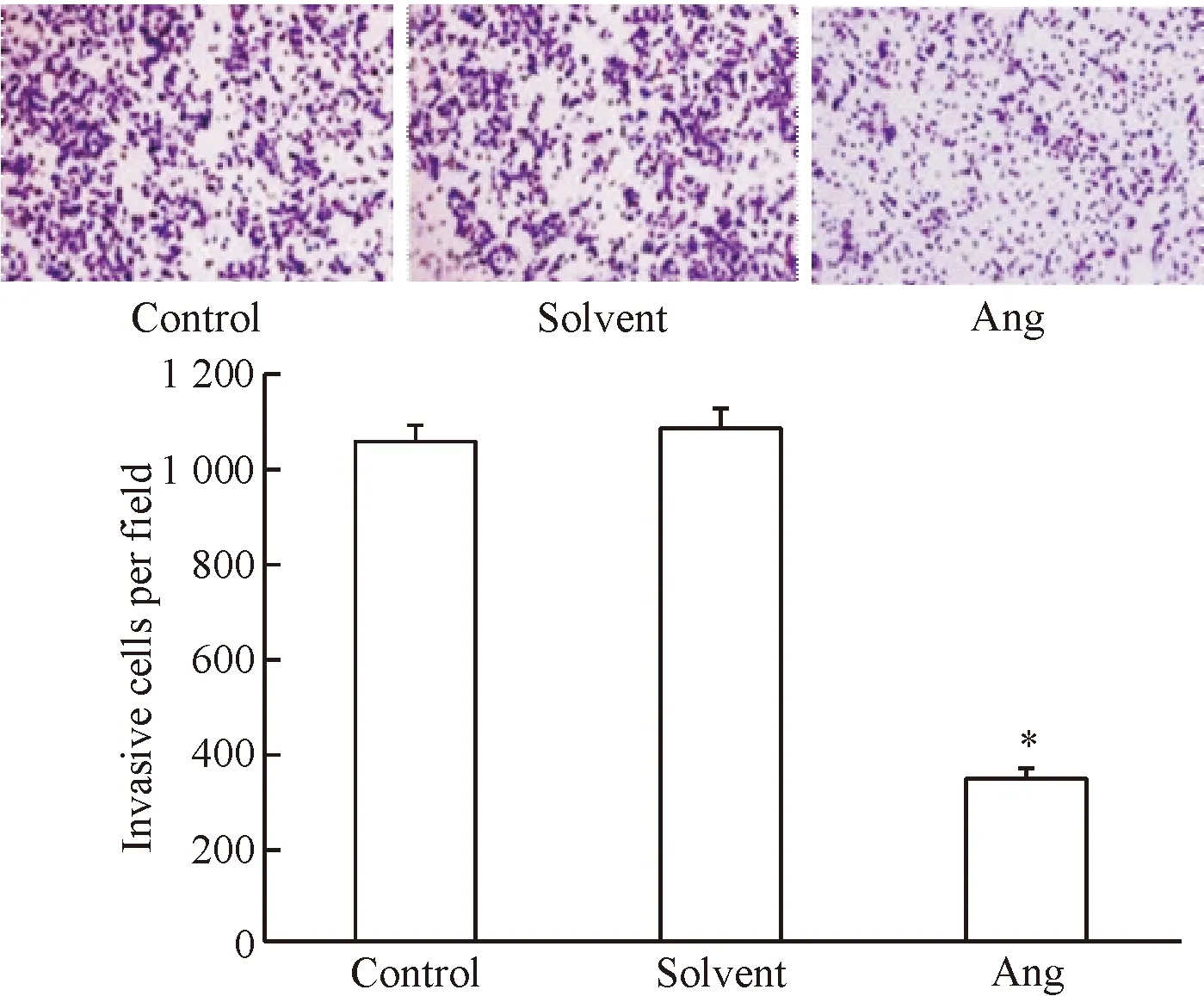
Figure 2.The invasion of SKOV-3 cells after 20 μmol/L andrographolide (Ang) treatment (×200).Mean±SD.n=3.*P<0.05vscontrol group.
圖2 穿心蓮內酯對SKOV-3細胞侵襲能力的影響
3 穿心蓮內酯對SKOV-3細胞凋亡的影響
TUNEL實驗結果如圖3所示。采用20 μmol/L穿心蓮內酯培養SKOV-3細胞36 h后,細胞凋亡數顯著高于正常對照組與溶劑對照組(P<0.05),其中正常對照組和溶劑對照組的細胞凋亡之間的差異無統計學顯著性。
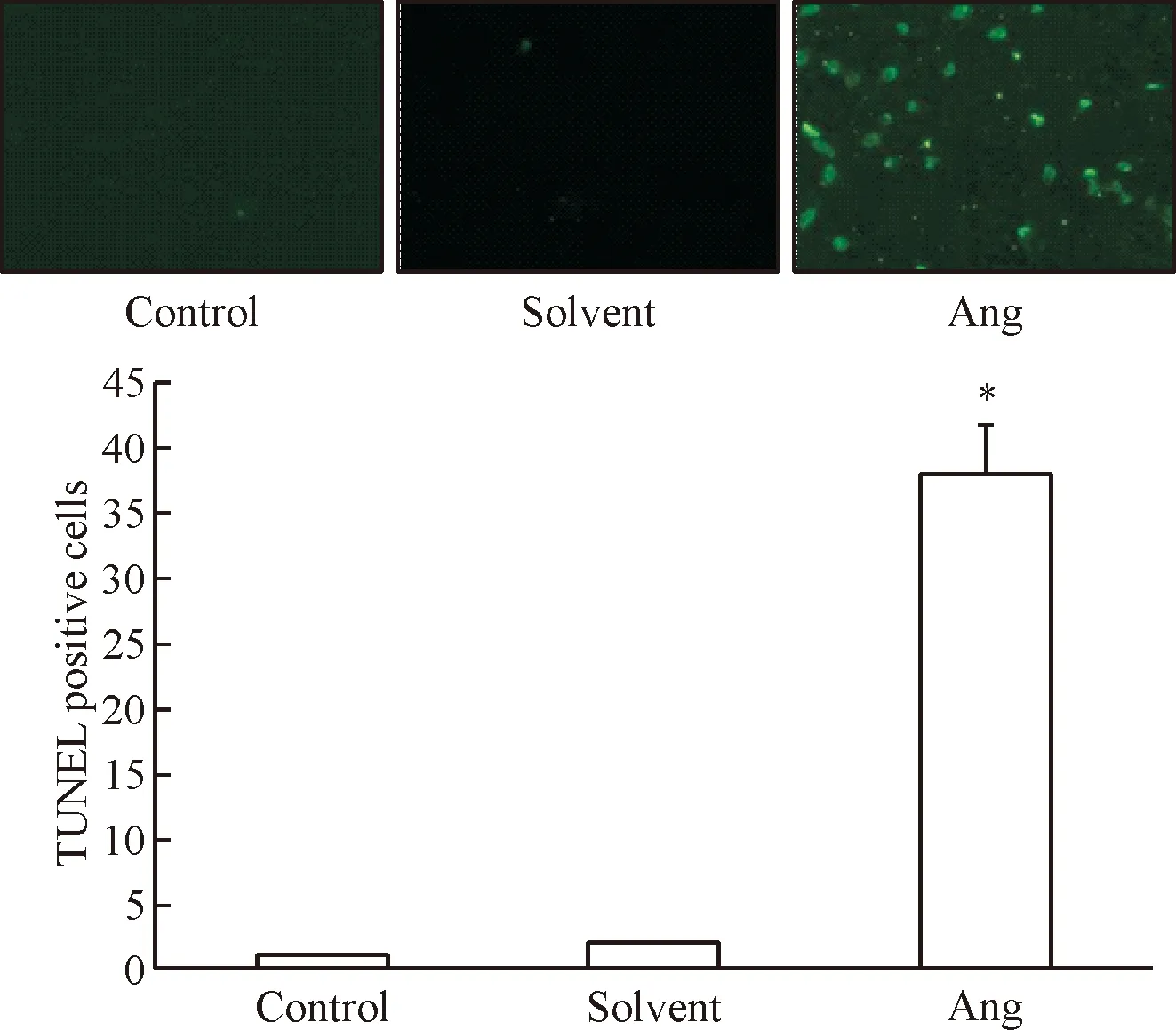
Figure 3.The effect of 20 μmol/L andrographolide (Ang) on the apoptosis of SKOV-3 cells (TUNEL staining, ×200). Mean±SD.n=3.*P<0.05vscontrol group.
圖3 穿心蓮內酯對SKOV-3細胞凋亡的影響
4 p-PI3K、p-Akt與p-mTOR蛋白水平的變化
Western blot實驗結果如圖4所示。采用20 μmol/L穿心蓮內酯培養SKOV-3細胞36 h后,細胞中p-PI3K、p-Akt與p-mTOR的蛋白水平較對照組明顯降低(P<0.05),而正常對照組和溶劑對照組之間蛋白表達水平的差異無統計學顯著性。
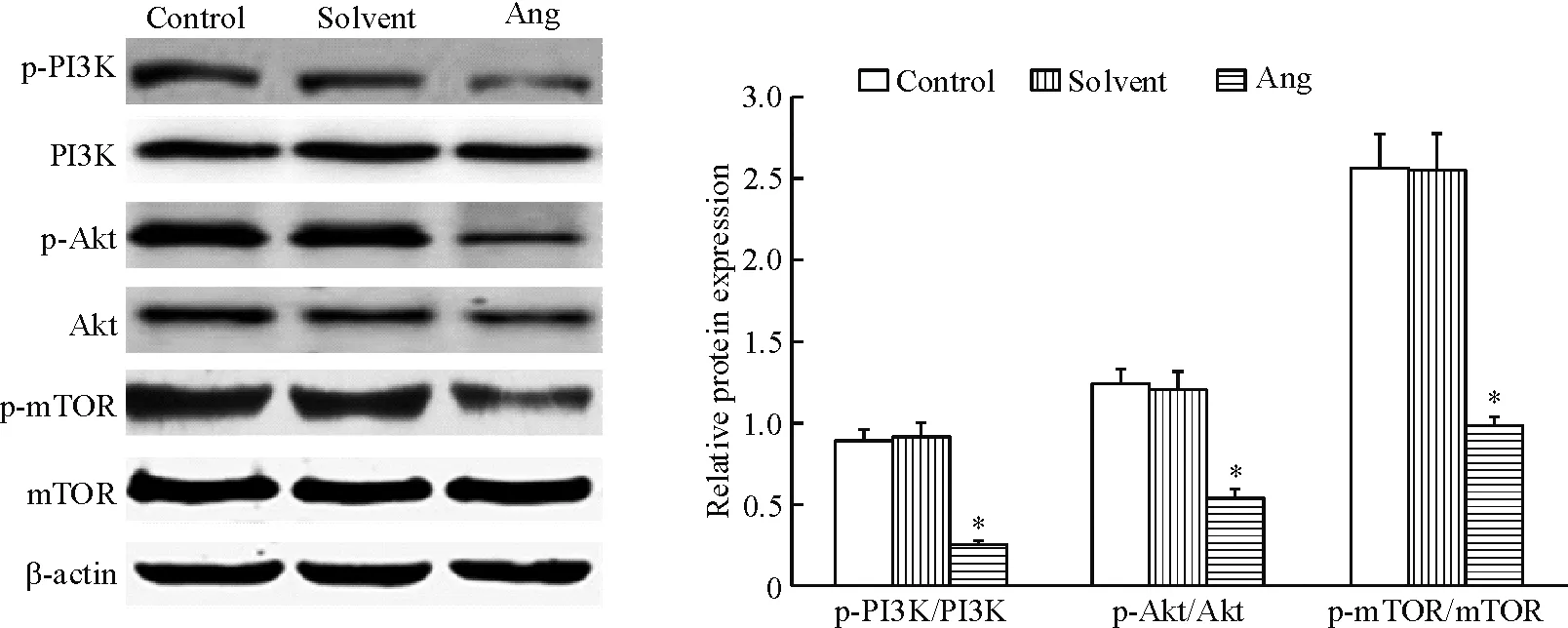
Figure 4.The effect of 20 μmol/L andrographolide (Ang) on the protein levels of p-PI3K, p-Akt and p-mTOR in the SKOV-3 cells. Mean±SD.n=3.*P<0.05vscontrol group.
圖4 SKOV-3細胞中p-PI3K、p-Akt與p-mTOR蛋白水平的變化
討 論
PI3Ks信號通路主要參與細胞增殖,分化與凋亡等多種細胞功能調節的過程,PI3K/Akt/mTOR信號通路被認為是腫瘤細胞存活的重要通路,對腫瘤細胞的生存、凋亡和細胞周期,以及腫瘤細胞新生血管的形成、轉移與侵襲等具有重要的意義[7-8]。近年來研究發現在多種惡性腫瘤細胞中,如乳腺癌和子宮內膜癌等惡性上皮性腫瘤中發現PI3K/Akt信號通路過度激活,并在腫瘤細胞的增殖,遷移與侵襲過程中發揮重要作用[9-10]。國內學者研究發現,PI3K/Akt信號通路抑制劑LY294002對卵巢癌細胞SKOV3和CAOV3的增殖與侵襲能力具有明顯的抑制作用,表明卵巢癌細胞的增殖與侵襲能力與PI3K/Akt信號通路的激活具有非常緊密的聯系[11]。我們研究發現,穿心蓮內酯對卵巢癌細胞的活力與侵襲能力具有明顯的抑制作用,而PI3K、Akt與mTOR的磷酸化水平下降,推測穿心蓮內酯對卵巢癌細胞SKOV3增殖與侵襲能力的抑制作用,以及凋亡的促進作用是通過抑制PI3K/Akt/mTOR信號通路的激活而實現的。
在卵巢惡性腫瘤中,腫瘤細胞的侵襲或轉移是導致卵巢腫瘤患者治療效果欠佳,預后不良與復發率高的主要原因,因此深入研究卵巢惡性腫瘤細胞侵襲或轉移的主要分子作用機制,對于尋找卵巢腫瘤的治療分子作用靶點,對卵巢惡性腫瘤進行早期的診斷與治療提供確切的依據。本實驗發現抑制PI3K/Akt/mTOR信號通路是穿心蓮內酯對卵巢腫瘤細胞的主要作用方式,PI3K/Akt/mTOR信號通路可以作為治療卵巢腫瘤作用靶點,對于指導卵巢腫瘤采用穿心蓮內酯輔助治療具有重要的意義。
[1] Sankaranarayanan R, Ferlay J. Worldwide burden of gynaecological cancer: the size of the problem[J]. Best Pract Res Clin Obstet Gynaecol, 2006, 20(2): 207-225.
[2] Liu CG, Calin GA, Meloon B, et al. An oligonucleotide microchip for genome-wide microRNA profiling in human and mouse tissues[J]. Proc Natl Acad Sci U S A, 2004, 101(26):9740-9744.
[3] 李 楓, 姚 麗, 張喜紅, 等. miRNA-22在卵巢癌組織的表達及其對卵巢癌細胞增殖、遷移與侵襲的影響[J].中國病理生理雜志, 2016, 32(12):2251-2255.
[4] 呂巧莉, 涂國剛, 王嘉琦, 等. 穿心蓮內酯的研究進展及臨床應用[J].南昌大學學報: 醫學版, 2013, 53(1):83-86.
[5] 戴桂馥, 趙 進, 王慶瑞, 等. 穿心蓮內酯誘導人食管癌Ec9706細胞凋亡機制研究[J]. 中國藥理學通報, 2009, 25(2):173-176.
[6] 彭偉文, 劉中秋, 葉 玲, 等. 穿心蓮內酯的溶解度和穩定性實驗研究[J]. 中國醫藥指南, 2008, 6(24):76-77.
[7] Liu Y, Cui B, Qiao Y, et al. Phosphoinositide-3-kinase inhibition enhances radiosensitization of cervical cancerinvivo[J]. Int J Gynecol Cancer, 2011, 21(1):100-105.
[8] Gao Y, Ishiyama H, Sun M, et al. The alkylphospholi-pid, perifosine, radiosensitizes prostate cancer cells bothinvitroandinvivo[J]. Radiat Oncol, 2011, 6:39.
[9] 郭瑞霞, 魏麗惠, 王建六, 等. 17β-雌二醇對子宮內膜癌細胞磷脂酰肌醇3激酶/蛋白激酶B信號傳導通路的激活作用[J]. 中華婦產科雜志, 2004, 39(7):469-473.
[10]Zhao M, Mueller BM, DiScipio RG, et al. Akt plays an important role in breast cancer cell chemotaxis to CXCL12[J]. Breast Canner Res Treat, 2008, 110(2):211-222.
[11]雷 婧. SDF-1激活PI3K/Akt通路在卵巢癌細胞增殖和侵襲中的作用[D]. 鄭州: 鄭州大學, 2015.
(責任編輯: 林白霜, 羅 森)
Effects of andrographolide on invasion and apoptosis of ovarian cancer SKOV-3 cells
SU Fang-jing, ZHANG Bin, TIAN Lin-yan
(SchoolofNursing,NanyangMedicalCollege,Nanyang473001,China.E-mail:sufangjing322904@126.com)
AIM: To investigate the effects of andrographolide on the invasion and apoptosis of ovarian cancer cell line SKOV-3, and to explore the possible mechanisms. METHODS: SKOV-3 cells were treated with different concentrations (0, 5, 10, 20 or 40 μmol/L) of andrographolide for different time (12, 24, 36 or 48 h), and then the cell viability was determined by CCK-8 assay. The cell invasion ability was analyzed by Transwell assay and cell apoptosis was detected by TUNEL staining. The protein levels of p-PI3K, p-Akt and p-mTOR were examined by Western blot. RESULTS: The results of CCK-8 assay revealed that andrographolide inhibited the growth of SKOV-3 cells in a dose- and time-dependent manner. Treatment with andrographolide at 20 μmol/L for 36 h significantly decreased the invasion ability of SKOV-3 cells, while increased cell apoptosis. In addition, the protein levels of p-PI3K, p-Akt and p-mTOR were reduced after andrographolide treatment. CONCLUSION: Andrographolide inhibits the growth and invasion of ovarian cancer SKOV-3 cells by suppression of PI3K/Akt/mTOR signaling pathway.
Andrographolide; Ovarian cancer cells; PI3K/Akt/mTOR signaling pathway
1000- 4718(2017)07- 1328- 04
2017- 02- 07
2017- 06- 14
河南省教育廳高校重點科研項目(No.15A360011)
R711.75; R730.23
A
10.3969/j.issn.1000- 4718.2017.07.029
雜志網址: http://www.cjpp.net
△通訊作者 Tel: 0377-63526369; E-mail: sufangjing322904@126.com

