豬流行性腹瀉病毒與圓環病毒2型復合PCR方法的建立
龔雙燕,李小璟,陳瑛琪,蔡 瑤,李雨濛,徐逸飛,朱 玲,b,徐志文,b,*
(四川農業大學 a.動物醫學院; b.動物疫病與人類健康四川省重點實驗室,四川 成都 611130)
豬流行性腹瀉病毒與圓環病毒2型復合PCR方法的建立
龔雙燕a,李小璟a,陳瑛琪a,蔡 瑤a,李雨濛a,徐逸飛a,朱 玲a,b,徐志文a,b,*
(四川農業大學 a.動物醫學院; b.動物疫病與人類健康四川省重點實驗室,四川 成都 611130)
為研究豬流行性腹瀉病毒(PEDV)、豬圓環病毒2型(PCV2)在腹瀉仔豬中的感染狀況,建立一種能同時檢測 PEDV與PCV2混合感染的復合PCR方法。根據GenBank已發表的PEDV、PCV2的基因序列,選擇保守區域分別設計、合成1對特異性引物,擴增目的片段分別為530和278 bp。經反應條件優化,建立了特異性檢測PEDV、PCV2的復合PCR方法。應用本試驗所建復合PCR方法,對2016年4—8月采自四川省樂山、宜賓、廣元和遂寧等地區的67份腹瀉仔豬樣品(腸系膜淋巴結、腸道黏膜及其內容物混合)進行檢測。結果顯示:PEDV、PCV2單一感染陽性率分別為34.33%、73.13%;PEDV+PCV2復合感染率為16.42%。經與特異性檢測PCV2的PCR法和PEDV的RT-PCR法檢測結果進行比較分析,符合率均為100%。
流行性腹瀉病毒;圓環病毒2型;復合PCR
豬流行性腹瀉病毒(porcine epidemic diarrhea virus, PEDV)會引發以嘔吐、腹瀉和脫水為特征的急性、接觸性、高度傳染性豬消化道疾病。近年,豬流行性腹瀉(porcine epidemic diarrhea, PED)在全球范圍暴發流行,表現為高發病率和7 d以內新生仔豬感染后高死亡率,給我國乃至世界養豬業造成了嚴重損失[1]。豬圓環病毒2型(porcine circovirus type 2, PCV2)感染可引起斷奶豬多系統衰竭綜合征、豬皮炎與腎炎綜合征、豬呼吸道綜合征等多種病型[2-4]。該病毒因可侵害感染豬免疫系統引起免疫抑制,降低機體抵抗力[5-6],導致繼發、并發其他病原而表現為臨床混合感染[7]。有報道顯示,PCV2感染可能加重PEDV所致的仔豬病毒性腹瀉病理損傷,導致死亡率提高。為進一步研究PCV2在腹瀉仔豬中感染狀況與疾病損害間關系,本試驗建立了同時檢測PCV2和PEDV的復合PCR方法,以期為開展以上病毒診斷提供靈敏、快速、特異的方法,科學分析其混合感染狀況,為制定仔豬PEDV、PCV2的綜合防控措施提供依據。
1 材料與方法
1.1 病毒、病料和菌株的來源
豬偽狂犬病病毒(pseudo rabies virus, PRV)、豬細小病毒(porcine parvovirus virus, PPV)、豬繁殖與呼吸綜合征病毒(porcine reproductive and respiratory syndrome virus, PRRSV)、豬瘟病毒(classical swine fever virus, CSFV)、豬傳染性胃腸炎(transmissible gastroenteritis of swine virus, TGEV)、豬輪狀病毒(rotavirus, RV)、豬流行性腹瀉病毒和豬圓環病毒2型均由四川農業大學動物生物技術中心保存;病料(腸道、腸系膜淋巴結、腸道內容物)采自四川省樂山、宜賓、廣元和遂寧等地區。
1.2 主要試劑
DL2000 DNA Marker、10×buffer(Mg2+free)、dNTP Mix、MgCl2、TaKaRaTaqHs、ddH2O、pMD19-T載體、DH5α大腸埃希菌感受態細胞、質粒(Plasmid)DNA小量純化試劑盒均購自寶生物工程(大連)有限公司。DNA膠回收試劑盒購自Omega公司。
1.3 引物設計與合成
根據GenBank已發表的PEDV(Accession: KR011756.1)、PCV2(Accession: KT336601.1)基因的核苷酸序列,分別設計1對特異引物PEDV-F、PEDV-R和PCV2-F、PCV2-R,預計擴增產物大小分別為530 bp和278 bp,由生工生物工程(上海)股份有限公司合成(表1)。
1.4 樣品處理及病毒核酸的提取
67份腹瀉病料,樣品編號1—67。病料處理:取病豬的腸道、腸系膜淋巴結、腸道內容物混合在一起,放進研缽加入適量的液氮磨碎成粉末狀,加入適量生理鹽水形成研磨液,反復凍融3次備用。
DNA的提取:采用傳統的酚-氯仿法提取病料研磨液的總DNA,-20 ℃保存備用。
RNA的提取和反轉錄:采用TrizoL法提取病料研磨液的總RNA。將提取的RNA利用反轉錄試劑盒反轉錄成為cDNA,反應體系(10 μL)如下:模板RNA 3.0 μL;5×PrimeScript Buffer 2.0 μL;Primer script RT Enzyme mix Ι 0.5 μL;Oligo dT primer 0.5 μL;Random 6 mers 0.5 μL;RNase free H2O 3.5 μL。放入PCR儀,經37 ℃反轉錄15 min,85 ℃滅活5 s,-20 ℃保存備用。
1.5 單項PCR的擴增
以1.4節制備的DNA和cDNA為模板,參照本實驗室檢測所用PCR反應體系,及所設計引物的Tm值,優化PCR反應溫度。選出兩對引物的最佳反應退火溫度。本實驗室常規PCR反應總體系25 μL∶10×buffer(Mg2+free) 2.5 μL;dNTP Mix 2.0 μL(2.5 mmol·L-1);MgCl22.0 μL(25 mmol·L-1);TaKaRaTaqHs 0.2 μL(5 U·μL-1);上游和下游引物各1.0 μL(10 pmol·μL-1);DNA或cDNA模板1.0 μL;其余用ddH2O補足。單項PCR擴增過程:95 ℃預變性5 min;95 ℃ 30 s,63 ℃ 30 s,72 ℃ 30 s,共35個循環;72 ℃延伸7 min。取PCR產物6 μL經1.5%瓊脂糖凝膠電泳檢測。
表1 復合PCR所用引物序列
Table 1 Primer sequences for the multiplex PCR
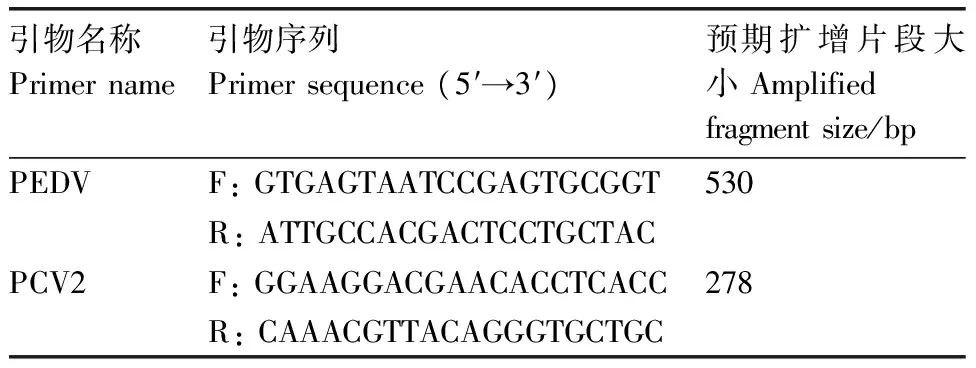
引物名稱Primername引物序列Primersequence(5′→3′)預期擴增片段大小Amplifiedfragmentsize/bpPEDVF:GTGAGTAATCCGAGTGCGGT530R:ATTGCCACGACTCCTGCTACPCV2F:GGAAGGACGAACACCTCACC278R:CAAACGTTACAGGGTGCTGC
1.6 目的片段克隆與測序
使用DNA膠回收試劑盒回收單項PCR目的片段,連接pMD19-T載體,轉化入DH5α克隆宿主菌中。將陽性克隆交由擎科生物公司測序,將測序正確的樣品擴大培養,用質粒小提試劑盒提取2種含有不同目的片段的質粒作為復合PCR的反應模板。
1.7 復合PCR方法的建立與反應條件的優化
1.7.1 dNTP Mix、Mg2+、TaqHs用量優化
在單項PCR基礎上,對PCV2、PEDV復合PCR中 dNTP Mix、Mg2+、TaqHs酶用量進行優化。PCR反應總體系25 μL。每試驗優化單一變量,其余參數仍使用未優化濃度與劑量(見1.5節)。分別只改變 dNTP Mix、Mg2+、TaqHs的用量,其梯度分別為dNTP Mix∶1.0、1.5、2.0、2.5 μL;Mg2+:1.0、1.5、2.0、2.5 μL;TaqHs∶0.2、0.3、0.4、0.5 μL,進行復合PCR擴增,反應程序同單項PCR,根據擴增條帶的效果差異逐步篩選出各自組分的最佳用量。
1.7.2 PCV2、PEDV復合PCR反應引物的優化
在單項PCR基礎上,進行復合PCR實驗(25 μL復合PCR優化體系),按不同引物用量(PCV2、PEDV分別為0.5、0.8、1.0、1.5、1.8、2.0 μL)進行試驗,篩選出最佳引物量。
1.7.3 PCV2、PEDV復合PCR反應退火溫度優化
在單項PCR基礎上,確定25 μL復合PCR優化體系,然后梯度選取10個退火溫度(56.6、57.5、58.6、60.0、61.7、63.0、64.2、65.2、65.7、66.0 ℃),選出最佳反應退火溫度。
1.8 復合PCR 的特異性試驗
利用已建立的復合PCR,取等量的PRV、PPV病毒的DNA,及CSFV、PRRSV、TGEV、RV病毒RNA反轉錄成的cDNA為模板進行PCR擴增,同時以ddH2O做陰性對照進行檢測,擴增產物經1.5%的瓊脂糖凝膠電脈拍照分析。
1.9 重復性試驗
將PCV2、PEDV陽性病料抽提出的DNA和RNA反轉錄的cDNA作為模板,以初步建立的該檢測方法,分別進行批間、批內重復性試驗,檢驗該方法的穩定性。
1.10 敏感性試驗
取鑒定陽性的PEDV、PCV2基因克隆,通過試劑盒抽提質粒,用核酸蛋白儀測量PEDV、PCV2的陽性重組質粒的濃度,分別對兩者進行10倍梯度稀釋(100~106),然后取同一稀釋度的2種病毒核酸各1 μL混合,用以上優化好的反應體系和程序進行復合PCR擴增,確定出現陽性反應條帶模板的最高稀釋倍數,推算出其最低檢出濃度。
1.11 臨床應用
從四川樂山、宜賓、廣元和遂寧等地區采集腹瀉病料,按照本試驗建立的復合PCR 擴增體系和擴增條件進行檢測,并設立陰陽性對照,取PCR產物6 μL在1.5%的瓊脂糖凝膠中進行電泳后判定結果。
2 結果與分析
2.1 單一PCR擴增
將1.6節所提取的2種質粒作為模板,用各自特異性引物進行擴增,并對PEDV和PCV2進行復合PCR擴增,擴增產物經1.5% 瓊脂糖凝膠電泳。單項PCR(體系見1.5節)產物大小分別與預期的530 bp和278 bp相符合。將產物送至擎科生物公司測序,NCBI Blast比對結果顯示,核苷酸序列同源性均為99%,表明擴增片段分別為各自病毒的特異性條帶(圖1)。
2.2 dNTP Mix、Mg2+、TaqHs酶用量優化
優化單一變量,其余參數仍使用未優化濃度與劑量,分別只改變dNTP Mix(1.0、 1.5、 2.0、 2.5 μL)、Mg2+(2.5、 2.0、 1.5 、1.0 μL)、TaqHs(0.5、 0.4、 0.3、 0.2 μL)的用量,結果顯示,在25 μL反應體系中,當dNTP Mix、Mg2+、Taq Hs酶用量分別為2.0、1.5和0.2 μL時擴增的2條條帶最清晰(分別見圖2、圖3、圖4)
2.3 引物濃度和退火溫度的優化
結果顯示,引物的最佳使用量分別為PCV2、PEDV各1.0 μL(圖5);63 ℃為最佳退火溫度(圖6)。
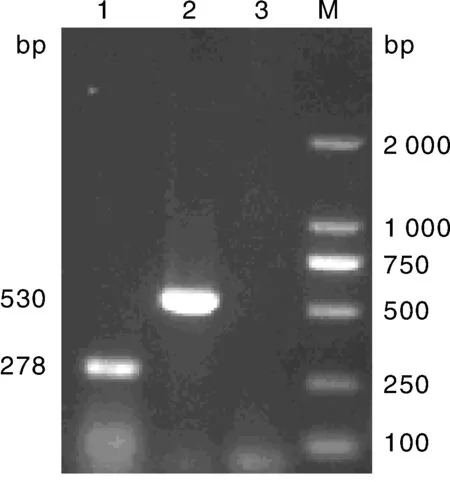
M, DNA 分子質量標準; 1, PCV2; 2, PEDV; 3, 陰性對照M, DL2000 DNA Marker; 1, PCV2; 2, PEDV; 3, Negative control圖1 單一PCR檢測結果Fig.1 Single PCR test result
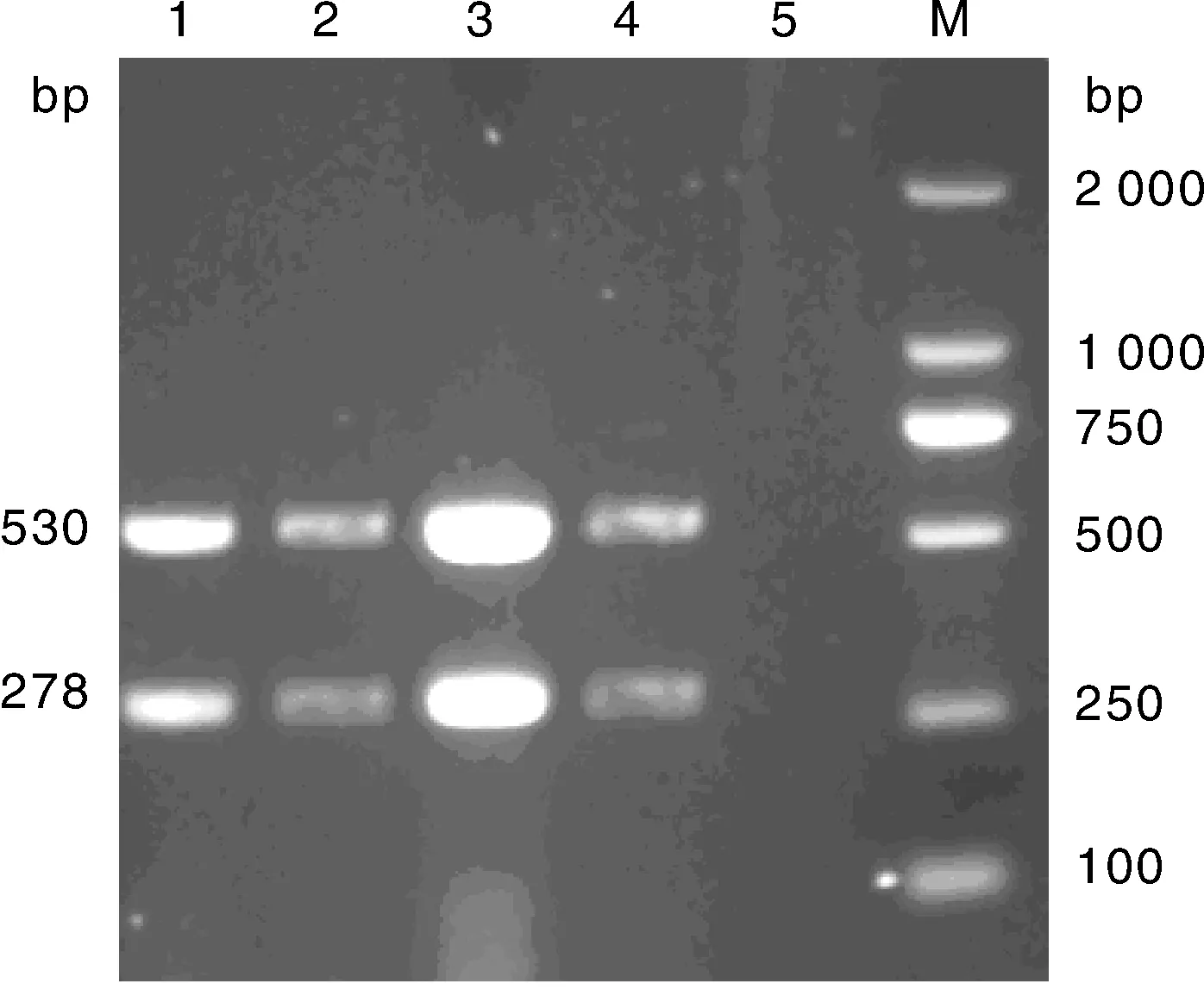
M, DNA 分子質量標準; 1、2、3、4,dNTP Mix 1.0、1.5、2.0、2.5 μL; 5, 陰性對照M, DL2000 DNA marker; 1, 2, 3, 4, dNTP mix 1.0, 1.5, 2.0, 2.5 μL, respectively; 5, Negative control圖2 不同濃度的dNTP mix的復合PCR擴增Fig.2 Multiplex PCR amplification result with different concentrations of dNTP mix
2.4 復合PCR擴增及體系的優化
反應體系25 μL: 10×buffer(Mg2+free) 2.5 μL,dNTP Mix 2.0 μL,MgCl21.5 μL,TakaraTaqHs 0.2 μL,上游和下游引物各1.0 μL,DNA或cDNA模板1.0 μL,其余用ddH2O補足。反應程序為:95 ℃預變性5 min;95 ℃ 30 s,63 ℃ 30 s,72 ℃ 30 s,共35個循環;72 ℃延伸7 min。在此條件下,反應結果最佳。
2.5 特異性檢測
利用已建立的復合PCR,以1.6節所提取的2種質粒作為模板,進行復合PCR擴增,電泳檢測結果顯示,復合PCR能特異性擴增PEDV和PCV2,產物大小分別約為530 bp和278 bp。分別以PRV、PPV病毒的DNAs,及PRRSV等病毒RNA反轉錄成的cDNA為模板,在已優化的反應條件下進行復合PCR擴增,同時以ddH2O做陰性對照進行檢測,其擴增產物能夠被明顯的區分開來,并且不會出現非特異性擴增,證實了PCR擴增的特異性(圖7)。

M, DNA 分子質量標準; 1、2、3、4, Mg2+ 2.5、2.0、1.5、1.0 μL; 5, 陰性對照M, DL2000 DNA marker, 1, 2, 3, 4, Mg2+ 2.5, 2.0, 1.5, 1.0 μL, respectively; 5, Negative control圖3 不同濃度的Mg2+的復合PCR擴增Fig.3 Multiplex PCR amplification result with different concentrations of Mg2+
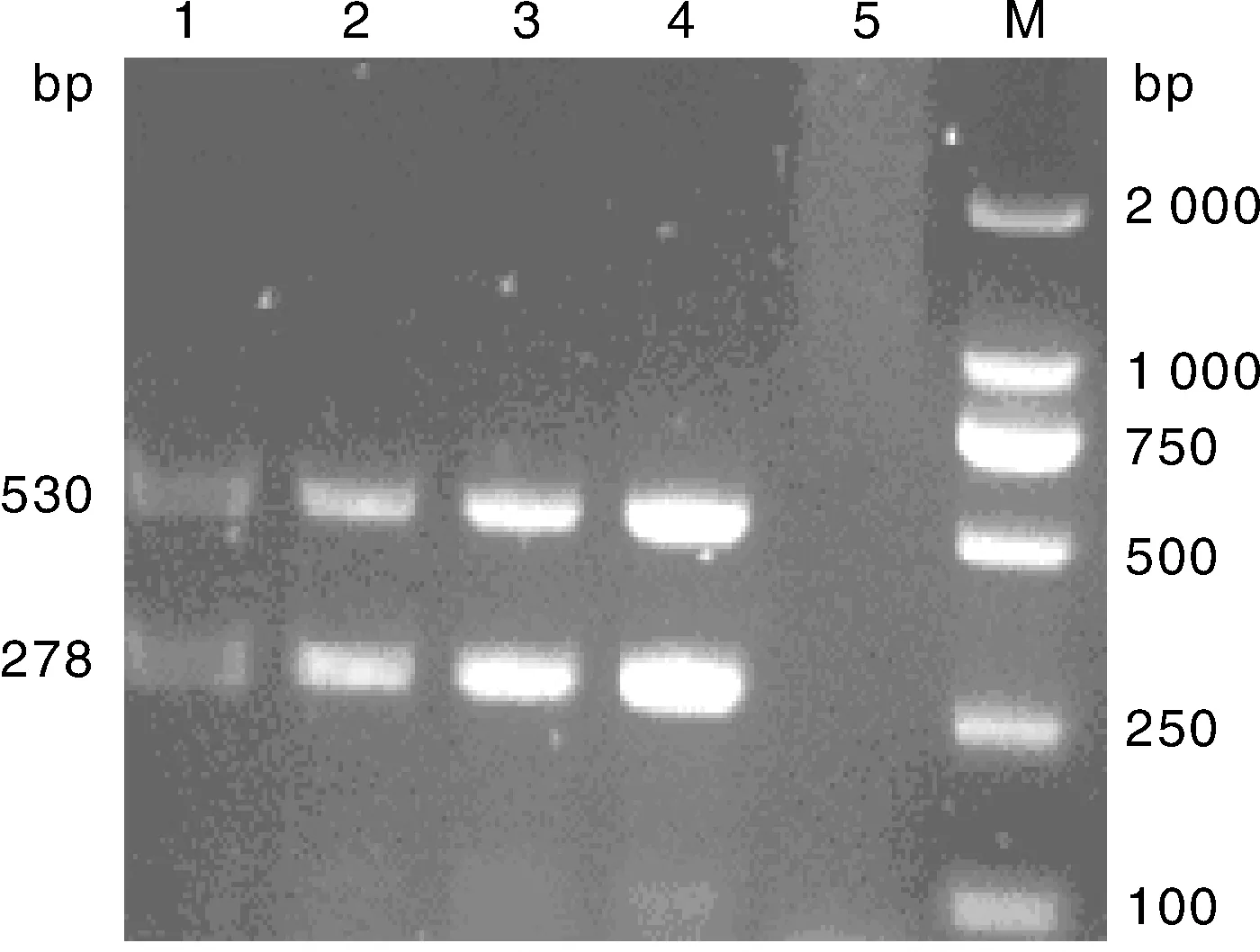
M, DNA 分子質量標準; 1、2、3、4, Taq Hs 0.5、0.4、0.3、0.2 μL; 5, 陰性對照M, DL2000 DNA marker; 1, 2, 3, 4, Taq Hs 0.5, 0.4, 0.3, 0.2 μL, respectively; 5, Negative control圖4 不同濃度的Taq Hs酶的復合PCR擴增Fig.4 Multiplex PCR amplification result with different concentrations of Taq Hs
2.6 重復性試驗

M, DNA 分子質量標準;1, 56.6 ℃;2, 57.5 ℃;3, 58.6 ℃;4, 60.0 ℃;5, 61.7 ℃;6, 63.0 ℃;7, 64.2 ℃;8, 65.2 ℃;9, 65.7 ℃;10, 66.0 ℃;11, 陰性對照M, DL2000 DNA marker;1, 56.6 ℃;2, 57.5 ℃;3, 58.6 ℃;4, 60.0 ℃;5, 61.7 ℃;6, 63.0 ℃;7, 64.2 ℃;8, 65.2 ℃;9, 65.7 ℃;10, 66.0 ℃;11, Negative control圖5 不同退火溫度的復合PCR擴增Fig.5 Multiplex PCR amplification result with different annealing temperature

M, DNA 分子質量標準;1、2、3、4、5、6, PCV2 和PEDV各 0.5、0.8、1.0、1.5、1.8、2.0 μL;7, 陰性對照M, DL2000 DNA marker; 1, PCV2 0.5 μL and PEDV 0.5 μL; 2, PCV2 0.8 μL and PEDV 0.8 μL; 3, PCV2 1.0 μL and PEDV 1.0 μL; 4, PCV2 1.5 μL and PEDV 1.5 μL; 5, PCV2 1.8 μL and PEDV1.8 μL; 6, PCV2 2.0 μL and PEDV 2.0 μL; 7, Negative control圖6 不同引物濃度的復合PCR擴增Fig.6 Multiplex PCR amplification result with different primer concentration
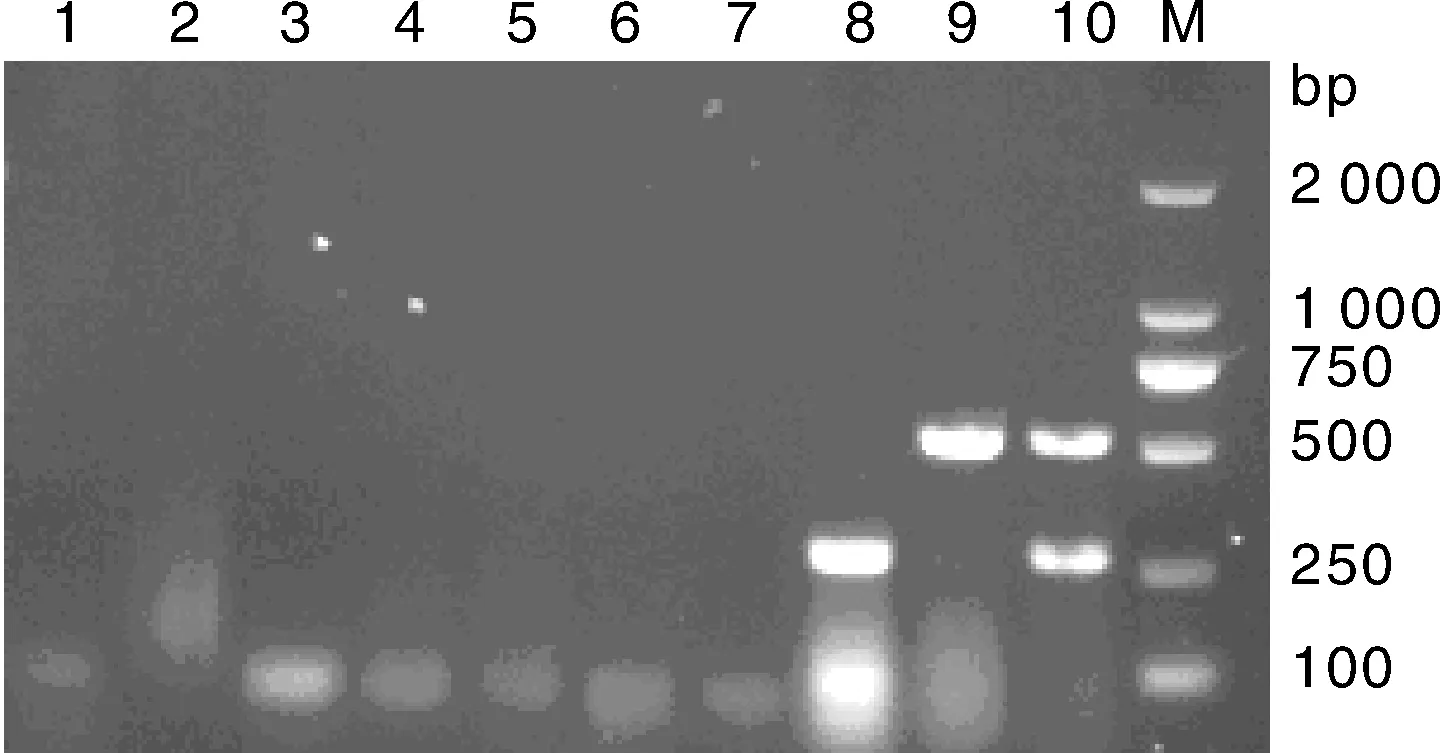
M, DNA 分子質量標準; 1, PRV; 2, PRRSV; 3, PPV; 4, CSFV; 5, TGEVV; 6, RV; 7, 陰性對照; 8, PCV2; 9, PEDV; 10, PCV2+PEDVM, DL2000 DNA marker; 1, PRV; 2, PRRSV; 3, PPV; 4, CSFV; 5, TGEVV; 6, RV; 7, Negative control; 8, PCV2; 9, PEDV; 10, PCV2+PEDV圖7 復合PCR的特異性試驗Fig.7 Specificity test result of multiplex PCR
應用復合PCR方法對陽性模板進行批間與批內重復性檢測,所有試驗結果一致,表明本試驗方法的重復性良好(圖8)。
2.7 敏感性試驗
采用復合PCR擴增條件來擴增倍比稀釋的PCV2、PEDV的質粒濃度混合模板,擴增結果如圖9所示,推算出PCV2、PEDV的最低檢出量分別為4.38×104copies·μL-1和3.30×104copies·μL-1。
2.8 臨床應用
從四川樂山、宜賓、廣元和遂寧等地采集的67份腹瀉病料提取病料中總RNA、DNA,按照本試驗建立的復合PCR 擴增體系和擴增條件進行檢測,并設立陰陽性對照,取PCR產物6 μL在1.5%的瓊脂糖凝膠中進行電泳后判定結果:PEDV單一感染陽性率為34.33%,PCV2單一感染陽性率為73.13%;PEDV+PCV2復合感染率為16.42%(表2)。復合PCR 擴增與單一的特異性檢測PCV2的PCR 和檢測PEDV 的RT-PCR檢測結果進行比較分析,符合率均為100%(表3)。

M: DNA 分子質量標準;1~5: 批間重復性試驗;6, 陰性對照;7~11, 批內重復性試驗;12,陰性對照M, DL2000 DNA marker; 1-5, Inter batch repeatability test;6, Negative control; 7-11, Intra batch repeatability test; 12, Negative control圖8 復合PCR的批間、批內重復性試驗結果Fig.8 Repeatability test of the multiplex PCR of inter batch and intra batch

M, DNA 分子質量標準;1~7, 模板的稀釋度分別為100、10-1、10-2、10-3、10-4、10-5、10-6;8, 陰性對照M, DL2000 DNA marker; 1-7, The dilutions of plasmid were 100, 10-1, 10-2, 10-3, 10-4, 10-5, 10-6; 8, Negative control圖9 復合PCR的敏感性試驗Fig.9 Sensitivity test of multiplex PCR
3 討論
近年來由腹瀉所導致疾病給各大豬場造成了嚴重的經濟損失,不同豬群死亡率差異較大,其中以仔豬腹瀉最為突出。在臨床中常見PPV、PRV、PRRSV、CSFV、TGEV、RV、PCV2等疾病混合
表2 PEDV和PCV2的檢測結果
Table 2 Detection results of PEDV and PCV2

檢測內容Testcontents檢測樣品數量TotalsampleNo.測出陽性樣品數PositivesampleNo.陰性樣品數NegativesampleNo.陽性率Positiverate/%PEDV6723443433PCV26749187313PEDV+PCV26711561642
表3 單項PEDV RT-PCR、PCV2 PCR與復合PCR對臨床病料檢測結果比較
Table 3 Detection results of multiplex PCR compared with PEDV RT-PCR and PCV2 PCR

病毒種類Virusspecies檢測樣品數量Totalsamplenumber單項檢測陽性數positivecountstestedbyPEDVRT?PCRandPCV2PCR復合PCR檢測陽性數PositivecountstestedbyMultiplexPCR陽性符合率Positivecoincidencerate/%PEDV672323100PCV2674949100PEDV+PCV2671111100
感染以致疫情加劇。隨著我國養豬業規模化集約化的發展,豬群之間接觸的概率增大,患病豬群多呈現混合感染現象,豬群死亡率大幅度上升,PED也會因為PCV2的垂直傳播而變得易發,使得二者的混合感染更加嚴重,病癥更加明顯,病情更加嚴重[8-11]。筆者認為,造成疫情嚴重的主要原因在于免疫接種的重視程度差異、飼喂方式差異、胎次差異等。根據本試驗檢測結果顯示,在臨床表現為腹瀉的仔豬病料中,PEDV、PCV2兩種導致腹瀉病毒的抗原檢測有較高的陽性檢出率,PEDV、PCV2混合感染豬場相較單獨感染PEDV、PCV2的豬場而言死亡率增加30%左右。對此應引起高度重視,故本試驗建立的這種快速有效檢測這兩種疾病的復合PCR方法意義重大。
以往實驗室常規使用的單一PCR[12]或RT-PCR[13]檢測方法,需要分別使用不同引物單獨擴增,分別鑒定,耗時長、檢測成本高,而本試驗可以節約一半以上的時間及成本。與李維華等[14]研究報告相比,本方法可根據臨床病癥以及季節性特征對PEDV、PCV2這2種疾病的可疑病料進行針對性的檢測,具有省時、省力、不浪費檢測試劑去檢測其余不相關病毒病,從而降低檢測成本的優點。根據2病毒的標準參考株的保守序列設計特異性引物,以抽提的DNA和RNA反轉錄的cDNA為模板進行復合PCR方法的構建與優化,發現在退火溫度為63 ℃時其擴增效果最好,沒有任何非特異擴增條帶。研究中所設計的2對引物長度分別為530 bp 、278 bp,在特異性試驗中,本方法能擴增出特異的陽性條帶,且本試驗檢測的所有其他易引起腹瀉的病毒(豬偽狂犬病病毒、豬細小病毒、豬繁殖與呼吸綜合征病毒、豬瘟病毒、豬傳染性胃腸炎、豬輪狀病毒等)和陰性對照均未出現非特異性擴增,說明該方法特異性良好。在敏感性試驗中,本方法與普通PCR相比較敏感性更高。在對臨床樣品的檢測比較中,筆者發現這種同時檢測PEDV、PCV2兩種疾病的復合PCR的方法與單項PCR、RT-PCR檢測的符合率達到100%,說明該方法在臨床上具有重要的應用前景。
[1] CHEN J F, WANG C B, SHI H Y, et al. Molecular epidemiology of porcine epidemic diarrhea virus in China[J].ArchivesofVirology, 2010, 155(9):1471-1476.
[2] 殷震, 劉景華. 動物病毒學 [M]. 北京:科學出版社, 1997: 562-571.
[3] 陸承平. 獸醫微生物學[M]. 北京:中國農業出版社,20014:72.
[4] MEEHAN BM, MCNEILLY F, MCNAIR I, et al. Isolation and characterization of porcine circovirus 2 from cases of sow abortion and porcine dermatitis and nephropathy syndrome[J].ArchivesofVirology, 2001, 146(4):835-842.
[5] TISCHER I, GEIDERBLOM H, VETTERMANN W, et al. A very small porcine virus with circular single-stranded DNA[J].Nature, 1982, 295(5844):64-66.
[6] NICHOL S T, BEATY B J, ELLIOTT R M, et al. Virus Taxonomy: Classification and Nomenclature of Viruses [M]// FAUQUET C M, MAYO M A, MANILOFF J, et al. Virus Taxonomy, 8th Report of the International Committee for the Taxonomy of Viruses. Oxford, UK: Academic Press, 2005: 695-716.
[7] DARWICH L, MATEU E. Immunology of porcine circovirus type 2(PCV2)[J].VirusResearch, 2012, 164(1/2):61-67.
[8] KIM J, HA Y, JUNG K, et al. Enteritis associated with porcine circovirus 2 in pigs[J].CanadianJournalofVeterinaryResearch, 2004, 68(3):218-221.
[9] JUNK K, KIM J, HA Y, et al. The effects of transplacental porcine circovirus type 2 infection on porcine epidemic diarrhea virus-induced enteritis in pre-weaning piglets[J].TheVeterinaryJournal, 2006, 171(3):445-450.
[10] JUNK K, HA Y, HA S K, et al. Identification of porcine circovirus type 2 in retrospective cases of pigs naturally infected with porcine epidemic diarrhea virus[J].TheVeterinaryJournal, 2006, 171(1):166-168.
[11] LUO Y, LI S, SUN Y, et al. Classical swine fever in China: a mini review[J].VeterinaryMicrobiology, 2014. 172(1/2):1-6.
[12] 蔣成硯,謝昆,田婷. 豬圓環病毒2型PCR檢測方法的建立及應用[J]. 黑龍江畜牧獸醫,2012(12):83-85. JIANG C Y, XIE K, TIAN T. Establishment and application of PCR detection method for porcine circovirus type 2[J].HeilongjiangAnimalScienceandVeterinaryMedicine, 2012(12):83-85.(in Chinese)
[13] 杜堅,白安斌,李斌,等. 應用RT-PCR檢測豬流行性腹瀉病毒[J]. 動物科學與動物醫學,2005,22(12):22-23. DU J, BAI A B, LI B, et al. Detection of porcine epidemic diarrhea virus by RT-PCR[J].AnimalScienceandAnimalMedicine, 2005, 22(12):22-23.(in Chinese)
[14] 李維華,任慧英,劉文華,等. PCV2、PPV、PRV、PRRSV和CSFV復合PCR的應用研究[J]. 西北農業學報,2008,17(3):12-15. LI W H, REN H Y, LIU W H, et al. Application of the multiplex PCR detecting PCV2, PPV, PRV, PRRSV and CSFV[J].ActaAgriculturaeBoreali-occidentalisSinica, 2008, 17(3):12-15.(in Chinese with English abstract)
(責任編輯 盧福莊)
Establishment of a multiplex PCR for porcine epidemic diarrhea virus and porcine circovirus type 2
GONG Shuangyana, LI Xiaojinga, CHEN Yingqia, CAI Yaoa, LI Yumenga, XU Yifeia, ZHU Linga,b, XU Zhiwena,b,*
(a.CollegeofVeterinaryMedicine; b.KeyLaboratoryofAnimalDiseaseandHumanHealthofSichuanProvince,SichuanAgriculturalUniversity,Chengdu611130,China)
In order to study the infection status of porcine epidemic diarrhea virus (PEDV) and porcine circovirus type 2 (PCV2) in diarrhea piglets, a multiplex PCR method for simultaneous detection of PEDV and PCV2 mixed infection was established. According to the published sequence of PEDV and PCV2 in GenBank, 2 pairs of specific primers were designed and synthesized for the conserved region, and the amplified fragments were 530 and 278 bp, respectively. The multiplex PCR method for the specific detection of PEDV and PCV2 was established by optimizing the reaction conditions. A total of 67 diarrhea samples (mixed mesenteric lymph nodes, intestinal mucosa and their contents) were collected from Leshan, Yibin, Guangyuan and Suining of Sichuan Province from April to August, 2016, and were detected by multiplex PCR. The results showed that the single infection positive rates of PEDV and PCV2 was 34.33% and 73.13%, respectively. The combined infection rate of PEDV and PCV2 was 16.42%. The coincidence rates of the multiplex PCR method and the specific detection methods of PCV2 PCR and PEDV RT-PCR were all 100%.
porcine epidemic diarrhea virus; porcine circovirus type 2; multiplex PCR
http://www.zjnyxb.cn
10.3969/j.issn.1004-1524.2017.07.05
2016-12-27
四川省科技支撐計劃(2017NZ0038);“十二五”農村領域國家科技計劃課題(2015BAD12B04-2.3)
龔雙燕(1994—),女,重慶開縣人,碩士研究生,主要從事動物傳染病病原分子生物學研究。E-mail: 654392857@qq.com
*通信作者,徐志文,E-mail: abtcxzw@126.com
S855.3
A
1004-1524(2017)07-1086-07
浙江農業學報ActaAgriculturaeZhejiangensis, 2017,29(7): 1086-1092
龔雙燕,李小璟,陳瑛琪,等. 豬流行性腹瀉病毒與圓環病毒2型復合PCR方法的建立[J].浙江農業學報,2017,29(7): 1086-1092.

