棉鈴蟲甾醇載體蛋白2原核表達及純化
杜新凱,任 娟,胡 珺,王常高,林建國,蔡 俊,杜 馨
(湖北工業大學 發酵工程教育部重點實驗室,工業發酵湖北省協同創新中心,工業微生物湖北省重點實驗室,湖北 武漢 430068)
棉鈴蟲甾醇載體蛋白2原核表達及純化
杜新凱,任 娟,胡 珺,王常高,林建國,蔡 俊,杜 馨*
(湖北工業大學 發酵工程教育部重點實驗室,工業發酵湖北省協同創新中心,工業微生物湖北省重點實驗室,湖北 武漢 430068)
甾醇載體蛋白2(SCP-2)在昆蟲體內甾醇吸收及運輸過程中有著重要的生理功能。試驗構建重組表達質粒pET-22b/HaSCP2,轉化至E.coliBL21 (DE3)進行誘導表達,并對IPTG濃度、誘導時間及溫度進行優化,經Ni柱分離純化后分析其與膽固醇結合活性。SDS-PAGE分析表明,重組蛋白相對分子質量約為16 ku,且在25 ℃,IPTG終濃度0.2 mmol·L-1下誘導10 h為最佳誘導表達條件。經熒光探針8-苯胺-1-萘磺酸(1,8-ANS)競爭分析,膽固醇與HaSCP-2結合半數有效濃度(EC50)為29.03 μmol·L-1。該研究為深入研究棉鈴蟲SCP-2的功能以及后續HaSCP-2抑制劑的篩選研究奠定了基礎。
棉鈴蟲;甾醇載體蛋白2;原核表達;原核純化;原核優化
甾醇載體蛋白(sterol carrier protein-2,SCP-2)又稱非特異性脂轉運蛋白(non-specific lipidtransfer proteins,nsLTPs),是一類堿性可溶的低分子量蛋白質,廣泛存在于動物、植物、細菌、真菌中[1]。已知的含SCP-2結構域家族包括:SCP-2、SCP-x、類SCP-2(SCP-2-like)、17-β-羥基固醇脫氫酶Ⅳ (17-β-hydroxysteroid dehydrogenase-4)、短鏈脫氫酶(short-chain dehydrogenase) 和血紅細胞膜整合蛋白(stomatin)。SCP-2主要參與胞內膽固醇、脂肪酸和脂肪酸輔酶A的吸收、轉運、氧化、酯化,以及磷脂代謝和信號傳遞等[2-3]。與哺乳動物不同,昆蟲自身不能合成類固醇,必須從食物中獲取谷甾醇、菜油甾醇、豆甾醇和麥角甾醇等植物甾醇,再轉化為自身必須的膽固醇[4-5]。因此,昆蟲SCP-2在甾醇代謝過程中扮演重要的角色。
目前,已在果蠅(Drosophilamelanogaster)、埃及伊蚊(Aedesaegypti)、棉貪夜蛾(Spodopteralittoralis)、家蠶(Bombyxmori)、斜紋夜蛾(Spodopteralitura)、煙草天蛾(Manducasexta)和棉鈴蟲(Helicoverpaarmigera)[6-12]等多種昆蟲中發現了SCP-x/2基因。SCP-2蛋白在體內獨立表達,其大小約13~16 ku。SCP-2功能研究發現,在培養的埃及伊蚊、斜紋夜蛾細胞中超表達SCP-2,促進了膽固醇的吸收和積累。此外,埃及伊蚊、斜紋夜蛾、棉鈴蟲幼蟲RNA干擾與定點突變明顯降低膽固醇的水平[13-16]。目前,關于SCP-2在體內膽固醇詳細的轉運機制仍不清楚。
棉鈴蟲是一類極具破壞性的世界農業害蟲,對棉花,玉米,番茄和小麥等至少60種宿主植物造成危害[17]。據統計,棉鈴蟲已對多種殺蟲劑如擬除蟲菊酯類、煙堿類、阿維菌素、多殺菌素、有機磷、氨基甲酸酯以及Bt毒素等產生抗性[18]。近年來關于昆蟲SCP-2抑制劑研究發現,埃及伊蚊SCP-2抑制劑(AeSCPIs)抑制蚊子和煙草天蛾幼蟲對膽固醇的吸收,同時具有明顯的致死效果[11,19-20]。此外,對棉鈴蟲的研究發現,AeSCPIs影響幼蟲發育,對低齡幼蟲具有致命性,同時推遲幼蟲化蛹和化蛾時間,降低卵孵化率[12]。昆蟲SCP-2作為新的害蟲防治的靶點,對新型殺蟲劑的開發具有重要意義。本文通過克隆棉鈴蟲SCP-2基因,進行構建表達載體,原核表達及其蛋白活性分析為進一步HaSCP-2的生物學功能和后續HaSCP-2抑制劑的篩選研究奠定了基礎。
1 材料與方法
1.1 試驗用昆蟲、菌株及質粒
試驗用棉鈴蟲購自湖北生物農藥工程研究中心,實驗室培養。大腸埃希菌E.coliBL21(DE3) 及質粒載體pET-22b由本實驗室保存。
1.2 主要試劑及儀器
質粒DNA提取試劑盒,第一鏈cDNA合成試劑盒購自天根生化科技有限公司;T4 DNA連接酶、限制性內切酶(NdeⅠ和XhoⅠ)、DNA Marker及PCR試劑購自寶生物工程(大連)有限公司;Taq聚合酶、蛋白Marker購自Thermo scientific公司;氨芐青霉素(Amp)、IPTG購自Amresco公司;8-苯胺-1-萘磺酸(1, 8-ANS)購自阿拉丁生化科技有限公司;膽固醇購自國藥集團化學試劑有限公司;其他試劑均為國產分析純。引物合成、測序由南京金斯瑞生物科技有限公司完成。
VeritiTMPCR儀購自美國ABI公司;ZHWY恒溫搖床購自上海智誠分析儀器制造有限公司;JY92-11超聲波細胞粉碎機購自寧波新芝生物科技股份有限公司;DYCZ-24DN蛋白質電泳儀購自北京六一儀器廠;NGC蛋白層析儀購自美國BIO-RAD公司;Synergy2酶標儀購自美國BioTek公司;GBOX凝膠成像儀購自英國Syngene公司。
1.3HaSCP-2基因原核表達載體的構建及鑒定
棉鈴蟲中腸總RNA提取及第一鏈cDNA合成參照文獻[12]。根據HaSCP-x基因序列(GenBank JN582013)設計HaSCP-2擴增引物HaSCP-2F:ATCATATGATGTACCGCAAAGGATTC和HaSCP-2R:GTCTCGAGCCTATTTACAGTTTGGAACGA,添加NdeI和XhoI酶切位點。以cDNA為模板進行PCR擴增,反應體系:cDNA 1 μL,10×PCR buffer 2.5 μL,dNTP 0.5 μL,HaSCP-2F 0.5 μL,HaSCP-2R 0.5 μL,Taq連接酶 0.5 μL,加無菌水至25 μL。反應條件為94 ℃預變性2 min;94 ℃變性30 s,56 ℃退火30 s,72 ℃延伸40 s,35個循環;72℃延伸2 min。通過PCR擴增得到HaSCP-2基因序列,經酶切后插入同樣酶切的pET-22b載體上。轉化至大腸埃希菌E.coliBL21(DE3)中,在含氨芐青霉素(100 μg·mL-1)的LB平板上37 ℃過夜培養12 h。篩選陽性克隆單菌株,根據質粒DNA提取試劑盒說明書提取重組質粒并進行PCR擴增鑒定及測序鑒定。
1.4 HaSCP-2蛋白的誘導表達及條件優化
取陽性單克隆菌株接種于含終濃度100 μg·mL-1氨芐青霉素的LB液體培養基中,37 ℃、180 r·min-1過夜培養10 h。再以1%接種量接種到含新鮮氨芐青霉素的LB液體培養基中培養,至D600值為0.6~0.8時,加入IPTG至終濃度0.3 mmol·L-1于30 ℃、220 r·min-1誘導表達10 h。培養菌液經5 000 r·min-1離心5 min,PBS(pH 7.3)重懸后,加入Loading buffer,加熱煮沸5 min,通過15% SDS-PAGE電泳分析菌體重組蛋白表達情況。
1.4.1 誘導劑IPTG濃度的優化
按上述方法活化含重組質粒菌株,以1∶50比例接種到新鮮培養基中,至D600值為0.6~0.8時分別加入終濃度為0、0.2、0.4、0.6、0.8、1.0和1.2 mmol·L-1的IPTG,30 ℃、220 r·min-1誘導表達10 h。收集菌液,經離心、PBS(pH 7.3)重懸后,通過12% SDS-PAGE電泳分析菌體重組蛋白表達情況。
1.4.2 誘導溫度的優化
重組質粒菌株培養同上,在最適IPTG濃度條件下,分別在20、25、30和37 ℃條件下220 r·min-1誘導10 h。收集菌液,經離心、PBS(pH 7.3)重懸后,通過12% SDS-PAGE電泳分析菌體重組蛋白表達情況。
1.4.3 誘導時間的優化
重組質粒菌株培養同上,在最適IPTG濃度和最適溫度情況下,220 r·min-1分別誘導2、4、6、8、10和12 h。收集菌液,經離心、PBS(pH 7.3)重懸后,通過15% SDS-PAGE電泳分析菌體重組蛋白表達情況。
1.5 HaSCP-2蛋白的純化
取陽性重組菌活化后,以1∶100比例擴大培養,按誘導表達優化后條件進行誘導表達。收集菌液,5 000 r·min-1離心5 min,PBS(pH 7.3)重懸后,再離心并用平衡緩沖液(25 mmol·L-1咪唑,20 mmol·L-1Tris-HCl,150 mmol·L-1NaCl,pH 8.0)重懸,于冰浴中超聲破碎裂解,功率180 W,超聲6 s,間隔4 s。10 000 r·min-1,4 ℃,離心15 min,取上清液。將上清液經0.45 μm濾膜過濾后于鎳離子層析柱進行親和純化,用洗脫緩沖液(300 mmol·L-1咪唑,20 mmol·L-1Tris-HCl,150 mmol·L-1NaCl,pH 8.0)梯度洗脫目的蛋白。純化后的蛋白在冰水浴下透析約10 h,再經超濾管濃縮。通過15%的SDS-PAGE電泳分析HaSCP-2重組蛋白的純度,采用Bradford法[21]測定純化的蛋白濃度。
1.6 HaSCP-2蛋白與膽固醇結合活性
使用8-苯胺-1-萘磺酸(1,8-ANS)熒光探針檢測其與HaSCP-2蛋白結合能力。在200 μL反應體系中,加入純化后的重組HaSCP-2蛋白終濃度為30 mmol· L-1,不同終濃度的1,8-ANS分別為0,5,10,15,20,25,30,35,40,45,50和55 μmol·L-1。孵育3 min后,酶標儀檢測,激發光360 nm,發射光460 nm,狹縫均為20 nm。記錄HaSCP-2蛋白和不同濃度1,8-ANS反應后的熒光值,分析結合能力,計算公式:Y=Bmax×X/(Kd+X)。
膽固醇與HaSCP-2蛋白結合親和力通過競爭取代分析測定。在96孔熒光酶標板中,10 μmol·L-1重組HaSCP-2蛋白與20 μmol·L-11,8-ANS混合反應2 min,在加入不同濃度膽固醇溶液(終濃度5、10、20、50和100 μmol·L-1),反應3 min后記錄熒光值。通過單位點競爭結合,非線性回歸分析計算半數效應濃度(EC50),計算公式為:Y=Best fit value MIN + (Best fit value MAX-Best fit value MIN)/(1+10(X-lgEC50)) 。
2 結果與分析
2.1HaSCP-2基因原核表達載體的構建及鑒定
從棉鈴蟲中腸總RNA反轉錄得到cDNA序列,以HaSCP-2F和HaSCP-2R為引物擴增得到HaSCP-2基因序列,經NdeI和XhoI酶切插入同樣酶切的pET-22b載體上,轉化到E.coliBL21(DE3)感受態細胞中,挑選陽性克隆菌提取重組質粒,PCR鑒定(圖1)和基因測序驗證,測序結果與NCBI上HaSCP-2序列一致,表明成功構建重組質粒。

M, DL2000 DNA Marker;1, pET-22b/HaSCP2重組質粒PCR產物M,DL2000 DNA Marker;1,pET-22b/HaSCP2 plasmids PCR product圖1 重組pET-22b/HaSCP2質粒PCR鑒定Fig.1 Identification of pET-22b/HaSCP-2 plasmids PCR amplification
2.2 HaSCP-2蛋白的誘導表達及條件優化
取含重組質粒pET-22b/HaSCP-2的BL21(DE3)菌株進行培養,經IPTG誘導表達,SDS-PAGE電泳分析結果表明,在16 ku左右出現一條蛋白帶,與目標蛋白分子量相符;未誘導重組菌則無該蛋白表達。由此可見,該蛋白條帶為重組HaSCP-2蛋白。
通過對誘導劑IPTG濃度,誘導溫度和誘導時間進行優化,SDS-PAGE電泳結果顯示在30 ℃、不同IPTG濃度下誘導10 h,目標蛋白的表達量并沒有太大變化(圖2)。高濃度的IPTG沒有明顯增加蛋白含量,考慮到高濃度IPTG對細胞的抑制影響,選擇最佳IPTG濃度為0.2 mmol·L-1;分別在20、25、30和37 ℃,終濃度0.2 mmol·L-1IPTG下誘導10 h(圖3),蛋白表達量在25 ℃時最大,隨著溫度的升高,蛋白表達量明顯下降,因此選擇最佳誘導溫度25 ℃;在25 ℃,終濃度0.2 mmol·L-1IPTG下分別誘導2、4、6、8、10和12 h(圖4),在0~10 h蛋白表達量隨著時間的增加而增加,10 h后表達量穩定,因此選擇最佳誘導時間為10 h。
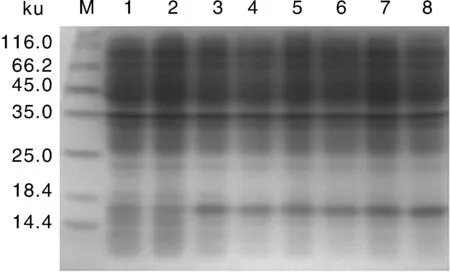
M, 蛋白質分子量標準;1~2, 未誘導組;3~8, 不同濃度IPTG濃度(0.2、0.4、0.6、0.8、1.0和1.2 mmol·L-1)處理組M, Marker; 1-2, Non-induced group; 3-8, Treatments of different concentrations of IPTG (0.2, 0.4, 0.6, 0.8, 1.0, 1.2 mmol·L-1)圖2 誘導劑IPTG對重組HaSCP-2蛋白表達的影響Fig.2 Effects of IPTG concentrations on the expression of recombinant HaSCP-2 protein
2.3 HaSCP-2蛋白的純化
在最佳誘導條件下對重組菌大量誘導表達,經親和鎳柱結合后,在150 mmol·L-1咪唑濃度下開始洗脫蛋白,再透析脫鹽。純化產物經SDS-PAGE分析,在16 ku處得到較純的重組HaSCP-2蛋白,含量在90%以上。純化的蛋白經Bradford法測得的濃度為1.003 mg·mL-1(圖5)。

M, 蛋白質分子量標準;1~4, 不同誘導溫度(20、25、30和37 ℃)實驗組;5, 未誘導組M, Marker; 1-4, Treatments of different temperature (20, 25, 30, 37 ℃); 5, Non-induced group圖3 誘導溫度對重組HaSCP-2蛋白表達的影響Fig.3 Effects of induced temperature on the expression of recombinant HaSCP-2 protein

M, 蛋白質分子量標準;1, 未誘導組;2~6, 實驗組不同誘導時間依次為2、4、6、8、10和12 hM, Marker; 1, Non-induced group; 2-6, Treatments of different induced time (2, 4, 6, 8, 10, 12 h)圖4 誘導時間對重組HaSCP-2蛋白表達的影響Fig.4 Effects of induced time on the expression of recombinant HaSCP-2 protein
2.4 HaSCP-2蛋白與膽固醇結合活性
熒光探針1,8-ANS與HaSCP-2蛋白結合曲線如圖6所示,隨著1,8-ANS濃度的升高,熒光強度逐漸升高,在50 μmol·L-1濃度后熒光值趨于飽和,表明蛋白和1,8-ANS有效結合。通過單位點結合、非線性回歸分析得到HaSCP-2蛋白與1,8-ANS的結合常數為1.973 μmol·L-1(R2= 0.98)。
HaSCP-2蛋白與1,8-ANS結合后,通過不同濃度膽固醇競爭取代1,8-ANS。如圖7,隨著膽固醇濃度的升高,體系相對熒光強度(relative fluorescence units,RFU)降低,表明熒光探針1,8-ANS被膽固醇從蛋白結合位點競爭取代,通過計算得到膽固醇結合半數有效劑量EC50值為29.03 μmol·L-1。

M, 蛋白質分子量標準;1, 未誘導菌液;2, 誘導后菌液;3, 經鎳柱純化重組HaSCP-2蛋白;4, 透析后重組HaSCP-2蛋白M, Marker; 1, Non-induced bacteria liquid; 2, Induced bacteria liquid; 3, Recombinant HaSCP-2 protein purified through Ni2+-affinity column; 4, Recombinant HaSCP-2 protein after dialysis圖5 重組HaSCP-2蛋白的SDS-PAGE分析Fig.5 SDS-PAGE analysis of recombinant HaSCP-2 protein

圖6 HaSCP-2蛋白與1,8-ANS結合曲線Fig.6 Binding curve of HaSCP-2 protein and 1,8-ANS

圖7 1,8-ANS與膽固醇競爭結合HaSCP-2分析Fig.7 Competitive binding assay of 1,8-ANS in HaSCP-2 with cholesterol
3 討論
昆蟲SCP-2蛋白在中腸細胞中表達量最高,能更好的吸收膽固醇,對昆蟲正常生長、發育和繁殖起著重要的作用[11-12,22]。本研究從棉鈴蟲中腸提取RNA,克隆HaSCP-2基因,選用大腸埃希菌做為克隆和表達。大腸埃希菌易繁殖培養,已被廣泛應用于表達宿主菌。pET-22b系統所帶His標簽小,不影響目的蛋白結構和功能,且蛋白表達量大,易純化,故以此進行克隆表達。PCR條帶單一,且序列一致,說明該載體可用于重組HaSCP-2表達。重組蛋白原核表達受誘導劑、誘導溫度和時間的影響,對誘導條件優化可提高重組蛋白的產量。在不同IPTG濃度下,重組蛋白產量并沒有顯著變化,高濃度的IPTG可能抑制重組蛋白的表達,因此低濃度的IPTG濃度更適合用于誘導表達。隨著溫度的升高,蛋白產量反而下降,這表明30~37 ℃下菌體更容易生長。在最適IPTG濃度和誘導溫度下,蛋白量不斷積累,10 h后蛋白量變化不大。因此,重組蛋白最佳誘導表達條件為25 ℃,IPTG終濃度0.2 mmol·L-1下誘導10 h。
SCP-2與配體結合親和力通過競爭取代分析,常用的熒光探針有NBD放射標記膽固醇(NBD-cholesterol)[14]和8-苯胺-1-萘磺酸(1,8-ANS)[15]。1,8-ANS相比NBD膽固醇更加廉價,且適合大規模藥物篩選。1,8-ANS在水溶液中幾乎無熒光,但是與蛋白疏水性表面結合后發出熒光,因此可用來作為探針用于競爭取代分析。重組HaSCP-2與1,8-ANS結合后發出熒光,可判斷1,8-ANS結合到蛋白疏水腔中,天然底物膽固醇競爭取代1,8-ANS后熒光強度下降,表明蛋白具有生物學活性,且半數有效劑量EC50值為29.03 μmol·L-1。綜上所述,本試驗可為后續HaSCP-2抑制劑的研發及SCP-2特異性新型農藥的研發奠定基礎。
[1] GALLEGOS A M, ATSHAVES B P, STOREY S M, et al. Gene structure, intracellular localization, and functional roles of sterol carrier protein-2[J].ProgressinLipidResearch, 2001, 40(6): 498-563.
[2] STOLOWICH N, PETRESCU A, HUANG H, et al. Sterol carrier protein-2: structure reveals function[J].CellularandMolecularLifeSciences, 2002, 59(2): 193-212.
[3] SCHROEDER F, ATSHAVES B P, MCINTOSH A L, et al. Sterol carrier protein-2: New roles in regulating lipid rafts and signaling[J].BiochimicaetBiophysicaActa(BBA) -MolecularandCellBiologyofLipids, 2007, 1771(6): 700-718.
[4] CLARK A, BLOCH K. The absence of sterol synthesis in insects[J].JournalofBiologicalChemistry, 1959, 234(10): 2578-2582.
[5] IKEKAWA N, MORISAKI M, FUJIMOTO Y. Sterol metabolism in insects: dealkylation of phytosterol to cholesterol[J].AccountsofChemicalResearch, 1993, 26(4): 139-146.
[6] KITAMURA T, KOBAYASHI S, OKADA M. Regional expression of the transcript encoding sterol carrier protein x-related thiolase and its regulation by homeotic genes in the midgut of Drosophila embryos[J].Development,Growth&Differentiation, 1996, 38(4): 373-381.
[7] KREBS K C, LAN Q. Isolation and expression of a sterol carrier protein-2 gene from the yellow fever mosquito,Aedesaegypti[J].InsectMolecularBiology, 2003, 12(1): 51-60.
[8] TAKEUCHI H, CHEN J, JENKINS J, et al. Characterization of a sterol carrier protein 2/3-oxoacyl-CoA thiolase from the cotton leafworm (Spodoptera littoralis): a lepidopteran mechanism closer to that in mammals than that in dipterans[J].BiochemicalJournal, 2004, 382: 93-100.
[9] GONG J, HOU Y, ZHA X F, et al. Molecular cloning and characterization of Bombyx mori sterol carrier protein x/sterol carrier protein 2 (SCPx/SCP2) gene[J].DNASequence, 2006, 17(5): 326-333.
[10] GUO X R, ZHENG S C, LIU L, et al. The sterol carrier protein 2/3-oxoacyl-CoA thiolase (SCPx) is involved in cholesterol uptake in the midgut of Spodoptera litura: gene cloning, expression, localization and functional analyses[J].BMCMolecularBiology, 2009, 10(1): 102.
[11] KIM M S, LAN Q. Sterol carrier protein-x gene and effects of sterol carrier protein-2 inhibitors on lipid uptake inManducasexta[J].BMCPhysiology, 2010, 10(1): 1-15.
[12] DU X, MA H, ZHANG X, et al. Characterization of the sterol carrier protein-x/sterol carrier protein-2 gene in the cotton bollworm,Helicoverpaarmigera[J].JournalofInsectPhysiology, 2012, 58(11): 1413-1423.
[13] LAN Q, WESSELY V. Expression of a sterol carrier protein-x gene in the yellow fever mosquito,Aedesaegypti[J].InsectMolecularBiology, 2004, 13(5): 519-529.
[14] RADEK J T, DYER D H, LAN Q. Effects of mutations in Aedes aegypti sterol carrier protein-2 on the biological function of the protein[J].Biochemistry, 2010, 49(35): 7532-7541.
[15] Zhang L, Li D, Xu R, et al. Structural and functional analyses of a sterol carrier protein inSpodopteralitura[J].PLoSOne, 2014, 9(1): e81542.
[16] Ma H, Ma Y, Liu X, et al. NMR structure and function of Helicoverpa armigera sterol carrier protein-2, an important insecticidal target from the cotton bollworm[J].ScientificReports, 2015, 5(1): 18186.
[17] Czepak C, Albernaz K C, Vivan L M, et al. First reported occurrence ofHelicoverpaarmigera(Hübner)(Lepidoptera: Noctuidae) in Brazil[J].PesquisaAgropecuriaTropical, 2013, 43(1): 110-113.
[18] Arthropod Pesticide Resistance Database (APRD)[EB/OL].[2016-12-20]. http://www.pesticideresistance.org/.
[19] KIM M S, WESSELY V, LAN Q. Identification of mosquito sterol carrier protein-2 inhibitors[J].JournalofLipidResearch, 2005, 46(4): 650-657.
[20] LARSON R T, WESSELY V, JIANG Z, et al. Larvicidal activity of sterol carrier protein-2 inhibitor in four species of mosquitoes[J].JournalofMedicalEntomology, 2008, 45(3): 439-444.
[21] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].AnalyticalBiochemistry, 1976, 72(1-2): 248-254.
[22] LAN Q, MASSEY R J. Subcellular localization of the mosquito sterol carrier protein-2 and sterol carrier protein-x[J].JournalofLipidResearch, 2004, 45(8): 1468-1474.
(責任編輯 張 韻)
Prokaryotic expression and purification of sterol carrier protein-2 fromHelicoverpaarmigera
DU Xinkai, REN Juan, HU Jun, WANG Changgao, LIN Jianguo, CAI Jun, DU Xin*
(KeyLaboratoryofFermentationEngineering(MinistryofEducation),HubeiProvincialCooperativeInnovationCenterofIndustrialFermentation,HubeiKeyLaboratoryofIndustrialMicrobiology,HubeiUniversityofTechnology,Wuhan430068,China)
Sterol carrier protein 2 (SCP-2) plays important physiological roles in sterols absorption and transport in insects. In this study, the recombinant expression plasmid pET-22b/HaSCP2 was constructed and transformed intoE.coliBL21 (DE3) for inducible expression. Induction conditions of the IPTG concentrations, the induction time and temperature were optimized. The recombinant HaSCP-2 was purified using Ni2+-affinity column, and the protein functions of HaSCP-2 was tested by competitive displacement assay. SDS-PAGE analysis suggested that the molecular weight of the recombinant protein was about 16 ku, and the optimal expression conditions were at the temperature of 25 ℃ and at the final concentration of 0.2 mmol·L-1IPTG for 10 h. Fluorescent probe 8-aniline-1-naphthalenesulfonic acid (1,8-ANS) was used for competitive analysis, and 1,8-ANS was replaced by cholesterol bound to HaSCP-2 with a half effective concentration (EC50) of 29.03 μmol·L-1. This study provides good opportunity for further study on the function of HaSCP-2 and the screening of HaSCP-2 specific inhibitors.
Helicoverpaarmigera; sterol carrier protein-2; prokaryotic expression; prokaryotic purification; prokaryotic optimization
http://www.zjnyxb.cn
10.3969/j.issn.1004-1524.2017.07.15
2017-02-22
國家自然科學基金項目(31401807);湖北工業大學高層次人才科研啟動項目(BSQD13002);湖北工業大學大學生創新創業項目(201510500064)
杜新凱(1991—),男,河南靈寶人,碩士研究生,研究方向為發酵過程優化。E-mail: duxinkai78@163.com
*通信作者,杜馨,E-mail: 99023801@qq.com
S435
A
1004-1524(2017)07-1166-06
浙江農業學報ActaAgriculturaeZhejiangensis, 2017,29(7): 1166-1171
杜新凱,任娟,胡珺,等. 棉鈴蟲甾醇載體蛋白2原核表達及純化[J].浙江農業學報,2017,29(7): 1166-1171.

