葫蘆素類化合物的抑瘤作用及其作用機制和聯合用藥研究進展Δ
王文雪,牟艷玲,姚慶強#(1.濟南大學/山東省醫學科學院醫學與生命科學學院,濟南 250200;2.山東省醫學科學院藥物研究所,濟南 250062;3.衛生部生物技術藥物重點實驗室,濟南 250062;4.山東省罕少見病重點實驗室,濟南 250062)
葫蘆素類化合物的抑瘤作用及其作用機制和聯合用藥研究進展Δ
王文雪1,2,3,4*,牟艷玲2,3,4,姚慶強2,3,4#(1.濟南大學/山東省醫學科學院醫學與生命科學學院,濟南 250200;2.山東省醫學科學院藥物研究所,濟南 250062;3.衛生部生物技術藥物重點實驗室,濟南 250062;4.山東省罕少見病重點實驗室,濟南 250062)
目的:為發現新的抑瘤靶點、完善葫蘆烷型四環三萜類化合物的構效關系以及開發四環三萜類抗腫瘤新藥提供參考。方法:以“葫蘆素”“腫瘤”“Cucurbitacin”“Tumour”等為關鍵詞,組合查詢2005-2016年在PubMed、Wiley-Blackwell、EBSCO、中國知網、萬方、維普等數據庫中的相關文獻,對葫蘆素類化合物中抑瘤效果最明顯的葫蘆素B、D、E、I及雪膽甲素的抑瘤作用及其作用機制和聯合用藥進行綜述。結果與結論:共檢索到相關文獻237篇,其中有效文獻47篇。葫蘆素是從葫蘆科植物中分離出的葫蘆烷型四環三萜類化合物,其對乳腺癌、肺癌、結腸癌等抑瘤效果顯著,可通過誘導細胞凋亡、誘導細胞自噬、阻滯細胞周期、抑制腫瘤轉移、破壞細胞骨架以及調節細胞內的信號轉導子與轉錄激活子3、絲裂原激活的蛋白激酶等信號通路來發揮抑瘤作用。葫蘆素類藥物無論是與臨床上使用的藥物聯合還是自身聯合應用,均有較好的協同作用;此外,葫蘆素類藥物還能提高放療的敏感性,逆轉卵巢癌紫杉醇耐藥細胞的多藥耐藥。目前,關于葫蘆素的抗腫瘤研究雖然很多,但大多集中于體外研究,體內研究較少且未見臨床應用。今后對含量豐富的葫蘆素類化合物開展抑瘤研究的同時,也應對其他的葫蘆素及衍生物進行研究對比。
葫蘆素;四環三萜類化合物;抗腫瘤藥;STAT3轉錄因子;肌動蛋白
近年來,癌癥已成為人類最大致死原因,我國癌癥的發病率和病死率也在逐年增加[1]。葫蘆素是從葫蘆科植物中分離出的葫蘆烷型四環三萜類化合物,該類化合物在結構上高度氧化,目前已經分離出了200多種葫蘆素及其衍生物[2-3]。現代藥理研究表明,葫蘆素具有抗腫瘤、抗菌消炎、抗人類免疫缺陷病毒(HIV)、保肝、提高機體免疫力等藥理活性。筆者總結了具有抗腫瘤活性的葫蘆素類化合物結構母核及結構式,見圖1、表1[4-10]。筆者以“葫蘆素”“腫瘤”“Cucurbitacin”“Tumour”等為關鍵詞,組合查詢2005-2016年在PubMed、Wiley-Blackwell、EBSCO、中國知網、萬方、維普等數據庫中的相關文獻。結果,共檢索到相關文獻237篇,其中有效文獻47篇。現對葫蘆素類化合物中抑瘤效果最明顯的葫蘆素B (CuB)、葫蘆素D(CuD)、葫蘆素E(CuE)、葫蘆素I(CuI)、雪膽甲素(CuⅡa)的抑瘤作用及其作用機制和聯合用藥進行綜述,以期為發現新的抑瘤靶點、完善葫蘆烷型四環三萜類化合物的構效關系以及開發四環三萜類抗腫瘤新藥提供參考。
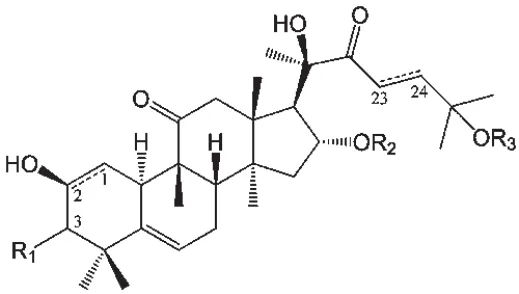
圖1 葫蘆素類化合物結構母核

表1 具有抗腫瘤活性的葫蘆素類化合物結構式
1 CuB
CuB是葫蘆素家族中含量最豐富的成員,對乳腺癌[11]、結腸癌[12]、喉癌[13]、肺癌[14]、黑色素瘤[15]、胰腺癌[16]、前列腺癌[17]等腫瘤細胞的增殖均有抑制作用,主要通過影響細胞信號轉導通路、阻滯細胞周期、誘導細胞凋亡、破壞細胞骨架來發揮抗腫瘤活性。
1.1 CuB對細胞信號轉導通路的影響
CuB影響細胞信號轉導通路的研究多集中在信號轉導子與轉錄激活子3(STAT3)和絲裂原激活的蛋白激酶(MAPK)信號轉導通路。但近幾年也有報道指出,葫蘆素抑瘤作用與STAT3無必然聯系。更值得關注的是,CuB對細胞形態及其他信號通路的影響早于STAT3信號通路的變化[18]。
1.1.1 STAT3信號轉導通路 STAT3是一種致癌基因轉錄因子,通過與其他轉錄因子如β-連環素、缺氧誘導因子1α(HIF-1α)、核因子κB(NF-κB)和原癌基因c-myc、c-jun等相互作用控制基因的表達,而且STAT3參與細胞死亡一般認為與細胞凋亡有關。阻斷STAT3信號通路中顯性失活的STAT3突變體或反義STAT3,可抑制與細胞凋亡相關的靶基因的表達,例如抗凋亡蛋白Bcl-xL、原癌基因c-myc、細胞周期蛋白Cyclin D1等。Zhang M等[19]對CuB進行了研究,發現CuB能阻滯人肺癌細胞A549于G2/M期,顯著抑制細胞增殖,并下調Bcl-2蛋白的表達,通過STAT3信號通路誘導人肺癌細胞A549凋亡。Zheng Q等[20]研究CuB對人神經母細胞瘤SH-SY5Y的抑瘤作用中發現,CuB不僅阻滯細胞于G2/M期,而且可下調磷酸化蛋白酪氨酸激酶2(JAK2)、磷酸化STAT3的表達,誘導細胞凋亡。然而,也有報道指出,抑制STAT3的活化并不是CuB抑瘤的機制。Yasuda S等[12]在給予CuB 24 h后檢測人結腸癌細胞SW 480的周期分布時發現,G2/M期的細胞比例顯著提高,細胞周期蛋白Cyclin B1和Cdc25C蛋白水平顯著下調,抗凋亡蛋白Bcl-2、Bcl-xL并沒有明顯變化,提示在人結腸癌細胞SW 480中CuB并不能促進STAT3脫磷酸化而發揮誘導細胞凋亡作用;另外,該研究還發現人結腸癌細胞SW 480內活性氧(ROS)含量升高,并以ROS依賴的方式誘導細胞凋亡。Zhang T等[21]在研究葫蘆素化合物引發細胞死亡的作用機制中發現,葫蘆素化合物CuB、CuD及CuI可過度促進細胞自噬標記蛋白LC3由可溶形式轉變為脂溶形式,也可促進自噬體在多種細胞中積累;同時,還發現由葫蘆素引起的細胞自噬及死亡與抑制STAT3無關,與線粒體釋放的ROS升高有關。可見,CuB對STAT3信號通路的抑制存在爭議,這可能與腫瘤細胞種類及給藥濃度等有關,不能同一而論。
1.1.2 MAPK信號轉導通路 MAPK在細胞增殖、分化和凋亡等過程中均起著十分重要的作用。在哺乳類動物細胞中,與細胞外信號調節激酶(ERK)相關的細胞內信號轉導途徑被認為是經典的MAPK信號轉導途徑。CuB抑制人膠質瘤細胞SH-SY5Y ERK1/2磷酸化,促進c-jun氨基末端激酶(JNK)及絲裂原活化蛋白激酶p38 (p38MAPK)磷酸化[20],并能在短時間內顯著抑制人白血病細胞K562中c-Raf激酶、ERK1/2和絲裂原活化蛋白的磷酸化,該影響早于對STAT3信號通路的抑制[18]。然而,CuB并非能抑制所有腫瘤細胞ERK1/2的磷酸化。用CuB處理人肝癌細胞BEL-7402發現,CuB抑制c-Raf激酶激活的同時可促進ERK1/2的磷酸化[22],這種現象的產生可能與信號通路之間的交聯有關。此外,Zhang T等[21]也發現CuB、CuD及CuI可激活ERK和JNK的磷酸化,促進細胞自噬,平衡調節細胞自噬和細胞凋亡的水平,可更高效地促進細胞死亡。可見,由于細胞內信號轉導通路之間的交聯及不同種類的細胞分子水平表達的差異,導致CuB對MAPK信號轉導通路的影響很復雜,仍需進一步的研究。
1.1.3 其他作用靶點 除上述兩條研究較多的信號通路外,也發現了新的作用靶點。Gao Y等[17]體外研究發現,CuB低濃度下就能顯著抑制前列腺癌細胞的生長,同時激活細胞凋亡蛋白酶Caspase-3、Caspase-7,增加二磷酸腺苷核糖聚合酶(PARP)的剪切激活,阻滯細胞于G0/G1期,顯著誘導細胞凋亡;體內研究發現,CuB能顯著降低體內腫瘤形成的速率,且三磷酸腺苷檸檬酸裂解酶(ACLY)為CuB的體內外作用的靶點,CuB呈劑量依賴性地抑制ACLY的磷酸化。BRCA1蛋白是一個與遺傳性乳腺癌和卵巢癌相關的腫瘤抑制因子。Promkan M等[23]用CuB給藥處理4種乳腺癌細胞并分析抑癌基因p21、p27和存活蛋白的表達,發現CuB能明顯抑制BRCA1突變組和BRCA1敲除組乳腺癌細胞的增殖和轉移,促進p21Waf1和p27Kip1的表達,抑制存活蛋白的表達,提示存活蛋白可能是CuB抑制BRCA1缺失的乳腺癌細胞增殖的重要作用靶點。Shang Y等[24]在研究CuB對神經母細胞瘤細胞SH-SY5Y的抑制作用時發現,抑癌基因p21及p27的表達顯著增加,細胞周期蛋白Cyclin D1及Cyclin E的表達顯著降低(P<0.01);隨后的分子水平研究發現,NF-κB、一磷酸腺苷激活蛋白激酶(AMPK)和p38信號通路均不是CuB發揮抑制神經母細胞瘤作用的通路,蛋白激酶B(Akt)的過度表達會減弱CuB體外對神經母細胞瘤細胞SH-SY5Y增殖的抑制作用,表明CuB是通過上調抑癌基因PTEN的表達、抑制Akt信號通路的激活來發揮抗神經母細胞瘤作用。
1.2 CuB對細胞骨架的影響
肌動蛋白微絲的主要生物學功能是構成細胞骨架,其對細胞形態的維持具有重要意義。構成微絲的主要成分為肌動蛋白和肌動蛋白結合蛋白。在完成對細胞形態的維持、運動、分裂等各種功能時,肌動蛋白需要通過多種方式錨定在質膜上,與質膜蛋白如整合素發生連接。Gupta P等[11]經體外試驗研究發現,CuB能抑制多種乳腺癌細胞的生長,主要通過顯著抑制整合素A6、整合素B4的表達及誘導整合素B1、整合素B3的表達來發揮作用。雖然已有眾多研究表明葫蘆素類藥物破壞了肌動蛋白的聚合/解聚合動力學平衡,誘導肌動蛋白的異常聚集,從而引起細胞形態的迅速改變,但具體是影響了哪些肌動蛋白調控因子,現在還沒有統一的認識。Zhang Y等[15]研究顯示,小鼠黑色素瘤細胞B16F10經CuB處理后能快速引起細胞膜出泡和變形,阻滯細胞于G2/M期,并促使多倍體細胞的形成;此外,球型肌動蛋白(G-actin)迅速殆盡,肌動蛋白快速聚集。降低ROS的含量,能顯著減少G-actin的損耗,同時抑制CuB的抗腫瘤活性,推測CuB通過ROS依賴的方式誘導G-actin迅速殆盡從而發揮抗黑素瘤的效果。Kausar H等[14]對4種非小細胞肺癌細胞進行體外研究時發現,CuB能顯著改變細胞骨架肌動蛋白聚集,阻滯細胞于G2/M期,并調節線粒體凋亡途徑中的幾個關鍵的分子靶點促進細胞凋亡;進一步研究發現,CuB通過p38MAPK/熱休克蛋白27信號通路誘發細胞形態變化及骨架重塑,并非由三磷酸鳥苷蛋白酶和ROS的表達變化引起。
以上研究表明,CuB對各種癌細胞形態的影響是快速而顯著的,但影響細胞骨架肌動蛋白的方式因細胞而異。鑒于目前對CuB影響的肌動蛋白調控因子尚不明確,將肌動蛋白細胞骨架作為靶標依然是葫蘆素化合物抑瘤研究的熱點。
2 CuD
CuD對肺癌、結腸癌、前列腺癌及乳腺癌等腫瘤細胞具有顯著的細胞毒活性,其抗癌機制包括誘導細胞凋亡及阻滯細胞周期等。
Kim SR等[25]研究瓜蔞乙醇提取物及CuD抑制乳腺癌細胞MDA-MB-231增殖及誘導細胞凋亡時發現,兩者均可通過抑制STAT3磷酸化,引起細胞凋亡及G2/M期細胞阻滯。IshiiT等[26]體外研究多個濃度的CuD對多種人子宮內膜及卵巢癌細胞的影響時發現,CuD能促進細胞凋亡蛋白酶Caspase-3、Caspase-9的剪切激活,增加PARP的分裂和p21Waf1、p27Kip1的表達,減少Cyclin A及Cyclin B的聚集。此外,Spear SA等[27]用CuD處理2型神經纖維瘤細胞Sch10545和人腦膜瘤細胞Ben-Men-1時發現,CuD通過抑制結合蛋白PRAS40和Akt的磷酸化狀態發揮凋亡前分子效應,同時降低Cyclin A、Cyclin B和Cyclin E的表達。因此,CuD也被認為是治療2型神經纖維瘤及腦膜瘤的候選藥物。
以上研究表明,CuD與CuB在抑瘤方面有很多相似之處,它也能通過抑制STAT3信號通路誘導多種腫瘤細胞的凋亡。但CuD在抑瘤方面的研究明顯少于CuB,可能與其在天然藥物中的含量稍低有關。
鉆孔灌注樁施工中大部分施工內容都是在水下環境開展的,施工過程不能得到全面觀察,并且施工活動需要在最短時間內完成,實際施工難度較大,對施工人員施工經驗以及施工專業性要求較大。鉆孔灌注樁的施工主要有成孔與成樁兩個部分構成,實際操作程序就是放線定位、埋設護筒、成孔、鋼筋籠綁扎、混凝土灌注等,在各個施工環節需要對技術合理應用,強化施工質量控制。
3 CuE
CuE在葫蘆素家族中的含量豐富,在早期研究中發現,CuE具有調節免疫、抗炎及保護神經等藥理活性,最近幾年對CuE的研究集中在抗腫瘤活性方向。CuE抗腫瘤機制包括誘導細胞凋亡[28]、引發細胞自噬[29]、破壞細胞骨架[30]、阻滯細胞周期[28]等。
除CuB之外,CuE是另外一個在細胞骨架方面研究較多的葫蘆素化合物。整體上,CuE也是通過影響細胞骨架肌動蛋白調控因子、打破肌動蛋白聚合/去聚合狀態的平衡,來誘發肌動蛋白的異常聚集。Zhang T等[30]在研究CuE對乳腺癌轉移的影響時發現,腹腔注射CuE能明顯抑制乳腺腫瘤轉移至肺;進一步研究發現,CuE能損壞肌動蛋白相關蛋白2/3復合物依賴性的肌動蛋白聚集,并經肉瘤/局部黏著斑激酶/Ras相關的C3肉毒素底物1/基質金屬蛋白酶通路抑制乳腺癌轉移。Cofilin是常見的一種肌動蛋白結合蛋白,能在細胞內結合和解聚纖維狀肌動蛋白(F-actin),同時介導細胞內的信號通路,調節肌動蛋白骨架的重組,對維持細胞形態有重要意義。LIM激酶是一類具有絲氨酸/蘇氨酸和酪氨酸雙重活性的激酶。LIM激酶作為Cofilin的上游信號分子,可調控Cofilin自身N末端第3位點絲氨酸(Ser3)的磷酸化狀態,LIM激酶磷酸化后被激活,而后引起Cofilin的 Ser3磷酸化而失活,提高F-actin的穩定性。李麗等[31]研究CuE對人結腸癌細胞Caco-2增殖與遷移的影響時發現,CuE可能通過抑制LIM激酶/Cofilin信號通路而損害細胞骨架肌動蛋白,從而導致人結腸癌細胞Caco-2的增殖與遷移受到抑制。
除破壞細胞骨架外,MaG等[32]研究CuE對肺癌細胞95D的抗癌效果時發現,CuE能降低細胞的生存能力,抑制集落形成,同時以濃度依賴性的方式增加ROS水平,該水平可由抗氧化劑N-乙酰-L-半胱氨酸逆轉;CuE通過影響Bcl-2和Caspase的表達誘導ROS依賴性的細胞凋亡,而且能誘導防護性的細胞自噬,由經Akt/哺乳動物雷帕霉素靶點(mTOR)信號通路的ROS水平調節,在細胞凋亡和自噬間達到一種動態平衡。在人類膀胱癌及乳腺癌細胞中觀察到CuE將細胞周期阻滯于G2/M期,同時檢測到p27、p21、p53的表達顯著升高,STAT3、CDK1、Cyclin B的表達降低[33-34]。此外,CuE抑制Cyclin B1/CDC2復合體的形成,誘導GADD45在結直腸癌及腦神經膠質瘤細胞中的表達,提示CuE抑制有絲分裂的進程可能是由GADD45基因家族的超表達所調控[35-36]。
以上研究表明,CuE發揮抑瘤作用所涉及的信號通路也非常廣泛,同時對細胞骨架肌動蛋白的破壞也是快速而顯著的。綜合CuE與CuB的抑瘤情況及結構差異,可推測葫蘆烷型四環三萜結構母核中Δ1,2雙鍵并不是抗腫瘤活性所必需,但該雙鍵是否與抑瘤強度相關還未可知,仍需進一步的研究對比。
4 Cu I
CuI可從多種植物中分離得到,多項研究證明CuI也具有良好的抗腫瘤效果。CuI抗腫瘤機制包括阻滯細胞周期、誘導細胞凋亡、引發細胞自噬及抑制癌細胞轉移等。
Kim HJ等[8]將CuI作用于人結腸癌細胞SW 480,發現CuI呈濃度依賴性地降低細胞活力、抑制細胞增殖,同時CuI還能降低細胞周期蛋白Cyclin B1、Cyclin A、CDK1、Cdc25C的表達,阻滯細胞于G2/M期,促進細胞凋亡蛋白酶Caspase-3、Caspase-7、Caspase-8、Caspase-9和PARP的剪切激活,加強細胞凋亡的發生。Chang CJ等[37]研究發現,CuI作用于頭頸部鱗狀細胞癌細胞,能有效抑制STAT3通路,抑制抗凋亡基因Bcl-2和存活蛋白的表達。除上述促進細胞凋亡發揮抑瘤效果外,CuI還可誘導細胞自噬。Yuan G等[38]從體內、體外兩個方面研究CuI對惡性膠質瘤的抑瘤效果,發現CuI經AMPK/ m TOR/人p70核糖體蛋白S6激酶(p70S6K)通路誘導膠質瘤細胞的自噬,并不經磷酸肌醇3激酶(PI3K)/Akt通路;同時CuI可降低HIF-1α的表達,減少Bcl-2和自噬基因Beclin1/PI3K家族Ⅲ聯合,引發自噬。除上述通路的研究外,有報道指出CuI也可導致細胞骨架肌動蛋白的改變,從而發揮抑瘤效果,與JAK2/STAT3信號通路無關[39]。另外,Lopez-Haber C等[40]發現,CuI能抑制乳腺癌細胞中信號轉導分子Ras相關的C3肉毒素底物1的激活,且不依賴于JAK2的表達,由ROS的水平調節Rho和Rac之間的平衡,從而抑制癌細胞的轉移。
可見,CuI能抑制多種腫瘤細胞的增殖,對JAK2/ STAT3信號通路抑制方面也存在爭議。CuI與CuE的結構非常相似,對比兩者抑瘤方面的研究,推測葫蘆烷型四環三萜結構母核中25位碳上的乙酰基也不是抗腫瘤活性所必需。
CuⅡa是雪膽屬植物的主要活性成分,最早用于治療桿菌痢疾和腸胃炎[9]。隨著人們研究的不斷深入發現,CuⅡa不僅具有清熱解毒、抗菌消炎、抗HIV及健胃止疼等功效,還具有抗腫瘤活性。
高申等[41]對人肺癌細胞A549及小鼠原代培養的脾細胞給予不同濃度的CuⅡa,觀察了CuⅡa對人肺癌細胞A549增殖抑制和誘導凋亡的作用。MTT結果顯示,CuⅡa對人肺癌細胞A549和脾細胞的增殖抑制作用呈濃度依賴性,且隨濃度的增大,CuⅡa對人肺癌細胞A549增殖的抑制作用顯著高于脾細胞,說明CuⅡa抑制細胞增殖有一定的傾向性;流式細胞儀檢測結果表明,隨著CuⅡa濃度升高,處于G2/M期細胞的比例逐漸下降,并隨時間延長,細胞凋亡率逐漸升高,推測阻滯細胞周期、誘導細胞凋亡是CuⅡa抑制人肺癌細胞A 549增殖的機制之一。Boykin C等[42]研究發現,CuⅡa可誘導F-actin不可逆聚集,阻滯細胞周期于G2/M期。此外,CuⅡa能降低磷酸化組蛋白H3的表達,顯著增加PARP的分裂,因此喪失DNA修復功能,誘導細胞發生凋亡。該研究還發現,CuⅡa并不能抑制JAK2/STAT3磷酸化,也不能改變促細胞分裂相關的蛋白激酶磷酸化狀態,但可降低與細胞周期調節相關的細胞凋亡蛋白抑制劑(IAP)存活蛋白的表達。因此,CuⅡa的抗癌機制可能是通過破壞肌動蛋白細胞骨架抑制癌細胞擴散,同時通過抑制下游存活蛋白的表達,促使細胞發生PARP介導下的細胞凋亡。
與高度氧化的葫蘆素類化合物比較,CuⅡa結構中不含Δ23,24雙鍵及3位羰基,并且其在抗腫瘤方面的報道較少,但上述研究中所發現的其對細胞骨架肌動蛋白的破壞與CuB在這方面的報道有很大的相似性。因此,可通過CuB的已知報道為CuⅡa的進一步研究提供思路。
6 其他葫蘆素
Abdelwahab SI等[43]報道了葫蘆素L 2-O-β-D-葡萄糖苷(CLG)的抗腫瘤活性。結果提示,CLG對人結腸癌細胞HT-29的促凋亡作用有一定的選擇性,推測CLG促凋亡的機制是對細胞內活性氮和ROS的抑制,基于研究,將CLG的抗炎和抗氧化活性視為預防結腸癌發生的重要特性。此外,LiY等[10]從金佛山雪膽中分離出了16,25-二乙酰基葫蘆素F等5種新的化合物,并分別進行了人肺腺癌細胞H460、人結腸癌細胞SW 620、人前列腺癌細胞DU145的細胞毒試驗,其中16,25-乙酰基葫蘆素F對3種細胞的半數抑制濃度分別為0.046、0.18、0.87 μg/m L。可見,該化合物有較強的細胞毒活性,且該化合物結構與CuB有較大的相似性,在后期研究中若對比CuB、CuⅡa進行抗腫瘤研究,有望明確3位羰基及16位碳上乙酰基的構效關系。
7 聯合用藥
葫蘆素類化合物不僅在單一用藥方面表現出良好的抗腫瘤活性,而且在藥物聯合應用方面也發揮了很好的協同作用。CuB與吉西他濱、多西他賽、甲氨蝶呤、順鉑等聯合用于治療胰腺癌、骨肉瘤、喉癌等腫瘤,能提高單一藥物的抗腫瘤增殖作用[13,44]。Liu T等[13]體外研究發現,與單一用藥及溶劑對照組比較,CuB與順鉑聯合用于治療喉癌能更顯著地降低磷酸化STAT3、細胞周期蛋白Cyclin B1和抗凋亡蛋白Bcl-2的表達水平,增強細胞凋亡的發生;另外,體內研究發現,聯合用藥組對小鼠移植瘤的抑制作用更明顯,具有統計學意義(P<0.01)。Lan T等[34]在研究CuE對化療藥物的影響時發現,低劑量的CuE可進一步加強順鉑對乳腺癌細胞的抑制作用,但高劑量的CuE并沒有這樣的效果,提示在藥物的聯合應用研究中,必須考察劑量因素。
葫蘆素類藥物不僅可與臨床上使用的藥物聯合應用發揮抗腫瘤協同作用,還可自身聯合增強抗腫瘤作用。Tannin-Spitz T等[45]研究發現,與單一用藥比較,CuB和CuE糖苷聯合應用可明顯阻滯人乳腺癌細胞于G2/M期,并引起纖維組織的損傷,誘導細胞凋亡。
聯合用藥除了能提高單一藥物的抗腫瘤增殖作用外,還可提高放射治療的敏感性,逆轉卵巢癌紫杉醇耐藥細胞的多藥耐藥。Chang CJ等[37]以CuI作為STAT3信號通路的抑制劑,處理成神經管細胞瘤(MB)派生的CD133陽性細胞,發現CuI可改善其對MB放療的敏感性。Duangmano S等[46]研究發現,CuB可改善人乳腺癌細胞MDA-MB-231和MCF7的放療敏感性,但是對人乳腺癌細胞SKBR-3的放療增敏不明顯;并通過流式細胞術檢測發現CuB僅將人乳腺癌細胞MDA-MB-231和MCF7阻滯于G2/M期,提示將細胞周期阻滯于G2/M期可能是葫蘆素對某些乳腺癌細胞放療增敏的重要機制。曲迎春[47]研究發現,CuB對卵巢癌紫杉醇耐藥細胞的多藥耐藥有逆轉作用,提示CuB可作為紫杉醇的互補藥物。
8 結語
葫蘆素類化合物對癌細胞的抑制作用是廣泛的,并不局限于一種癌細胞,其通過誘導細胞凋亡、誘導自噬、阻滯細胞周期、抑制腫瘤轉移、破壞細胞骨架等多種途徑發揮抑癌作用;同時,葫蘆素也調節細胞內的多條信號通路。鑒于葫蘆素類化合物對STAT3信號通路的影響晚于細胞形態和其他一些信號通路的變化,推測其抗腫瘤活性可能涉及更為上游的靶點,且大多葫蘆素類化合物能破壞細胞骨架,顯著引起細胞形態的改變,通過相應的因子將細胞周期阻滯在G2/M期。考慮到已知的影響微絲骨架的藥物都會引起不同程度的細胞周期阻滯,推測葫蘆素類化合物引起細胞周期阻滯也可能與微絲骨架受損相關。目前,關于葫蘆素抗腫瘤的研究雖多,但大多集中于體外,體內研究較少且臨床未見應用。今后對含量豐富的葫蘆素類化合物開展抑瘤研究的同時,也應對其他的葫蘆素及其衍生物進行研究對比。
[1]Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CACancer JClin,2016,66(2):115-132.
[2]李悅,承偉,鄒艾岑.瓜蒂中葫蘆素B的不同提取工藝研究[J].中國藥房,2012,23(19):1760-1761.
[3]CaiY,Fang X,He C,etal.Cucurbitacins:a systematic review of the phytochemistry and anticancer activity[J].Am JChin Med,2015,43(7):1331-1350.
[4]Chen JC,Chiu MH,Nie RL,etal.Cucurbitacins and cucurbitane glycosides:structures and biological activities [J].NatProd Rep,2005,22(3):386-399.
[5]Duangmano S,Sae-Lim P,Suksam rarn A,etal.Cucurbitacin B inhibits human breast cancer cell proliferation through disruption ofm icrotubule polymerization and nucleophosm in/B23 translocation[J].BMC Complement Altern Med,2012,doi:10.1186/1472-6882-12-185.
[6]TakahashiN,Yoshida Y,Sugiura T,etal.Cucurbitacin D isolated from Trichosanthes kirilow ii induces apoptosis in human hepatocellular carcinoma cells in vitro[J].Int Immunopharmacol,2009,9(4):508-513.
[7]Saade M,Magdalou J,OuainiN,et al.Stability of cucurbitacin E in human plasma:chemical hydrolysis and role of plasma esterases[J].Biopharm Drug Dispos,2009,30 (7):389-397.
[8]Kim HJ,Park JH,Kim JK.Cucurbitacin I,a natural cellpermeable triterpenoid isolated from Cucurbitaceae,exerts potentanticancer effect in colon cancer[J].Chem Biol Interact,2014,doi:10.1016/j.cbi.2014.05.005.
[9]He J,Wang Y,Xu LH,etal.CucurbitacinⅡa induces caspase-3-dependentapoptosis and enhances autophagy in lipopolysaccharide-stimulated RAW 264.7 macrophages[J]. Int Immunopharmacol,2013,16(1):27-34.
[10]LiY,Zheng ZF,Zhou L,etal.Fivenew cucurbitane triterpenoids w ith cytotoxic activity from Hemsleya jinfushanensis[J].Phytochem Lett,2015,doi:10.1016/j.phytol. 2015.10.019.
[11]Gupta P,Srivastava SK.Inhibition of HER2-integrin signaling by Cucurbitacin B leads to in vitro and in vivo breast tumor grow th suppression[J].Oncotarget,2014,5 (7):1812-1828.
[12]Yasuda S,Yogosawa S,IzutaniY,etal.Cucurbitacin B induces G2 arrest and apoptosis via a reactive oxygen species-dependentmechanism in human colon adenocarcinoma SW 480 cells[J].Mol Nutr Food Res,2010,54(4): 559-565.
[13]Liu T,Peng H,Zhang M,et al.Cucurbitacin B,a small molecule inhibitor of the Stat3 signaling pathway,enhances the chemosensitivity of laryngeal squamous cell carcinoma cells to cisplatin[J].Eur J Pharmacol,2010,641 (1):15-22.
[14]Kausar H,Munagala R,Bansal SS,et al.Cucurbitacin B potently suppresses non-small-cell lung cancer grow th: identification of intracellular thiols as critical targets[J]. Cancer Lett,2013,332(1):35-45.
[15]Zhang Y,Ouyang D,Xu L,et al.Cucurbitacin B induces rapid depletion of the G-actin pool through reactive oxygen species-dependent actin aggregation in melanoma cells[J].Acta Biochim Biophys Sin:Shanghai,2011,43 (7):556-567.
[16]Iwanski GB,Lee DH,En-Gal S,et al.Cucurbitacin B,a novel in vivo potentiator of gemcitabinew ith low toxicity in the treatment of pancreatic cancer[J].Br JPharmacol,2010,160(4):998-1007.
[17]Gao Y,Islam MS,Tian J,etal.Inactivation of ATP citrate lyase by Cucurbitacin B:a bioactive compound from cucumber,inhibits prostate cancer grow th[J].Cancer Lett,2014,349(1):15-25.
[18]Chan KT,Li KS,Chu KH,et al.Cucurbitacin B inhibits STAT3 and the Raf/MEK/ERK pathway in leukemia cell line K562[J].Cancer Lett,2010,289(1):46-52.
[19]Zhang M,Bian ZG,Zhang Y,etal.Cucurbitacin B inhibits proliferation and induces apoptosis via STAT3 pathway inhibition in A549 lung cancer cells[J].Mol Med Rep,2014,10(6):2905-2911.
[20]Zheng Q,Liu Y,Liu W,et al.Cucurbitacin B inhibits grow th and induces apoptosis through the JAK2/STAT3 and MAPK pathways in SH-SY5Y human neuroblastoma cells[J].MolMed Rep,2014,10(1):89-94.
[21]Zhang T,Li Y,Park KA,et al.Cucurbitacin induces autophagy through m itochondrial ROS production which counteracts to lim it caspase-dependent apoptosis[J].Autophagy,2012,8(4):559-576.
[22]Chan KT,Meng FY,Li Q,et al.Cucurbitacin B induces apoptosis and S phase cell cycle arrest in BEL-7402 human hepatocellular carcinoma cells and is effective via oral adm inistration[J].Cancer Lett,2010,294(1):118-124.
[23]Promkan M,Dakeng S,Chakrabarty S,etal.The effectiveness of cucurbitacin B in BRCA1 defective breast cancer cells[J].PLoSOne,2013,8(2):e55732.
[24]Shang Y,Guo XX,LiWW,et al.Cucurbitacin-B inhibits neuroblastoma cell proliferation through up-regulation of PTEN[J].Eur Rev for Med Pharmacol Sci,2014,18(21): 3297-3303.
[25]Kim SR,Seo HS,Choi HS,et al.Trichosanthes kirilow ii ethanol extract and cucurbitacin D inhibit cell grow th and induce apoptosis through inhibition of STAT3 activity in breast cancer cells[J].Evid Based Complement Alternat Med,2013,doi:10.1155/2013/975350.
[26]Ishii T,Kira N,Yoshida T,et al.Cucurbitacin D induces grow th inhibition,cell cycle arrest,and apoptosis in human endometrial and ovarian cancer cells[J].Tumor Biol,2013,34(1):285-291.
[27]Spear SA,Burns SS,Oblinger JL,et al.Natural compoundsaspotential treatmentsof NF2-deficientschwannoma and meningioma:cucurbitacin D and goyazensolide [J].OtolNeurotol,2013,34(8):1519-1527.
[28]Hung CM,Chang CC,Lin CW,etal.Cucurbitacin Eas inducer of cell death and apoptosis in human oral squamous cell carcinoma cell line SAS[J].Int JMol Sci,2013,14 (8):17147-17156.
[29]Zha QB,Zhang XY,Lin QR,etal.Cucurbitacin E induces autophagy via downregulatingmTORC1 signaling and upregulating AMPK activity[J].PLoSOne,2015,10(5): e0124355.
[30]Zhang T,Li J,Dong Y,et al.Cucurbitacin E inhibits breast tumormetastasis by suppressing cellm igration and invasion[J].BreastCancer Res Treat,2012,135(2):445-458.
[31]李麗,隨何歡,黃家君.葫蘆素E對人結腸癌細胞Caco-2增殖與遷移的影響及其作用機制[J].第三軍醫大學學報,2015,37(13):1342-1348.
[32]Ma G,Luo W,Lu J,et al.Cucurbitacin E induces caspase-dependent apoptosis and protective autophagy mediated by ROS in lung cancer cells[J].Chem Biol Interact,2016,doi:10.1016/j.cbi.2016.04.028.
[33]Huang WW,Yang JS,Lin MW,et al.Cucurbitacin E induces G2/M phase arrest through STAT3/p53/p21 signaling and provokes apoptosis via Fas/CD95 and m itochondria-dependent pathways in human bladder cancer T24 cells[J].Evid Based ComplementAlternatMed,2012,doi: 10.1155/2012/952762.
[34]Lan T,Wang L,Xu Q,et al.Grow th inhibitory effect of Cucurbitacin E on breast cancer cells[J].Int J Clin Exp Pathol,2013,6(9):1799-1805.
[35]Hsu YC,Chen MJ,Huang TY.Inducement ofmitosis delay by cucurbitacin E,a novel tetracyclic triterpene from climbing stem of Cucum ismelo L.,through GADD45γin human brainmalignantglioma(GBM)8401 cells[J].Cell Death Dis,2014,doi:10.1038/cddis.2014.22.
[36]Hsu YC,Huang TY,Chen MJ.Therapeutic ROS targeting of GADD45γin the induction of G2/M arrest in primary human colorectal cancer cell lines by cucurbitacin E[J]. CellDeath Dis,2014,doi:10.1038/cddis.2014.151.
[37]Chang CJ,Chiang CH,SongWS,etal.Inhibition of phosphorylated STAT3 by cucurbitacin Ienhances chemoradiosensitivity in medulloblastoma-derived cancer stem cells [J].Child’s Nervous System,2012,28(3):363-373.
[38]Yuan G,Yan SF,Xue H,etal.Cucurbitacin Iinduces protective autophagy in glioblastoma in vitro and in vivo[J].J BiolChem,2014,289(15):10607-10619.
[39]KnechtDA,LaFleur RA,KahsaiAW,etal.Cucurbitacin I inhibits cell motility by indirectly interfering w ith actin dynam ics[J].PLoSOne,2010,5(11):e14039.
[40]Lopez-Haber C,Kazanietz MG.Cucurbitacin I inhibits Rac1 activation in breast cancer cells by a reactive oxygen species-mediated mechanism and independently of Janus tyrosine kinase2 and P-Rex1[J].Mol Pharmacol,2013,83 (5):1141-1154.
[41]高申,于孟可,魏佳慧,等.雪膽甲素對人非小細胞肺癌A549細胞增殖的抑制作用[J].中國生物制品學雜志,2012,25(1):69-71.
[42]Boykin C,Zhang G,Chen YH,et al.CucurbitacinⅡa:a novel class of anti-cancer drug inducing non-reversible actin aggregation and inhibiting survivin independent of JAK2/STAT3 phosphorylation[J].Br JCancer,2011,104 (5):781-789.
[43]Abdelwahab SI,Hassan LE,Abdul Majid AM,et al.Cucurbitacin L 2-O-β-glucoside demonstrates apoptogenesis in colon adenocarcinoma cells(HT-29):involvement of reactive oxygen and nitrogen species regulation[J].Evid Based Complement Alternat Med,2012,doi:10.1155/ 2012/490136.
[44]Lee DH,Thoennissen NH,Goff C,etal.Synergistic effect of low-dose cucurbitacin B and low-dosemethotrexate for treatment of human osteosarcoma[J].Cancer Lett,2011,306(2):161-170.
[45]Tannin-Spitz T,Grossman S,Dovrat S,et al.Grow th inhibitory activity of cucurbitacin glucosides isolated from Citrullus colocynthis on human breast cancer cells[J].Biochem Pharmacol,2007,73(1):56-67.
[46]Duangmano S,Sae-lim P,Suksam rarn A,etal.Cucurbitacin B causes increased radiation sensitivity of human breast cancer cells via G2/M cell cycle arrest[J].JOncol,2012,doi:10.1155/2012/601682.
[47]曲迎春.葫蘆素B對卵巢癌紫杉醇耐藥細胞凋亡誘導作用及其機制研究[D].沈陽:中國醫科大學,2015.
R961;R966
A
1001-0408(2017)19-2712-06
2016-10-29
2017-01-05)
(編輯:余慶華)
山東省自主創新及成果轉化專項項目(No.2014 ZZCX02105)
*碩士研究生。研究方向:天然藥物化學。電話:0531-82919960。E-mail:407785182@qq.com
#通信作者:研究員,碩士生導師,博士。研究方向:天然藥物化學。電話:0531-82919960。E-mail:yao_imm@163.com
DOI 10.6039/j.issn.1001-0408.2017.19.33

