人參皂苷Rb3對肝糖異生作用機理的研究
孟凡麗
摘要:為了探討人參皂苷Rb3在降低血糖方面的分子調控機制,利用HepG2細胞為研究材料,系統分析了人參皂苷Rb3對肝糖異生關鍵酶PEPCK、G6Pase和轉錄因子FOXO1、HNF4α的影響。結果表明,人參皂苷Rb3可以顯著抑制HepG2細胞肝糖異生途徑關鍵轉錄因子FOXO1、HNF4α蛋白表達,從而抑制PEPCK和G6Pase酶活性及糖異生作用,該作用能夠被AMPK抑制劑Compound C部分阻斷,推測人參皂苷Rb3抑制肝糖異生作用是通過激活AMPK信號通路實現。AMPK信號轉導通路作為重要的糖脂代謝靶點,在糖尿病及相關代謝類疾病的調控中發揮著重要的作用,為探討人參皂苷Rb3治療糖尿病的作用機制提供了新的理論依據。
關鍵詞:人參皂苷Rb3;HepG2細胞;肝糖異生
中圖分類號:R285.5 文獻標識碼:A 文章編號:0439-8114(2017)14-2717-05
DOI:10.14088/j.cnki.issn0439-8114.2017.14.030
Abstract: In order to investigate the effects of ginsenoside Rb3 on reducing the molecular mechanism of blood glucose, using HepG2 cells as research material, the influence of ginsenoside Rb3 on gluconeogenesis key enzymes of PEPCK, G6Pase, and transcription factor of FOXO1 and HNF4α was analyzed. The results showed that ginsenoside Rb3 could significantly inhibit HepG2 cell expression of hepatic gluconeogenic pathway of nuclear transcription factor FOXO1, HNF4α, and inhibited activity and gluconeogenesis of PEPCK and G6Pase and the effect could be partially blocked Compound C which was AMPK inhibitor, speculated that ginsenoside Rb3 inhibited gluconeogenesis was through activation of AMPK signaling pathway to achieve. The AMPK signal transduction pathway as an important target for lipid metabolism, plays an important role in the regulation of diabetes and related metabolic diseases, which provides a new theoretical basis for the mechanism of ginsenoside Rb3 in the treatment of diabetes.
Key words: ginsenoside Rb3; HepG2 cells; hepatic gluconeogenesis
糖尿病是一種世界性的疾病,主要病因為患者體內胰島素分泌的絕對或者相對不足而引發高血糖和尿糖[1],長期高血糖還會導致心腦血管、腎、眼及神經組織的病變,給患者造成很大危害。近年來,隨著人們生活水平的不斷提高,糖尿病患者的數量呈快速上升趨勢。因此,開展糖尿病調控機制及防治方面的研究刻不容緩。糖尿病的治療方法很多,有胰島素治療、胰島移植、基因治療、口服降糖藥物、“運動治療”和“飲食治療”等輔助治療方法[2]。
口服降糖藥物包括3類[3]:即促進胰島素分泌類藥物、增加胰島素敏感性藥物和α-葡萄糖苷酶的抑制劑類藥物。
隨著中藥醫學的發展,源于中藥的降血糖藥物種類也不斷涌現,該類藥物除了具有降血糖作用外,兼具有降血脂及改善血液黏度等作用。人參皂苷Rb3,是人參二醇型皂苷的成分之一,具有多種生物活性,如抗抑郁藥[4]、抗細胞凋亡的影響[5]、抗氧化活性和微循環的改善[6]、降血糖[7,8]、抗肥胖[9]、保護血管內皮細胞[10]、神經保護作用[11]、心血管保護作用[12]等。前期研究發現人參皂苷Rb3能降低糖尿病小鼠血糖,增加血液中葡萄糖耐量和抗氧化,改善血脂紊亂,改善胰島素敏感性和耐藥性[8]。在前期研究的基礎上,從分子水平研究人參皂苷Rb3降血糖機理,進行人參皂苷Rb3對肝糖異生AMPK影響主要的PEPCK、G6Pase關鍵酶和FOXO1、HNF4α轉錄因子研究,為人參皂苷Rb3降血糖機理研究提供理論依據。
1 材料與方法
1.1 材料
人參皂苷Rb3(純度≥98.%HPLC),上海士瑞化工實業有限公司產品;HepG2細胞系,中國科學院上海細胞所;AICAR(AMPK激發劑)、胰蛋白酶、DMEM培養基,美國Sigma公司;PEPCK、G6Pase、FOXO1、HNF4α和二抗,Santa Cruz Biotechnology公司;二甲基亞砜(DMSO)、小牛血清白蛋白、蛋白酶抑制劑,cocktail Roche診斷所;MTT(噻唑藍),天津市魯鑫化工科技有限公司;Compound C(AMPK 選擇性抑制劑)、葡萄糖試劑盒,北京北化康泰臨床試劑有限公司;ECL試劑盒,廣州寶泰克生物有限公司;X-膠片,Eastman Kodak Company公司。
1.2 細胞培養
將HepG2細胞系凍存管從液氮中取出于37 ℃水浴液化,然后轉移細胞至無菌的10 mL離心管中,加3 mL培養基并將細胞混勻,1 000 r/min離心 5 min收集下層細胞系,用含15%的胎牛血清的DMEM培養基培養,次日換液。復蘇后的細胞系改用含有10%胎牛血清的DMEM培養基正常培養,當有80%的細胞融合期時,加入0.25%胰蛋白酶處理,并按1∶3的比例進行傳代培養。
1.3 MTT檢測
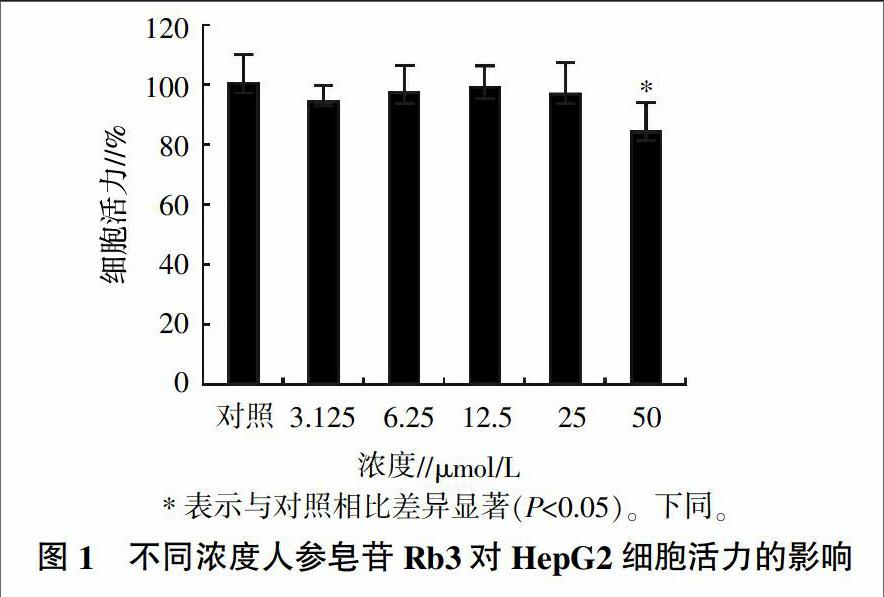
采用MTT方法檢測人參皂苷Rb3處理24 h后的HepG2細胞活力。人參皂苷Rb3參試濃度包括0、3.125、6.25、12.5、25和50 μmol/L作用。MTT處理細胞一定時間后,棄上清液并加入DMSO溶液以溶解藍色結晶。利用酶標儀測定490 nm的吸光度,計算細胞的存活率,細胞存活率(%)=(處理組平均值OD/對照組平均值OD)×100。最后,確定對HepG2細胞無傷害的人參皂苷Rb3濃度,作為進行葡萄糖生成和糖異生試驗分析中的最佳給藥濃度。
1.4 葡萄糖生成檢測
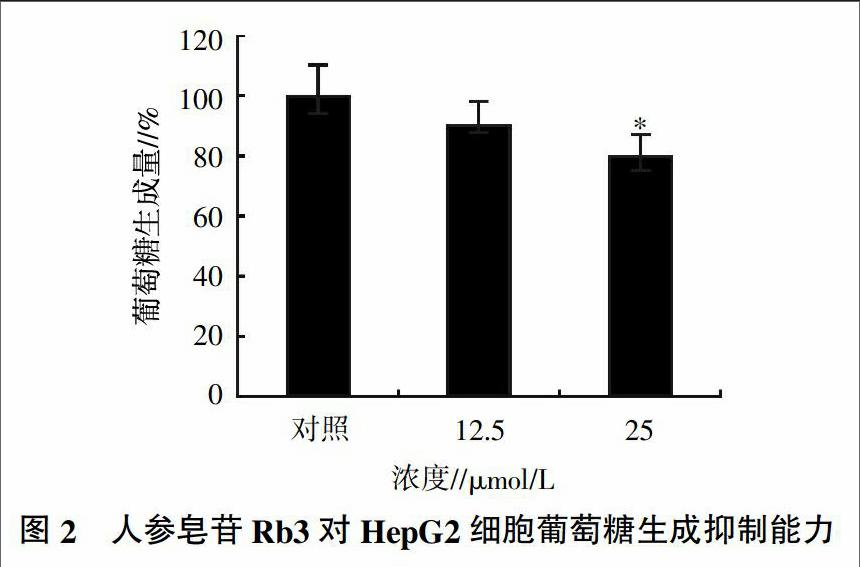
參照前人報道的方法[13]進行試驗,設3個處理,即對照、濃度分別為12.5 μmol/L和25.0 μmol/L的人參皂苷Rb3,3個重復。將HepG2細胞培養至對數生長期,用24孔培養板每孔接種細胞懸液1 mL,用含10%胎牛血清DMEM培養基在37 ℃培養(CO2濃度為5%),處理24 h后;換用葡萄糖生成緩沖溶液于37 ℃(5%CO2含量)培養4 h。最后,將培養液轉入EP管中,利用葡萄糖氧化酶法測定其中的葡萄糖濃度。
1.5 細胞試驗
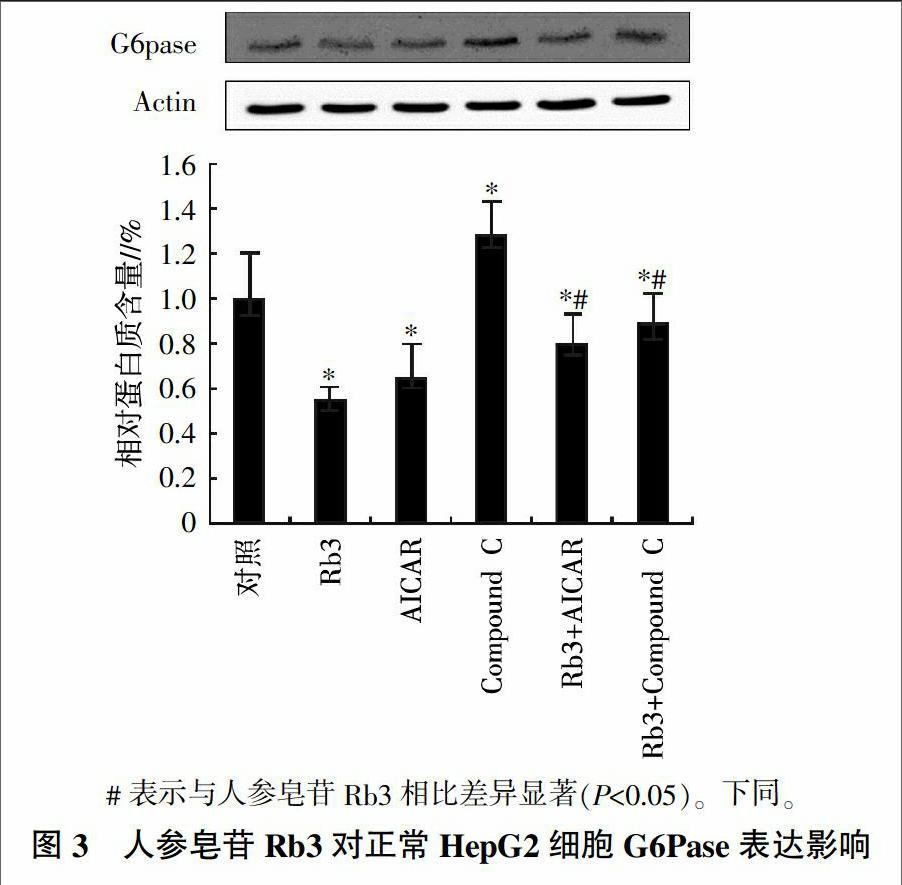
當HepG2細胞處于對數生長期時,細胞接種于6 孔板(密度5×104個/mL,3 mL每孔),用DMEM溶液培養(10%胎牛血清)培養。12 h后,放入含有25.0 μmol/L人參皂苷Rb3、1.0 mmol/L AICAR、10 μmol/L Compound C、25.0 μmol/L人參皂苷Rb3+1.0 mmol/L AICAR、25.0 μmol/L人參皂苷Rb3+和10 μmol/L Compound C不同處理DMEM培養基中。孵育24 h后,用蛋白提取試劑盒提取總蛋白和核蛋白。主要檢測細胞系中的下列蛋白表達水平,包括PEPCK、G6Pase、FOXO1 和 HNF4α。
1.6 蛋白含量分析
HepG2細胞細胞用預冷的RIPA緩沖液處理,添加蛋白酶抑制劑和磷酸酶抑制劑。用Bradford法測定蛋白(Bio-Rad蛋白檢測試劑盒)。掃描儀掃描X-膠片,利用Quantity One軟件對結果進行分析。以目的蛋白OD與內參OD比值計算蛋白相對表達量。
1.7 統計學分析
運用方差分析,數據用Mean±SE表示,兩組間比較采用t檢驗分析,所有數據用統計軟件SPSS 13.0進行分析,P<0.05被認為差異顯著。
2 結果與分析
2.1 人參皂苷Rb3對HepG2細胞葡萄糖生成的影響
通過MTT法進行人參皂苷Rb3活性的檢測分析,結果如圖1所示。濃度為3.125、6.25、12.5、25 μmol/L人參皂苷Rb3給藥24 h后,對細胞產生少量劑量的殺傷;而50 μmol/L的Rb3可導致HepG2細胞的明顯傷害,表現出細胞的皺縮和凋亡現象。因此,合適的人參皂苷Rb3給藥濃度為12.5、25 μmol/L。
用PBS漂洗下層的HepG2細胞,然后用蛋白酶將細胞裂解,并提取蛋白,最后在蛋白定量的基礎上將測得的葡萄糖含量與提取的總蛋白含量相比,這個比值可以更為準確地體現人參皂苷Rb3對HepG2細胞中葡萄糖生成能力的抑制效應。結果(圖2)表明,兩個劑量的人參皂苷Rb3均對HepG2細胞系的糖異生具有一定的抑制效應,特別是25 μmol/L的劑量可產生顯著的抑制作用(P<0.05)。
2.2 人參皂苷Rb3對HepG2細胞糖異生關鍵酶PEPCK和G6Pase的影響
為了進一步證實人參皂苷Rb3對糖異生抑制作用的分子機制,分析了HepG2細胞中糖異生關鍵酶PEPCK和G6Pase的表達情況。結果(圖3、圖4)表明,與對照相比,人參皂苷Rb3、AMPK激活劑AICAR以及這兩者的聯合使用均可顯著抑制(P<0.05)PEPCK和G6pase的表達水平。而Compound C(AMPK的抑制劑)對PEPCK和G6pase的表達有上調的影響趨勢(P<0.05);另外,人參皂苷Rb3與Compound C聯合使用后,PEPCK和G6Pase的表達水平也顯著低于對照組(P<0.05);不過,單獨使用Compound C后細胞中的PEPCK和G6pase表達水平卻顯著高于單用人參皂苷Rb3的處理(P<0.05),說明人參皂苷Rb3對PEPCK及G6pase的抑制效應可以部分被AMPK抑制劑Compound C所阻斷;綜合來看,人參皂苷Rb3的抑制肝糖異生效應與其激活AMPK有關。
2.3 人參皂苷Rb3對HepG2細胞糖異生轉錄因子的影響
轉錄因子是真核基因表達調控的重要因子,為深入探討人參皂苷Rb3對糖異生作用的分子機制,通過蛋白雜交試驗分析了轉錄因子FOXO1和HNF4α(圖5、圖6)的表達特性。通過Western雜交對FOXO1表達水平的分析顯示,人參皂苷Rb3及AMPK的激活劑AICAR對轉錄因子FOXO1均具有表達抑制的效應,二者聯用后對FOXO1的表達也有顯著的抑制效應(P<0.05),不過其抑制效應要顯著低于單獨使用兩種藥品時的效果,即人參皂苷Rb3和AICAR在抑制FOXO1的表達過程中未表現出協同效應;雖然AMPK的激活劑AICAR并沒有增強人參皂苷Rb3對FOXO1表達的抑制效應,但AMPK的抑制劑Compound C和人參皂苷Rb3聯用后FOXO1的表達水平卻顯著(P<0.05)高于人參皂苷Rb3的單獨使用,即Compound C減弱了Rb3對FOXO1抑制效應的趨勢。
對轉錄因子HNF4α的表達水平分析顯示,人參皂苷Rb3和AICAR單用或聯合使用后均可顯著(P<0.05)抑制HNF4α的表達水平,且兩種藥劑聯用后HNF4α的表達水平顯著(P<0.05)低于人參皂苷Rb3單獨使用時的表達水平,但較AICAR單用時略高,而且AMPK的抑制劑Compound C具有顯著(P<0.05)減弱人參皂苷Rb3對HNF4α表達抑制的趨勢。
3 討論
肝癌細胞系HepG2是來源于人的肝細胞系,該類細胞具有正常肝細胞的基本生物學特性,常用于肝臟糖異生的體外生物學功能研究。HepG2細胞的葡萄糖合成量來反映糖異生情況及其對2型糖尿病治療的作用。因此,利用HepG2細胞系常作為篩選糖尿病治療的藥物載體,是目前應用的比較廣泛的降血糖效應研究手段[14]。
AMPK是細胞和系統的能量平衡調節因子,被缺氧、低糖和營養不足代謝產物激活[15],在骨骼肌、肝臟和脂肪組織激活AMPK可以提高代謝、改善胰島素敏感性,并可能有利于糖尿病的治療[16]。AMPK是一個有吸引力的藥物靶點,在全身能量平衡的調節起著關鍵的作用。肝臟AMPK的激活導致增加脂肪酸氧化,同時抑制肝葡萄糖生產以及脂肪和膽固醇的合成[17]。研究發現,AMPK對于肝糖異生過程中幾個關鍵酶(例如PEPCK和G6Pase)的表達具有調劑作用[8];轉錄因子CREB、HNF4α和FOXO1是AMPK調節通路上的關鍵調控因子,而AMPK可使TORC2(一種調控CREB活性的轉導蛋白)發生磷酸化,從而抑制CREB的表達。AMPK還可通過對SHP、HNF4α和FOXO1的調控進而發揮來實現抑制糖異生的作用,這對于降低血糖均具有積極意義。
為了系統分析人參皂苷Rb3對AMPK的調控機制,本研究中使用了AMPK的抑制劑Compound C和激活劑AICAR,增加了正負對照組及處理的組合,試驗處理設置更為系統科學[18]。研究結果發現,人參皂苷Rb3和AMPK的激活劑AICAR對HepG2細胞中的AMPK均具有活性作用,同時對于糖異生途徑中的關鍵限速酶PEPCK和G6Pase具有顯著的抑制作用,這可能是人參皂苷抑制肝糖異生的原因所在。另外,研究還發現人參皂苷Rb3與AICAR聯合使用后對PEPCK的抑制作用顯著增強,表現出較強的協同效應。AMPK抑制劑Compound C可以有效阻斷人參皂苷Rb3對PEPCK和G6Pase的抑制作用,說明AMPK是人參皂苷Rb3作用的重要靶位點。另外,對糖異生途徑中兩個關鍵核轉錄因子FOXO1及HNF4α的表達水平分析顯示,人參皂苷Rb3對其表達均具有顯著的抑制效應,而且抑制作用可以被AMPK抑制劑Compound C部分阻斷,推斷人參皂苷Rb3對這兩個轉錄因子的抑制作用可能與AMPK的激活有關。研究結果發現,在抑制FOXO1的表達水平方面,人參皂苷Rb3和AICAR并未表現出協同效應(圖5);在調控HNF4α蛋白的表達過程中,兩種藥品的聯合使用也表現出減弱了AICAR對HNF4α抑制作用的趨勢(圖6);由此推斷,人參皂苷Rb3和AICAR在調控上述轉錄因子的過程中存在一定的相互干擾。這些結果表明,人參皂苷Rb3可以顯著抑制HepG2細胞肝糖異生途徑關鍵轉錄因子FOXO1、HNF4α蛋白表達,從而抑制PEPCK和G6Pase酶活性及糖異生,該作用能夠被AMPK抑制劑Compound C部分阻斷,推測人參皂苷Rb3抑制肝糖異生作用是通過激活AMPK信號通路實現。AMPK信號轉導通路作為重要的糖脂代謝靶點,在糖尿病及相關代謝類疾病的調控中發揮著重要的作用,為探討人參皂苷Rb3治療糖尿病的作用機制提供了新的理論依據。
參考文獻:
[1] 李 靜.高危人群糖尿病的發病原因及預防措施研究[J].中國醫藥指南,2012,10(20):679-680.
[2] BUDINSKY,WOLFRAM R,OGUOGHO A,et al. Regular ingestion of opuntia robusta lowers oxidation injury[J].Prostaglandins Leukot Essent Fatty Acids,2001,65(1):45-50.
[3] 李 清,周金培,張惠斌.抗糖尿病藥物研究進展[J].藥學進展,2013,37(9):417-427.
[4] CUI J,JIANG L,XIANG H. Ginsenoside Rb3 exerts antidepressant-like effects in several animal models[J]. J Psychopharmacol,2012,26(5):697-713.
[5] LIU X,JIANG Y,YU X,et al. Ginsenoside-Rb3 protects the myocardium from ischemia-reperfusion injury via the inhibition of apoptosis in rats[J].Exp Ther Med,2014,8(6):1751-1756.
[6] SHI Y,HAN B,YU X,et al.Ginsenoside Rb3 ameliorates myocardial ischemia-reperfusion injury in rats[J].Pharm Biol,2011, 49(9):900-906.
[7] BU Q T,ZHANG W Y,CHEN Q C,et al. Anti-diabetic effect of ginsenoside Rb3 in alloxan-induced diabetic mice[J].Medicinal Chemistry,2012,8:934-941.
[8] MENG F L,SU X T,MENG F R,et al. Effects of Ginsenoside Rb3 on antihyperglycemia and antioxidation in diabetic mice[J].Journal of South China Agricultural University,2013,34(4):553-557.
[9] LIU R,ZHENG Y N,LIU W C. Inhibitory activity of ginsenoside Rb3 on pancreatic lipase[J].Nat Prod Res Dev,2011,23:522-525.
[10] PAN Y T,GUO C Y,MA X J,et al.The estrogen-like protective effect of ginsenoside Rb3 on oxidative stress and dysfunction of endothelial cells induced by oxidized low-density lipoprotein[J].Acta Pharmaceutica Sinica,2014,49(10):1406-1412.
[11] JIANG S,MIAO B,SONG X,et al. Inactivation of GABAA receptor reduces ginsenoside Rb3 neuroprotection in mouse hippocampal slices after oxygen-glucose deprivation[J].J Ethnopharmacol,2011,133(2):914-916.
[12] WANG Y H,DONG J H,LIU P,et al. Ginsenoside Rb3 attenuates oxidative stress and preserves endothelial function in renal arteries from hypertensive rats[J].Br J Pharmacol,2014, 171(13):3171-3181.
[13] LIU Z,LI Y,LI X,et al.The effects of dynamic changes of malonyl ginsenosides on evaluation and quality control of Panax ginseng C.A.Meyer[J].J Pharm Biomed Anal,2012,64-65(4):56-65.
[14] 李秀麗,賀嵩敏,朱 瑩,等.HepG2細胞胰島素抵抗模型的建立與鑒定[J].中國實驗方劑學雜志,2013,19(5):203-207.
[15] RYU G R,LEE M K,LEE E,et al. Activation of AMP-activated protein kinase mediates acute and severe hypoxic injury to pancreatic beta cells[J].Biochem Biophys Res Commun,2009,386:356-362.
[16] DZIEWULSKA A,DOBRZYN P,DOBRZYN A. The role of AMP-activated protein kinase in regulation of skeletal muscle metabolism[J].Postepy Hig Med Dosw (Online),2010,64:513-521.
[17] KOO S H,FLECHNER L,QI L,et al. The CREB coactivator TORC2 is a key regulator of fasting glucose metabolism[J]. Nature,2005,437:1109-1111.
[18] LANGELUEDDECKE C,JAKAB M,KETTERL N,et al. Effect of the AMP-Kinase Modulators AICAR, Metformin and Compound C on Insulin Secretion of INS-1E Rat Insulinoma Cells under Standard Cell Culture Conditions[J].Cell Physiol Biochem,2012,29(1-2):75-86.

