雞源Iss抗血清對雞大腸埃希菌O2、O78、CVCC1551的抑制作用
咸富榮+溫均皓+樊琛+徐旺燁+鄭煥芹
摘要:為探討Iss抗體對雞大腸埃希菌(Escherichia coli)血清抗性的抑制作用,將純化的Iss融合蛋白免疫雛雞而獲得抗血清,并對3株雞大腸埃希菌株O2、O78、CVCC1551進行血清抗性抑制試驗,分析Iss抗血清對雞大腸埃希菌血清抗性的抑制作用。結果表明,抗血清對O2、O78、CVCC1551等3株致病性-血清抗性,但iss基因氨基酸序列不同的大腸桿菌均產生抑制作用,且抑制作用的程度與抗血清含量有關。
關鍵詞:雞大腸埃希菌(Escherichia coli);Iss抗血清;抑制作用
中圖分類號:S852.4;S831 文獻標識碼:A 文章編號:0439-8114(2017)14-2725-03
DOI:10.14088/j.cnki.issn0439-8114.2017.14.032
Abstract: To explore the inhibition of Iss antiserum to the Escherichia coli,the Iss fusion protein was purified and immuned to chickens. The serum resistances of 3 strains were detected after processed by antiserum and negative serum, the inhibition effect of Iss antiserum on E.coli serum resistance was examined. The results showed that Iss antiserum has the inhibition effect on the O2,O78 and CVCC1551,which were virulent-serum resistant stains,and the inhibition rate was related to content of antiserum.
Key words: avian Escherichia coli; Iss antiserum; inhibition
大腸埃希氏菌(Escherichia coli)可引起人畜共患的細菌性傳染病,病型復雜,其中危害最大的是急性敗血型。大腸桿菌的毒力是由多種毒力因子共同作用的,包括黏附素、1型菌毛、毒素、外膜蛋白、ColV質粒、補體抗性、鐵轉運系統、宿主細胞表面改變因子等[1-4]。血清抗性可能受莢膜抗原、脂多糖和特定外膜蛋白調節,在多數菌株中表現出與毒力相關。iss基因編碼的外膜蛋白可能通過調節細胞表面上對補體膜攻擊復合體敏感的位點,導致表面排斥,使菌體具有抗血清補體溶菌能力[5-7]。
若能抑制菌株的血清抗性(補體抗性),降低菌株在血液中的存活和增殖能力,可減緩大腸桿菌病的進程,尤其是減少敗血癥的發生。本試驗制備雞源Iss抗血清,并探討Iss抗血清對大腸埃希菌血清抗性的抑制作用,為大腸桿菌病的防制提供新的研究方向,并有利于食品安全的防控。
1 材料與方法
1.1 材料
1.1.1 菌株來源 CVCC1551、O78購于中國獸醫藥品監察所;O2為北京發病雞場分離,經中國獸醫藥品監察所鑒定的強毒株,由東北農業大學預防獸醫教研室170 mL/L甘油于-70 ℃凍存保存。其中CVCC1551、O2菌株iss基因序列一致,O78菌株核酸序列與O2的同源性99.4%,氨基酸序列同源性98%。
1.1.2 試劑 LB肉湯、麥康凱瓊脂、大腸桿菌大腸菌群測試片購自青島高科技園海博生物技術有限公司。
1.2 方法
1.2.1 雛雞致死試驗 將待測大腸桿菌分別劃板,挑取平板上的單菌落,將細菌置于LB液體培養基中37 ℃振蕩培養過夜,離心,經PBS洗2次,并用PBS溶液倍比稀釋。1日齡雛雞買回后適應環境1 d,取0.2 mL稀釋液經大腿肌肉注射2日齡雛雞,約108 CFU/只,每組5只。連續觀察7 d,每天計死亡數,并對死亡雛雞進行剖檢,取心、血、肝、脾于麥康凱平板上劃線,檢測大腸埃希菌感染情況[2,5]。
1.2.2 雞源抗血清的制備 純化的Iss融合蛋白0.1 mg與弗氏佐劑1∶1乳化[3]。14日齡雛雞,皮下注射常規免疫。對照組注射PBS與弗氏佐劑乳化液[4]。四免7 d后加強免疫1次,5 d后取血,效價為1∶100,于-20 ℃保存備用。臨用前56 ℃ 30 min滅活補體[1,2,8]。
1.2.3 Iss抗血清對菌株血清抗性抑制作用的檢測 1∶100接菌于LB液體培養基中,按不同比例加入56 ℃ 30 min滅活雞抗血清及對照組陰性雞血清,37 ℃培養至對數期。取1 mL菌液8 000 r/min離心,0.6 mol/L NaCl溶液洗2次。0.9%生理鹽水重懸混勻,倍比稀釋。0.1 mL菌液加入0.5 mL生理鹽水、0.4 mL新鮮血清混合,混合物于37 ℃溫育。分別于0、 2 h取樣,涂板計數,37 ℃培養18 h,計活菌數[1,3]。
試驗組:Δlg=lg(2h)-lg(0h);
對照組:Δlg=lg(2h)-lg(0h);
抑制作用:ΔΔlg=Δlg(試驗組)-Δlg(對照組)
以ΔΔlg的值為判定依據。若ΔΔlg<0,則說明Iss抗血清對菌株血清抗性有抑制作用;若ΔΔlg≥0,則說明Iss抗血清對菌株血清抗性無抑制作用[7]。
2 結果與分析
2.1 菌株致病力結果
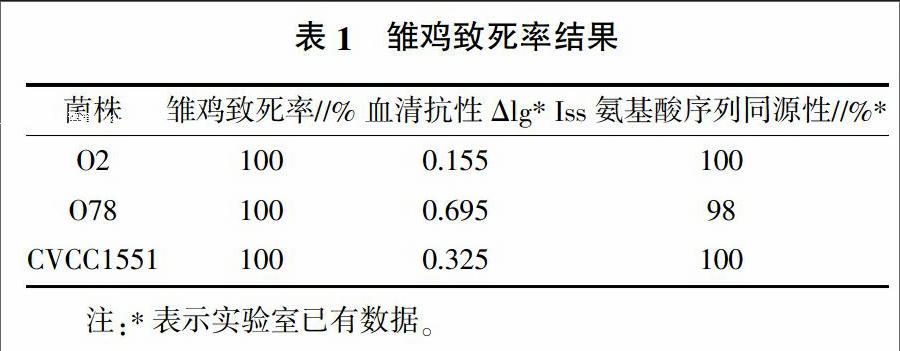
由表1可見,O2、O78、CVCC1551三株菌株雛雞致死率均為100%,屬于致病性菌株,且3株菌株血清抗性較強[6]屬血清抗性菌株。由此可知,3株菌株為致死性-血清抗性菌株。
2.2 抗血清對菌株血清抗性的抑制作用
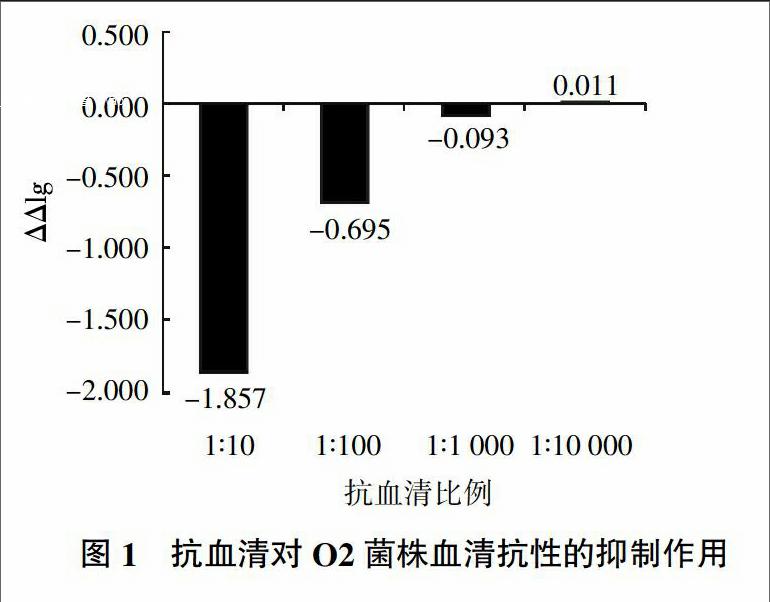
56 ℃ 30 min滅活的雞抗血清及對照組陰性雞血清分別按1∶10、1∶100、1∶1 000、1∶10 000加入菌液,37 ℃培養至對數期。收獲菌體,加入新鮮雞血清檢測試驗組及對照組菌體血清抗性的差值ΔΔlg,結果見圖1。由圖1可見,當抗血清及陰性血清含量降低時,O2菌株ΔΔlg值增大,即抗Iss抗血清對細菌血清抗性的抑制作用越弱。抗血清及陰性血清加入比例為1∶10 000時,O2菌株ΔΔlg值為正值,說明此時抗血清對O2菌株的血清抗性已無明顯抑制作用;加入比例為1∶10時,抗血清對菌株的血清抗性抑制作用最強,但此時抗性組的平板上菌落數過少,不利于控制誤差。因此選擇1∶10、1∶100比例進行后續試驗。
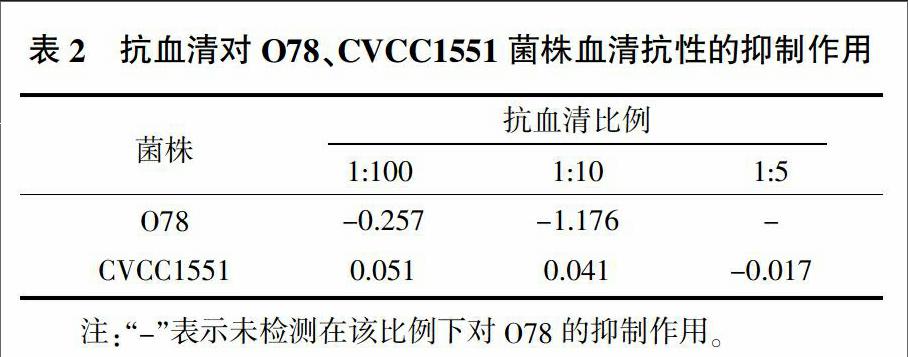
按1∶10、1∶100加入抗血清及陰性血清,檢測抗血清對菌株O78、CVCC1551的抑制作用(表2)。如表2所示,抗血清含量增加時,對菌株血清抗性抑制作用也增強。CVCC1551在加入1∶10抗血清時仍未顯示抑制作用。但增加抗血清比例至1∶5時,抗血清顯示出對菌株血清抗性的抑制作用,ΔΔlg值為 -0.017。抗血清對O2菌株血清抗性的抑制作用最強,其次為O78菌株,對CVCC1551的抑制作用最弱,并且此抑制作用隨抗血清含量增加而增強。
3 討論
根據抗血清對菌株血清抗性的抑制作用試驗,在3株致病性菌株中,Iss抗血清對菌株血清抗性的抑制作用存在明顯差異。抗血清對O2菌株血清抗性的抑制作用最強,其次為O78菌株,對CVCC1551的抑制作用最弱。菌株O78與其他2株菌株的氨基酸序列有差異,抑制作用居中,顯示Iss抗血清對Iss氨基酸序列不同的菌株都可產生血清抗性的抑制作用。iss基因是高度保守的[9,10],通常高度保守的基因在功能上也是較為重要的,并且具有制備亞單位疫苗,對動物產生免疫保護的潛力。本試驗中Iss抗血清在抑制雞大腸埃希氏菌的增殖中發揮了作用,但其作用機制還不清楚。可能是在細菌血清增殖的過程中減少了Iss蛋白的表達,因此降低了菌株的血清抗性。iss基因是編碼大腸桿菌補體抗性的基因,iss基因編碼的外膜蛋白可能通過調節細胞表面上的對補體膜攻擊復合體敏感的位點,導致表面排斥,使菌株具有抗血清補體的融菌能力[5-7,9]。Iss抗血清對大腸埃希氏菌血清抗性的抑制作用越強,則表現為菌株的活菌數越少,ΔΔlg越小。試驗表明,Iss抗血清的含量越大,對菌株血清抗性的抑制作用越強。樊琛等[5]在探究雞源致病性大腸桿菌iss基因的原核表達中證實Iss抗血清可抑制雞大腸埃希氏菌的血清抗性。但沒有檢測抗血清含量對此抑制作用的影響;也沒有檢測Iss抗血清對Iss氨基酸序列不同的菌株,在血清抗性的抑制作用上是否有選擇性。本試驗證實抗血清含量增高,抑制作用增強,且抑制作用對Iss氨基酸序列不同的菌株未顯示特殊的選擇性或專一性。
參考文獻:
[1] 樊 琛,劉桂芹,王亞君,等.Iss蛋白在雞源大腸桿菌不同毒力菌株中的檢測[J].畜牧與獸醫,2010,42(2):71-73.
[2] 樊 琛,王亞君,李一經.iss基因與雞大腸桿菌毒力相關性的分析[J].畜牧獸醫學報,2005,36(1):58-61.
[3] JOHNSON T J,GIDDINGS C W,HORNE S M,et al. Location of increased serum survivalgene and selected virulence traits on a conjugative R plasmid in an avian Escherichia coli isolate[J].Avian Dis,2002,46(2):342-352.
[4] NOLAN L K,GIDDINGS C W,HOME S M,et al. Complement resistance,as determined by viable count abd cytan entic methods and its association with the presence of iss and the virulence of avian Escherichia coli[J].Avian Dis,2002,46(2):386-392.
[5] 樊 琛,劉桂芹,王 宇,等.雞源致病性大腸桿菌iss基因原核表達產物的免疫保護作用[J].畜牧獸醫學報,2010,42(11):84-86.
[6] 樊 琛,王 宇,王 會,等.一株O1血清型雞大腸埃希菌iss基因的序列分析[J].動物醫學進展,2009,30(11):80-82.
[7] 李貴蕭,朱宗濤,康燕青,等.雞大腸桿菌的血清抗性與致病性檢驗[J].江蘇農業科學,2015,43(11):301-302.
[8] 牛明福,皇甫和平,王川慶.多殺性巴氏桿菌的血清抗性及毒力比較研究[J].上海畜牧獸醫通訊,2003,30(1):16-17.
[9] JOHN T J,SUBHASHINIE K,WANNEMUEHLER Y,et al. The genome sequence of avian pathogenic strain O1∶K1∶H7 shares strong similarities with human extraintestinal pathogenic genomes[J].Jouinal of Bacteriology,2007,189(8):3228-3236.
[10] JOHNSON T J,WANNEMUEHLER Y,JOHNSON S J,et al. Comparison of extraintestinal pathogenic Escherichia coli strains from human and avian sources reveals a mixed subset representing potential zoonotic pathogens[J].Appl Environ Microbiol,2008,74:7043-7050.

