尿路上皮癌抗原1過表達對胰腺癌CaPan-2細胞侵襲和轉移能力的影響
許朝 陳思 呂超藍 余躍 張開光
·短篇論著·
尿路上皮癌抗原1過表達對胰腺癌CaPan-2細胞侵襲和轉移能力的影響
許朝 陳思 呂超藍 余躍 張開光
長鏈非編碼RNA(long noncoding RNA, lncRNA)是指一類長度大于200個核苷酸、不編碼蛋白質的RNA。近年來研究發現,它在諸如表觀遺傳調控、轉錄激活、轉錄干擾和核內轉運等多種生物學過程中發揮重要的調控作用[1]。尿路上皮癌抗原1(urothelial carcinoma associated 1,UCA1)即是一個lncRNA,在人類多種惡性腫瘤中異常表達,并顯著增強癌細胞的增殖和耐藥性[2-4]。本課題組前期研究發現,UCA1在胰腺癌組織中高表達,且與臨床轉移成正相關,抑制UCA1可抑制人胰腺癌PANC1細胞的體外侵襲能力[5]。本研究通過脾內注射切脾法建立胰腺癌肝轉移模型,進一步探討UCA1過表達對胰腺癌細胞體內轉移能力的影響。
一、材料與方法
1.穩定過表達UCA1的CaPan-2細胞株的建立:全長UCA1基因(1.44 kb)由上海吉瑪制藥技術有限公司合成。合成的UCA1基因片段及pGLV5-EF1a-EGFP/Puro質粒用NotⅠ和NsiⅠ雙酶切后經1%瓊脂糖凝膠電泳分離,回收和純化酶切片段,用T4 DNA連接酶將UCA1片段以黏端方式與質粒片段連接,轉化感受態DH5a大腸桿菌擴增后提取重組質粒,通過酶切及測序鑒定正確后,采用脂質體法將其與包膜蛋白質粒(pVSV-G)、核心蛋白/逆轉錄酶質粒(pGag/Pol)和載體質粒(pRev)共轉染293T細胞。72 h后收集細胞培養上清,過濾后4℃ 20 000 r/min離心2 h,-80℃冰箱保存備用。用10% FBS的DMEM培養液20 μl 10倍稀釋4個梯度分別感染293T細胞,通過熒光顯微鏡計數熒光細胞,結合稀釋倍數計算病毒滴度約為1×109TU/ml。CaPan-2細胞1.0×106/孔的密度接種96孔板,培養24 h,吸去培養液,每孔加入200 μl 1×108TU/ml的病毒液,常規培養24 h后更換為McCoy′s 5a完全培養液培養,48 h后更換為含嘌呤霉素(終濃度為0.35 μg/ml)的McCoy′s 5a完全培養液培養,期間每2 d換液。10 d后獲得穩定過表達UCA1的人胰腺癌CaPan-2細胞(CaPan-2/UCA1)。同法用空病毒載體感染CaPan-2細胞(CaPan-2/NC)作為陰性對照。
2.CaPan-2細胞UCA1的表達水平檢測:Trizol提取各組細胞的總RNA,采用SuperscriptⅡ反轉錄試劑盒逆轉錄獲得cDNA。實時熒光定量PCR法檢測細胞UCA1 mRNA的表達,以GAPDH為內參。引物序列:UCA1上游引物為5′-ATGGTGTCCTCAAGCCTACTCTCA-3′,下游引物為5′-TGAAATGTCCCAAGCCCTCTAAC-3′, 產物片段長度為139 bp;GAPDH上游引物為5′-GGGAAACTGTGGCGTGAT-3′,下游引物為5′-GAGTGGGTGTCGCTGTTGA-3′,產物片段長度為299 bp。PCR擴增條件:95℃ 10 min;95℃ 10 s、60℃ 60 s,40個循環。采用2-△△Ct法計算UCA1在癌細胞中的相對表達量。
3.CaPan-2細胞體外侵襲能力檢測:胰酶消化并收集各組細胞,計數后用McCoy′s 5a無血清培養液調整細胞密度為1×106個/ml。將Matrigel Transwell小室(Chemicon公司)置于24孔板中,上室中加入無血清培養液稀釋的細胞懸液100 μl,下室中加入含10%胎牛血清的McCoy′s 5a培養液500 μl,常規培養24 h。棄上室液體,用棉簽輕輕拭去濾膜上表面未穿膜的細胞,用甲醇溶液固定10 min,常規結晶紫染色。在倒置顯微鏡下選擇10個高倍鏡視野(×200),計數穿膜細胞數。每組設3個復孔,實驗重復3次。
4.裸鼠體內實驗:6周齡BALB/C裸鼠購自中國科學院上海實驗動物中心,飼養于SPF條件下,8周齡后進行實驗。采用脾內注射切脾法建立胰腺癌肝轉移模型,即在麻醉后行左上腹橫切口,顯露脾臟并小心拉出體外,用1 ml注射器從脾臟上極沿脾縱軸進針,緩慢注射胰腺癌CaPan-2細胞懸液0.5 ml(1×107個/ml),注射區可見被膜變白隆起。待隆起消失后5 min切除脾臟,無出血后關腹。用隨機數字表法將裸鼠分為2組;CaPan-2/UCA1組,注射CaPan-2/UCA1細胞懸液;CaPan-2/NC組,注射CaPan-2/NC細胞懸液,每組10只。注射6周后脫頸處死裸鼠,開腹取肝臟,計數肝表面的轉移結節并稱重。以10%甲醛固定肝組織后常規行病理學檢查。
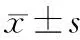
二、結果
1.各組細胞UCA1 mRNA表達量:CaPan-2/UCA1、CaPan-2/NC及親本CaPan-2細胞UCA1 mRNA相對表達量分別為3.103±0.103、1.130±0.043和1.000±0.047。CaPan-2/UCA1細胞的表達顯著高于CaPan-2/NC(t=2.110,P<0.05)以及親本細胞(t=2.204,P<0.05),而CaPan-2/NC和親本細胞間差異無統計學意義(P>0.05)。
2.UCA1過表達CaPan-2細胞體外侵襲能力的改變:CaPan-2/UCA1、CaPan-2/NC和親本CaPan-2細胞24 h的穿膜細胞數分別為(34.67±7.35)、(24.33±4.12)和(21.67±4.04)個/200倍視野。CaPan-2/UCA1明顯高于CaPan-2/NC(t=22.99,P<0.05)及親本細胞(t=20.323,P<0.05),而CaPan-2/NC與親本細胞間的差異無統計學意義(P>0.05,圖1)。
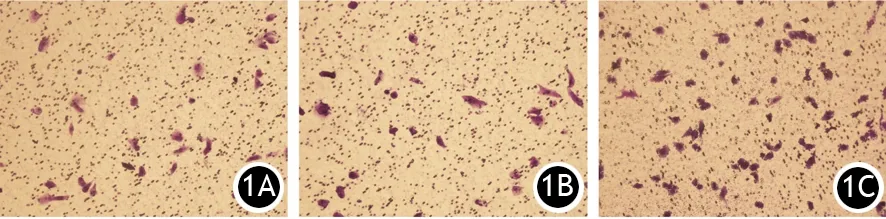
圖1 CaPan-2組(1A)、CaPan-2/NC組(1B)、CaPan-2/UCAI(1C)的穿膜細胞(結晶紫染色 ×200)
3.UCA1過表達CaPan-2細胞肝轉移的影響:CaPan-2/NC組中只有2只裸鼠有肝轉移結節(2/10),而Capan-2/UCA1組6只裸鼠有肝轉移結節(6/10),兩組間差異有統計學意義(P<0.05,圖2)。
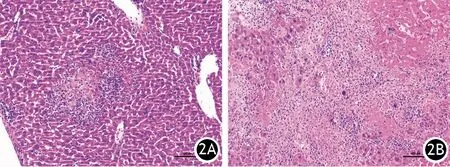
圖2 CaPan-2/NC(2A)、CaPan-2/UCA1(2B)裸鼠的肝轉移灶(HE ×100)
討論 UCA1基因位于19號染色體的區鏈p13區,其轉錄產物UCA1是一個lncRNA,缺少明顯的開放性閱讀框而不具備蛋白編碼功能。Wang等[6]首次在膀胱癌中鑒定并克隆出了UCA1的全長cDNA,并因其與泌尿道上皮腫瘤的密切相關性而將其命名。此后的研究顯示UCA1在人類胎盤組織和胎兒的心臟、膀胱和宮體組織中均有表達,而在絕大多數正常成人組織(除心臟和脾臟外)中均無表達[7]。隨后的研究顯示,UCA1在人類多種惡性腫瘤中(如胃癌,卵巢癌、肺癌、結腸癌等)異常高表達,并能促進腫瘤增殖能力和耐藥性,被認為具有癌基因功能[8-11]。
本課題組前期研究發現,UCA1在胰腺癌組織中表達異常增高,并且在伴有淋巴結或遠處轉移的胰腺癌組織中的表達明顯高于無轉移者;進一步通過RNA干擾技術下調UCA1表達后,胰腺癌PANC1細胞的體外遷移和侵襲能力均明顯減弱[5]。最新研究報道,UCA1表達水平與黑色素瘤和舌鱗癌的臨床轉移呈正相關,抑制UCA1表達可抑制癌細胞的體外遷移和侵襲能力[12-13]。為進一步探討UCA1對胰腺癌細胞體內轉移能力的影響,本研究成功建立了穩定過表達外源UCA1的CaPan-2細胞株,結果顯示,UCA1過表達顯著增強了CaPan-2細胞的體外侵襲能力和肝轉移能力。
上皮-間質轉化是上皮細胞通過特定程序轉化為間質表型細胞的生物學過程,是腫瘤細胞獲得侵襲和轉移能力的重要機制。本課題組前期研究發現,沉默UCA1可顯著下調胰腺癌PANC1細胞間質分子vimentin的表達[5],細胞呈現成纖維細胞樣的細胞形態。Cheng等[14]早前通過芯片技術檢測沉默UCA1對膀胱癌細胞基因表達譜的影響,結果顯示細胞中間質分子fibronectin和vimentin的表達水平均明顯下調。因此,筆者推測UCA1可能通過正向調控細胞上皮-間質轉化過程繼而促進腫瘤侵襲。新近研究發現,UCA1可通過激活多條細胞內信號通路誘導上皮-間質轉化,如AKT/mTOR,Wnt/β-catenin信號通路[15-16]。另一項研究則發現,UCA1通過競爭結合hsa-miR-145并干擾后者對 ZEB1/2表達的負性調控,ZEB1/2表達上調繼而誘導了上皮-間質轉化過程。然而,UCA1是否通過以上機制調控胰腺癌上皮-間質轉化仍有待進一步研究。
[1] Ponting CP, Oliver PL, Reik W. Evolution and functions of long noncoding RNAs[J]. Cell, 2009,136(4):629-641. DOI: 10.1016/j.cell.2009.02.006.
[2] Huang J, Zhou N, Watabe K, et al. Long non-coding RNA UCA1 promotes breast tumor growth by suppression of p27 (Kip1)[J]. Cell Death Dis, 2014, 5: e1008. DOI: 10.1038/cddis.2013.541.
[3] Han Y, Yang YN, Yuan HH, et al. UCA1, a long non-coding RNA up-regulated in colorectal cancer influences cell proliferation, apoptosis and cell cycle distribution[J]. Pathology, 2014, 46(5):396-401. DOI: 10.1097/PAT.0000000000000125.
[4] Tsang WP, Wong TW, Cheung AH, et al. Induction of drug resistance and transformation in human cancer cells by the noncoding RNA CUDR[J]. RNA, 2007, 13(6): 890-898. DOI: 10.1261/rna.359007.
[5] 許朝,諸琦,余躍,等. 尿路上皮癌抗原1基因沉默可抑制人胰腺癌細胞的體外遷移和侵襲. 腫瘤,2015, 35(11):1192-1199. DOI:10.3781/j.issn.1000-7431.2015.11.482.
[6] Wang XS, Zhang Z, Wang HC, et al. Rapid identification of UCA1 as a very sensitive and specific unique marker for human bladder carcinoma[J]. Clin Cancer Res, 2006, 12(16):4851-4858. DOI: 10.1158/1078-0432.CCR-06-0134.
[7] Nie W, Ge HJ, Yang XQ, et al. LncRNA-UCA1 exerts oncogenic functions in non-small cell lung cancer by targeting miR-193a-3p[J]. Cancer Lett, 2016, 371(1):99-106. DOI: 10.1016/j.canlet.2015.11.024.
[8] Bian Z, Jin L, Zhang J, et al. LncRNA-UCA1 enhances cell proliferation and 5-fluorouracil resistance in colorectal?cancer?by inhibiting miR-204-5p[J]. Sci Rep, 2016, 6:23892. DOI: 10.1038/srep23892.
[9] Wang F, Zhou J, Xie X, et al. Involvement of SRPK1 in cisplatin resistance related to long non-coding RNA UCA1 in human ovariancancer cells[J]. Neoplasma, 2015, 62(3):432-438. DOI: 10.4149/neo_2015_051.
[10] Zheng Q, Wu F, Dai WY, et al. Aberrant expression of UCA1 in gastric cancer and its clinical significance[J]. Clin Transl Oncol, 2015, 17(8):640-646. DOI: 10.1007/s12094-015-1290-2.
[11] Tian Y, Zhang X, Hao Y, et al. Potential roles of abnormally expressed long noncoding RNA UCA1 and Malat-1 in metastasis of melanoma[J]. Melanoma Res, 2014,24(4):335-341. DOI: 10.1097/CMR.0000000000000080.
[12] Fang Z, Wu L, Wang L, et al. Increased expression of the long non-coding RNA UCA1 in tongue squamous cell carcinomas: a possible correlation with cancer metastasis[J]. Oral Surg Oral Med Oral Pathol Oral Radiol, 2014,117(1): 89-95. DOI: 10.1016/j.oooo.2013.09.007.
[13] Yang C, Li X, Wang Y, et al. Long non-coding RNA UCA1 regulated cell cycle distribution via CREB through PI3-K dependent pathway in bladder carcinoma cells[J]. Gene, 2012, 496(1):8-16. DOI: 10.1016/j.gene.2012.01.012.
[14] Cheng N, Cai W, Ren S, et al. Long non-coding RNA UCA1 induces non-T790M acquired resistance to EGFR-TKIs by activating the AKT/mTOR pathway in EGFR-mutant non-small cell lung cancer[J]. Oncotarget, 2015, 6(27):23582-23593. DOI: 10.18632/oncotarget.4361.
[15] Xiao C, Wu CH, Hu HZ. LncRNA UCA1 promotes epithelial-mesenchymal transition (EMT) of breast cancer cells via enhancing Wnt/beta-catenin signaling pathway[J]. Eur Rev Med Pharmacol Sci, 2016, 20(13):2819-2824.
[16] Xue M, Pang H, Li X, et al. Long non-coding RNA urothelial cancer-associated 1 promotes bladder cancer cell migration and invasion by way of the hsa-miR-145-ZEB1/2-FSCN1 pathway[J]. Cancer Sci, 2016, 107(1):18-27.DOI: 10.1111/cas.12844.
(本文編輯:屠振興)
10.3760/cma.j.issn.1674-1935.2017.04.010
230001 合肥,安徽醫科大學附屬省立醫院消化內科
許朝,Email: xuchaoseu@126.com
2016-07-02)

