野生型p53誘導的磷酸酶1基因缺失對小鼠心功能的影響
劉可美,劉臣,周鵬,劉娟,譚宇,李健楠,張連峰,張宏冰,顏紅兵
基礎與實驗研究
野生型p53誘導的磷酸酶1基因缺失對小鼠心功能的影響
劉可美,劉臣,周鵬,劉娟,譚宇,李健楠,張連峰,張宏冰,顏紅兵
目的:探討敲除野生型p53誘導的磷酸酶1(Wip1)基因對小鼠心功能的影響及心臟組織中基因和蛋白表達水平的變化。
方法:隨機選取野生型(WT)小鼠和Wip1基因敲除(Wip1-KO)小鼠各10只,分別檢測兩組小鼠的心功能和心重/體重比,應用蘇木精伊紅(HE)染色觀察小鼠心肌組織的病理形態,應用實時定量反轉錄聚合酶鏈式反應(RT-PCR)檢測心肌組織中心房利鈉肽(ANP)、B型利鈉肽(BNP)、單核細胞趨化蛋白-1(MCP-1)和α-平滑肌肌動蛋白(α-SMA)的基因表達水平,并應用蛋白免疫印跡(Western blot)檢測凋亡相關蛋白包括B淋巴細胞瘤-2(Bcl-2)、B淋巴細胞瘤-2相關X蛋白(Bax)和活化半胱氨酸天冬氨酸蛋白酶-3(c-Caspase3)的表達水平。
結果:與WT組小鼠相比,Wip1-KO組小鼠心肌組織中Wip1 mRNA表達明顯降低(P<0.05),左心室射血分數和左心室縮短分數降低(P<0.05),左心室收縮末期內徑增大(P<0.05)。雖然Wip1-KO組小鼠與WT小鼠的心臟重量沒有差異,但Wip1-KO組小鼠體重較WT組小鼠減輕(P<0.05),心重/體重比增加(P<0.05)。HE染色顯示Wip1-KO組小鼠的心肌形態與WT組小鼠之間沒有明顯差異。心肌組織中ANP、BNP、MCP-1和α-SMA基因表達水平在兩組小鼠之間差異無統計學意義(P>0.05)。Wip1-KO組小鼠心肌組織中凋亡相關蛋白Bax/Bcl-2和c-Caspase3表達水平與WT組小鼠之間沒有明顯差異(P>0.05)。
結論:敲除Wip1基因可以損害小鼠心功能,但相關的機制還有待進一步闡明。
小鼠,基因敲除;心臟功能試驗;細胞凋亡
(Chinese Circulation Journal, 2017,32:792.)
野生型p53誘導的磷酸酶1(wildtype p53-induced phosphatase 1, Wip1)屬于絲氨酸-蘇氨酸蛋白磷酸酶,含有605個氨基酸,是蛋白磷酸酶2C(Type 2C protein phosphatase,PP2C)家族成員之一[1]。近年來,研究發現,Wip1在很多疾病和生理過程中起著關鍵作用,其可以通過某些信號通路促進腫瘤發生、發展或調節衰老過程[2]。另外,Wip1在個體發育過程中也起著重要的調節作用。研究顯示,Wip1基因敲除(Wip1 knockout, Wip1-KO)小鼠表現出一系列發育異常,包括雄鼠體重減輕、生殖器官萎縮,生殖能力下降和生存期縮短[3]。Wip1-KO小鼠免疫功能存在缺陷,體內T細胞和B細胞數量減少,對炎癥反應抵抗能力下降[3]。敲除Wip1基因還可影響小鼠脂質代謝和動脈粥樣硬化斑塊形成,Wip1-KO小鼠主動脈中粥樣硬化斑塊明顯減少[4]。Wip1在心臟組織中表達水平較高[1],但Wip1基因缺失是否會影響小鼠心血管系統的結構或功能鮮有研究。本課題組初步研究發現,Wip1-KO小鼠心功能減弱。本研究旨在探討Wip1基因敲除對小鼠心功能的影響并進一步明確心臟組織中可能發生的基因和蛋白水平的改變,為研究Wip1在心臟中的作用提供理論基礎。
1 材料與方法
1.1 實驗動物及試劑
實驗動物:C57BL/6野生型(wildtype,WT)小鼠購買于北京維通利華實驗動物技術有限公司,Wip1-KO小鼠由中國醫學科學院醫學實驗動物研究所北京協和醫學院比較醫學中心提供。Wip1-KO小鼠與WT小鼠在中國醫學科學院北京協和醫學院阜外醫院動物實驗中心飼養繁殖,研究用的子代小鼠為8~12周齡雄鼠。所有動物實驗均遵守《實驗動物管理條例》和相關的實驗動物倫理規則。
主要試劑:蘇木精伊紅(hematoxylin and eosin, HE)染色試劑盒購于碧云天生物技術研究所。組織RNA提取試劑盒購自美國OMEGA公司,反轉錄試劑盒和實時定量反轉錄聚合酶鏈式反應(Realtime PCR,RT-PCR)試劑盒均購于日本Takara公司,Nu-PAGE預制膠Bis-Tris 4%~12%購于美國Invitrogen公司,增強型化學發光免疫印跡底物購于美國ThermoFisher公司。
主要儀器:小動物高頻超聲系統Vevo2100購自加拿大VisualSonic公司,電子天秤購于德國Satorious公司, PCR儀購自美國Bio-Rad公司,電泳槽和轉膜儀購于美國Invitrogen公司,化學發光成像儀購于北京賽智創業科技有限公司。
1.2 超聲評估小鼠心功能
Wip1-KO組與WT組分別隨機抽取10只小鼠,放置于裝有2%異氟烷的密閉箱中麻醉。麻醉好的小鼠左側臥位平放于檢測臺,使用Vevo 2100高頻小動物超聲檢測系統行心臟超聲檢查,選用M型超聲模式,測量左心室舒張末期內徑(left ventricular internal diameter at end-diastole,LVIDd)和左心室收縮末期內徑(left ventricular internal diameter at endsystolic, LVIDs)并計算小鼠的左心室射血分數(left ventricular ejection fraction, LVEF)和左心室縮短分數(left ventricular fractional shortening, LVFS)。
1.3 小鼠體重、心臟重量測量
用電子天秤準確稱量每只小鼠體重。小鼠麻醉處死后,迅速取出心臟置于冰浴的磷酸鹽緩沖液(PBS)中,擠出心腔內殘余血液,用剪刀除去心臟大血管起始部,用濾紙吸干心臟表面液體。于分析天平上稱量心臟并記錄重量。根據小鼠體重和心臟重量計算心重/體重比。
1.4 HE染色觀察小鼠心肌組織的病理形態
小鼠心臟稱重后于多聚甲醛溶液中固定,脫水,行石蠟切片,用HE染色試劑盒染色。電鏡下觀察染色結果并拍照記錄。
1.5 檢測小鼠心肌組織中基因表達水平
取適量小鼠心肌組織,用組織RNA提取試劑盒提取總RNA,逆轉錄為cDNA。采用RT-PCR試劑盒檢測Wip1、心房利鈉肽(atrial natriureticpeptide,ANP)、B型利鈉肽(B-type Natriuretic Peptide,BNP)、單核細胞趨化蛋白-1(monocyte chemoattractant protein-1,MCP-1)和α-平滑肌肌動蛋白(α-smooth muscle actin,α-SMA)基因表達水平。所有引物均由上海Invitrogen公司合成,引物序列如表1所示,甘油醛-3-磷酸脫氫酶(GAPDH)為內參基因。
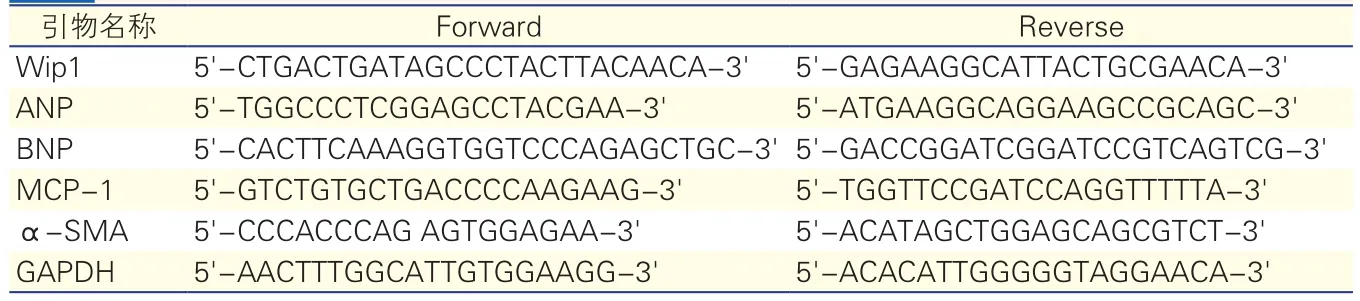
表1 所用引物序列
1.6 檢測小鼠心肌組織中凋亡相關蛋白表達水平
取適量心肌組織提取總蛋白。各取等量樣品上樣,先在80 V電壓下電泳30 min,待樣品進入分離膠后用100 V電壓電泳1.5 h。通過轉膜儀將蛋白轉移至PVDF膜上。取下PVDF膜,置于5%脫脂牛奶中室溫封閉1 h,分別加入一抗B淋巴細胞瘤-2(Bcl-2,1:1000,貨號CST2876,Cell Signaling Technology公司,美國)、一抗B淋巴細胞瘤-2相關X蛋白(Bax,1:1000,貨號SC493,Santa Cruz公司,美國)、一抗活化半胱氨酸天冬氨酸蛋白酶-3(c-Caspase3,1:1000, 貨號CST9664, Cell Signaling Technology公司,美國)和內參GAPDH(1:4000,貨號CW0100M,北京康為世紀生物科技有限公司,中國),4℃孵育過夜。用PBST液洗膜3次,每次10 min,加入與一抗相對應的二抗孵育2 h,用PBST液洗膜3次,每次10 min,ECL顯影。應用Image J軟件分析各條帶灰度值,以目的條帶與GAPDH的灰度值比值反映蛋白表達水平。
1.7 統計學方法
所有實驗均重復3次,數據應用GraphPad Prism 5統計軟件進行分析,并用均數±標準差(±s)表示。兩組間比較用獨立樣本t檢驗進行分析,P<0.05為差異具有統計學意義。
2 結果
兩組小鼠心肌組織中Wip1 mRNA表達水平、心功能指標比較:與WT組小鼠相比,Wip1-KO組小鼠心肌組織中Wip1 mRNA表達水平明顯降低(圖1)。應用超聲系統對兩組小鼠心功能進行評估的結果顯示(圖2),Wip1-KO組小鼠的LVEF和LVFS均低于WT組小鼠(P<0.05),LVIDs比WT組小鼠高(P<0.05)。雖然Wip1-KO組小鼠的LVIDd比WT組小鼠稍高,但兩組差異無統計學意義(P>0.05)。
兩組小鼠的體重、心臟重量及心重/體重比的比較(表2): 通過測量小鼠體重和心臟重量評估小鼠心臟大小。與同齡WT組小鼠相比,Wip1-KO組小鼠的體重減輕,差異有統計學意義(P<0.05)。雖然兩組小鼠的心臟重量無明顯差異(P>0.05),但心重/體重比在Wip1-KO小鼠中明顯增加(P<0.05)。
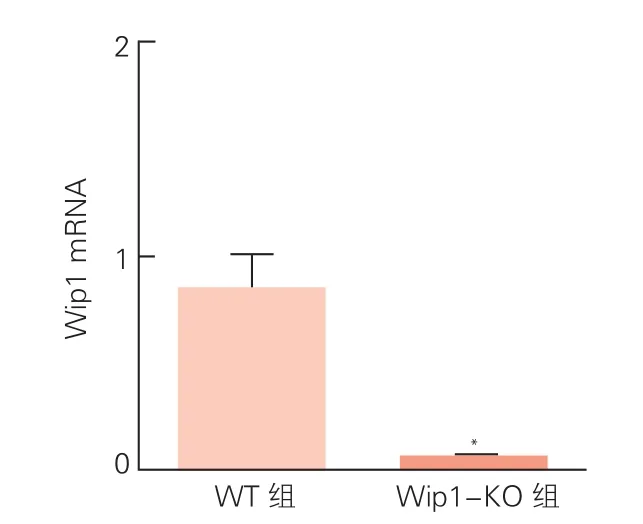
圖1 兩組小鼠心肌組織中Wip1 mRNA表達比較
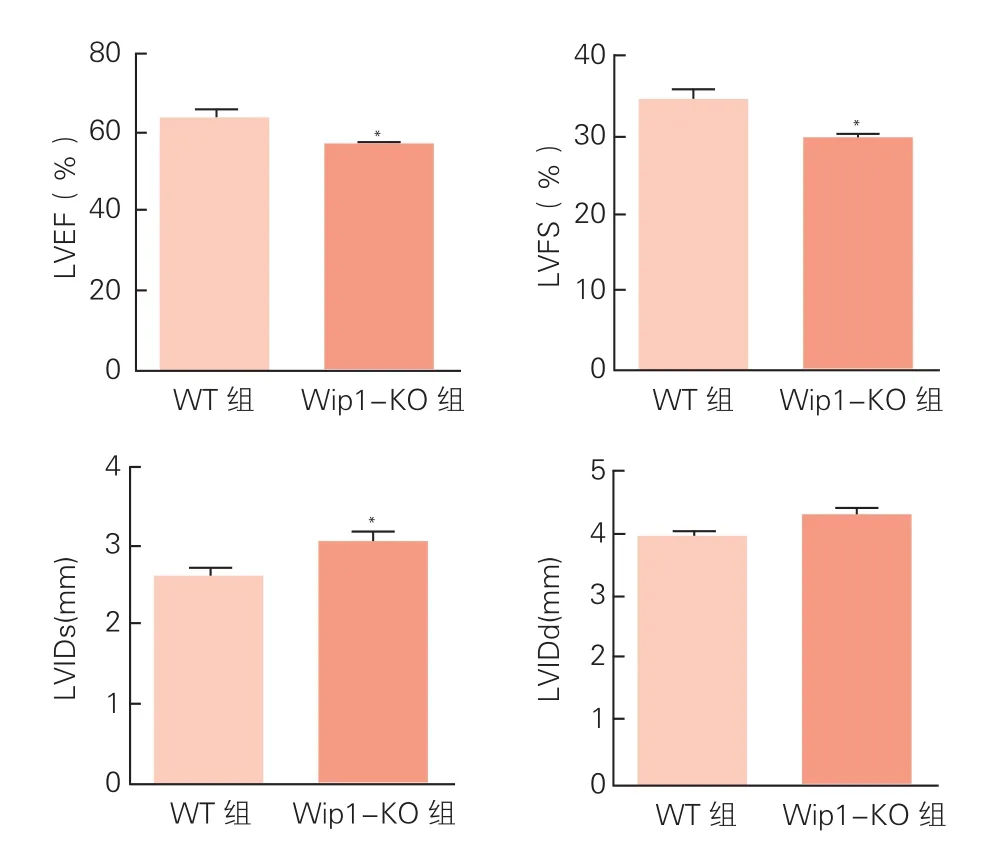
圖2 兩組小鼠的心功能指標的比較

表2 兩組小鼠的體重、心臟重量及心重/體重比的比較
兩組小鼠心肌病理形態比較(圖3):兩組小鼠心肌組織切片行HE染色顯示,Wip1-KO組小鼠的心肌組織病理形態基本正常,與WT小鼠心肌組織無明顯差異。
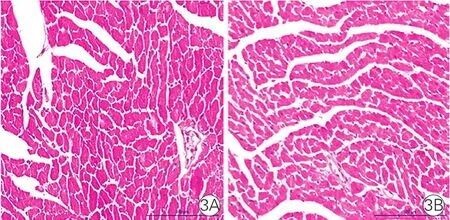
圖3 兩組小鼠心肌組織病理形態比較(×100)
兩組小鼠心臟中ANP、BNP、MCP-1和α-SMA基因表達:受到外界病理因素刺激或應激時,心肌組織中某些基因表達上調,可以反映心肌組織受損。我們檢測了兩組小鼠的ANP、BNP、MCP-1和α-SMA的表達水平(圖4)。與WT組小鼠相比,Wip1-KO組小鼠心肌組織中ANP、BNP和α-SMA mRNA的表達都略有減少,但差異無統計學意義(P>0.05)。Wip1-KO組小鼠心肌組織MCP-1 mRNA基因表達較WT組小鼠升高,但兩組差異無統計學意義(P>0.05)。
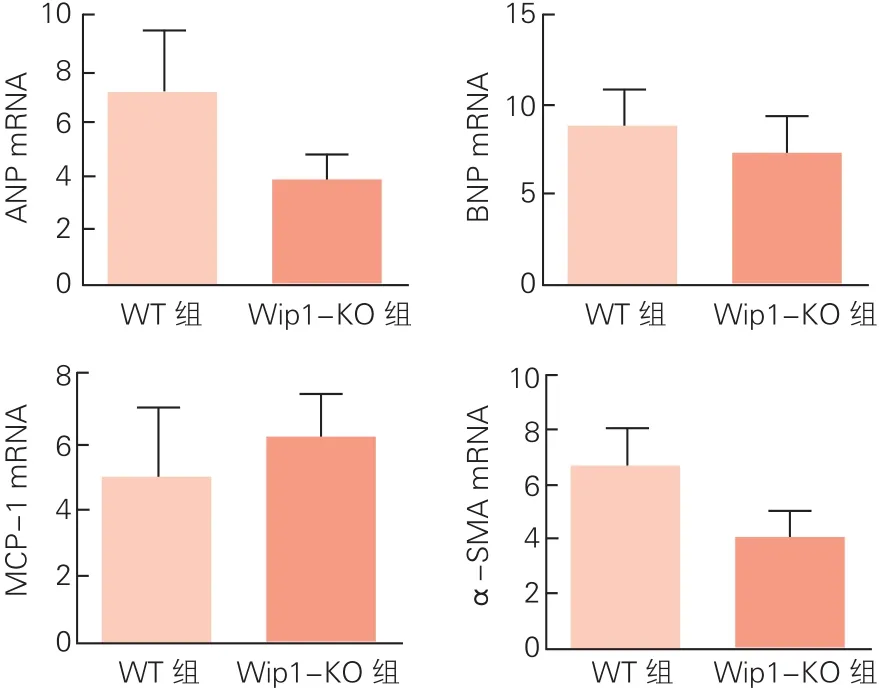
圖4 兩組小鼠心肌組織ANP、BNP、MCP-1和α-SMA的mRNA表達水平比較
兩組小鼠心臟中凋亡相關蛋白表達的比較(圖5):通過Western blot對小鼠心肌組織中凋亡相關蛋白表達水平的檢測分析發現,Wip1-KO組小鼠心肌組織中凋亡相關蛋白Bax/Bcl-2比值和c-Caspase3的表達與WT組小鼠之間沒有明顯差異(P>0.05)。
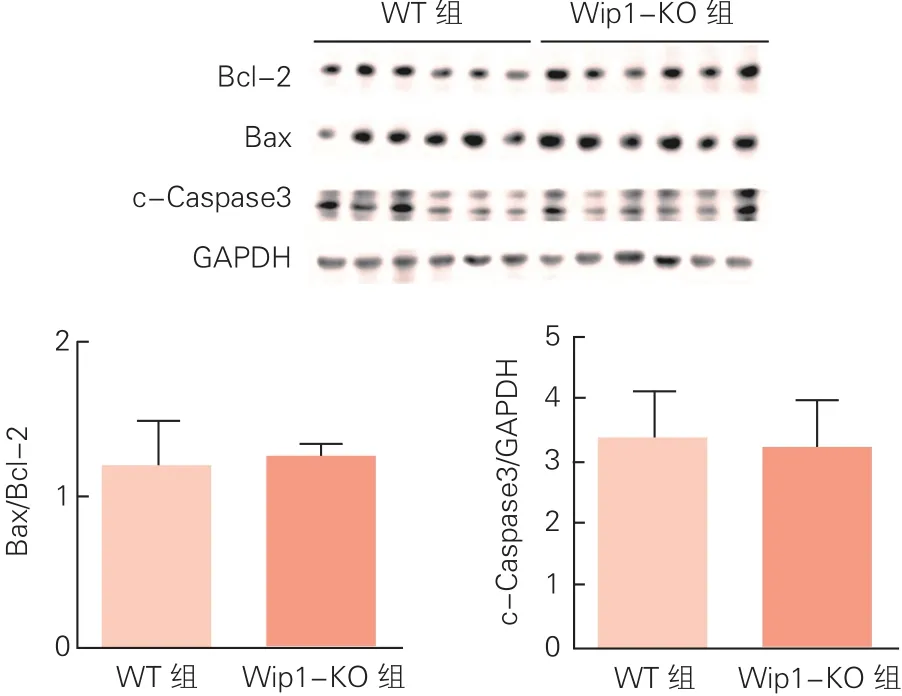
圖5 兩組小鼠心肌組織中凋亡相關蛋白表達水平的比較
3 討論
Wip1在很多病理和生理過程中起著重要作用。研究報道,Wip1基因敲除可影響小鼠血糖代謝。敲除Wip1基因的小鼠在高脂飲食時出現糖耐量異常和胰島素抵抗[5]。Wip1還可以通過調節脂質轉化影響動脈粥樣硬化斑塊形成,并通過哺乳動物雷帕霉素靶蛋白信號通路和自噬影響斑塊進展[4]。本研究中敲除Wip1基因的小鼠心功能下降,心重/體重比增加,初步提示Wip1在小鼠心臟中也起著調節作用。
Wip1基因缺失小鼠存在發育缺陷。與野生型小鼠相比,敲除Wip1基因的雄性小鼠體重減輕,皮膚表面容易出現潰瘍,生精小管退化,脾臟增大,伴或不伴有正常的脾臟結構缺失,并且對抗原的敏感性增加[3]。敲除Wip1基因可以影響小鼠胸腺發育,胸腺中T細胞數量較少并且發育異常[6]。此外,Wip1基因缺失也可以影響小鼠體內B細胞發育,骨髓、外周血液和脾臟中B細胞數量明顯減少,早期B細胞前體出現細胞內在缺陷[7]。與既往研究結果相一致,本研究發現Wip1-KO小鼠的體重比野生型小鼠減輕。雖然兩組小鼠之間心臟重量的差異沒有統計學意義,但Wip1-KO小鼠的心重/體重比值較野生型小鼠大。本研究還發現敲除Wip1基因可引起小鼠心功能減弱,射血分數和縮短分數都降低,左心室收縮末期內徑增大,說明Wip1基因缺失可以損害小鼠心功能。
ANP和BNP是心臟分泌的利鈉肽,心臟壓力超負荷或容量超負荷時分泌增加。因此,ANP和BNP基因表達水平上調可以反映心臟收縮或舒張功能受損[8]。MCP-1是單核細胞趨化因子,具有誘導單核細胞浸潤的作用。MCP-1可以通過調節內皮細胞遷移直接影響損傷部位血管生成[9],并通過刺激細胞外基質促進纖維組織形成[10]。小鼠心肌缺血再灌注損傷模型中,MCP-1可以誘導炎性單核細胞聚集,促進內膜增生,從而使梗死面積擴大并加重心肌損傷[11,12]。α-SMA主要由血管平滑肌細胞和成纖維細胞表達,在發育過程中被α-骨骼肌肌動蛋白和α-心肌肌動蛋白取代。病理性刺激或應激狀態可誘導α-SMA表達,心肌梗死后疤痕組織中成纖維細胞表達α-SMA水平上調[13]。近期研究發現,α-SMA可與細胞外基質蛋白相互作用,進而調節心肌細胞的收縮功能[14]。本研究檢測了這四種基因在小鼠心肌組織中的表達水平,雖然兩組小鼠之間存在一定差異,但差異并不具有統計學意義。
細胞凋亡是一種細胞程序性死亡,主要表現為細胞體積變小,染色質濃縮和核DNA降解[15]。Bcl-2家族在細胞凋亡中起著重要作用,迄今為止,已發現有大約25種蛋白。其中,Bcl-2具有抗凋亡作用,Bax屬于促凋亡蛋白[16]。Caspase是一組半胱氨酸蛋白酶,在凋亡過程中主要作用是清除細胞蛋白,引起細胞的生物化學和形態學改變。受到凋亡信號刺激后,Bcl-2家族的促凋亡成員如Bax活化,進而引起線粒體膜上的滲透性轉運孔形成。線粒體釋放細胞色素C等形成凋亡體,活化Caspase 9和Caspase 3,從而誘發凋亡[17]。p53在細胞凋亡過程中起著重要的調節作用,研究發現Wip1可通過使p53去磷酸化和使上游蛋白失活達到抑制凋亡的作用[18]。本研究檢測了WT小鼠和Wip1-KO小鼠心肌組織中凋亡相關蛋白的表達水平,兩組小鼠之間無統計學差異,提示Wip1敲除不影響心肌組織中凋亡信號通路。
本研究發現敲除Wip1基因可影響小鼠心功能,但具體的分子學機制尚不清楚,是此研究的局限之一。此外,研究中缺乏Wip1基因敲除小鼠補充外源性Wip1蛋白對照組,是該研究的另一不足。
雖然本研究的結果發現Wip1基因缺失可損害小鼠心功能和影響小鼠心重/體重比,但并不影響小鼠心肌組織病理形態改變,也不影響心臟中相關基因和蛋白表達。Wip1基因敲除通過何種信號通路影響小鼠心功能仍需進一步研究。
[1] Choi J, Appella E, Donehower LA. The Structure and Expression of the Murine Wildtype p53-Induced Phosphatase 1(Wip1). Genomics, 2000, 64: 298-306.
[2] Zhu YH, Bulavin DV. Wip1-Dependent Signaling Pathways in Health and Diseases. Prog Mol Biol Transl Sci, 2012, 106: 307-325.
[3] Choi J, Nannenga B, Demidov ON, et al. Mice deficient for the wild-type p53-induced phosphatase gene (Wip1) exhibit defects in reproductive organs, immune function, and cell cycle control. Mol Cell Biol, 2001, 22: 1094-1105.
[4] Leguezennec X, Brichkina A, Huang YF, et al. Wip1-Dependent Regulation of Autophagy, Obesity, and Atherosclerosis. Autophagy, 2012, 16: 68.
[5] Armata HL, Chamberland S, Watts L, et al. Deficiency of the tumor promoter gene wip1 induces insulin resistance. Mol Endocrinol, 2014, 29: 28-39.
[6] Schito ML, Demidov ON, Saito S, et al. Wip1 phosphatase-deficient mice exhibit defective T cell maturation due to sustained p53 activation. J Immunol, 2006, 176: 4818-4825.
[7] Yi W, Hu X, Chen Z, et al. Phosphatase Wip1 controls antigenindependent B-cell development in a p53-dependent manner. Blood, 2015, 126: 620-628.
[8] Daniels LB, Maisel AS. Natriuretic peptides. J Am Coll Cardiol, 2007, 50: 2357-2368.
[9] Weber KS, Nelson PJ, Gr?ne HJ, et al. Expression of CCR2 by endothelial cells : implications for MCP-1 mediated wound injury repair and In vivo inflammatory activation of endothelium. Arterioscler Thromb Vasc Biol, 1999, 19: 2085-2093.
[10] Sakai N, Wada T, Furuichi K, et al. MCP-1/CCR2-dependent loop for fibrogenesis in human peripheral CD14-positive monocytes. J Leukoc Biol, 2006, 79: 555-563.
[11] Dewald O, Zymek P, Winkelmann K, et al. CCL2/Monocyte Chemoattractant Protein-1 regulates inflammatory responses critical to healing myocardial infarcts. Cir Res, 2005, 96: 881-889.
[12] Liehn EA, Piccinini AM, Koenen RR, et al. A new monocyte chemotactic protein-1/chemokine CC motif ligand-2 competitor limiting neointima formation and myocardial ischemia/reperfusion injury in mice. J Am Coll Cardiol, 2010, 56: 1847-1857.
[13] Suurmeijer AJ, Clément S, Francesconi A, et al. α Actin isoform distribution in normal and failing human heart: a morphological, morphometric, and biochemical study. J Pathol, 2003, 199: 387-397.
[14] Bildyug N, Bozhokina E, Khaitlina S. Contribution of α-smooth muscle actin and extracellular matrix to the in vitro reorganization of cardiomyocyte contractile system. Cell Biol Int, 2016, 40: 472-477.
[15] Maiese K, Chong ZZ, Shang YC, et al. Targeting disease through novel pathways of apoptosis and autophagy. Expert Opin Ther Targets. 2012, 16: 1203-1214.
[16] Ola MS, Nawaz M, Ahsan H. Role of Bcl-2 family proteins and caspases in the regulation of apoptosis. Mol Cell Biochem, 2011, 351: 41-58.
[17] Siddiqui WA, Ahad A, Ahsan H. The mystery of Bcl2 family: Bcl-2 proteins and apoptosis: an update. Arch Toxicol, 2015, 89: 289-317.
[18] Lowe J, Cha H, Lee MO, et al. Regulation of the Wip1 phosphatase and its effects on the stress response. Front Biosci (Landmark Ed), 2012, 17: 1480-1498.
(編輯:許菁)
Impact of Wildtype p53 Induced Phosphatase 1 Gene Lacking on Heart Function in Experimental Mice
LIU Ke-mei, LIU Chen, ZHOU Peng, LIU Juan, TAN Yu, LI Jian-nan, ZHANG Lian-feng, ZHANG Hong-bing, YAN Hong-bing.
State Key Laboratory of Cardiovascular Disease, Cardiovascular Institute and Fu Wai Hospital, CAMS and PUMC, Beijing (100037), China
YAN Hong-bing, Email: hbyanfuwai@aliyun.com
Objective: To explore the impact of knocking out wildtype p53 phosphatase 1 gene on heart function with the changes of cardiac tissue mRNA and protein expressions in experimental mice.
Methods: Our research included in 2 groups: Wildtype (WT) mice group and Wip1 knockout (Wip1-KO) mice group. n=10 in each group. The heart function, ratio of heart weight to body weight (HW/BW) were examined and compared between 2 groups; cardiac tissue morphology was observed by HE staining; mRNA expressions of ANP, BNP, MCP-1 and α-SMA were determined by RT-PCR and protein expressions of Bcl-2, Bax and c-caspase3 were measured by Western blot analysis.
Results: Compared with WT mice group, Wip1-KO mice group showed decreased Wip1 mRNA expression, P<0.05, decreased LVEF, LV fraction shortening and increased left ventricular end systolic diameter (LVESD), all P<0.05; Wip1-KO mice group had reduced BW and elevated ratio of HW/BW, both P<0.05 even the heart weight was similar between 2 groups. There was no difference in cardiac tissue morphology between 2 groups; mRNA expressions of ANP, BNP, MCP-1 and α-SMA
Conclusion: Wip1 gene knockout may impair the heart function in experimental mice, while the relevant mechanism should be further investigated.
Mice, Gene knockout; Heart function test; Apoptosis
book=792,ebook=68
國家自然科學基金(81270288 , 81541095)
100037 北京市,北京協和醫學院 中國醫學科學院 國家心血管病中心 阜外醫院(劉可美、劉臣、周鵬、劉娟、譚宇、李健楠、顏紅兵);中國醫學科學院醫學實驗動物研究所 北京協和醫學院比較醫學中心(張連峰);中國醫學科學院基礎醫學研究所 北京協和醫學院基礎學院(張宏冰)
劉可美 碩士研究生 主要從事心血管病學基礎與臨床研究 Email:liukemei@aliyun.com 通訊作者:顏紅兵 Email: hbyanfuwai@aliyun.com
R54
A
1000-3614(2017)08-0792-05
10.3969/j.issn.1000-3614.2017.08.015were similar between 2 groups, P>0.05; apoptosis related protein expressions of Bax/Bcl-2 and c-caspase3 were similar between 2 groups, P>0.05.
2017-02-19)

