分子影像技術在抗腫瘤藥物研發中的應用進展Δ
高海燕,任 恩,劉 剛(廈門大學公共衛生學院分子影像暨轉化醫學研究中心,福建廈門 361102)
·綜述講座·
分子影像技術在抗腫瘤藥物研發中的應用進展Δ
高海燕*,任 恩,劉 剛#(廈門大學公共衛生學院分子影像暨轉化醫學研究中心,福建廈門 361102)
目的:為借助分子影像技術提高抗腫瘤藥物研發效率、降低研發成本提供參考。方法:以“分子影像技術”“藥物研發”“腫瘤診斷”“生物標志物”等為關鍵詞,通過檢索和篩選中國知網、中國國家圖書館、PubMed、Web of Science等數據庫收錄的2017年4月以前發表的分子影像技術用于抗腫瘤藥物研發的最新文獻,進行整理、歸納和綜述。結果與結論:近年來分子影像技術已取得重大進展,正越來越廣泛地應用于抗腫瘤藥物研發,并在藥物生物分布標志物(藥物由血液循環運送到體內各臟器的過程)、藥效學生物標志物(藥物對機體的作用及作用機制)、疾病生物標志物(用于疾病診斷、判斷疾病分期或者用來評價新藥或新療法在目標人群中的安全性及有效性)及患者選擇生物標志物(識別可能對治療有反應的患者,指導治療)等方面發揮重要作用。分子影像技術的成功應用,有望提高抗腫瘤藥物開發全鏈條的效率和收益,其潛在價值有待進一步開發。
分子影像技術;抗腫瘤藥物;研發;生物標志物
如今,雖然人們對腫瘤生物學和相關藥物研發方面的認識有了長足進步,但惡性腫瘤致死率仍居高不下[1]。與此同時,傳統抗腫瘤藥物研發模式所需周期長且成本高昂,因此降低藥物研發成本也是當前面臨的巨大挑戰[2-3]。近年來,分子影像技術發展迅速,為腫瘤早期診斷和相關藥物研發提供了非常有效的工具,如定量全身放射自顯影、X射線計算機斷層掃描(CT)、正電子發射斷層掃描(PET)、單光子發射計算機斷層掃描(SPECT)、磁共振成像(MRI)、超聲(US)、光學成像(包括生物發光、熒光、紅光及多光譜等)、光聲成像、高分辨顯微鏡以及多模態顯像等技術。借助分子影像技術,可方便、快速地了解一種新的抗腫瘤藥物的體內代謝過程,縮短藥物研發時間,并可評估藥效和確定有效劑量[4-5]。本文中,筆者以“分子影像技術”“藥物研發”“腫瘤”“診斷”“生物標志物”等為關鍵詞,檢索和篩選中國知網、中國國家圖書館、PubMed、Web of Science等數據庫收錄的2017年4月以前發表的分子影像技術用于抗腫瘤藥物研發的最新文獻,進行整理、歸納和綜述,旨在為借助該技術提高抗腫瘤藥物研發效率、降低研發成本提供參考。
1 生物標志物分類及分子影像技術應用
惡性腫瘤伴隨著高發病率和死亡率,是當前一個主要的公共衛生問題,而研發新的抗腫瘤藥物是惡性腫瘤治療中迫切需要解決的難題。在惡性腫瘤治療中,患者的個體差異以及腫瘤的時間和空間異質性等因素都會影響到藥物的療效;而在不同的病理過程中有不同的生物標志物,其隨著腫瘤的形態變化而發生特異性變化,借助分子影像技術檢測相關的生物標志物對于評價新藥在目標人群中的安全性及有效性至關重要,生物標志物的發現推動了新藥的研發進程。相關生物標志物分類及分子影像技術應用見表1。
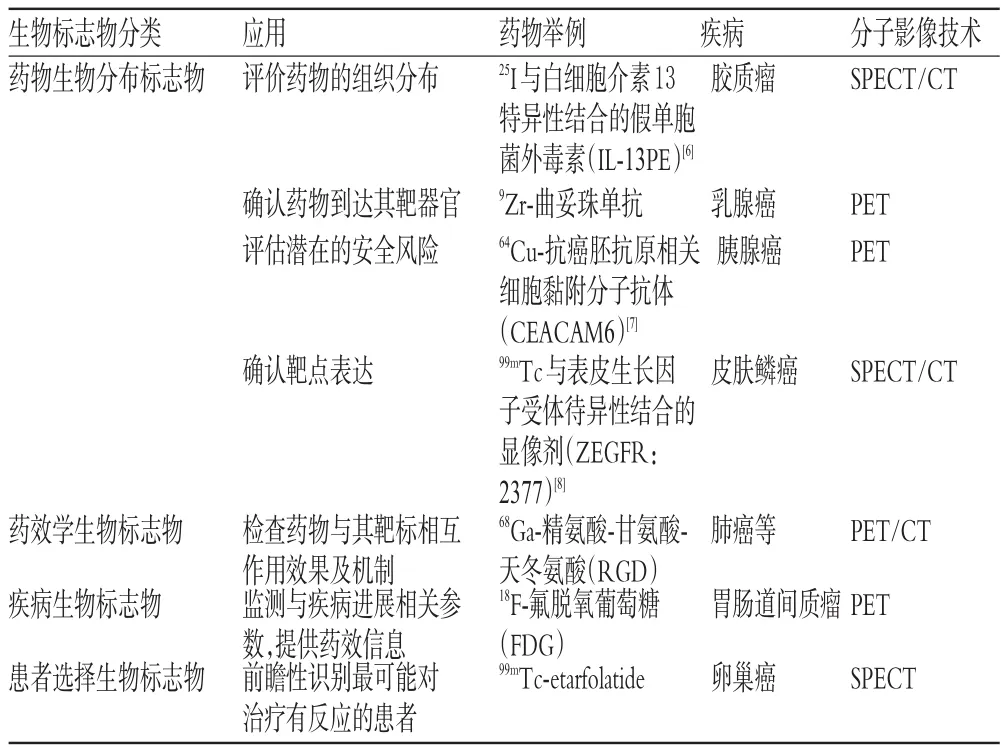
表1 生物標志物分類及分子影像技術應用
2 藥物生物分布標志物
藥物生物分布是指從給藥部位進入血液后,由血液循環轉運到各臟器的過程。理想制劑應在給藥后,迅速到達靶器官,實現藥物高效性治療。但藥物的分布往往受到機體的影響,比如血腦屏障[9]、轉移蛋白P-糖蛋白(P-gp)、乳腺癌阻抗蛋白(BCRP)和其他耐藥性蛋白(MRPs)[10]。同時,藥物療效也可能會因為無法到達靶組織或受到病理變化的影響如腎功能改變而降低。在這些情況下,得到精準的機體藥物分布數據至關重要[11]。例如,在腦膠質瘤治療過程中,確定治療藥物在腫瘤區域的濃度非常必要[6]。通常藥物小分子被放射性核素標記后能夠用PET和SPECT成像檢測其在體內的分布,但是也需要注意藥物標記后的藥理學分布可能發生改變。而放射性核素標記的基本原則是所選用的核素與藥物的半衰期應該是在同一個范圍內。
通過同位素置換法(如11C替代12C,18F替代19F)直接標記藥物是理想方法,但需確定標記物與藥物結合不會影響藥物的重要理化性質。此外,含有螯合基團的金屬元素或者碘同位素因具有較長的半衰期通常用來標記抗體和其他蛋白質(89Zrt1/2=78.41 h)。但應注意這些同位素或螯合劑可能對放射性藥物的生物分布和功能產生影響,而開發新的標記方法是當前藥物生物分布標志物研究的熱點,如利用單克隆抗體的選擇性和小分子的快速藥動學性質的優點,設計放射性標記的單克隆抗體[12-13],使其在被血液清除前到達靶組織,或使用放射性核素標記抗體片段等[14-16]。除了評估藥物的療效之外,了解藥物的生物分布還有助于評估安全性。例如,抗體-藥物綴合物(ADC)在非靶器官中的積累可能需要仔細檢查藥物對該器官功能的潛在危害性問題[17]。此外,治療持續時間和器官敏感性也是重要的考察因素。
藥物生物分布標志物研究還可提供靶向驗證[18],如89Zr-曲妥珠單抗用于轉移性乳腺癌患者中人表皮生長因子受體2(HER2)陽性病變的PET成像[19]。將標記的雙特異性抗體的生物分布與其兩種親本抗體(治療和靶向組分)進行比較,可以確認靶組織分布情況[8]。
3 藥效學生物標志物
藥效學(PD)生物標志物用于監測抗腫瘤藥物達到靶標后的作用情況。利用分子影像技術可在動物模型上以連續、動態、定量的非侵襲的方式觀測細胞代謝、增殖、凋亡、血管再生以及某些疾病的病理變化,因此可真正實現活體的無創藥效評價。
3.1 細胞代謝成像
分子影像技術可顯示腫瘤細胞的代謝情況,包括葡萄糖、氨基酸和脂類代謝。與解剖成像相比,PET成像的優點在于可評估腫瘤細胞的藥物反應。18F-FDG是使用最為廣泛的PET成像示蹤劑,其原理是惡性腫瘤細胞內糖酵解增加[20-23]。目前認為,18F-FDG PET在評價對胃腸道肉瘤中的伊馬替尼(Gleevec)治療反應是有效的。在胃腸道間質瘤患者(GIST)服用甲磺酸伊馬替尼后24 h內,利用FDG-PET可監測到其體內藥物反應[24];并且Valls-Ferrusola E等[25]利用18F-FDG PET/CT評估了GIST的轉移情況,其成像數據對GIST的疾病發展進程也有一定參考價值。FDG-PET作為癌癥分子成像工具的價值在其他幾種癌癥如乳腺癌、前列腺癌、直腸癌和卵巢癌中都得到體現。同時,FDG-PET也可對接受免疫治療的患者實施無創免疫檢測。此外,腫瘤細胞對卵磷脂需求增加,由此將加快膽堿的轉運和磷酸化速度,因此膽堿也可作為腫瘤增殖的成像標記物[26]。
3.2 細胞增殖成像
腫瘤細胞增殖成像常用于抗增殖藥物的療效評估[27-28],如用于評估法尼酰基轉移酶抑制劑、表皮生長因子受體抑制劑等藥物的抗增殖作用[29]。類胸苷3′-脫氧-3′-氟胸苷(FLT)是細胞增殖成像中應用最廣泛的一類標記物,其通過核苷轉運蛋白被細胞攝取,并被胸苷激酶(TK)1磷酸化。研究表明,18F-FLT可作為藥效評估和療效評價的重要標記物[30]。Leyton J等[31]向小鼠腫瘤模型體內注射順鉑,發現與FDG-PET相比,FLT-PET對腫瘤增殖的反應更具敏感性,成像效果更佳。此外,18FFLT也用于評估注射胸苷酸合酶抑制劑5-氟尿嘧啶后對腫瘤的抑制效果。
3.3 細胞凋亡成像
腫瘤細胞凋亡是惡性腫瘤治療研究中的一個熱點。許多化療藥物是通過誘導細胞凋亡而抑制腫瘤增殖,對誘導細胞凋亡進行無創性成像,可為評價腫瘤治療藥物的藥效提供重要信息[32-33]。細胞凋亡時,膜聯蛋白(Annexin V)與磷酯酰絲氨酸(Phosphatidylser,PS)相結合移動到細胞膜外。使用99mTc、124I或18F標記Annexin V進行SPECT和PET成像,可用于評估化療效果[34-36]。Belhocine TZ等[37-38]使用99mTc-Annexin V結合SPECT評估由化療藥物誘導形成的腫瘤細胞凋亡,并根據所有的臨床成像數據定量分析了99mTc-Annexin V攝取標準,從而可更好地預測腫瘤對治療的反應。然而,Annexin V也能在壞死細胞中通過滲透作用穿過細胞膜而與膜內的PS結合,難以特異性地反映腫瘤細胞凋亡。因此,如何優化相關成像方法仍需進一步研究。
3.4 血管生成成像
血管生成為腫瘤細胞提供所需要的營養,其與腫瘤形成和發展密切相關,對其進行評價已成為抗血管生成藥物的目標。動態增強MRI(DCE-MRI)是MRI成像的一個常用成像方法,可測量腫瘤微血管功能情況,被廣泛用于抗血管生成和血管阻斷藥物的早期臨床藥物試驗評估中的成像監控。除MRI成像[尤其是高分辨率磁共振血管造影(MRA)],CT、PET、US和光學成像等方法也可用于腫瘤血管生成成像,包括CT血管造影(CTA)及增強US造影(CEU)等。整合素αvβ3在許多腫瘤的新生血管系統活化的內皮細胞上表達較高,并參與腫瘤生長、侵襲和轉移,對αvβ3受體成像可以用于監測血管生成[39]。例如,RGD與αvβ3結合用于血管生成成像促進了多種藥物研發。18F-低聚半乳糖(Galacto)-RGD在多種腫瘤中顯示出良好的腫瘤攝取、動力學特征和藥物生物分布成像效果[40]。而68Ga標記的RGD目前也在進行臨床前研究,其腫瘤血管生成成像效果良好[41-42]。
3.5 組織缺氧成像
幾乎所有的腫瘤中均存在缺氧現象,組織缺氧與血管生成、腫瘤侵襲、局部復發和轉移密切相關,是宮頸、頭頸、前列腺、胰腺和腦等部位癌癥的預后指標[43]。缺氧性腫瘤表現出對放療或化療的低響應,低氧影像技術可以幫助選擇、指導放療和化療[44-45]。相比較氧分壓[p(O2)]的創傷性Eppendorf測量,基于分子標記物(如缺氧誘導因子1和碳酸酐酶同工酶Ⅸ)的組織缺氧成像方法提供了更好的選擇[46-47]。其他腫瘤組織缺氧顯影劑還包括[18F]氟硝基咪唑阿拉伯糖苷(FAZA)、60/62/64Cu標記的二乙酰-2(N4-甲基氨基硫脲)、氟化的19F MR造影劑和[18F]氟甲氧甲基硝基咪唑乙醇(FMISO)等。
3.6 免疫治療成像
免疫治療已成為部分癌癥患者的新選擇。隨著人類基因組計劃的開展,新型分子標記物和相應靶向治療藥物數量不斷激增。抗體治療藥是目前正在開發的最新一類分子藥物。抗體可自身發揮生物效應,也可作為與藥物分子結合的遞送制劑。為最大限度地發揮藥物治療作用,減少副作用,免疫療法的定點釋藥已成為一種重要的手段。一些利用基因工程抗體片段[如Fab、單鏈Fv、(Fab’)2等]結合放免液閃法和SPECT取得了令人振奮的結果,打開了利用免疫PET探索短半衰期同位素(如18F、68Ga)標記相關衍生物的大門[48]。
免疫PET將PET理想的靈敏性與單克隆抗體的特異靶向性結合起來[49]。用放射性免疫顯像的長半衰期正電子發射放射性核素(如124I、89Zr和86Y)彌補了針對特異性抗原的單克隆抗體藥動學過程較慢的不足,是該領域的發展趨勢[50]。特別是長半衰期的正電子發射放射性核素89Zr具有適用于毫米尺寸腫瘤的分辨率以及3.27 d半衰期的理想物理成像特征,與完整的抗體所達到最佳的腫瘤-血液比的時間一致。此外,抗體治療也可與相關免疫放射性核素結合用于免疫SPECT成像。例如,在小細胞肺癌(SCLC)患者身上同時進行相應的非放射性單克隆抗體給藥,通過111In-hu3S193 SPECT能無創實時監控所有>2 cm的FDG陽性病灶[51]。
4 疾病生物標志物
疾病生物標志物可用于反映疾病相關的病理生理學的變化。疾病生物標志物評估經常被判斷為臨床治療反應的持續效應指標,理論上,疾病的生物標志物的分子成像可以在腫瘤體積變化前驗證治療是否有效。當前,FDG-PET被廣泛用于GIST患者對舒尼替尼(一種多靶向酪氨酸激酶抑制劑)的治療反應預測。一項研究對患者在舒尼替尼治療前和治療中的第4周進行FDGPET成像,發現在第4周時FDG-PET應答情況與生存期密切相關[52]。這些成像數據往往在早期臨床診斷中至關重要。
5 患者選擇生物標志物
患者選擇生物標志物通常用于識別可能對治療有反應的患者。蛋白質和受體的發現對于靶向治療來說是必要的,如目前99mTc-etafolatide已被用于鑒定葉酸受體陽性患者。研究顯示,99mTc-etafolatide-SPECT陽性與vintafolide二期臨床試驗效果密切相關[53]。Meng X等、Gebhart G等[54-55]研究還表明,用于表皮生長因子受體(EGFR)的成像劑11C-PD153035的最大標準化攝取值(SUVmax)與用厄洛替尼治療的非小細胞肺癌(NSCLC)患者總生存期和無惡化存活期呈正相關。患者選擇生物標志物的成像方法重點考慮因素是成本和技術可行性,尤其是當目標人口相對較少時。為增加早期臨床陽性檢出率,分子影像技術作為篩選工具是可行和實用的,也有助于對其他生物標記物識別和理解。基于該技術的患者選擇策略有助于優化治療方案,提升臨床治療成功率。
6 結語與展望
分子影像技術當前已取得重大進展,正被越來越廣泛地應用于抗腫瘤藥物研發中,并在各個階段發揮重要作用。例如,通過藥物生物分布標志物研究可確定藥物的活體分布、藥動學和潛在的靶向作用;通過藥效學生物標志物研究可用于確認給藥方案和藥物作用機制;通過疾病生物標志物研究可反映疾病相關病理生理學變化;通過患者選擇生物標志物研究可指導患者進行治療。因此,分子影像技術應用有望提高抗腫瘤藥物開發全鏈條的效率和收益,其潛在價值有待進一步開發。
[1] Shamliyan TA,Middleton M,Borst C.Patient-centered outcomes with concomitant use of proton pump inhibitors and other drugs[J].Clin Ther,2017,39(2):404-427.
[2] Morgan S,Grootendorst P,Lexchin J,et al.The cost of drug development:a systematic review[J].Health Policy,2011,100(1):4-17.
[3] Fitzner K,Oteng-Mensah F,Donley P,et al.Safety of cancer therapies:at what cost?[J].Popul Health Manag,2017,doi:10.1089/pop.2016.0097.
[4] Dienstmann R,Rodon J,Tabernero J.Biomarker-driven patient selection for early clinical trials[J].Curr Opin Oncol,2013,25(3):305-312.
[5] Roda D,Jimenez B,Banerji U.Are doses and schedules of small-molecule targeted anticancer drugs recommended by phaseⅠstudies realistic?[J].Clin Cancer Res,2016,22(9):2127-2132.
[6] Suzuki A,Leland P,Kobayashi H,et al.Analysis of biodistribution of intracranially infused radiolabeled interleukin-13 receptor-targeted immunotoxin IL-13PE by SPECT/CT in an orthotopic mouse model of human glioma[J]. J Nucl Med,2014,55(8):1323-1329.
[7] Strickland LA,Ross J,Williams S,et al.Preclinical evaluation ofcarcinoembryonic celladhesion molecule(CEACAM)6 as potential therapy target for pancreatic adenocarcinoma[J].J Pathol,2009,218(3):380-390.
[8] Andersson KG,Oroujeni M,Garousi J,et al.Feasibility of imaging of epidermal growth factor receptor expression with ZEGFR:2377 affibody molecule labeled with99mTc using a peptide-based cysteine-containing chelator[J].Int J Oncol,2016,49(6):2285-2293.
[9] Allhenn D,Boushehri MA,Lamprecht A.Drug delivery strategies for the treatment of malignant gliomas[J].Int J Pharm,2012,436(1/2):299-310.
[10] Binkhathlan Z,Lavasanifar A.P-glycoprotein inhibition as a therapeutic approach for overcoming multidrug resistance in cancer:current status and future perspectives[J]. Curr Cancer Drug Targets,2013,13(3):326-346.
[11] Wei YH,Xu LZ,Shen Q,et al.Microdialysis:a technique for pharmacokinetic-pharmacodynamic studies of oncological drugs[J].Curr Pharm Biotechnol,2009,10(6):631-640.
[12] Zeglis BM,Sevak KK,Reiner T,et al.A pretargeted PET imaging strategy based on bioorthogonal Diels-Alder click chemistry[J].J Nucl Med,2013,54(8):1389-1396.
[13] Denk C,Svatunek D,Filip T,et al.Development of a(18)F-labeled tetrazine with favorable pharmacokinetics for bioorthogonal PET imaging[J].Angew Chem Int Ed Engl,2014,53(36):9655-9659.
[14] Wiehr S,Bühler P,Gierschner D,et al.Pharmacokinetics and PET imaging properties of two recombinant anti-PSMA antibody fragments in comparison to their parental antibody[J].Prostate,2014,74(7):743-755.
[15] Lütje S,Franssen GM,Sharkey RM,et al.Anti-CEA antibody fragments labeled with[(18)F]AlF for PET imaging of CEA-expressing tumors[J].Bioconjug Chem,2014,25(2):335-341.
[16] Zhang Y,Hong H,Orbay H,et al.PET imaging of CD105/endoglin expression with a61/64Cu-labeled Fab antibody fragments[J].Eur J Nucl Med Mol Imaging,2013,40(5):759-767.
[17] Cheng TM,Murad YM,Chang CC,et al.Single domain antibody against carcinoembryonic antigen-related cell adhesion molecule 6(CEACAM6)inhibits proliferation,migration,invasion and angiogenesis of pancreatic cancer cells[J].Eur J Cancer,2014,50(4):713-21.
[18] van Rij CM,Lütje S,Frielink C,et al.Pretargeted immuno-PET and radioimmunotherapy of prostate cancer with an anti-TROP-2 x anti-HSG bispecific antibody[J].Eur J Nucl Med Mol Imaging,2013,40(9):1377-1383.
[19] Dijkers EC,Oude Munnink TH,Kosterink JG,et al.Biodistribution of89Zr-trastuzumab and PET imaging of HER2-positive lesions in patients with metastatic breast cancer[J].Clin Pharmacol Ther,2010,87(5):586-592.
[20] Nativo P,Prior IA,Brust M.Uptake and intracellular fate of surface-modified gold nanoparticles[J].ACS Nano,2008,2(8):1639-1644.
[21] Groheux D,Majdoub M,Sanna A,et al.Early metabolic response to neoadjuvant treatment:FDG PET/CT criteria according to breast cancer subtype[J].Radiology,2015,277(2):358-371.
[22] Beriwal S,Kannan N,Sukumvanich P,et al.Complete metabolic response after definitive radiation therapy for cervical cancer:patterns and factors predicting for recurrence[J].Gynecol Oncol,2012,127(2):303-306.
[23] Hatt M,van Stiphout R,le Pogam A,et al.Early prediction of pathological response in locally advanced rectal cancer based on sequential 18F-FDG PET[J].Acta Oncol,2013,52(3):619-626.
[24] Van den Abbeele AD,Badawi RD.Use of positron emission tomography in oncology and its potential role to assess response to imatinib mesylate therapy in gastrointestinal stromal tumors(GISTs)[J].Eur J Cancer,2002,38(Suppl 5):S60-S65.
[25] Valls-Ferrusola E,García-Garzón JR,Ponce-López A,et al.Patterns of extension of gastrointestinal stromal tumors(GIST)treated with imatinib(Gleevec?)by 18F-FDG PET/CT[J].Rev Esp Enferm Dig,2012,104(7):360-366.
[26] Campoy FJ,Vidal CJ,Mu?oz-Delgado E,et al.Cholinergic system and cell proliferation[J].Chem Biol Interact,2016,259(Pt B):257-265.
[27] Hanahan D,Weinberg RA.Hallmarks of cancer:the next generation[J].Cell,2011,144(5):646-674.
[28] Bading JR,Shields AF.Imaging of cell proliferation:status and prospects[J].J Nucl Med,2008,49(Suppl 2):64S-80S.
[29] Scarpelli M,Bruce JY,Carmichael L,et al.18F-FLT PE-T/CT imaging in patients with advanced solid malignancies treated with axitinib on an intermittent dosing regimen[J].Cancer Chemother Pharmacol,2016,78(6):1245-1252.
[30] Nakajo M,Kajiya Y,Jinguji M,et al.Current clinical status of 18F-FLT PET or PET/CT in digestive and abdominal organ oncology[J].Abdom Radiol(NY),2017,42(3):951-961.
[31] Leyton J,Latigo JR,Perumal M,et al.Early detection of tumor response to chemotherapy by 3′-deoxy-3′-[18F]fluorothymidine positron emission tomography:the effect of cisplatin on a fibrosarcoma tumor model in vivo[J].Cancer Res,2005,65(10):4202-4210.
[32] Zeng X,Yuan Y,Wang T,et al.Targeted imaging and induction of apoptosis of drug-resistant hepatoma cells by miR-122-loaded graphene-InP nanocompounds[J].J Nanobiotechnology,2017,15(1):9.
[33] Wang X,Feng H,Zhao S,et al.SPECT and PET radiopharmaceuticals for molecular imaging of apoptosis:from bench to clinic[J].Oncotarget,2017,8(12):20476-20495.
[34] Benali K,Louedec L,Azzouna RB,et al.Preclinical validation of99mTc-annexin A5-128 in experimental autoimmune myocarditis and infective endocarditis:comparison with99mTc-HYNIC-annexin A5[J].Mol Imaging,2014,doi:10.2310/7290.2014.00049.
[35] Verma VK,Beevi SS,Tabassum A,et al.In vitro assessment of cytotoxicity and labeling efficiency of 99mTc-HMPAO with stromal vascular fraction of adipose tissue [J].Nucl Med Biol,2014,41(9):744-748.
[36] Lu C,Jiang Q,Hu M,et al.Preliminary biological evaluation of18F-FBEM-Cys-Annexin V a novel apoptosis imaging agent[J].Molecules,2015,20(3):4902-4914.
[37] Belhocine TZ,Blankenberg FG,Kartachova MS,et al.(99m)Tc-Annexin A5 quantification of apoptotic tumor response:a systematic review and meta-analysis of clinical imaging trials[J].Eur J Nucl Med Mol Imaging,2015,42(13):2083-2097.
[38] Belhocine TZ,Blankenberg FG.99mTc-Annexin A5 uptake and imaging to monitor chemosensitivity[J].Methods Mol Med,2005(111):363-380.
[39]Hyoun Kim M,Kim SG,Guhn Kim C,et al.A novel Tc-99m and fluorescence labeled peptide as a multimodal imaging agent for targeting angiogenesis in a murine hindlimb ischemia model[J].Appl Radiat Isot,2017(121):22-27.
[40] Laitinen I,Saraste A,Weidl E,et al.Evaluation of alphavbeta3integrin-targeted positron emission tomography tracer 18F-galacto-RGD for imaging of vascular inflammation in atherosclerotic mice[J].Circ Cardiovasc Imaging,2009,2(4):331-338.
[41] Eo JS,Jeong JM.Angiogenesis imaging using(68)Ga-RGD PET/CT:therapeutic implications[J].Semin Nucl Med,2016,46(5):419-427.
[42] Pohle K,Notni J,Bussemer J,et al.68Ga-NODAGARGD is a suitable substitute for(18)F-Galacto-RGD and can be produced with high specific activity in a cGMP/ GRP compliant automated process[J].Nucl Med Biol,2012,39(6):777-784.
[43] Colliez F,Gallez B,Jordan BF.Assessing tumor oxygenation for predicting outcome in radiation oncology:a review of studies correlating tumor hypoxic status and outcome in the preclinical and clinical settings[J].Front Oncol,2017(7):10.
[44] Gallez B,Neveu MA,Danhier P,et al.Manipulation of tumor oxygenation and radiosensitivity through modification of cell respiration.A critical review of approaches and imaging biomarkers for therapeutic guidance[J].Biochim Biophys Acta,2017,1858(8):700-711.
[45] Grkovski M,Sch?der H,Lee NY,et al.Multiparametric imaging of tumor hypoxia and perfusion with18F-fluoromisonidazole dynamic PET in head and neck cancer[J].J Nucl Med,2017,58(7):1072-1080.
[46] Shu C,Wang J.The relationship between MRI quantitative parameters and the expression of hypoxia inducible factor-1 alpha in cerebral astrocytoma[J].Clin Neurol Neurosurg,2017(153):14-19.
[47] Li J,Bao B,Liu L,et al.Near-infrared fluorescence imaging of carbonic anhydraseⅨ in athymic mice bearing HT-29 tumor xenografts[J].Biomed Res Int,2016(2016):6825712.
[48] Wong KJ,Baidoo KE,Nayak TK,et al.In vitro and in vivo pre-clinical analysis of a F(ab′)(2)fragment of panitumumab for molecular imaging and therapy of HER1 positive cancers[J].EJNMMI Res,2011(1):1.
[49] Nayak TK,Brechbiel MW.Radioimmunoimaging with lo-nger-lived positron-emitting radionuclides:potentials and challenges[J].Bioconjug Chem,2009,20(5):825-841.
[50] Dijkers EC,Kosterink JG,Rademaker AP,et al.Development and characterization of clinical-grade89Zr-trastuzumab for HER2/neu immuno PET imaging[J].J Nucl Med,2009,50(6):974-981.
[51] Krug LM,Milton DT,Jungbluth AA,et al.Targeting Lewis Y(Le(y))in small cell lung cancer with a humanized monoclonal antibody,hu3S193:a pilot trial testing two dose levels[J].J Thorac Oncol,2007,2(10):947-952.
[52] Prior JO,Montemurro M,Orcurto MV,et al.Early prediction of response to sunitinib after imatinib failure by18F-fluorodeoxyglucose positron emission tomography in patients with gastrointestinal stromal tumor[J].J Clin Oncol,2009,27(3):439-445.
[53] Morris RT,Joyrich RN,Naumann RW,et al.PhaseⅡ study of treatment of advanced ovarian cancer with folatereceptor-targeted therapeutic(vintafolide)and companion SPECT-based imaging agent(99mTc-etarfolatide)[J].Ann Oncol,2014,25(4):852-858.
[54] Meng X,Loo BW Jr,Ma L,et al.Molecular imaging with11C-PD153035 PET/CT predicts survival in nonsmall cell lung cancer treated with EGFR-TKI:a pilot study[J].J Nucl Med,2011,52(10):1573-1579.
[55] Gebhart G,Lamberts LE,Wimana Z,et al.Molecular imaging as a tool to investigate heterogeneity of advanced HER2-positive breast cancer and to predict patient outcome under trastuzumab emtansine(T-DM1):the ZEPHIR trial[J].Ann Oncol,2016,27(4):619-624.
R979.1;R96
A
1001-0408(2017)24-3448-06
2017-03-03
2017-07-19)
(編輯:周 箐)
國家科技部重點專項項目(No.2017YFA0205200);國家自然科學基金資助項目(No.81101101、81422023、51273165、U1505221);教育部科技重點項目(No.212149);教育部新世紀優秀人才支持計劃(No.NCET-13-0502)
*碩士研究生。研究方向:納米藥物。E-mail:1074144437@qq. com
#通信作者:教授,博士。研究方向:分子影像探針、生物醫用高分子、藥物/基因傳輸體系。E-mail:gangliu.cmitm@xmu.edu.cn
DOI10.6039/j.issn.1001-0408.2017.24.39

