跨物種篩選黃毛鼠的微衛(wèi)星分子標(biāo)記*
韓金巧, 譚江東, 王艷妮, 任 鵬,張新玉, 龔 堃, 黃相相, 周 曉
(浙江師范大學(xué) 生態(tài)研究所,浙江 金華 321004)
跨物種篩選黃毛鼠的微衛(wèi)星分子標(biāo)記*
韓金巧, 譚江東, 王艷妮, 任 鵬,張新玉, 龔 堃, 黃相相, 周 曉
(浙江師范大學(xué) 生態(tài)研究所,浙江 金華 321004)
利用微衛(wèi)星引物側(cè)翼序列具有保守性的特點(diǎn)進(jìn)行了跨物種篩選黃毛鼠微衛(wèi)星引物的研究.選取60對(duì)大鼠、小鼠已知的微衛(wèi)星位點(diǎn)引物,對(duì)黃毛鼠的基因組DNA進(jìn)行了PCR擴(kuò)增,通過(guò)瓊脂糖凝膠電泳、聚丙烯酰氨凝膠電泳及基因掃描技術(shù)篩選了適合黃毛鼠的多態(tài)性位點(diǎn)引物.研究結(jié)果顯示,60對(duì)微衛(wèi)星位點(diǎn)引物中,17對(duì)引物能夠穩(wěn)定擴(kuò)增,其中8對(duì)引物的多態(tài)信息含量(PIC)均大于0.5,為高度多態(tài)性引物.研究篩選到的微衛(wèi)星位點(diǎn)可為后期黃毛鼠的種群遺傳學(xué)研究提供參考.
黃毛鼠;微衛(wèi)星標(biāo)記;跨物種擴(kuò)增;多態(tài)性
黃毛鼠(Rattuslosea)隸屬于嚙齒目(Rodentia)鼠科(Muridae)大鼠屬(Rattus),是我國(guó)華南地區(qū)水稻生產(chǎn)區(qū)重要的害鼠之一,是鉤端螺旋體、立克次體等多種病原體的儲(chǔ)存者和傳播者[1],主要分布于長(zhǎng)江以南及湖北、安徽等地區(qū)[2].目前,有關(guān)黃毛鼠生長(zhǎng)發(fā)育[3]、年齡鑒定[4]、生態(tài)習(xí)性[5-6]、種群數(shù)量變動(dòng)[7]、種群空間格局[8]及危害防治[9]等方面已有較多的研究,但利用分子生物學(xué)技術(shù)進(jìn)行遺傳分析的研究報(bào)道較少.
微衛(wèi)星DNA標(biāo)記是一種分子遺傳標(biāo)記技術(shù),具有共顯性遺傳、多態(tài)信息含量高、檢測(cè)快速方便、重復(fù)性好等特點(diǎn),被廣泛地應(yīng)用于遺傳圖譜構(gòu)建、遺傳多樣性分析、遺傳疾病診斷和遺傳育種等方面[10-12].目前,大鼠(Rattusnorvegicus)[13]、小鼠(Musmusculus)[14]、社鼠(Niviventerconfucianus)[15]、大倉(cāng)鼠(Cricetulustriton)[16]、黑線倉(cāng)鼠(Cricetulusbarabensis)[17]和長(zhǎng)爪沙鼠(Merionesunguiculatus)[18]等嚙齒動(dòng)物的微衛(wèi)星引物已通過(guò)開(kāi)發(fā)或篩選而獲得,但適合黃毛鼠的微衛(wèi)星引物尚未見(jiàn)報(bào)道.由于黃毛鼠、大鼠及小鼠都屬于鼠科動(dòng)物,存在一定的親緣關(guān)系,所以,本研究采用跨物種擴(kuò)增的方法,從大鼠、小鼠的微衛(wèi)星引物中篩選適合黃毛鼠的多態(tài)性引物,為進(jìn)一步進(jìn)行黃毛鼠遺傳結(jié)構(gòu)與遺傳多樣性分析奠定基礎(chǔ).
1 材料與方法
1.1 樣本采集
分別于2013年6月和9月,采用夾捕法,在浙江省舟山群島的大摘箬山、刺山、小貓島、小盤(pán)峙島、大貓島、六橫島、桃花島及小摘箬山8個(gè)島嶼上捕捉到黃毛鼠171只,其中雄性56只、雌性115只.取適量的黃毛鼠肌肉組織,放入95%乙醇溶液中固定保存,帶回實(shí)驗(yàn)室,置于-70 ℃冰箱中待處理.
1.2 組織DNA提取
取95%乙醇溶液固定保存的黃毛鼠肌肉樣品,用雙蒸水清洗樣品表面3次,用濾紙吸干表面水分.剪取肌肉組織150~200 mg,采用經(jīng)典的酚氯仿抽提法提取肌肉組織的DNA.用1%瓊脂糖凝膠電泳檢測(cè)DNA提取結(jié)果.
1.3 微衛(wèi)星位點(diǎn)選取
參照黃毛鼠的近緣種大鼠、小鼠等的微衛(wèi)星位點(diǎn),選取位于大鼠和小鼠不同染色體上的60個(gè)微衛(wèi)星位點(diǎn)[13-15,18].微衛(wèi)星引物全部由生工生物工程(上海)股份有限公司合成,用TE(Tris-EDTA)緩沖液將引物稀釋至10 μmol/L,根據(jù)實(shí)驗(yàn)需要取出適量,其余放入-20 ℃冰箱中保存.
1.4 PCR擴(kuò)增
1.4.1 反應(yīng)體系
PCR反應(yīng)體系為25 μL,其中:10×PCR buffer 2.5 μL;Mg2+溶液分為1.0,1.5和2.0 μL(25 mmol/L)3個(gè)梯度進(jìn)行篩選;dNTP 1.5 μL(2.5 mmol/L);上游和下游引物各0.5 μL(10 μmol/L);樣品DNA溶液1.0 μL;rTag DNA聚合酶溶液0.2 μL(5 U/μL);雙蒸水定容至25 μL.
1.4.2 反應(yīng)程序
PCR反應(yīng)在BIO-RAD公司的MyCycleTM梯度PCR擴(kuò)增儀上進(jìn)行.第1階段:預(yù)變性95 ℃,5 min;第2階段40個(gè)循環(huán):變性95 ℃ 30 s,退火50~60 ℃(不同引物退火溫度不同) 35 s,延伸72 ℃ 35 s;第3階段:延伸72 ℃,7 min.
1.5 引物篩選
1.5.1 退火溫度及Mg2+濃度的確定
退火溫度及Mg2+濃度對(duì)于微衛(wèi)星引物擴(kuò)增的影響較大.Mg2+濃度分為1.0,1.5,2.0 mmol/L 3個(gè)梯度;利用BIO-RAD公司的MyCycleTM梯度PCR擴(kuò)增儀,設(shè)置溫度范圍為50~60 ℃,儀器自動(dòng)生成8個(gè)溫度梯度:50.0,50.9,52.3,54.0,56.3,58.1,59.3和60.0 ℃,隨機(jī)抽取一個(gè)經(jīng)電泳檢測(cè)條帶較清晰的樣本DNA進(jìn)行PCR擴(kuò)增,PCR產(chǎn)物用加有Gold View Ⅰ型核酸染料的1.5%瓊脂糖凝膠、120 V電壓電泳40 min,判斷引物能否擴(kuò)增及對(duì)應(yīng)的最適退火溫度和Mg2+濃度.
1.5.2 引物的篩選
每個(gè)島上隨機(jī)抽取6個(gè)樣本,利用能擴(kuò)增的引物,采用篩選的退火溫度及Mg2+濃度,對(duì)8個(gè)島上的48個(gè)樣本DNA進(jìn)行PCR擴(kuò)增,將PCR產(chǎn)物用1.5%瓊脂糖凝膠電泳檢測(cè),判斷引物能否進(jìn)行穩(wěn)定擴(kuò)增.
將能夠穩(wěn)定擴(kuò)增的微衛(wèi)星引物的PCR產(chǎn)物,利用BIO-RAD生產(chǎn)的DcodeTMUniversal Mutation Detection System進(jìn)行6%變性聚丙烯酰胺凝膠電泳,150 V電壓預(yù)電泳40 min,點(diǎn)樣后250 V電壓電泳4 h,電泳結(jié)束后用10%冰醋酸溶液固定20 min,0.1%AgNO3溶液染色30 min,30 s快速水洗,顯色液(0.2 g碳酸鈉,10 g氫氧化鈉,1 mL甲醛,500 mL蒸餾水)顯色5 min,至條帶清晰時(shí)用10%冰醋酸溶液終止顯色,最后用Bio-Rad Gel DocTMXR+凝膠成像系統(tǒng)進(jìn)行觀察.若條帶的泳動(dòng)距離一致,則說(shuō)明該位點(diǎn)是單態(tài)位點(diǎn);若泳動(dòng)距離有差異,則表明該位點(diǎn)為多態(tài)性位點(diǎn).
將初步篩選出的多態(tài)性引物的5′端分別用FAM,TAMRA和HEX進(jìn)行熒光標(biāo)記,對(duì)48個(gè)樣本DNA進(jìn)行PCR擴(kuò)增,擴(kuò)增產(chǎn)物委托生工生物工程(上海)股份有限公司進(jìn)行短串聯(lián)重復(fù)序列(short tandem repeats,STR)基因掃描,掃描結(jié)果采用GeneMapper ID v3.2軟件判讀,獲得擴(kuò)增片段的長(zhǎng)度.用CERVUS 3.0[19]統(tǒng)計(jì)各微衛(wèi)星位點(diǎn)的等位基因數(shù),并計(jì)算多態(tài)信息含量(PIC),進(jìn)一步驗(yàn)證引物的多態(tài)性.計(jì)算公式為
其中,Pi,Pj分別為第i和第j個(gè)等位基因的頻率.
2 結(jié)果與分析
2.1 DNA提取
利用本實(shí)驗(yàn)室改善的酚-氯仿抽提法提取黃毛鼠肌肉組織的DNA.提取的DNA樣品用100 μLTE緩沖液溶解稀釋?zhuān)? μL用1.0%瓊脂糖凝膠電泳檢測(cè).部分DNA的電泳結(jié)果見(jiàn)圖1.
2.2 退火溫度及Mg2+濃度確定
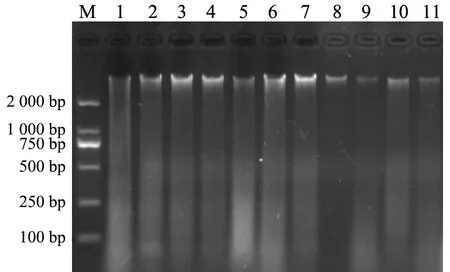
圖1 部分組織樣本DNA提取的電泳檢測(cè)結(jié)果
綜合考慮條帶的明亮、實(shí)驗(yàn)成本及條帶的特異性等,最終選定每對(duì)引物最適合的Mg2+濃度及退火溫度.圖2為引物TNF的瓊脂糖凝膠電泳圖.不同引物的最適Mg2+濃度和退火溫度見(jiàn)表1.
2.3 微衛(wèi)星引物擴(kuò)增和篩選
經(jīng)PCR反應(yīng)體系優(yōu)化,60對(duì)引物中,17對(duì)引物能夠穩(wěn)定擴(kuò)增,其位點(diǎn)名稱(chēng)、引物序列、擴(kuò)增條件及所在染色體見(jiàn)表1.其中,8對(duì)引物雜合且多態(tài)性較好,平均等位基因數(shù)為9.625(7~12),平均多態(tài)信息含量為0.811(0.696~0.871)(見(jiàn)表2).部分引物PCR擴(kuò)增產(chǎn)物的聚丙烯酰胺凝膠電泳結(jié)果見(jiàn)圖3和圖4;圖5為引物IGHE的STR掃描圖.
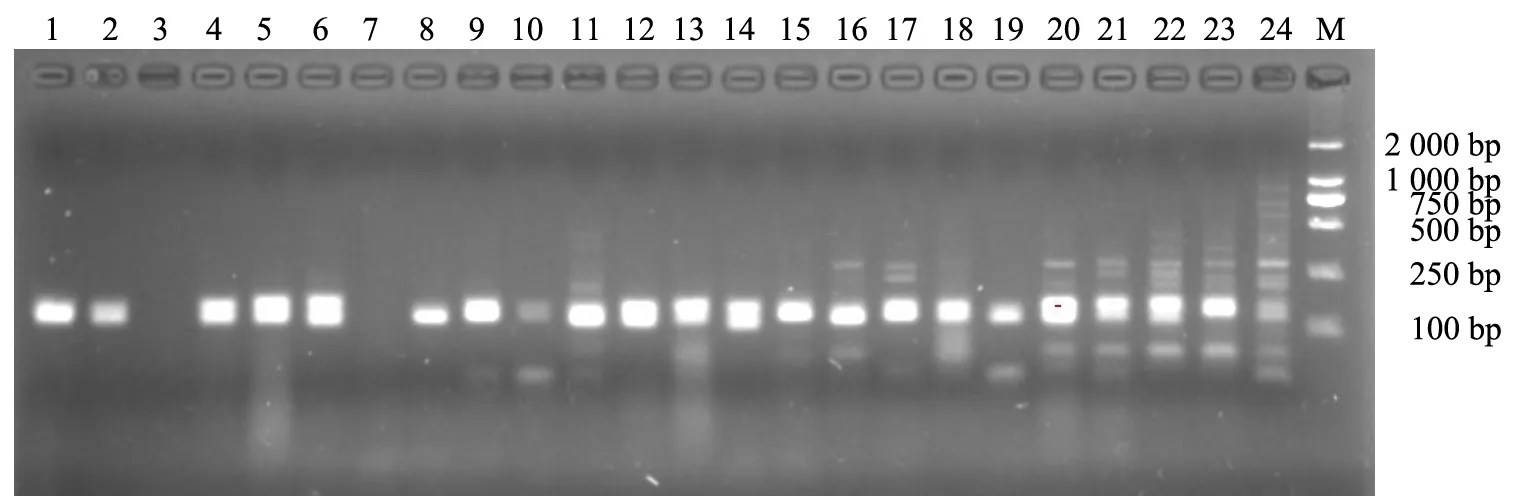
1~8:Mg2+濃度為1.0 mmol/L,退火溫度依次降低;9~16:Mg2+濃度為1.5 mmol/L,退火溫度依次降低;17~24:Mg2+濃度為2.0 mmol/L,退火溫度依次降低;M:DM 2000圖2 引物TNF的瓊脂糖凝膠電泳結(jié)果

序號(hào)座位引物序列(5'—3')退火溫度/℃c(Mg2+)/(mmol·L-1)所在染色體1TNFAGGAAATGGGTTTCAGTTCCCAGGATTCTGTGGCAATCTG60.01.5202FGGCAGCAACGACAAAAATGTCCATCTCCCCAACTGTCAAATG60.02.023APOC3GATTTGAAGCGATTGTCCATGTCTAGCTGCCCACAGGAG59.32.084CATCTTATGTTACCTCACAGCCT-GGGGGTGGGCCATCTTTATAATC52.32.03
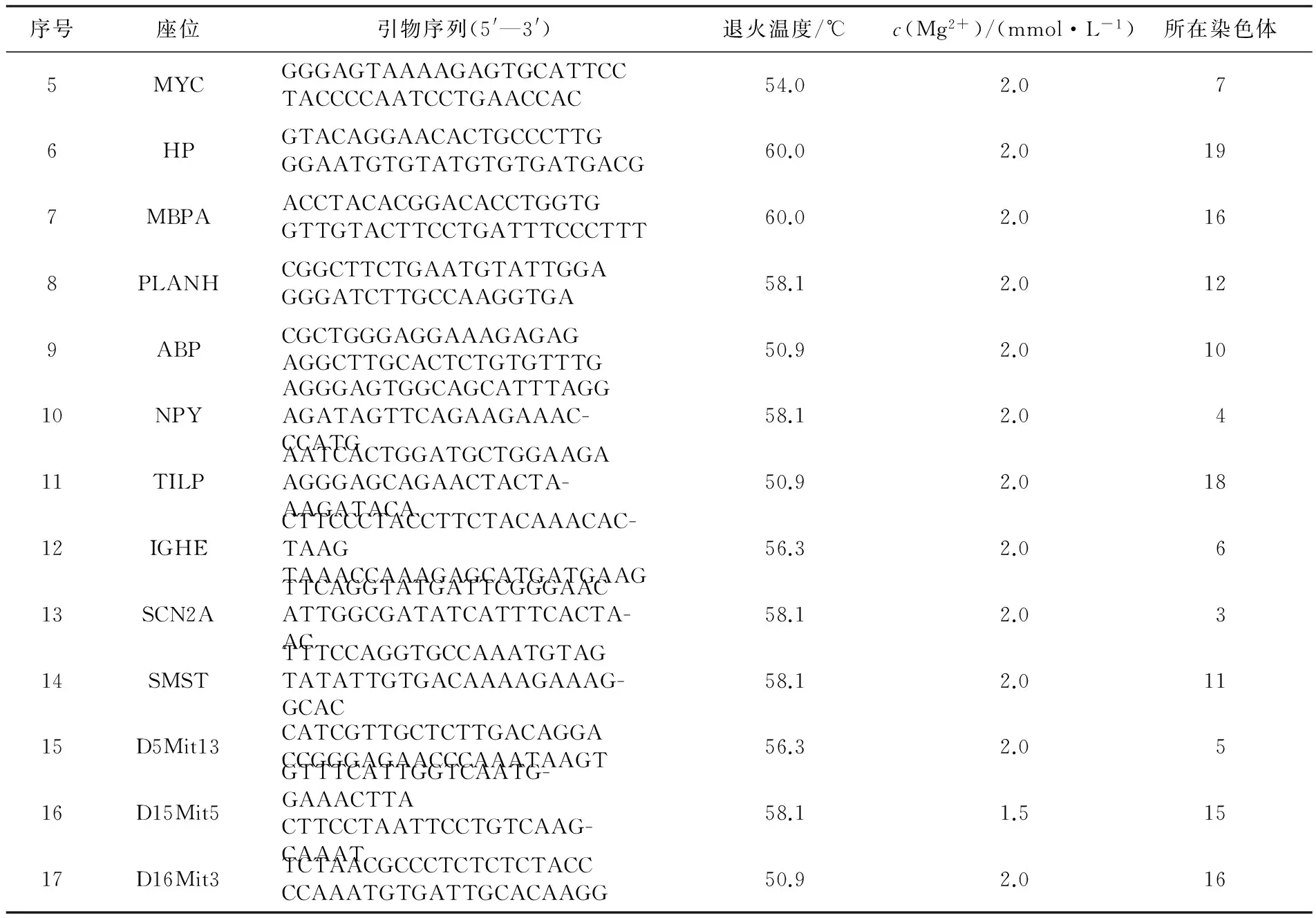
續(xù)表1
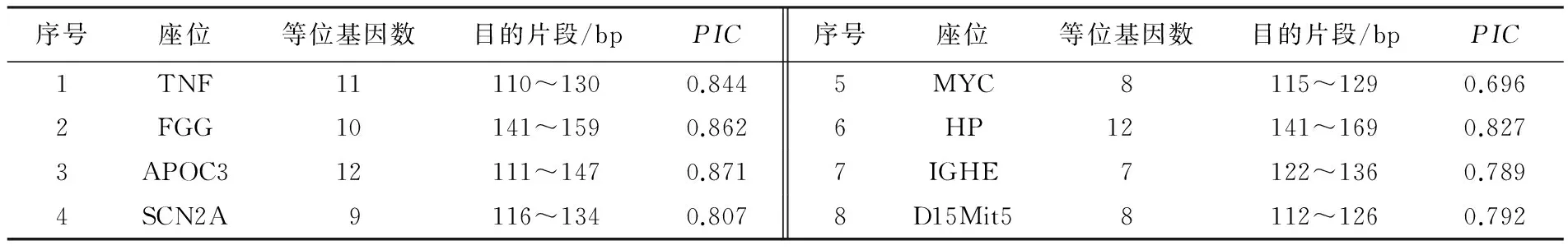
表2 黃毛鼠的多態(tài)性微衛(wèi)星位點(diǎn)
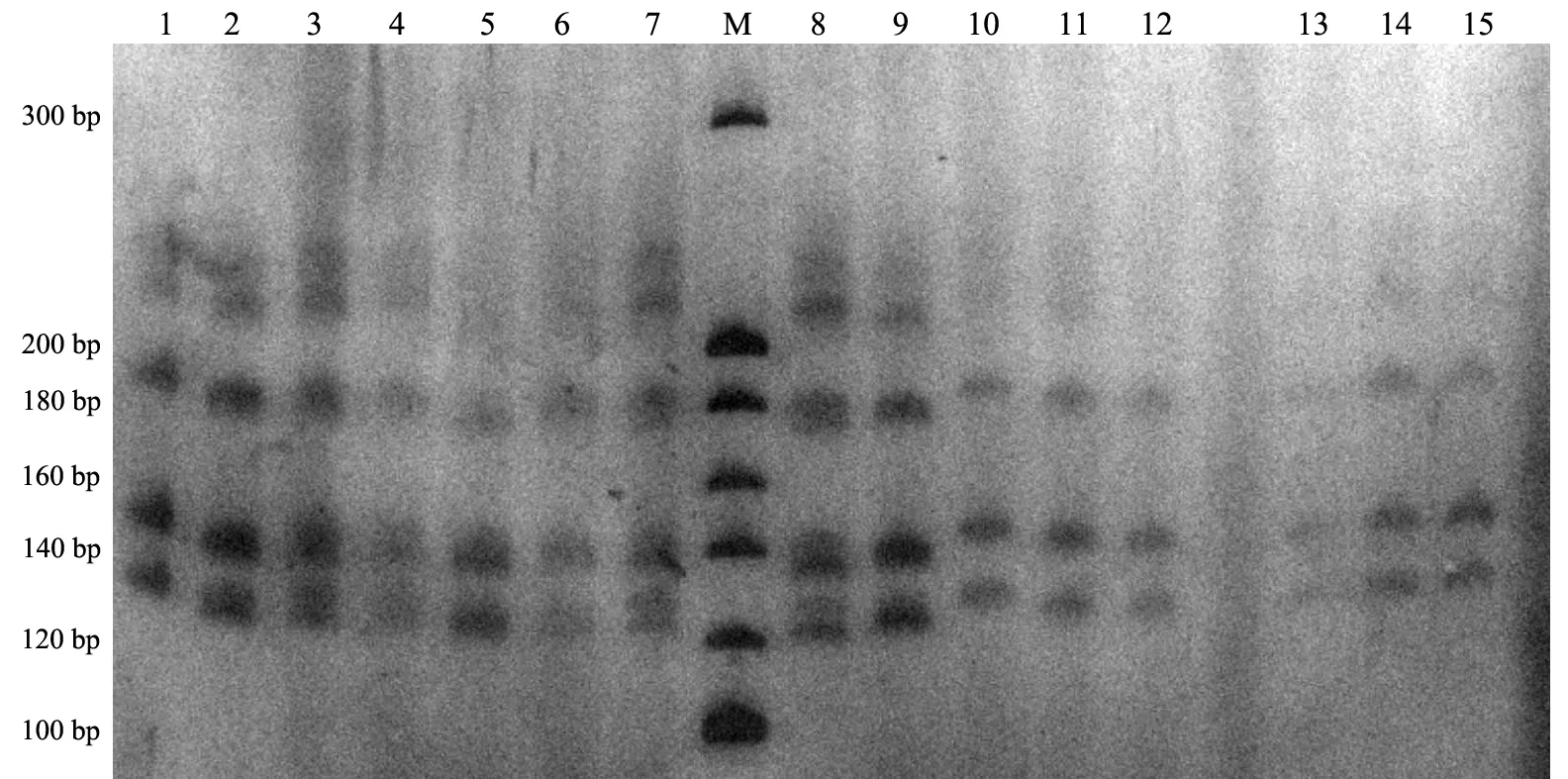
1~15:PCR產(chǎn)物的編號(hào);M:20 bp DNA Ladder marker圖3 引物MYC的聚丙烯酰胺凝膠電泳圖
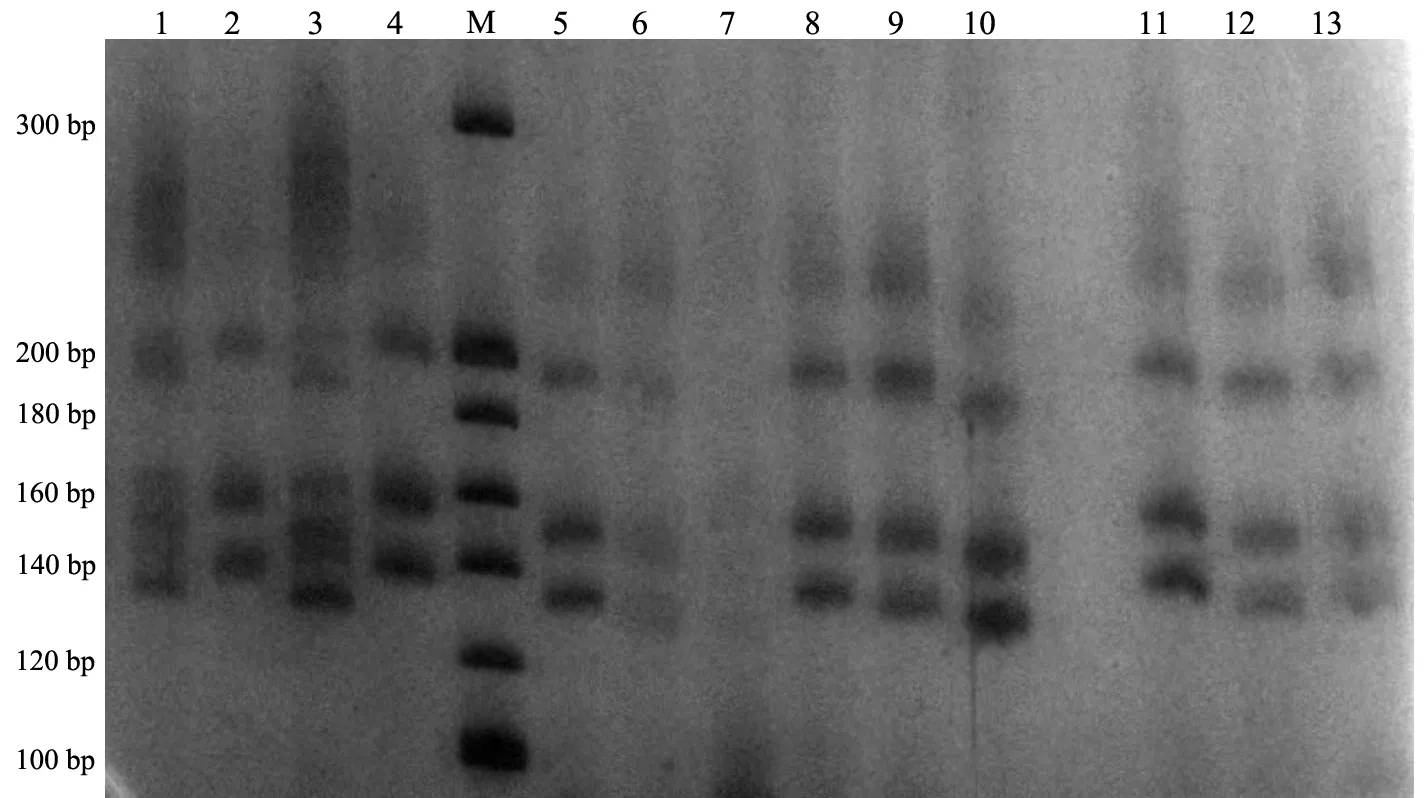
1~13:PCR產(chǎn)物的編號(hào);M:20 bp DNA Ladder marker圖4 引物IGHE的聚丙烯酰胺凝膠電泳圖
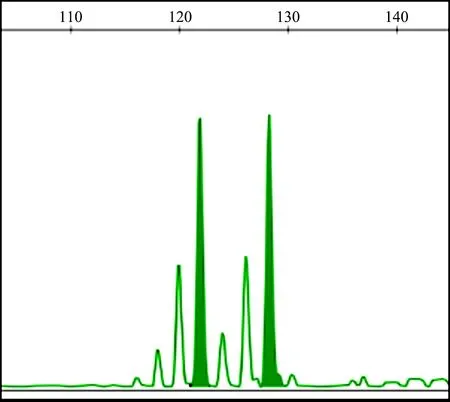
圖5 引物IGHE的STR掃描圖
3 討 論
PCR反應(yīng)體系的建立和優(yōu)化是引物篩選的基礎(chǔ).影響PCR反應(yīng)的主要因素有Mg2+濃度、dNTP濃度、引物濃度及rTaq酶濃度等,退火溫度也會(huì)對(duì)擴(kuò)增條帶產(chǎn)生顯著的影響.本研究對(duì)每對(duì)引物的退火溫度及Mg2+濃度進(jìn)行了優(yōu)化,結(jié)果顯示,本實(shí)驗(yàn)篩選的多態(tài)性引物退火溫度在50.9~60.0 ℃間不等,部分引物的退火溫度范圍較寬,而個(gè)別引物只能在特定的退火溫度下才能擴(kuò)增出條帶.Mg2+濃度主要集中為1.5和2.0 mmol/L.綜合考慮條帶的明亮、實(shí)驗(yàn)成本及條帶的特異性等,最終選定每對(duì)引物最適合的Mg2+濃度及退火溫度.PCR反應(yīng)體系及反應(yīng)條件的優(yōu)化是PCR反應(yīng)順利進(jìn)行的前提.聚丙烯酰胺凝膠電泳(PAGE)具有分辨率高、不易擴(kuò)散、熱穩(wěn)定、易于觀察和靈敏度高等優(yōu)點(diǎn),已被廣泛應(yīng)用于核酸與蛋白質(zhì)的分離,特別是在SSR,AFLP,SNP等分子標(biāo)記研究中具有極其重要的作用.雖然PAGE技術(shù)操作步驟繁瑣復(fù)雜、費(fèi)時(shí)費(fèi)工,但不失為初步篩選多態(tài)性引物的較節(jié)約成本的有效方法.STR基因掃描技術(shù)相比聚丙烯酰胺電泳技術(shù)的結(jié)果更加準(zhǔn)確客觀,可以檢測(cè)到微小片段的差異,得到更準(zhǔn)確的等位基因數(shù),以進(jìn)一步檢驗(yàn)微衛(wèi)星引物的多態(tài)性[20].
自從1991年Moore等[21]發(fā)現(xiàn)了哺乳動(dòng)物基因組中的微衛(wèi)星側(cè)翼保守序列后,對(duì)于相同屬、科、目的不同物種的跨種擴(kuò)增篩選微衛(wèi)星位點(diǎn)的方法得到了證實(shí).吳云良等[22]利用16對(duì)家貓微衛(wèi)星引物和4對(duì)蘇門(mén)答臘虎微衛(wèi)星引物,篩選出15對(duì)具有高度多態(tài)性的微衛(wèi)星引物,并有效地檢測(cè)了東北虎的遺傳多樣性及親緣關(guān)系;孫波等[15]利用大鼠和小鼠的微衛(wèi)星引物對(duì)社鼠的基因組DNA進(jìn)行了擴(kuò)增,擴(kuò)增的同源率達(dá)到30%;包文斌等[23]利用29對(duì)雞的微衛(wèi)星標(biāo)記對(duì)孔雀基因組DNA進(jìn)行了跨種擴(kuò)增,發(fā)現(xiàn)14對(duì)引物能擴(kuò)增出穩(wěn)定的特異性條帶,且7對(duì)引物具有較豐富的多態(tài)性,并成功利用篩選的微衛(wèi)星標(biāo)記對(duì)藍(lán)孔雀和綠孔雀群體間和群體內(nèi)的遺傳多樣性進(jìn)行了分析.本研究選取60對(duì)大鼠和小鼠已知的微衛(wèi)星位點(diǎn)引物,對(duì)黃毛鼠的基因組DNA進(jìn)行了擴(kuò)增,研究結(jié)果顯示,60對(duì)微衛(wèi)星位點(diǎn)引物中,17對(duì)引物能夠穩(wěn)定擴(kuò)增,其中8對(duì)引物的多態(tài)信息含量(PIC)大于0.5,為高度多態(tài)性引物,能夠客觀地分析黃毛鼠種群的遺傳變異情況.由此可見(jiàn),微衛(wèi)星跨種擴(kuò)增的方法簡(jiǎn)單、操作方便,是一種有效快速的方法,對(duì)于種群遺傳學(xué)的研究具有一定指導(dǎo)意義.
[1]謝福才.劃分黃毛鼠種群年齡指標(biāo)的分析比較[J].獸類(lèi)學(xué)報(bào),1994,14(4):306-308.
[2]秦姣.卡麥角林對(duì)黃毛鼠的不育效果及其作用機(jī)理[D].北京:中國(guó)農(nóng)業(yè)大學(xué),2015.
[3]黃鐵華,王耀培,秦耀亮.防治稻田黃毛鼠和板齒鼠的試驗(yàn)[J].植物保護(hù)學(xué)報(bào),1984,11(3):205-209.
[4]郭志南,蘇成豪,陳國(guó)偉,等.黃毛鼠種群年齡劃分的研究[J].中華衛(wèi)生殺蟲(chóng)藥械,2014,20(4):332-335.
[5]鮑毅新,丁平,諸葛陽(yáng),等.舟山島黃毛鼠種群生態(tài)研究[J].浙江師大學(xué)報(bào):自然科學(xué)版,1997,20(2):60-65.
[6]劉全生,馮志勇,龔鵬博,等.高纖維食物對(duì)黃毛鼠攝食和消化的影響[J].獸類(lèi)學(xué)報(bào),2010,30(3):291-296.
[7]洪朝長(zhǎng),袁高林,鄭本棟.黃毛鼠的種群動(dòng)態(tài)研究及數(shù)量預(yù)測(cè)的意見(jiàn)[J].獸類(lèi)學(xué)報(bào),1989,9(2):137-145.
[8]黃秀清,馮志勇,顏世祥,等.黃毛鼠種群空間格局的研究[J].廣東農(nóng)業(yè)科學(xué),2004(4):46-48.
[9]黃秀清,馮志勇,顏世祥,等.黃毛鼠綜合防治對(duì)策及技術(shù)研究[J].廣東農(nóng)業(yè)科學(xué),2002(1):40-42.
[10]段辛樂(lè),喬憲鳳,彭雄,等.我國(guó)禾谷縊管蚜微衛(wèi)星位點(diǎn)擴(kuò)增穩(wěn)定性及遺傳多樣性[J].植物保護(hù)學(xué)報(bào),2015,42(3):297-303.
[11]吳則東,倪洪濤,王茂芊,等.適合于甜菜品種鑒定的ISSR核心引物的篩選[J].中國(guó)農(nóng)學(xué)通報(bào),2015,31(17):48-52.
[12]閔金金,張加勇,鄭榮泉,等.跨種擴(kuò)增篩選大鱷龜微衛(wèi)星標(biāo)記及遺傳多樣性分析[J].動(dòng)物學(xué)雜志,2013,48(6):926-932.
[13]Serikawa T,Kuramoto T,Hilbert P,et al.Rat gene mapping using PCR-analyzed microsatellites[J].Genetics,1992,131(3):701-721.
[14]Jacob H J,Brown D M,Bunker R K,et al.A genetic linkage map of the laboratory rat,Rattusnorvegicus[J].Nature Genetics,1995,9(1):63-69.
[15]孫波,鮑毅新,張龍龍,等.大鼠及小鼠微衛(wèi)星引物在社鼠中的跨種擴(kuò)增[J].動(dòng)物學(xué)雜志,2009,44(6):145-150.
[16]郭俁.大倉(cāng)鼠高變異微衛(wèi)星座位的篩選及應(yīng)用[D].曲阜:曲阜師范大學(xué),2005.
[17]李傳海.黑線倉(cāng)鼠(Cricetulusbarabensis)微衛(wèi)星引物的篩選及應(yīng)用[D].曲阜:曲阜師范大學(xué),2006.
[18]趙太云,路靜,王鉅,等.大、小鼠微衛(wèi)星引物對(duì)長(zhǎng)爪沙鼠的擴(kuò)增[J].中國(guó)比較醫(yī)學(xué)雜志,2006,16(2):114-117.
[19]Kalinowski S T,Taper M L,Marshall T C.Revising how the computer program CERVUS accommodates genotyping error increases success in paternity assignment[J].Molecular Ecology,2010,16(7):1099-1106.
[20]張媛,李曉飛,李振宇,等.滇西亞種樹(shù)鼩微衛(wèi)星分子標(biāo)記的篩選[J].中國(guó)比較醫(yī)學(xué)雜志,2015,25(6):36-41.
[21]Moore S S,Sergeant L L,King T J,et al.The conservation of dinucleotide microsatellites among mammalian genomes allows the use of heterologous PCR primer pairs in closely related species[J].Genomics,1991,10(3):654-660.
[22]吳云良,包文斌,張紅霞,等.微衛(wèi)星技術(shù)分析東北虎遺傳多樣性及親緣關(guān)系[J].揚(yáng)州大學(xué)學(xué)報(bào):農(nóng)業(yè)與生命科學(xué)版,2011,32(1):87-91.
[23]包文斌,陳國(guó)宏,束婧婷,等.孔雀微衛(wèi)星引物篩選及其遺傳多樣性分析[J].遺傳,2006,28(10):1242-1246.
(責(zé)任編輯 薛 榮)
Cross-species amplication of microsatellite loci inRattuslosea
HAN Jinqiao, TAN Jiangdong, WANG Yanni, REN Peng,ZHANG Xinyu, GONG Kun, HUANG Xiangxiang, ZHOU Xiao
(InstituteofEcology,ZhejiangNormalUniversity,Jinhua321004,China)
Based on the conservatism of microsatellite flanking sequences, cross-species amplication of microsatellite loci was an effective method. 60 microsatellite markers of rat (Rattusnorvegicus) and mouse (Musmusculus) were screened forRattusloseathrough PCR amplification, polyacrylamide gel electrophoresis and gene scanning technique. The results showed that 17 microsatellite loci could be amplified stably and 8 of them were highly polymorphic, and the polymorphism information content (PIC) was more than 0.5. These microsatellite loci would provide a reference for the later research on the population genetics ofRattuslosea.
Rattuslosea; microsatellite loci; cross-species amplication; polymorphism
10.16218/j.issn.1001-5051.2017.03.011
?2016-03-01;
2017-12-21
國(guó)家自然科學(xué)基金資助項(xiàng)目(31200323)
韓金巧(1990-),女,山西汾陽(yáng)人,碩士研究生.研究方向:生物多樣性保護(hù).
王艷妮.E-mail: wangyn@zjnu.cn>
Q959.837
A
1001-5051(2017)03-0312-06

