GPR56基因在骨肉瘤組織中的表達變化及其對骨肉瘤細胞增殖、遷移、侵襲能力的影響
夏海,楊瑜瑜,孫英華,焦兆德,張玉德
(濰坊市益都中心醫院,山東濰坊262500)
GPR56基因在骨肉瘤組織中的表達變化及其對骨肉瘤細胞增殖、遷移、侵襲能力的影響
夏海,楊瑜瑜,孫英華,焦兆德,張玉德
(濰坊市益都中心醫院,山東濰坊262500)
目的探討G蛋白偶聯受體56(GPR56)基因在骨肉瘤發生、發展中的作用。方法選取擬行手術治療的骨肉瘤患者53例,術中留取骨肉瘤組織及其癌旁正常組織,采用實時熒光定量PCR法檢測組織GPR56 mRNA相對表達量,并分析其與患者臨床病理參數的關系。將對數生長期人骨肉瘤細胞株MG-63隨機分為三組,其中siRNA-GPR56組轉染GPR56干擾序列,siRNA-對照組轉染siRNA對照序列,空白對照組不作任何處理。采用實時熒光定量PCR法檢測各組細胞GPR56 mRNA相對表達量,CCK-8法和克隆形成試驗檢測細胞增殖能力(分別以培養24、48、72、96 h的吸光度值及克隆形成率表示),Transwell法檢測細胞遷移、侵襲能力(以遷移、侵襲細胞數表示)。結果骨肉瘤組織GPR56 mRNA相對表達量為1.86±0.14,癌旁正常組織為1.39±0.12,二者比較P<0.01。骨肉瘤組織GPR56 mRNA相對表達量與患者年齡、性別、發病部位、腫瘤直徑、組織類型、血清堿性磷酸酶水平均無關(P均>0.05),與Enneking分期、肺部轉移、軟組織浸潤均有關(P均<0.05)。siRNA-GPR56組GPR56 mRNA相對表達量明顯低于siRNA-對照組及空白對照組(P均<0.01)。siRNA-GPR56組培養48、72、96 h吸光度值及克隆形成率、遷移細胞數、侵襲細胞數均低于siRNA-對照組及空白對照組(P<0.05或<0.01)。結論骨肉瘤組織中GPR56基因表達升高,GPR56基因可能通過影響細胞增殖、遷移和侵襲能力而參與骨肉瘤的發生與發展。
骨肉瘤;G蛋白偶聯受體56;小分子RNA干擾;細胞增殖;細胞侵襲
骨肉瘤好發于青少年,惡性程度高,易轉移和(或)復發[1],患者5年生存率不足70%,若出現肺部轉移則預后更差[2]。研究發現,多種基因表達變化參與了骨肉瘤的復發及轉移過程[3]。G蛋白偶聯受體56(GPR56)為黏附性G蛋白偶聯受體家族成員,在細胞生長、分化、黏附及行為調控中發揮關鍵作用,與多種惡性腫瘤的發生、轉移密切相關[4,5]。本研究探討骨肉瘤組織GPR56基因表達變化及其對人骨肉瘤細胞株MG-63增殖、侵襲能力的影響,以期為骨肉瘤發生、發展機制的研究提供依據。
1 資料與方法
1.1 GPR56基因在骨肉瘤組織中的表達檢測
1.1.1 臨床資料 選取2013年2月~2017年3月于濰坊市益都中心醫院行手術切除的骨肉瘤患者53例,男31例、女22例,年齡7~45(23.6±10.7)歲;均經影像學及術后病理檢查確診,術前均未接受放、化療及免疫治療。腫瘤發生部位:軀干14例,肢體39例;腫瘤直徑:>8 cm 31例,≤8 cm 22例;組織類型:骨母細胞型25例,纖維母細胞型12例,軟骨母細胞型16例;Enneking分期:Ⅱa期11例,Ⅱb期26例,Ⅲ期16例;發生肺部轉移17例,軟組織浸潤38例,血清堿性磷酸酶升高19例。所有患者術中留取骨肉瘤組織及其癌旁正常組織(距離腫瘤邊緣>3 cm),迅速置于液氮中,-70 ℃保存備檢。本研究通過醫院倫理委員會批準,患者及其家屬均知情同意。
1.1.2 骨肉瘤組織及其癌旁正常組織GPR56基因表達 采用實時熒光定量PCR法。取凍存的骨肉瘤及其癌旁正常組織,研磨后加入細胞裂解液,采用TRIzol總RNA提取試劑盒提取細胞總RNA。紫外分光光度計檢測總RNA純度和濃度合格后,逆轉錄為cDNA,以cDNA為模板進行PCR反應。GPR56及內參引物均由上海生工生物工程有限公司合成。引物序列:GPR56上游引物:5′-ATCAGCCAGCAGTTACAG-3′,下游引物: 5′-GAAGCAACAGCGAGTAT-G-3′,引物長度400 bp;β-actin上游引物:5′-TCCTGGCCTCACTGTCCA-3′, 下游引物:5′-GTCCGCCTAG-AAGCACTTGC-3′,引物長度548 bp。PCR反應條件:95 ℃預變性5 min,94℃變性30 s,58 ℃退火30 s,73 ℃延伸30 s,連續進行38次循環。每個樣品均設3個平行反應復孔,以β-actin為內參,采用2-ΔΔCt法計算骨肉瘤組織及其癌旁正常組織GPR56 mRNA相對表達量。
1.1.3 骨肉瘤組織GPR56基因表達與患者臨床病理參數的關系 收集患者的臨床資料,分析骨肉瘤組織GPR56 mRNA相對表達量與患者性別、年齡、發生部位、腫瘤直徑、組織類型、Enneking分期、肺部轉移、軟組織浸潤及血清堿性磷酸酶水平的關系。
1.2 GPR56基因對人骨肉瘤細胞株MG-63增殖、侵襲能力影響的觀察
1.2.1 細胞培養及分組處理 取人骨肉瘤細胞株MG-63,置于含10%胎牛血清的DMEM培養基中,37 ℃條件下置于含5% CO2的恒溫培養箱中培養。取對數生長期細胞,胰酶消化后接種于6孔板中,調整細胞密度為2×106個/孔,過夜恒溫培養。將細胞隨機分為siRNA-GPR56組、siRNA-對照組及空白對照組,siRNA-GPR56組、siRNA-對照組分別采用Lipfectamine 2000脂質體轉染試劑盒轉染GPR56干擾序列及siRNA對照序列。GPR56干擾序列:5′-AGAUUACAUCUUCUCUAUGGCAAGC-3′,siRNA對照序列:5′-UUCUCCGAACGUGUCACGU-3′。空白對照組不作任何處理。各組轉染后繼續恒溫培養。
1.2.2 GPR56基因表達檢測 取各組轉染后培養48 h細胞,加入細胞裂解液進行裂解,采用實時熒光定量PCR法檢測GPR56 mRNA相對表達量,具體步驟參照1.1.2。
1.2.3 細胞增殖能力檢測 ①CCK-8法。取各組細胞,胰酶消化后收集、重懸細胞,調整細胞密度為1×105個/mL。各組取200 μL細胞懸液接種于96孔板,每組設6個平行反應復孔。分別于培養24、48、72、96 h,棄去培養基,加入100 μL無血清培養基及10 μL CCK-8溶液,以無血清培養基作為空白對照,孵育12 min后停止培養。采用酶標儀檢測450 nm波長處的吸光度(A)值[6]。②克隆形成試驗。取各組細胞,胰酶消化后收集、重懸細胞,調整細胞密度為1×104個/mL。各組取40 μL細胞懸液接種于培養皿中,常規培養14 d,將培養液棄去,4%多聚甲醛固定15 min,結晶紫染色后對接種細胞數及克隆數進行計數,以≥50個細胞記為1個克隆。克隆形成率=克隆數/接種細胞數×100%。
1.2.4 細胞遷移能力檢測 采用Transwell法。取各組轉染后培養48 h細胞,胰酶消化后,用400 μL無血清培養液制備單細胞懸液,接種于24孔板中,調整細胞密度為1×105個/孔。將各組細胞加入Transwell小室上室,取600 μL含10%胎牛血清的培養液加入小室下室,37 ℃條件下置于含5% CO2的恒溫培養箱中培養24 h。取出小室,PBS沖洗3次,4%甲醛固定15 min,結晶紫染色20 min,將小室內散落的細胞輕輕擦去。光學顯微鏡下觀察并拍照,隨機選取10個高倍視野計數遷移細胞數。
1.2.5 細胞侵襲能力檢測 采用Transwell法。取Matrigel膠50 μL,稀釋后平鋪于Transwell小室上室,4 ℃風干以備用。其余步驟同1.2.4。光學顯微鏡下觀察并拍照,隨機選取10個高倍視野計數侵襲細胞數。
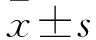
2 結果
2.1 骨肉瘤組織GPR56基因表達及其與患者臨床病理參數的關系 骨肉瘤組織及其癌旁正常組織GPR56 mRNA相對表達量分別為1.86±0.14、1.39±0.12,二者比較P<0.01。骨肉瘤組織GPR56 mRNA相對表達量與患者年齡、性別、發病部位、腫瘤直徑、組織類型、血清堿性磷酸酶水平均無關(P均>0.05),與Enneking分期、肺部轉移、軟組織浸潤均有關(P均<0.05)。見表1。
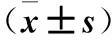
表1 骨肉瘤組織GPR56基因表達與患者臨床病理參數的關系
2.2 GPR56基因對人骨肉瘤細胞株MG-63增殖、侵襲能力的影響
2.2.1 各組GPR56基因表達比較 siRNA-GPR56組、siRNA-對照組及空白對照組GPR56 mRNA相對表達量分別為1.06±0.14、1.91±0.10、1.88±0.09,siRNA-GPR56組明顯低于siRNA-對照組及空白對照組(P均<0.01)。
2.2.2 各組細胞增殖能力比較 各組培養24 h吸光度值比較差異無統計學意義(P>0.05),siRNA-GPR56組培養48、72、96 h A值及克隆形成率均低于siRNA-對照組及空白對照組(P均<0.01)。見表2。
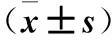
表2 各組細胞增殖能力比較
注:與siRNA-對照組同時間點比較,*P<0.01;與空白對照組同時間點比較,△P<0.01。
2.2.3 各組細胞遷移、侵襲能力比較 siRNA-GPR56組遷移、侵襲細胞數均少于siRNA-對照組及空白對照組(P均<0.05)。見表3。
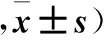
表3 各組遷移、侵襲細胞數比較(個
注:與siRNA-對照組比較,*P<0.05;與空白對照組比較,△P<0.05。
3 討論
骨肉瘤細胞侵襲、轉移能力強,目前尚無特效的臨床治療手段,患者預后較差,是骨科亟待解決的難題[7]。研究表明,腫瘤細胞增殖、遷移、侵襲過程是多步驟、多基因共同作用的結果[8,9]。GPR56為非典型G蛋白偶聯受體,也是一種新型的黏附受體,在細胞間及細胞-基質黏附、粘連中發揮重要作用[10]。研究發現,GPR56參與了多種惡性腫瘤生長及轉移過程[11,12];敲除裸鼠GPR56基因則前列腺癌細胞的生長受到抑制[13]。本研究結果顯示,骨肉瘤組織GPR56 mRNA相對表達量高于癌旁組織,說明GPR56基因在骨肉瘤組織中呈高表達,其可能作為癌基因參與骨肉瘤的發生。本研究結果顯示,骨肉瘤組織GPR56 mRNA相對表達量與Enneking分期、肺部轉移、軟組織浸潤有關,Enneking分期為Ⅲ期、發生肺部轉移和軟組織浸潤的患者骨肉瘤組織GPR56 mRNA相對表達量顯著升高,進一步說明GPR56基因高表達可能參與了骨肉瘤的發生與發展。
為進一步探討GPR56基因對骨肉瘤細胞生物學特性的影響,本研究利用小分子RNA干擾技術特異性沉默骨肉瘤細胞中GPR56基因表達。結果顯示,與空白對照組和siRNA-對照組比較,siRNA-GPR56組細胞GPR56 mRNA相對表達量顯著降低,說明成功特異性沉默骨肉瘤細胞GPR56基因表達。本研究結果顯示,siRNA-GPR56組培養48、72、96 h A值及克隆形成率、遷移細胞數、侵襲細胞數均低于siRNA-對照組及空白對照組;說明特異性沉默骨肉瘤細胞GPR56基因表達可抑制細胞增殖、遷移及侵襲能力。分析原因,細胞黏附在腫瘤發生、轉移中發揮重要作用[14],包括細胞間黏附和細胞-基質黏附兩種類型,前者是細胞間直接接觸,后者則是細胞與細胞外基質間的相互作用;GPR56已被證實是新型的黏附受體,可能同時在細胞間黏附和細胞-基質黏附中共同發揮重要作用[15]。
綜上所述,骨肉瘤組織GPR56基因表達升高,GPR56基因可能通過影響細胞增殖、遷移及侵襲能力而參與骨肉瘤的發生與發展。GPR56基因有望成為臨床治療骨肉瘤的一個新靶點。
[1] Lindsey BA, Markel JE, Kleinerman ES. Osteosarcoma overview[J]. Rheumatol Ther, 2017,4(1):25-43.
[2] Friebele JC, Peck J, Pan X, et al. Osteosarcoma: a meta-analysis and review of the literature[J]. Am J Orthop (Belle Mead NJ), 2015,44(12):547-553.
[3] Jour G, Wang L, Middha S, et al. The molecular landscape of extraskeletal osteosarcoma: a clinicopathological and molecular biomarker study[J]. J Pathol Clin Res, 2015,29(1):9-20.
[4] Mehta P, Piao X. Adhesion G-protein coupled receptors and extracellular matrix proteins: roles in myelination and glial cell development[J]. Dev Dyn, 2017,246(4):275-284.
[5] 郭芮伶.黏附受體GPR56與腫瘤[J].中華肺部疾病雜志(電子版),2015,8(4):66-68.
[6] 金波,高亮,李望,等.LIM和SH3蛋白1蛋白在腎透明細胞癌組織中的表達及其對腎透明細胞癌786-O細胞侵襲和遷移能力的影響[J].中華腫瘤雜志,2017,39(3):166-171.
[7] He X, Gao Z, Xu H, et al. A meta-analysis of randomized control trials of surgical methods with osteosarcoma outcomes[J]. J Orthop Surg Res, 2017,12(1):5-11.
[8] 宋秀軍.肝再生磷酸酶3與腫瘤相關性的研究進展[J].腫瘤研究與臨床,2017,29(3):208-211.
[9] 袁忠,胡俊,雷家維,等.Eag1對骨肉瘤細胞增殖、遷移與侵襲的影響及其機制[J].山東醫藥,2016,56(48):33-35.
[10] Liu Z, Huang Z, Yang W, et al. Expression of orphan GPR56 correlates with tumor progression in human epithelial ovarian cancer[J]. Neoplasma, 2017,64(1):32-39.
[11] Yang L, Xu L. GPR56 in cancer progression: current status and future perspective[J]. Future Oncol, 2012,8(4):431-440.
[12] Daria D, Kirsten N, Muranyi A, et al. GPR56 contributes to the development of acute myeloid leukemia in mice[J]. Leukemia, 2016,30(8):1734-1741.
[13] Xu L, Begum S, Barry M, et al. GPR56 plays varying roles in endogenous cancer progression[J]. Clin Exp Metastasis, 2010,27(4):241-249.
[14] Chiang NY, Chang GW, Huang YS, et al. Heparin interacts with the adhesion GPCR GPR56, reduces receptor shedding, and promotes cell adhesion and motility[J]. J Cell Sci, 2016,129(11):2156-2169.
[15] Salzman GS, Ackerman SD, Ding C, et al. Structural basis for regulation of GPR56/ADGRG1 by its alternatively spliced extracellular domains[J]. Neuron, 2016,91(6):1292-1304.
孫英華(E-mail: qzydsyh@163.com)
10.3969/j.issn.1002-266X.2017.32.010
R738.1
A
1002-266X(2017)32-0036-04
2017-06-13)

