銀屑病關(guān)節(jié)炎患者血清tP1NP、β-CTX、OC、25-(OH)VD3水平變化及意義
王麗芳,董鵬,劉偉,宋慧
(北京積水潭醫(yī)院,北京100035)
銀屑病關(guān)節(jié)炎患者血清tP1NP、β-CTX、OC、25-(OH)VD3水平變化及意義
王麗芳,董鵬,劉偉,宋慧
(北京積水潭醫(yī)院,北京100035)
目的探討銀屑病關(guān)節(jié)炎(PsA)患者血清總Ⅰ型前膠原氨基端延長肽(tP1NP)、Ⅰ型膠原羧基端肽β特殊序列(β-CTX)、N-端骨鈣素(OC)、25-羥維生素D3[25-(OH)VD3)]水平變化及其臨床意義。方法選擇51例PsA患者作為觀察組,其中骨質(zhì)破壞19例、無骨質(zhì)破壞32例,28例健康體檢者作為對照組。采用電化學(xué)發(fā)光法檢測兩組血清骨標(biāo)記物tP1NP、β-CTX、OC及25-(OH)VD3,并分析血清骨標(biāo)記物水平與PsA患者病情相關(guān)指標(biāo)(年齡、病程、血沉及血清CRP)的關(guān)系。結(jié)果觀察組血清tP1NP、β-CTX、OC水平均高于對照組(P<0.05或<0.01),兩組血清25-(OH)VD3水平比較差異無統(tǒng)計學(xué)意義(P>0.05)。觀察組有骨質(zhì)破壞者血清tP1NP、OC水平均高于無骨質(zhì)破壞者(P均<0.01),有、無骨質(zhì)破壞者血清β-CTX、25-(OH)VD3水平比較差異均無統(tǒng)計學(xué)意義(P均>0.05)。血清tP1NP、β-CTX、OC、25-(OH)VD3水平與PsA患者年齡、病程、血沉及血清CRP水平均無關(guān)(P均>0.05)。觀察組有骨質(zhì)破壞者血清tP1NP水平與血沉呈正相關(guān)(r=0.557,P<0.05),血清β-CTX、OC、25-(OH)VD3水平與患者病情相關(guān)指標(biāo)均無關(guān)(P均>0.05)。結(jié)論P(yáng)sA患者血清tP1NP、β-CTX、OC水平均升高;血清tP1NP水平有助于判斷PsA患者骨質(zhì)破壞及病情活動程度。
銀屑病;關(guān)節(jié)炎;總Ⅰ型前膠原氨基端延長肽;Ⅰ型膠原羧基端肽β特殊序列;N-端骨鈣素
銀屑病關(guān)節(jié)炎(PsA)屬于血清陰性脊柱關(guān)節(jié)炎[1],發(fā)病隱匿,有顯著的骨質(zhì)破壞傾向[2],約2/3的患者疾病早期即發(fā)生骨質(zhì)破壞[3],最終可導(dǎo)致關(guān)節(jié)殘毀。依據(jù)受累關(guān)節(jié)的不同,PsA患者可分為5個亞型,即遠(yuǎn)端指(趾)間關(guān)節(jié)炎型(僅遠(yuǎn)端指間關(guān)節(jié)及近端指間關(guān)節(jié)受累)、殘毀性關(guān)節(jié)炎型、對稱性多關(guān)節(jié)炎型、非對稱性寡關(guān)節(jié)炎型、脊柱關(guān)節(jié)炎型[4]。血清骨標(biāo)記物主要包括25-羥維生素D3[25-(OH)VD3]、骨形成標(biāo)志物總Ⅰ型前膠原氨基端延長肽(tP1NP)和N-端骨鈣素(OC),以及骨吸收特異性標(biāo)志物Ⅰ型膠原羧基端肽β特殊序列(β-CTX)等。本研究探討tP1NP、β-CTX、OC、25-(OH)VD3在PsA患者血清中的變化及其在PsA診斷、骨質(zhì)破壞預(yù)測等方面的作用。
1 資料與方法
1.1 臨床資料 選擇2010年1月~2016年11月北京積水潭醫(yī)院收治的PsA患者51例(觀察組),男35例、女16例,年齡(45.29±13.83)歲,病程0.5個月~40年;銀屑病家族史11例;臨床分型:遠(yuǎn)端指(趾)間關(guān)節(jié)炎型1例,殘毀性關(guān)節(jié)炎型7例,對稱性多關(guān)節(jié)炎型14例,非對稱性寡關(guān)節(jié)炎型16例,脊柱關(guān)節(jié)炎型13例;血沉(ESR)為2~120 mm/h,CRP為2.02~178 mg/dL;X線片和CT檢查顯示骨質(zhì)破壞19例。研究對象均符合2006年修訂的銀屑病關(guān)節(jié)炎分類診斷標(biāo)準(zhǔn)中的PsA診斷標(biāo)準(zhǔn),即炎性關(guān)節(jié)病(關(guān)節(jié)、脊柱、肌腱)伴有以下3項或3項以上表現(xiàn)者:①目前患有銀屑病、既往有銀屑病史或有銀屑病家族史;②有典型的銀屑病指甲改變,包括甲剝離、頂針樣改變、過度角化等表現(xiàn);③類風(fēng)濕因子陰性;④指趾炎表現(xiàn)或指趾炎病史;⑤影像學(xué)顯示關(guān)節(jié)周圍新骨形成,手足X線片可見關(guān)節(jié)間隙附近有模糊骨化(而非骨贅形成)。排除標(biāo)準(zhǔn):①孕婦、哺乳期婦女及有生育計劃者;②惡性腫瘤及合并心、肝、腎等重要臟器疾病者;③近1年內(nèi)行激素治療者;④急、慢性嚴(yán)重感染者;⑤合并內(nèi)分泌系統(tǒng)疾病者。選擇同期體檢健康者28例作為對照組,男15例、女13例,年齡(46.15±13.79)歲。兩組性別構(gòu)成比及年齡具有可比性。本研究通過醫(yī)院倫理委員會審核,患者及其家屬均知情同意。
1.2 血清骨標(biāo)記物檢測 所有受試者過夜禁食10 h以上,清晨經(jīng)肘靜脈采血2 mL,采用日立PAM離心機(jī)室溫條件下4 000 r/min離心10 min,分離血清,采用電化學(xué)發(fā)光法檢測血清tP1NP、β-CTX、OC、25-(OH)VD3。采用直線相關(guān)分析法分析血清骨標(biāo)記物水平與病情相關(guān)指標(biāo)(年齡、病程、ESR及血清CRP水平)的關(guān)系。
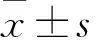
2 結(jié)果
2.1 兩組血清骨標(biāo)記物水平比較 觀察組血清tP1NP、β-CTX、OC水平均高于對照組(P<0.05或<0.01),兩組血清25-(OH)VD3水平比較差異無統(tǒng)計學(xué)意義(P>0.05)。見表1。

表1 兩組血清骨標(biāo)記物水平比較(ng/mL)
注:與對照組比較,*P<0.05,#P<0.01。
2.2 有、無骨質(zhì)破壞PsA患者血清骨標(biāo)記物水平比較 有骨質(zhì)破壞PsA患者血清tP1NP、OC水平均高于無骨質(zhì)破壞者(P均<0.01),有、無骨質(zhì)破壞PsA患者血清β-CTX、25-(OH)VD3水平比較P均>0.05。見表2。

表2 有、無骨質(zhì)破壞PsA患者血清骨標(biāo)記物水平比較(ng/mL)
注:與無骨質(zhì)破壞者比較,*P<0.01。
2.3 血清骨標(biāo)記物水平與病情相關(guān)指標(biāo)的關(guān)系 血清tP1NP、β-CTX、OC、25-(OH)VD3水平與PsA患者年齡、病程、ESR、CRP均無關(guān)(P均>0.05)。見表3。PsA骨質(zhì)破壞患者血清tP1NP與ESR呈正相關(guān)(r=0.557,P<0.05);與年齡、病程、CRP均無關(guān)(P均>0.05);血清β-CTX、OC、25-(OH)VD3與PsA骨質(zhì)破壞患者年齡、病程、ESR、CRP均無關(guān)(P均>0.05)。見表4。

表3 PsA患者血清骨標(biāo)記物水平與病情相關(guān)指標(biāo)的關(guān)系

表4 PsA骨質(zhì)破壞患者血清骨標(biāo)記物水平與病情相關(guān)指標(biāo)的關(guān)系
注:*P<0.05。
3 討論
骨質(zhì)丟失和骨質(zhì)破壞是多種風(fēng)濕性疾病尤其是炎性關(guān)節(jié)疾病常見的臨床特點之一[5]。研究表明,多種炎癥因子均參與骨代謝過程,如活化的IL-17可加速骨溶解進(jìn)程[6]。TNF-α不僅作用于破骨細(xì)胞的各個階段,影響骨質(zhì)吸收,還是一種具有較強(qiáng)作用的骨吸收誘導(dǎo)劑,可抑制骨細(xì)胞的形成。TNF-α還可增強(qiáng)破骨細(xì)胞的吸收功能,促進(jìn)骨的快速分解[7]。PsA患者的影像學(xué)檢查可表現(xiàn)為離心性骨質(zhì)溶解、筆帽征及遠(yuǎn)端指趾溶解[8],關(guān)節(jié)周圍骨質(zhì)礦化如骨膜炎和關(guān)節(jié)強(qiáng)直等,以上均提示PsA患者可能存在骨質(zhì)破壞和新骨再生現(xiàn)象。
骨基質(zhì)中90%的有機(jī)成分為Ⅰ型膠原,tP1NP是從Ⅰ型前膠原分子的兩端分解出來的前膠原肽。當(dāng)成骨細(xì)胞活性增強(qiáng)時,前膠原合成增多,tP1NP在血液中的水平顯著增高[9]。因此,tP1NP是重要的骨形成標(biāo)志物。OC又稱為骨谷氨酰基蛋白(BGP),是人體骨組織中含量最多的非膠原蛋白,其主要生理功能是維持正常的骨礦化速率,抑制異常的羥基磷灰石結(jié)晶形成,血清OC水平可反映成骨細(xì)胞活性以及骨質(zhì)形成情況[10]。骨形成標(biāo)記物水平上升代表成骨細(xì)胞作用失衡,可表現(xiàn)為異常的新骨再生及骨融合、強(qiáng)直。近來有學(xué)者認(rèn)為,附著點炎是PsA最重要的病理機(jī)制[11],主要表現(xiàn)為骨再生[12,13]。本研究發(fā)現(xiàn),觀察組血清tP1NP、OC水平均明顯高于對照組,且骨質(zhì)破壞的PsA患者血清tP1NP、OC水平均高于無骨質(zhì)破壞者,說明PsA患者尤其是已經(jīng)發(fā)生骨質(zhì)破壞者多伴有明顯的異常骨增生,提示血清tP1NP、OC水平檢測有助于判斷PsA患者骨質(zhì)破壞和異常骨增生情況。但PsA患者成骨細(xì)胞活性增強(qiáng)導(dǎo)致異常骨增生的機(jī)制尚不明確,有待進(jìn)一步研究。
活性維生素D不僅通過調(diào)節(jié)體內(nèi)鈣磷水平參與成骨及破骨活動,還可通過抑制細(xì)胞因子(如IL-1、IL-23、IFN-γ、TNF-α等)表達(dá)以及促進(jìn)活化的T細(xì)胞和B細(xì)胞產(chǎn)生IL-10等,對骨代謝發(fā)揮免疫調(diào)節(jié)作用[14]。本研究觀察組與對照組血清25-(OH)VD3水平比較差異無統(tǒng)計學(xué)意義,PsA有、無骨質(zhì)破壞者血清25-(OH)VD3水平比較差異亦無統(tǒng)計學(xué)意義。可能與血清25-(OH)VD3水平受多種因素影響有關(guān),如皮損嚴(yán)重程度、BMI、骨礦物質(zhì)密度(BMD)等[15]。β-CTX是Ⅰ型膠原蛋白的羧基端降解產(chǎn)物,是骨吸收的特異標(biāo)記物。當(dāng)骨吸收增強(qiáng)時,Ⅰ型膠原蛋白降解,形成的C末端肽降解為β-CTX入血[16]。骨吸收標(biāo)記物水平上升代表破骨細(xì)胞骨吸收能力增強(qiáng),可導(dǎo)致骨量降低或骨質(zhì)疏松。本研究觀察組血清β-CTX水平高于對照組,但有、無骨質(zhì)破壞的PsA患者血清β-CTX水平比較差異無統(tǒng)計學(xué)意義,可能與納入患者的PsA亞型不同有關(guān)。既往研究發(fā)現(xiàn),除脊柱關(guān)節(jié)炎亞型外,其他亞型的PsA患者并無明顯的骨量減低[17]。不同亞型PsA患者的骨代謝情況仍需進(jìn)一步研究。
目前用于評價PsA患者病情的評分系統(tǒng)較多,如28處關(guān)節(jié)的疾病活動度評分、銀屑病關(guān)節(jié)炎關(guān)節(jié)活動指數(shù)、銀屑病綜合活動指數(shù)等[18~20],但目前尚無統(tǒng)一的評分標(biāo)準(zhǔn),且多數(shù)評分與患者的主觀意識有關(guān)。ESR和CRP是臨床常用的炎癥相關(guān)指標(biāo),可用于評價PsA的病情活動程度[21,22]。本研究相關(guān)性分析結(jié)果顯示,PsA骨質(zhì)破壞者血清tP1NP與ESR呈正相關(guān),其他血清骨標(biāo)志物與病情相關(guān)指標(biāo)均無相關(guān)性,說明tP1NP可作為PsA骨質(zhì)破壞患者病情活動程度的相關(guān)指標(biāo)。
綜上所述,PsA患者血清tP1NP、β-CTX、OC水平均升高;血清tP1NP水平有助于判斷PsA患者骨質(zhì)破壞及病情活動程度。
[1] Myers WA, Gottlieb AB, Mease P. Psoriasis and psoriatic arthritis: clinical features and disease mechanisms [J]. Clin Dematol, 2006,24(5):438-447.
[2] Ronti T, Lupattelli G, Mannarino E. The endocrine function of adipose tissue: an update[J]. Clin Endocrinol (Oxf), 2006,64(4):355-365.
[3] Gladman DD, Farewell VT, Nadeau C. Clinical indicators of progression in psoriatic arthritis: multivariate relative risk model[J]. J Rheumatol, 1995,22(4):675-679.
[4] Moll JM, Wright V. Psoriatic arthritis[J]. Semin Arthritis Rheum, 1973(3):55-78.
[5] Schwarz EM, Looney RJ, Drissi MH, et al. Autoimmunity and bone[J]. Ann N Y Acad Sci, 2006,1068(1):275-283.
[6] Lockhart E , Green AM, Flynn JL. IL-17 production is dominated by gammadelta T cells rather than CD4 T cells during Mycobacterium tuberculosis infection[J]. J Immunol, 2006,177(7):4662-4669.
[7] Mantravadi S, Ogdie A, Kraft WK. Tumor necrosis factor inhibitors in psoriatic arthritis[J]. Expert Rev Clin Pharmacol, 2016(22):1-12.
[8] Gladman DD, Antoni C, Mease P, et al. Psoriatic arthritis: epidemiology, clinical features, course and outcome[J]. Ann Rheum Dis, 2005,64(suppl2):l4-l7.
[9] Recker RR, Marin F, Ish-Shalom S, et al. Comparative effects of teriparatide and strontium ranelate on bone biopsies and biochemical markers of bone turnover in postmenopausal women with osteoporosis[J]. J Bone Miner Res, 2009,24(8):1358-1368.
[10] 劉石平,廖二元,伍賢平,等.尿Ⅰ型膠原羧基末端肽和氨基末端肽排泄率與年齡、絕經(jīng)和絕經(jīng)后骨丟失的關(guān)系[J].中華醫(yī)學(xué)雜志,2006,86(6):371-375.
[11] McGonagle D. Enthesitis: an autoinflammatory lesion linking nail and joint involvement in psoriatic disease[J]. J Eur Acad Dermatol Venereol, 2009,23 (Suppl 1):9-13.
[12] Franck H, Ittel T. Serum osteocalcin levels in patients with psoriatic arthritis: an extended report[J]. Rheumatol Int, 2000,19(5):161-164.
[13] Braun J, Bollow M, Sieper J. Radiologic diagnosis and pathology of the spondyloarthropathies[J]. Rheum Dis Clin North Am, 1998,24(4):697 -735.
[14] Soleymani T, Hung T, Soung J. The role of vitamin D in psoriasis: a review[J]. Int J Dermatol, 2015(54):383-392.
[15] Kincse G, Bhattoa PH, Heredi E, et al. Vitamin D3 levels and bone mineral density in patients with psoriasis and/or psoriatic arthritis[J]. J Dermatol, 2015,42(7):679-684.
[16] Kirylow E, Kaminski G. Place of biochemical markers of bone turnover in guidelines for diagnosis and treatment of osteoporosis[J]. Pol Merkur Lekarski, 2008,25(148):386-389.
[17] Nolla JM, Fiter J, Rozadilla A, et al. Bone mineral density in patients with peripheral psoriatic arthritis [J]. Rev Rhum Engl Ed, 1999,66(10):457-461.
[18] Gladman DD, Mease PJ, Strand V, et al. Consensus on a core set of domains for psoriatic arthritis[J]. J Rheumatol, 2007(34):1167-1170.
[19] Mease PJ. Assessment tools in psoriatic arthritis[J]. J Rheumatol, 2008(35):1426-1430.
[20] Mease PJ, CE Antoni, Gladman DD, et al. Psoriatic arthritis assessment tools in clinical trials[J]. Ann Rheum Dis, 2005,64(Suppl 2):49-54.
[21] Maejima H, Taniguchi T, Watarai A, et al. Analysis of clinical, radiological and laboratory variables in psoriatic arthritis with 25 Japanese patients[J]. J Dermatol, 2010,37(7):647-656.
[22] Gladman DD, Mease PJ, Choy EH, et al. Risk factors for radiographic progression in psoriatic arthritis: subanalysis of the randomized controlled trial ADEPT[J]. Arthritis Res Ther, 2010,12(3):113.
宋慧(E-mail: jst_fsmy@163.com)
10.3969/j.issn.1002-266X.2017.32.020
R593.9
B
1002-266X(2017)32-0065-03
2016-12-08)

