早期非小細胞肺癌患者血清ERCC1水平與療效、預后的關系
劉洋,陳耀輝,劉建剛,李曉剛
(1平頂山學院,河南平頂山467000;2貴陽中醫(yī)學院;3中國人民解放軍第152醫(yī)院)
早期非小細胞肺癌患者血清ERCC1水平與療效、預后的關系
劉洋1,陳耀輝2,劉建剛3,李曉剛2
(1平頂山學院,河南平頂山467000;2貴陽中醫(yī)學院;3中國人民解放軍第152醫(yī)院)
目的探討核苷酸切除修復交錯互補基因1(ERCC1)與早期非小細胞肺癌(NSCLC)患者治療效果和預后的關系及其作用機制。方法選取早期NSCLC患者90例,TNM分期Ⅰ期48例、Ⅱ期 42例;均行腫瘤根治術,術后完全緩解(CR)26例、部分緩解(PR)35例、穩(wěn)定(SD)22例、疾病進展(PD)17例;術后隨訪12~36個月,發(fā)生終點事件29例(腫瘤復發(fā)、轉(zhuǎn)移26例,死亡3例)。患者入院時均采用ELISA法檢測血清ERCC1,采用全自動化學發(fā)光免疫分析儀檢測氧化應激相關因子谷胱甘肽過氧ERCC1化物酶(GSH-PX)、超氧化物歧化酶(SOD)、丙二醛(MDA)及晚期氧化蛋白產(chǎn)物(AOPP)。分析血清ERCC1水平與療效、預后及氧化應激相關指標的關系。結果90例患者血清ERCC1水平為(74.8±28.4)ng/mL,其中≥74.8 ng/mL者43例(ERCC高水平組)、<74.8 ng/mL者47例(ERCC低水平組)。ERCC高水平組治療有效(CR+PR)率為74.4%,高于ERCC低水平組的61.7%(P<0.05)。發(fā)生終點事件者入院時血清ERCC1水平低于未發(fā)生終點事件者,其中死亡者低于存活者(P均<0.05)。ERCC高水平組血清氧化物MDA、AOPP水平均低于ERCC低水平組,血清抗氧化物GSH-PX、SOD水平均高于ERCC低水平組(P均<0.05)。結論早期NSCLC患者血清ERCC1水平升高提示患者治療效果及預后均好,抑制氧化應激反應、促進DNA損傷修復可能是ERCC1抑制早期NSCLC進展的相關機制。
非小細胞肺癌;核苷酸切除修復交錯互補基因1;預后
多數(shù)肺癌患者就診時已處于臨床中晚期,失去手術治療機會,化療是其主要治療方法[1]。肺癌患者體內(nèi)某種基因表達存在差異可導致其對化療藥物的敏感性不同[2,3]。研究證實,DNA修復異常與腫瘤發(fā)生、發(fā)展密切相關;核苷酸切除修復系統(tǒng)活化是機體抵御癌癥的重要機制。核苷酸切除修復交錯互補基因1(ERCC1)是DNA修復過程中的關鍵酶,參與胃癌、肝癌等多種惡性腫瘤的發(fā)生、發(fā)展[4]。本研究探討早期非小細胞肺癌(NSCLC)患者血清ERCC1表達變化及意義。
1 臨床資料
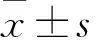
1.2 血清ERCC1水平及其與化療效果、預后及氧化應激相關因子水平的關系
1.2.1 血清ERCC1水平 患者入院時均抽取外周靜脈血2 mL,離心后取血清。采用ELISA法檢測血清ERCC1。結果顯示,血清ERCC1水平為(74.8±28.4)ng/mL,以中位數(shù)為分界標準,ERCC1≥74.8 ng/mL為高水平,<74.8 ng/mL為低水平。ERCC高水平組43例,ERCC低水平組47例。
1.2.2 血清ERCC1水平與化療效果的關系 ERCC高水平組CR 14例、PR 18例、SD 12例、PD 9例,有效(CR+PR)率為74.4%(32/43);ERCC低水平組CR 12例、PR 17例、SD 10例、PD 8例,有效率為61.7%(29/47);兩組有效率比較P<0.05。
1.2.3 血清ERCC1水平與患者預后的關系 發(fā)生與未發(fā)生終點事件患者入院時血清ERCC1水平分別為(60.9±16.9)、(84.5±16.8)ng/mL,兩者比較P<0.05;其中死亡者與存活者入院時血清ERCC1水平分別為(69.6±15.3)、(96.5±15.8)ng/mL,兩者比較P<0.05。
1.2.4 血清ERCC1水平與氧化應激相關因子水平的關系 患者入院時均采用MAGLUMI 1000全自動化學發(fā)光免疫分析儀檢測血清氧化應激相關因子谷胱甘肽過氧化物酶(GSH-PX)、超氧化物歧化酶(SOD)、丙二醛(MDA)及晚期氧化蛋白產(chǎn)物(AOPP)水平(試劑盒均購于上海酶聯(lián)生物科技有限公司)。結果顯示,ERCC高水平組血清氧化物MDA、AOPP水平均低于ERCC低水平組,血清抗氧化物GSH-PX、SOD水平均高于ERCC低水平組(P均<0.05)。見表1。
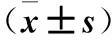
表1 兩組血清氧化應激相關因子水平比較
注:與ERCC1低水平組比較,*P<0.05。
2 討論
吸煙、大氣污染、電離輻射等均會不同程度地造成機體DNA損傷,誘發(fā)肺癌的發(fā)生[6]。DNA修復系統(tǒng)是人類抵御內(nèi)外環(huán)境造成DNA損傷的防御系統(tǒng),其存在對于維持基因組完整性、穩(wěn)定,排除復制錯誤,避免可導致嚴重后果的基因突變及防止癌變意義重大[7,8]。若DNA損傷得不到及時修復,易導致細胞分化和增殖失控,促進腫瘤的發(fā)生、發(fā)展[9]。核苷酸修復系統(tǒng)(NER)參與DNA修復,其通過泛基因組修復和轉(zhuǎn)錄偶聯(lián)修復兩種途徑修復損傷的DNA。NER系統(tǒng)中任何環(huán)節(jié)出現(xiàn)問題均可能導致惡性腫瘤的發(fā)生[10],而DNA修復基因的能力與肺癌的發(fā)病及耐藥密切相關。
ERCC1是DNA修復過程中的限速酶,亦是NER過程中的關鍵酶,定位于19號染色體上,編碼297個氨基酸,可以識別DNA損傷部位并進行修復[11]。ERCC1與腫瘤發(fā)生、發(fā)展的關系報道較多,但在不同腫瘤中其作用不盡相同。有報道,卵巢癌患者血清ERCC1水平升高,并與細胞分化程度密切相關,提示ERCC1作為促癌基因參與卵巢癌的發(fā)生、發(fā)展[12];舌鱗狀細胞癌組織ERCC1蛋白陽性表達率及過表達水平均明顯低于正常舌組織[13];胃癌組織ERCC1陽性率顯著低于癌旁正常對照組織,DNA損傷后切除修復基因不能及時進行修復, 可能導致胃癌細胞增殖、生長失控,促進腫瘤發(fā)展[14]。研究發(fā)現(xiàn),ERCC1表達陽性是影響Ⅲ期NSCLC患者預后的危險因子; NSCLC組織(臨床分期主要為Ⅰ、Ⅱ期)中ERCC1蛋白陽性表達率與癌旁正常肺組織比較差異無統(tǒng)計學意義,但ERCC1陽性者預后較好[15]。在肺癌早期階段,ERCC1通過預防突變減少癌癥的發(fā)生、抑制其進展,ERCC1高表達提示患者預后良好;對于晚期NSCLC,尤其是接受鉑類化療的患者,ERCC1高表達提示對鉑類化療藥物耐藥,患者預后差[16]。本研究患者均為僅接受手術治療的早期NSCLC患者,ERCC1高水平組化療效果及預后均優(yōu)于ERCC1低水平組,證實了上述觀點。
正常機體內(nèi)存在氧化與抗氧化平衡。癌癥患者體內(nèi)氧自由基大量產(chǎn)生,導致抗氧化物過多消耗,當氧化物產(chǎn)生增多和(或)抗氧化物減少時,可通過多種氧化應激途徑誘發(fā)腫瘤的發(fā)生、發(fā)展。氧化應激參與肺癌的發(fā)生、發(fā)展,并與患者病情及預后相關。火照春[17]報道,肺癌患者血清活性氧簇水平顯著升高,抗氧化物SOD水平顯著降低。抗氧化物SOD、GSH-PX缺乏是導致細胞DNA損傷的原因之一。MDA是細胞膜中脂質(zhì)成分被氧化后的最重要產(chǎn)物之一,AOPP是細胞內(nèi)蛋白質(zhì)成分被氧化后的產(chǎn)物,二者能夠反映氧化應激程度及氧自由基的生成量[13~15]。本研究結果顯示, ERCC1高水平組血清氧化物SOD、GSH-PX水平明顯高于ERCC1低水平組,抗氧化物MDA、AOPP水平明顯低于ERCC1低水平組,提示ERCC1水平與氧化應激水平相關,ERCC1可能通過抑制氧化應激反應發(fā)揮抑癌基因作用。
綜上所述,早期NSCLC患者血清ERCC1水平升高提示其治療效果及預后均好;抑制氧化應激反應、促進DNA損傷修復可能是ERCC1抑制早期NSCLC進展的機制。
[1] 楊拴盈.肺癌早期診斷的現(xiàn)狀、困惑和希望[J].西安交通大學學報(醫(yī)版),2011,32(1):1-5.
[2] 李昊,鐘理,丁浩,等.肺癌個體化治療的現(xiàn)狀及展望[J].臨床與實驗病理學雜志,2014,30(2):196-199.
[3] 張俠,王衍富.老年肺癌的臨床現(xiàn)狀及流行病學研究[J].中國全科醫(yī)學,2008,11(7):610-612.
[4] 周大明,魯慶峰,陳光宇,等.ERCC1在非小細胞肺癌中的表達及與臨床預后的相關性[J].實用腫瘤學雜志,2014,28(6):524-529.
[5] 陸舜,虞永峰,紀文翔,等.2015年肺癌診療指南:共識和爭議[J].解放軍醫(yī)學雜志,2016,41(1):1-6.
[6] 丁大鵬,張英,郭云波,等.DNA修復酶XPA基因多態(tài)性與腫瘤易感性關系的研究進展[J].廣東醫(yī)學,2014,35(18):2947-2950.
[7] 楊姣,蒿艷蓉,馮國生,等.COX多因素分析和ROC曲線綜合評價DNA修復基因?qū)Ρ茄拾┑念A后價值[J].基礎醫(yī)學與臨床,2014,34(10):1333-1338.
[8] 白莎莎,祁小飛,陳子興,等.DNA修復及其在腫瘤發(fā)生中的作用[J].醫(yī)學綜述,2016,22(17):3386-3389.
[9] 王振,武新虎,劉志冰,等.肺腺癌細胞株表皮生長因子受體突變對射線誘導的DNA修復的影響[J].中華放射醫(yī)學與防護雜志,2013,33(4):355-359.
[10] 陳偉文,王志剛,沈冰寒,等.ERCC-1和RRM-1在非小細胞肺癌組織中的表達及病理的臨床分析[J].臨床肺科雜志,2013,18(2):215-216.
[11] 高長明,史美祺,吳建中,等.ERCC 1和XRCC 1多態(tài)與非小細胞肺癌GP方案化療敏感性的研究[J].中華腫瘤防治雜志,2009,16(1):27-30.
[12] 孫業(yè)紅,陳富強,朱瑩.沉默ERCC1基因?qū)β殉舶┘毎鸄2780順鉑耐藥性的影響[J]. 江蘇大學學報醫(yī)學版,2010,20(1):56-60.
[13] 何黎明,郭新程,陶山松,等.CCND1、ORAOV1、ERCC1在舌鱗狀細胞癌中的表達和臨床意義[J].口腔醫(yī)學研究,2015,31(31):597-600.
[14] 王丹丹,顧康生.DNA修復率與晚期消化道腫瘤含鉑化療方案療效相關性的研究[J].臨床腫瘤學雜志,2015,20(5):427-432.
[15] 郝艷艷,胡雪君,劉云鵬,等.ERCC1、DNA-PKcs蛋白在非小細胞肺癌中的表達與預后的關系[J].中國肺癌雜志,2008,11(2):226-230.
[16] 許崇安,馮丹,李琳,等.ERCC1和GST-pi在肺癌中的表達及預后意義[J].中國肺癌雜志,2010,13(3):195-200.
[17] 火照春.肺癌患者血清中氧化應激和炎性反應相關因子的表達及意義[J].甘肅科技,2013,29(13):119-121.
10.3969/j.issn.1002-266X.2017.32.024
R734.2
B
1002-266X(2017)32-0076-03
2017-04-06)

