食管鱗癌組織miR-106b、Smad7表達變化及其與患者臨床病理特征和預后的關系
韓東,杜煒,劉東海,林慶祿
(1 單縣中心醫院,山東菏澤274300;2 濟寧市第一人民醫院;3 中國人民解放軍第88醫院)
食管鱗癌組織miR-106b、Smad7表達變化及其與患者臨床病理特征和預后的關系
韓東1,杜煒1,劉東海2,林慶祿3
(1 單縣中心醫院,山東菏澤274300;2 濟寧市第一人民醫院;3 中國人民解放軍第88醫院)
目的探討組織微小RNA-106b (miR-106b)、信號轉導分子7(Smad7)在食管鱗癌發生、發展中的作用。方法選擇食管鱗癌組織及其配對的癌旁正常組織各97例份。采用qRT-PCR法檢測食管鱗癌組織及癌旁正常組織miR-106b、Smad7 mRNA表達,分析二者的關系及其與患者臨床病理參數和預后的關系。結果食管鱗癌組織miR-106b相對表達量高于癌旁正常組織,Smad7 mRNA相對表達量低于癌旁正常組織(P均<0.05)。相關性分析顯示,食管鱗癌組織miR-106b與Smad7表達呈負相關(r=-0.778,P<0.05)。miR-106b、Smad7表達與食管鱗癌患者臨床分期、組織分化程度、淋巴結轉移均有關(P均<0.05),與性別、年齡、腫瘤直徑及浸潤深度均無關(P均>0.05)。生存分析顯示,miR-106b高表達、Smad7低表達患者預后較差(P均<0.05)。結論miR-106b、Smad7異常表達與食管鱗癌的發生、發展及預后有關,Smad7可能是miR-106b的負性調控靶基因。
食管腫瘤;鱗狀細胞癌;微小RNA-106b;信號轉導分子7
食管癌是臨床常見的惡性腫瘤之一,在我國以食管鱗狀細胞癌(以下稱食管鱗癌)為主[1]。目前,食管癌的治療主要是以手術、化療、放療等為主的綜合治療,雖然已經取得了長足的進步,但患者預后仍然較差[2],絕大多數患者死于腫瘤的復發與遠處轉移。近年來,分子靶向治療在惡性腫瘤的治療中取得了一定成果,但迄今為止尚無對食管癌有效的靶向藥物。信號轉導分子7(Smad7)是抑制性信號轉導分子(Smad)蛋白,可抑制轉化生長因子β(TGF-β)/Smad信號通路介導的生物學效應,在細胞和組織生長發育過程中具有重要作用[3],其異常表達可能參與多種惡性腫瘤的發生、發展。近年研究發現,Smad7與微小RNA(miRNA)關系密切[4,5]。miR-106b是miRNA家族成員之一,有研究證實,miR-106b可通過作用于Smad7調控腫瘤細胞的惡性生物學行為[6,7]。但miR-106b、Smad7在食管鱗癌組織中的表達情況目前研究甚少。本研究探討miR-106b、Smad7在食管鱗癌發生、發展中的作用。
1 資料與方法
1.1 臨床資料 選擇2009年1月~2010年12月濟寧市第一人民醫院收治的食管鱗癌患者97例。所有患者行食管癌根治術,術后組織病理檢查明確診斷,臨床資料及術后隨訪資料完整。排除術前接受過任何抗腫瘤治療者或合并有其他器官惡性腫瘤者。其中,男70例、女27例,年齡(64.11±4.59)歲,腫瘤直徑:≥5 cm 46例、<5 cm 51例,臨床分期:Ⅰ期4例、Ⅱ期50例、Ⅲ期43例;組織分化程度:低分化40例、中高分化57例;浸潤深度:黏膜或黏膜下層9例、肌層或外膜88例;有淋巴結轉移35例,無淋巴結轉移62例。本研究經濟寧市第一人民醫院倫理委員會批準,患者及家屬均知情同意。
1.2 食管鱗癌組織及其癌旁正常組織miR-106b、Smad7 mRNA表達檢測 采用qRT-PCR法。取食管鱗癌患者術后癌組織及其配對的癌旁正常組織(距腫瘤邊緣3~5 cm)石蠟包埋標本,按照RNeasy石蠟包埋組織RNA提取試劑盒說明書提取組織總RNA,紫外分光光度計檢測總RNA濃度和純度,A260/A280為1.9~2.1。根據RNA逆轉錄試劑盒說明書逆轉錄為cDNA,然后進行PCR擴增。PCR引物序列:miR-106b上游引物:5′-TTTTCGCCCTTAGC-GTGAAGA-3′,下游引物: 5′-GAGGCAGTCGAAGCT-CTCG-3′;內參U6上游引物:5′-CTCGCTTCGGCAGCACA-3′,下游引物: 5′-AACGCTTCACGAATTTGCG-T-3′;Smad7上游引物:5′-TGAGGGUGACCCAATUG-TTTAG-3′,下游引物:5′-GACAGUUUATGTUGTTGGT-3′;內參GAPDH上游引物: 5′-TGACTTCAACAGCGACACCCA-3′,下游引物:5′-CACCCTGTTGCTGTAGCCAAA-3′。PCR反應體系共15 μL:cDNA 1 μL,上下游引物各0.5 μL、Ultra SYBR Mixture 7.5 μL,DEPC水5.5 μL;反應條件:95 ℃、10 min,95 ℃、15 s,60 ℃、60 s,共40個循環。分別以U6、GAPDH為內參,采用2-ΔΔCt法計算miR-106b、Smad7 mRNA相對表達量。實驗重復3次,取平均值。分析miR-106b與Smad7表達的關系及其與患者臨床病理參數的關系。
1.3 預后情況 所有患者術后接受隨訪,隨訪截至2016年12月。以手術日開始至末次隨訪時間計算生存時間,研究結束、失訪及其他原因死亡作為終點事件。以食管鱗癌組織miR-106b、Smad7 mRNA相對表達量的均值為臨界值,采用Kaplan-Meier法分析miR-106b、Smad7高表達及低表達者的預后情況。
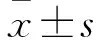
2 結果
2.1 食管鱗癌組織及其癌旁正常組織miR-106b、Smad7 mRNA表達比較 食管鱗癌組織miR-106b、Smad7 mRNA相對表達量分別為3.98±0.15、0.28±0.09,癌旁正常組織分別為1.02±0.03、1.03±0.02,二者比較P均<0.05。
2.2 食管鱗癌組織miR-106b與Smad7表達的關系 食管鱗癌組織miR-106b相對表達量與Smad7 mRNA相對表達量呈負相關(r=-0.778,P<0.05)。
2.3 miR-106b、Smad7表達與食管鱗癌患者臨床病理參數的關系 見表1。
2.4 miR-106b、Smad7表達與食管鱗癌患者預后的關系 97例患者中miR-106b高表達55例、低表達42例,Smad7高表達40例、低表達57例。Kaplan-Meier生存分析顯示,miR-106b高表達、Smad7低表達患者預后較差(P均<0.05)。
3 討論
miRNA是一組高度保守的非編碼單鏈小RNA分子,長度為18~25個核苷酸,可特異性與下游靶基因mRNA的3′-UTR區結合,調節靶基因表達,參與機體炎癥反應、免疫應答及細胞增殖、凋亡等生理及病理過程[8,9]。已有研究證實,食管鱗癌的發生、發展與某些miRNA關系密切[10,11]。miR-106b是miR-106b~25基因簇家族成員之一,其定位于人染色體7q22,在多種惡性腫瘤中具有癌基因作用,如肝癌、胃癌、喉癌等[12~14]。Smad蛋白家族是TGF-β信號通路途徑中的中心轉導物質[15],而TGF-β信號通路是EMT中最關鍵的信號通路[16]。Smad7是Smads家族的主要成員之一,是TGF-β/Smad信號通路負性調控的主要承擔者,與多種惡性腫瘤的發生密切相關[4,5,17,18]。Salot等[19]研究發現,提高TGF-β通路的關鍵負性調控因子Smad7的表達能夠明顯抑制乳腺癌的浸潤和轉移。但目前miR-106b、Smad7在食管鱗癌組織中表達的研究甚少。
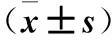
表1 miR-106b、Smad7表達與食管鱗癌患者臨床病理參數的關系
注:miR-106b、Smad7表達與食管鱗癌患者臨床分期、組織分化程度、淋巴結轉移有關(P均<0.05),與患者性別、年齡、腫瘤直徑及浸潤深度無關(P均>0.05)。
本研究結果顯示,食管鱗癌組織miR-106b相對表達量均高于癌旁正常組織,與Xiao等[20]研究結果一致; 進一步分析發現,miR-106b表達與患者臨床分期、組織分化程度、淋巴轉移有關。提示miR-106b與食管鱗癌的發生、發展及轉移可能有關。miR-106b參與腫瘤的發生、發展涉及多個信號通路。有研究證實,miR-106b在乳腺癌中可通過SIX1抑制Smad7,從而激活下游TGF-β通路,導致上皮細胞間質轉化的發生,促進腫瘤發展[7]。Yu等[6]研究證實,胃癌組織中miR-106b表達與Smad7表達呈負相關關系,共同參與胃癌的發生、發展和轉移。目前,關于食管癌組織miR-106b與Smad7表達的關系尚不明確。本研究結果顯示,食管鱗癌組織miR-106b與Smad7表達呈負相關關系;進一步分析發現,Smad7表達與患者臨床分期、組織分化程度、淋巴轉移有關。提示miR-106b與Smad7共同參與了食管鱗癌的發生、發展和轉移;miR-106b有可能通過負性調控Smad7在食管鱗癌的發生、發展中起調節作用,有可能成為食管鱗癌發生、發展的分子標志物及可能的基因治療靶點。
有研究發現,miR-106b高表達的乳腺癌、肝癌等患者生存時間較短,預后較差[21,22];Smad7低表達的前列腺癌患者生存時間較短,預后較差[23]。本研究結果顯示,miR-106b高表達、Smad7低表達者預后較差。提示miR-106b、Smad7表達與惡性腫瘤患者的預后有關,可作為預測食管鱗癌患者預后的相關指標。
綜上所述,食管鱗癌組織中miR-106b高表達、Smad7低表達,二者呈負相關關系;miR-106b、Smad7表達與食管鱗癌組織分化程度、臨床分期、淋巴轉移及預后密切相關;二者可能共同參與食管鱗癌的發生、發展及轉移,Smad7可能是miR-106b的負性調控靶基因。
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015,65(2):87-108.
[2] Chen W, Zheng R, Zhang S, et al.Esophageal cancer incidence and mortality in China, 2010[J]. Thorac Cancer, 2014,5(4):343-348.
[3] Lan HY, Chung AC. TGF-β/Smad signaling in kidney disease[J]. Semin Nephrol, 2012,32(3):236-343.
[4] Han M, Wang F, Gu Y, et al. MicroRNA-21 induces breast cancer cell invasion and migration by suppressing smad7 via EGF and TGF-β pathways[J]. Oncol Rep, 2016,35(1):73-80.
[5] Yu F, Guo Y, Chen B, et al. MicroRNA-17-5p activates hepatic stellate cells through targeting of Smad7[J]. Lab Invest, 2015,95(7):781-789.
[6] Yu D, Shin HS, Lee YS, et al. miR-106b modulates cancer stem cell characteristics through TGF-β/Smad signaling in CD44-positive gastric cancer cells[J]. Lab Invest, 2014,94(12):1370-1381.
[7] Smith AL, Iwanaga R, Drasin DJ, et al. The miR-106b-25 cluster targets Smad7, activates TGF-β signaling, and induces EMT and tumor initiating cell characteristics downstream of Six1 in human breast cancer[J]. Oncogene, 2012,31(50):5162-5171.
[8] Gruber AR, Martin G, Muller P, et al. Global 3′ UTR shortening has a limited effect on protein abundance in proliferating T cells[J]. Nat Commun, 2014(5):5465.
[9] Zhou P, Xu W, Peng X, et al. Large-scale screens of miRNA-mRNA interactions unveiled that the 3′UTR of a gene is targeted by multiple miRNAs[J]. PLoS One, 2013,8(7):e68204.
[10] Harada K, Baba Y, Ishimoto T, et al. The role of microRNA in esophageal squamous cell carcinoma[J].J Gastroenterol, 2016,51(6):520-530.
[11] Feber A, Xi L, Luketich JD, et al. MicroRNA expression profiles of esophageal cancer[J]. J Thorac Cardiovasc Surg, 2008,135(2):255-260.
[12] Yen CS, Su ZR, Lee YP, et al. miR-106b promotes cancer progression in hepatitis B virus-associated hepatocellular carcinoma[J]. World J Gastroenterol, 2016,22(22):5183-5192.
[13] Yang TS, Yang XH, Chen X, et al. MicroRNA-106b in cancer-associated fibroblasts from gastric cancer promotes cell migration and invasion by targeting PTEN[J]. FEBS Lett, 2014,588(13):2162-2169.
[14] Xu Y, Wang K, Gao W, et al. MicroRNA-106b regulates the tumor suppressor RUNX3 in laryngeal carcinoma cells[J]. FEBS Lett, 2013,587(19):3166-3174.
[15] Singh P,Wig JD,Srinivasan R. The Smad family and its role in pancreatic cancer[J].Indian J Cancer, 2011,48(3):351-360.
[16] Heldin CH,Moustakas A.Role of Smads in TGF-β signaling[J]. Cell Tissue Res, 2012,347(1):21-36.
[17] Su F, Li X, You K, et al. Expression of VEGF-D, SMAD4, and SMAD7 and their relationship with lymphangiogenesis and prognosis in colon cancer[J]. J Gastrointest Surg, 2016,20(12):2074-2082.
[18] Hu J, Xu JF, Ge WL. MiR-497 enhances metastasis of oral squamous cell carcinoma through SMAD7 suppression[J]. Am J Transl Res, 2016,8(7):3023-3031.
[19] Salot S, Gude R. MTA1-mediated transcriptional repression of SMAD7 in breast cancer cell lines[J]. Eur J Cancer, 2013,49(2):492-499.
[20] Xiao CY, Guo ZJ, Cao L, et al. Expression of mir-106b in esophageal squamous cell carcinoma [J]. Nan Fang Yi Ke Da Xue Xue Bao, 2016,36(12):1667-1671.
[21] Zheng R, Pan L, Gao J, et al. Prognostic value of miR-106b expression in breast cancer patients[J]. J Surg Res, 2015,195(1):158-165.
[22] Li BK, Huang PZ, Qiu JL, et al. Upregulation of microRNA-106b is associated with poor prognosis in hepatocellular carcinoma[J]. Diagn Pathol, 2014(9):226.
[23] Wang P, Fan J, Chen Z, et al. Low-level expression of Smad7 correlates with lymph node metastasis and poor prognosis in patients with pancreatic cancer[J]. Ann Surg Oncol, 2009,16(4):826-835.
林慶祿(E-mail: lin_1011peony@163.com)
10.3969/j.issn.1002-266X.2017.32.032
R571
B
1002-266X(2017)32-0095-03
2017-02-12)

