超聲作用下2種壓電陶瓷多孔支架材料上成骨細胞的增殖與分化
全泉,矯義來,曹洪娟,吳琳
(1. 中國醫科大學附屬口腔醫院修復一科,沈陽 110002;2. 中國科學院金屬研究所材料特種制備與加工研究部,沈陽 110016)
超聲作用下2種壓電陶瓷多孔支架材料上成骨細胞的增殖與分化
全泉1,矯義來2,曹洪娟1,吳琳1
(1. 中國醫科大學附屬口腔醫院修復一科,沈陽 110002;2. 中國科學院金屬研究所材料特種制備與加工研究部,沈陽 110016)
目的在低強度脈沖超聲波(LIPUS)作用下對比研究鈦酸鋇/微弧氧化鈦合金多孔材料(簡稱BaTiO3)和氧化鋅/微弧氧化鈦合金多孔材料(簡稱ZnO)的表面MC3T3-E1成骨細胞增殖和分化的特性。方法分別將BaTiO3和ZnO這2種材料隨機分成超聲組(UBaTiO3組和UZnO組)和對照組(CBaTiO3組和CZnO組),將MC3T3-E1成骨細胞與材料復合培養,超聲組每天接受20 min LIPUS輻照,對照組為不開功率源假輻照。通過檢測噻唑蘭(MTT)、堿性磷酸酶(ALP)和骨鈣素(OCN )值觀察成骨細胞增殖和分化的水平。結果4 d時UBaTiO3組MTT值高于CBaTiO3組,差異有統計學意義(P < 0.05);1、4和7 d時UBaTiO3組和CBaTiO3組的MTT值均高于UZnO組和CZnO組,差異均有統計學意義(P < 0.05)。4和7 d時UBaTiO3組的ALP值高于CBaTiO3組,7 d時UZnO組的ALP值高于CZnO組,差異均有統計學意義(P < 0.05);4和7 d時UBaTiO3組和CBaTiO3組的ALP值均高于UZnO組和CZnO組,差異均有統計學意義(P < 0.05)。7、10和14 d時UBaTiO3組的OCN值高于CBaTiO3組,14 d時UZnO組的OCN值高于CZnO組,差異均有統計學意義(P < 0.05),7、10和14 d時UBaTiO3組的OCN值高于UZnO組,10和14 d時CBaTiO3組的OCN值高于CZnO組,差異均有統計學意義(P < 0.05)。結論LIPUS可以促進 BaTiO3和ZnO這2種材料上MC3T3-E1的增殖與分化。在LIPUS作用下,BaTiO3材料優于ZnO材料,更具有成為骨修復材料的潛能。
低強度脈沖超聲波; 成骨細胞; 壓電陶瓷; 壓電效應
Abstract ObjectiveTo evaluate the effects of low-intensity pulsed ultrasound (LIPUS) treatment on the proliferation and differentiation of osteoblasts cultured on barium titanate/titanium alloy (BaTiO3) and zinc oxide/titanium alloy (ZnO) piezoelectric ceramic composite scaffolds.MethodsThe BaTiO3and ZnO porous composite scaffolds were randomly divided into ultrasound (UBaTiO3and UZnO) and control (CBaTiO3and CZnO) groups,and MC3T3-E1 cells were cultured on the surface of the materials in each group. Cells in the ultrasound groups were subjected to a 20-min treatment LIPUS session daily,and the control group was sham-treated without the power source.The proliferation and differentiation rates of osteoblasts were evaluated using methyl thiazolyl tetrazolium (MTT),alkaline phosphatase(ALP),and osteocalcin (OCN) assays.ResultsSignificant differences in the MTT values were observed between the UBaTiO3and CBa-TiO3groups at day 4 (P < 0.05) and between the UBaTiO3and UZnO groups at days 1,4,and 7 (P < 0.05). Compared with the CBaTiO3group,the UBaTiO3group showed significantly higher ALP activity and OCN levels at days 4 and 7 (P < 0.05). Further,a significant difference in the ALP and OCN values between the UBaTiO3and UZnO groups (P < 0.05) was observed.ConclusionLIPUS promotes the proliferation and differentiation of osteoblasts on BaTiO3and ZnO scaffolds. BaTiO3scaffolds enable better promotion of osteogenesis under LIPUS treatment than ZnO scaffolds do.
Keywordslow-intensity pulsed ultrasound; osteoblast; piezoelectric ceramic; piezoelectric effect
近年來,臨床上大段骨或大面積骨缺損的治療難題導致對骨缺損修復材料的需求不斷加大,因此學者們對人工骨材料的研發熱情也不斷增高。理想的人工骨材料要具備與骨相似的機械性能、良好的可加工性、骨傳導性、骨誘導性及生物降解性。目前用于骨缺損修復的材料有鈦及鈦合金、生物陶瓷、高分子材料及其復合材料,壓電材料由于具有與骨本身相同的壓電效應而備受關注[1]。1880年居里兄弟發現,當外界機械力對壓電材料擠壓或拉伸時,其兩端會產生不同的電荷,這種效應稱為壓電效應[2]。壓電陶瓷具備陶瓷材料良好的生物相容性,并且將其植入后可以不需要外電源,依靠機體自身的活動將骨組織的力傳導至材料而產生壓電效應,產生適合的電刺激。本研究使用的2種材料是由中國科學院金屬研究所提供的鈦酸鋇/微弧氧化鈦合金多孔材料(簡稱BaTiO3)和氧化鋅/微弧氧化鈦合金多孔材料(簡稱ZnO)。多孔材料的結構特點:(1)鈦合金支架是高強韌的多孔支架,可以提供骨組織生長的空間,多孔材料表面粗糙有利于細胞的粘附;(2)孔隙率和孔徑的調控可以使其與骨組織彈性模量匹配;(3)多孔材料的骨傳導性可促進骨組織的修復和提高植入物的長期穩定。
低強度脈沖超聲波(low-intensity pulsed ultrasound stimulation,LIPUS)是一種強度較低、發射方式為脈沖式、能以壓力波形式傳送到人體內的非侵入性機械波。已有研究[3]表明,LIPUS可以通過調節細胞增殖,影響細胞因子分泌及促進基因表達,促進膠原和非膠原蛋白合成,誘導細胞分化而對細胞產生生物學效應。LIPUS產生的振蕩壓力、聲流、微聲流以及重復脈沖相互循環作用,為骨愈合提供力學環境,這些力的作用可以加快骨重建,改善骨痂結構,增強骨的力學性能[4]。壓電陶瓷涂層通過機械力的激發產生微電流為成骨提供電環境,已有學者證實電環境有利于成骨效應[5]。本研究將MC3T3-E1成骨細胞分別與BaTiO3和 ZnO 2種材料復合培養,超聲組給予LIPUS刺激,對照組為不開功率源的假輻照,比較材料表面MC3T3-E1成骨細胞的增殖與分化特性,為LIPUS的多因素作用下的高強韌多孔鈦人工骨的開發提供基礎數據。
1 材料與方法
1.1 實驗材料
BaTiO3多孔材料和ZnO多孔材料由中國科學院金屬研究所制作提供,利用電子束逐層熔化技術打印鈦合金支架,表面進行微弧氧化處理,再利用水熱合成技術原位分別形成鈦酸鋇和氧化鋅涂層,完成BaTiO3多孔材料和ZnO多孔材料的制作。樣品規格為直徑10 mm、厚5 mm的圓柱狀,孔徑400~500 μ m,孔隙率為65%~70%(圖1)。依次放入丙酮、無水乙醇、蒸餾水浸泡10 min,放入電熱恒溫鼓風干燥箱干燥烘干后(150 ℃,30 min),高溫高壓滅菌后備用(121 ℃/0.21 MPa)。細胞接種前4 h,將高壓滅菌后的支架材料放入培養液中,抽真空4 h以排出材料內氣體,并使材料達到預濕潤狀態。

圖1 掃描電鏡觀察材料表面形貌Fig.1 Morphology of the BaTiO3and ZnO porous scaffolds observed using scanning electron microscope
1.2 主要儀器與試劑
1.2.1 主要儀器:740型超聲波發生器(美國Mettler Electronics公司),Hitachi S3400掃描電子顯微鏡(日本日立公司),Infinite M200酶標儀(奧地利Tecan公司)。
1.2.2 主要試劑:α-MEM培養基(美國HyClone公司),胎牛血清(美國ExCell公司),1%雙抗(美國Gibco公司),超聲耦合劑(西苑公司),MTT試劑、DMSO (美國Sigma公司),ALP試劑盒(南京建成有限公司),OCN檢測試劑盒(北京鼎國試劑公司)。
1.3 實驗方法
1.3.1 實驗分組:將BaTiO3多孔材料和ZnO多孔材料隨機分為超聲組(UBaTiO3組和UZnO組)和對照組(CBaTiO3組和CZnO組),保證每組樣品數量不低于5。
1.3.2 超聲加載:頻率1 MHz,強度30 mW/cm2,脈沖寬度1 ms,脈沖重復頻率100 Hz,20 min/次,1次/d。對照組為不開功率源的假輻照。
1.3.3 細胞培養:將經過真空排氣和預濕的多孔支架材料放入 24 孔板中,待培養的小鼠MC3T3-E1成骨細胞(中國醫科大學附屬口腔醫院中心實驗室提供,第 20 代)融合度達到近 80%時,0.25%胰蛋白酶消化,吹打成細胞懸液,并將50 μ L細胞懸液緩慢均勻接種到支架材料上,37 ℃、5% CO2恒溫培養箱中孵育 2 h 后,每孔緩慢加入1 mL改良的MEM培養基(α-MEM),內含10%胎牛血清、1%青霉素抗體、1%鏈霉素抗體,再次放入恒溫培養箱中,待 24 h 細胞貼壁穩定后,將細胞脫落多于20個的樣本丟棄,余留樣本隨機分為超聲組和對照組,培養基每2 d更換1次。
1.3.4 MTT 檢測:將 MC3T3-E1 與 UBaTiO3、UZnO、CBaTiO3和CZnO 4組支架材料復合培養于24孔板24 h后,超聲組加載超聲,對照組假輻照。1、4和7 d后吸棄培養基,PBS沖洗3次去除未粘附細胞,每孔加入800 μ L純培養基和200 μ L MTT溶液,于37 ℃培養箱靜置4 h,而后吸出每孔液體加入1 000 μ L DMSO振蕩10 min使其充分溶解,將每孔液體吸出200 μ L放入96孔板,空白孔放入200 μ L DMSO,用酶標儀490 nm波長下測定各組光密度(optical density,OD)值。
1.3.5 ALP 檢測:將 MC3T3-E1 與 UBaTiO3、UZnO、CBaTiO3和CZnO 4組支架材料復合培養于24孔板24 h后,超聲組加載超聲,對照組假輻照。培養1、4和7 d后,吸出培養基,PBS沖洗3遍,胰酶消化細胞,離心,再次加入PBS吹打材料上殘余細胞,收集并離心,去上清液,加入曲拉通裂解液(0.3%)裂解細胞,同時進行-80 ℃與0 ℃反復凍融2次的物理裂解方法,最后4 ℃、12 000 r/min離心5 min,取上清液,加入到96孔板,分別在酶標儀562 nm和520 nm波長下測得BCA標準蛋白量和ALP含量,計算ALP活力值,ALP活力(金氏單位/100 mL) = (測定OD-空白OD)/(標準OD-空白OD)×0.02/標準蛋白×106。
1.3.6 OCN檢測:將MC3T3-E1成骨細胞與UBaTiO3、UZnO、CBaTiO3和CZnO 4組支架材料復合培養于24孔板24 h后,超聲組加載超聲,對照組假輻照。7、10和14 d后,吸取孔內培養基100 μ L,4 ℃、12 000 r/min離心5 min后取上清,依次在96孔板加入樣品、標準品及空白對照組,生物素標記二抗及酶標試劑,37℃反應 60 min,洗板5次,加入顯色劑A、B,37 ℃顯色10 min,加入終止液,10 min內讀取OD值,并按標準品繪制的標準曲線計算樣本相應OCN含量。
1.4 統計學分析
采用SPSS 17.0軟件進行統計學分析,所有數據均用x-±s表示,組間比較采用單因素方差分析,P <0.05為差異有統計學意義。
2 結果
2.1 MTT值
各組MTT值均隨培養時間增長而升高。第1、4和7 天時UBaTiO3組MTT值高于CBaTiO3組,且在第4天時差異有統計學意義(P = 0.006)。第1天時CZnO組MTT值高于UZnO組,第4和7天時UZnO組MTT值高于CZnO組,但差異均無統計學意義(P > 0.05)。第1、4和7天時UBaTiO3組MTT值高于UZnO組,CBaTiO3組MTT值高于CZnO組,差異均有統計學意義(均P < 0.05)。見表1。
2.2 ALP值
各組ALP活力值均隨培養時間增長而升高。第1、4和7天時UBaTiO3組ALP值高于CBaTiO3組,且在第4和7 天時有統計學差異(均P < 0.05)。第1、4和7天時UZnO組ALP值高于CZnO組,且在第7天時有統計學差異(P = 0.01)。第1、4和7天時UBaTiO3組ALP值高于UZnO組,且在第4和7天時有統計學差異(均P <0.05),第1、4和7天時CBaTiO3組ALP值高于CZnO組,且在第4和7天時有統計學差異(均P < 0.05)。見表1。
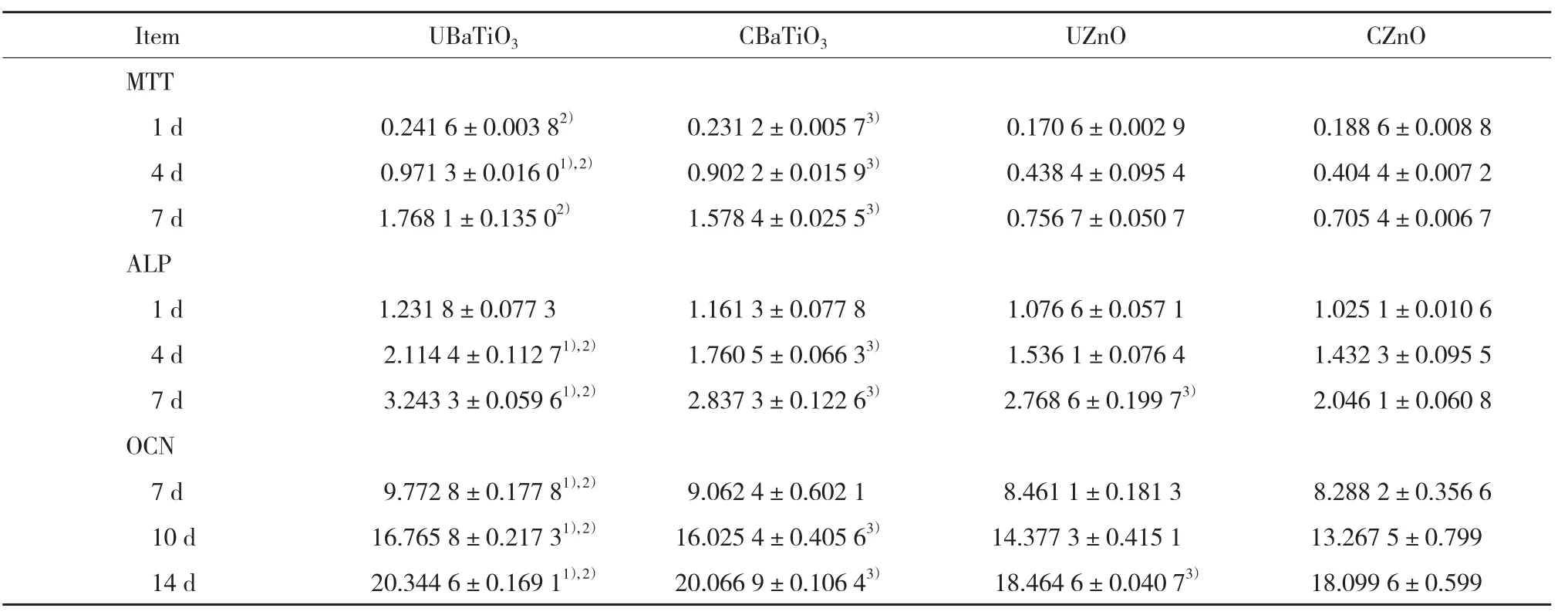
表1 不同時間點各組MTT、ALP、OCN結果Tab.1 Results of the MTT,ALP,and OCN assays for the four groups at different time points
2.3 OCN值
各組OCN值均隨培養時間增長而升高。第7、10和14天時UBaTiO3組OCN值高于CBaTiO3組,均有統計學差異(均P < 0.05)。第7天時UZnO組與CZnO組比較OCN值無統計學差異,第10和14天時UZnO組OCN值高于CZnO組,且第14天時有統計學差異(P = 0.000 5)。第7、10和14天時UBaTiO3組OCN值高于UZnO組,差異均有統計學差異(均P < 0.05),第7、10和14天時CBaTiO3組OCN值高于CZnO組,且在第10、14天時有統計學差異均(P < 0.05)。見表1。
3 討論
超聲波是高頻聲壓波(>20 kHz),以機械振動的形式在生物組織內傳遞。LIPUS因其非侵入性、有效性、安全性、操作方便、治療時間短,是近年來公認的能促進骨愈合修復的一種新的物理治療方法。1994年和2000年相繼得到美國食品藥品監督管理局的批準,在臨床上用于骨折和骨不連的治療[6]。近年來,LIPUS作為非侵入性輔助手段與骨支架材料聯合應用的研究,為大面積骨缺損的人工骨移植修復治療提供了一個新的可行方案。
目前關于壓電材料在骨移植材料領域的研究,鈦酸鋇基無鉛壓電陶瓷具有較高的優越性,實驗研究顯示它具有良好的生物相容性、良好的骨誘導性與骨傳導性,可以作為直接的骨替代材料[7]。MARIANNA等[8]認為BaTiO3的壓電效應能夠促進細胞更快增殖,提高復合陶瓷的生物活性。ANTONELLA等[9]發現BaTiO3不僅具有良好的生物相容性,而且還保持了較高的介電常數與壓電性能。但由于Ba-TiO3需要高溫燒結(1 300~1 350 ℃),且燒結存在一定難度,越來越多學者開始關注其他類壓電材料。ZnO壓電陶瓷由于其成本低、光敏性好、氧化性強、無毒性以及優良的化學穩定性,引起科研工作者廣泛的研究興趣。在醫學應用方面,人們最為廣泛關注的是ZnO優越的抗菌性。劉冠花等[10]在研究防治種植體周圍炎癥中發現,通過在鈦合金表面制備氧化鋅涂層可達到良好抗菌效果。
在骨缺損研究中,為了更好地模擬細胞三維培養環境,三維支架材料的研究受到廣泛關注。傳統二維細胞培養系統與體內情況相異,細胞會逐漸失去原有的性狀,但怎樣實現三維支架內外的物質交換而為細胞生長提供良好的環境成為困擾學者們的一大難題,學者們開始將LIPUS作為輔助手段并取得一定成果。WU等[11]的體外實驗證實LIPUS可以提高成骨細胞在三維支架材料內的長入深度和細胞的DNA復制;HUANG等[12]認為LIPUS能夠促進支架深部空隙區成骨細胞的增殖;胡瑩等[13]認為LIPUS可與泡沫TiC/Ti聯合應用促進骨缺修復。本研究以BaTiO3和ZnO三維支架材料作為細胞載體,發現 LIPUS促進了BaTiO3和ZnO三維支架與成骨細胞共培養體系中細胞的增殖與分化,這為LIPUS作為輔助手段配合壓電陶瓷三維支架人工骨材料的應用提供了有益數據。
LIPUS可以使骨組織本身產生壓電效應,但作用于壓電材料后是否可以使材料產生壓電效應尚無文獻報道。本研究結果提示,在LIPUS作用下Ba-TiO3和ZnO復合材料均具有良好的生物相容性,且成骨細胞在BaTiO3表面的增殖與分化優于在ZnO表面,這其中包含了在LIPUS作用下結構、生化、力學、電學的綜合效應。 LIPUS與BaTiO3、ZnO三維支架材料構建的結構、力學、生化和電學多因素環境促進了細胞的增殖與分化,但本研究并不能闡明具體是哪些因素導致了最終結果,這些因素的匹配關系和耦合作用及其促進骨生長的修復機制還有待進一步研究。
綜上所述,LIPUS有利于MC3T3-E1成骨細胞在BaTiO3和ZnO復合材料上的增殖與分化,在LIPUS作用下BaTiO3復合材料優于ZnO復合材料,更具有成為人工骨代替品的潛能。
[1] TRIPATHY A,PRAMANIK S,MANNA A,et al. Synthesis and characterizations of novel Ca-Mg-Ti-Fe-oxides based ceramic nanocrystals and flexible film of polydimethylsiloxane composite with improved mechanical and dielectric properties for sensors [J]. Sensors (Basel),2016,16(3):292. DOI:10.3390/s16030292.
[2] YAN Z,JIANG L. Modified continuum mechanics modeling on size-dependent propertie of piezoelectric nanomaterials:a review [J].Nanomaterials (Basel),2017,7(2):27. DOI:10.3390/nano7020027.
[3] KUSUYAMA J,BANKOW K,SHAMOTO M,et al. Low intensity pulsed ultrasound (LIPUS) influences the multilineage differentiation of mesenchymal stem and progenitor cell lines through ROCK-Cot/Tpl2-MEK-ERK signaling pathway [J]. J Biol Chem,2014,289(15):10330-10344. DOI:10.1074/jbc.M113.546382.
[4] ZHU H,CAI H,LIN T,et al. Low-intensity pulsed ultrasound enhances bone repair in a rabbit model of steroid-associated osteonecrosis[J]. Clin Orthop Relat Res,2015,473(5):1830-1839. DOI:10.1007/s11999-015-4154-8.
[5] BUSSCHE L,HARMAN RM,SYRACUSE BA,et al. Microencapsulated equine mesenchymal stromal cells promote cutaneous wound healing in vitro [J]. Stem Cell Res Ther,2015,6(1):66. DOI:10.1186/s13287-015-0037-x.
[6] KINAMI Y,NODA T,OZAKI T. Efficacy of low-intensity pulsed ultrasound treatment for surgically managed fresh diaphysealfractures of the lower extremity:multi-center retrospective cohort study[J]. J Orthop Sci,2013,18(3):410-418. DOI:10.1007/s00776-013-0358-5.
[7] DOROZHKIN SV. Calcium orthophosphates as bioceramics:state of the art[J]. J Funct Biomater,2010,1(1):22-107. DOI:10.3390/jfb1010022.
[8] GIANNINI M,GIANNACCINI M,SIBILLANO T,et al. Sheets of vertically aligned BaTiO3nanotubes reduce cell proliferation but not viability of NIH-3T3 cells [J]. PLoS One,2014,9(12):e115183.DOI:10.1371/journal.pone.0115183.
[9] ROCCA A,MARINO A,ROCCA V,et al. Barium titanate nanoparticles and hypergravity stimulation improve differentiation of mesenchymal stem cells into osteoblasts [J]. Int J Nanomedicine,2015,10(8):433-445. DOI:10.2147/IJN.S76329.
[10] 劉冠花,王金清,劉曉輝,等. 鈦合金表面納米氧化鋅薄膜制備及抗菌性研究[J]. 中國現代醫學雜志,2014,24(32):1-4.DOI:10.3969/j.issn.1005-8982.2014.32.001.
[11] WU L,LIN L,QIN YX. Enhancement of cell in growth,proliferation,and early differentiation in a three-dimensional silicon carbide scaffold using low-intensity pulsed ultrasound [J]. Tissue Eng Part A,2015,21(1/2):53-61. DOI:10.1089/ten.TEA.2013.0597.
[12] HUANG L,CAI H,HU H,et al. Enhanced regeneration of large cortical bone defects with electrospun nanofibrous membranes and low-intensity pulsed ultrasound[J]. Exp Ther Med,2017,14(1):525-530. DOI:10.3892/etm.2017.4565.
[13] 胡瑩,吳琳,劉笑涵,等. 低強度脈沖超聲波輻照與泡沫TiC/Ti對犬節段性骨缺修復的促進作用[J]. 中國比較醫學雜志,2013,23(4):44-47. DOI:10.3969/j.issn.1671-7856.2013.04.010.
(編輯 陳 姜)
Effect of Low-intensity Pulsed Ultrasound on the Proliferation and Differentiation of Osteoblasts Cultured on Two Piezoelectric Ceramic Porous Scaffolds
QUAN Quan1,JIAO Yilai2,CAO Hongjuan1,WU Lin1
(1. Department of Prosthodontics,School of Stomatology,China Medical University,Shenyang 110002,China; 2. Materials Fabrication and Processing Division,Institute of Metal Research,Chinese Academy of Sciences,Shenyang 110016,China)
R783.1
A
0258-4646(2017)10-0869-05
http://kns.cnki.net/kcms/detail/21.1227.R.20170927.0942.004.html
10.12007/j.issn.0258‐4646.2017.10.002
國家高技術研究發展計劃(863計劃)(2015AA033702);遼寧省自然科學基金(2014021008)
全泉(1984 -),女,主治醫師,碩士.
吳琳,E-mail:wulin13@163.com
2016-12-15
網絡出版時間:2017-09-27 09:42

