右美托咪定減輕酒精誘導的小鼠急性肝損傷*
黃 強, 夏明珠, 陽文杰, 戴中亮, 姜遠旭△
(1深圳市人民醫院麻醉科, 深圳市麻醉醫學工程研究中心, 2深圳市羅湖醫院集團湖貝社區健康服務中心, 廣東 深圳 518020)
右美托咪定減輕酒精誘導的小鼠急性肝損傷*
黃 強1, 夏明珠2, 陽文杰1, 戴中亮1, 姜遠旭1△
(1深圳市人民醫院麻醉科, 深圳市麻醉醫學工程研究中心,2深圳市羅湖醫院集團湖貝社區健康服務中心, 廣東 深圳 518020)
目的探討右美托咪定(DEX)對酒精誘導的小鼠急性肝損傷的作用及機制。方法50只昆明小鼠隨機分為5組(n=10):生理鹽水對照(NS)組、酒精性肝損傷模型(E)組、DEX低劑量(10 μg/kg)治療(E+L)組、DEX中劑量(50 μg/kg)治療(E+M)組和DEX高劑量(100 μg/kg)治療(E+H)組。各組動物乙醇灌胃后6 h處死,采集血和肝組織標本。測定各組血清丙氨酸氨基轉移酶(ALT)、天冬氨酸氨基轉移酶(AST)水平以及甘油三酯(TG)濃度;測定各組肝組織丙二醛(MDA)、還原型谷胱甘肽(GSH)的含量及超氧化物歧化酶(SOD)活性;ELISA測定小鼠肝組織腫瘤壞死因子α(TNF-α)和白細胞介素1β(IL-1β)的濃度;Western blot檢測肝組織細胞色素 P450 2E1(CYP2E1)和核因子κB (NF-κB)的表達;HE染色觀察肝組織病理學改變并進行肝損傷評分。結果與NS組比較,E組血清的AST、ALT水平及TG含量升高,與E組比較,E+M組和E+H組血清AST、ALT水平及TG含量降低;與NS組比較,E組肝組織MDA含量升高,GSH含量和SOD活性降低,與E組比較,E+M組和E+H組肝組織MDA含量降低,GSH含量及SOD活性升高;與NS組比較,E組肝組織TNF-α和IL-1β含量升高,與E組比較,E+M組和E+H組肝組織TNF-α和IL-1β含量降低;與NS組比較,E組肝組織CYP2E1和NF-κB表達升高,與E組比較,E+M組和E+H組肝組織CYP2E1和NF-κB表達降低;肝組織病理學檢查可見,DEX中、高劑量可明顯減輕肝細胞變性和壞死及炎性細胞浸潤程度。結論右美托咪定通過抗炎及抗氧化作用對急性酒精性損傷的肝臟具有一定的保護作用,其作用機制可能與抑制CYP2E1和NF-κB的表達有關。
右美托咪定; 酒精性肝損傷; 細胞色素 P450 2E1; 核因子κB
酒精性肝損傷常發生于過度飲酒者,嚴重者發展為酒精性肝硬化,5年生存率約為23%~50%[1]。酒精性肝損傷發病機制復雜,研究表明,氧化應激反應及其誘導的肝臟炎性反應在酒精性肝損傷中扮演重要角色[2-3]。因此,減輕肝臟炎癥和氧化應激是治療酒精性肝損傷的重要手段。
右美托咪定(dexmedetomidine,DEX)是一種高選擇性α2-腎上腺素能受體激動劑,由于具有良好的鎮靜和鎮痛作用,近年來用于危重病人的鎮靜及術后需要機械通氣的病人[4-5]。目前的研究表明,DEX具有抗炎和抗氧化作用,且對內毒素、肝缺血再灌注和急性肺損傷誘導的肝損傷有保護作用[5-9]。然而,DEX對酒精性肝損傷的保護作用及機制未見報道。本研究制備小鼠急性酒精性肝損傷模型, 以探討DEX對酒精性肝損傷的保護作用及其可能的作用機制。
材 料 和 方 法
1藥物和試劑
鹽酸右美托咪定注射液(江蘇恒瑞醫藥公司);天冬氨酸氨基轉移酶(aspartate aminotransferase,AST)、丙氨酸氨基轉移酶(alanine aminotransferase,ALT)、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)和還原型谷胱甘肽(glutathione,GSH)測定試劑盒(南京建成生物工程研究所);TNF-α和IL-1β ELISA試劑盒(RayBiotech);抗細胞色素P450 2E1(cytochrome P450 2E1,CYP2E1) 抗體(Abcam);抗NF-κB和β-actin抗體(CST)。
2方法
2.1模型制作和分組 清潔級昆明種小鼠50只,4~5周齡,體重(20.0±2.0)g,雄性(購于廣東省醫學實驗動物中心)。 實驗前適應性喂養2 d,造模前禁食12 h,自由飲水。實驗按體重隨機分為5組,每組10只:生理鹽水對照(NS)組(腹腔注射等體積生理鹽水25 mL/kg,0.5 h后給予等熱量、等體積糖水12 mL/kg灌胃)、酒精性肝損傷模型(E)組(腹腔注射等體積生理鹽水25 mL/kg,0.5 h后給予50%乙醇12 mL/kg灌胃)、DEX低劑量治療(E+L)組(腹腔注射DEX 10 μg/kg,0.5 h后給予50%乙醇12 mL/kg灌胃)、DEX中等劑量治療(E+M)組(腹腔注射Dex 50 μg/kg,0.5 h后給予50%乙醇12 mL/kg灌胃)和DEX高劑量治療(E+H)組(腹腔注射DEX 100 μg/kg,0.5 h后給予50%乙醇12 mL/kg灌胃)。末次給藥6 h后,腹腔注射3%戊巴比妥鈉50 mg/kg麻醉小鼠,麻醉后開腹,暴露下腔靜脈,采集血標本,室溫靜置30 min,4 ℃、2 500×g離心10 min,取上清備用。放血處死動物,完整取出肝臟并稱重。冰面上取部分肝右葉用10%中性多聚甲醛固定24 h后,用于病理學檢查,取部分肝左葉液氮速凍后,-70 ℃冰箱凍存備用。
2.2血清AST、ALT和甘油三酯(triglyceride,TG)水平的檢測 取上述血清,嚴格按照試劑盒操作方法檢測AST、ALT及TG水平。
2.3肝組織TNF-α和IL-1β含量的檢測 取冰凍肝組織解凍,ELISA檢測TNF-α和IL-1β含量,嚴格按說明書操作。
2.4肝組織MDA、GSH含量及SOD活性的檢測 取肝組織100 mg解凍,制備肝勻漿用于測定肝組織中MDA、GSH含量和SOD活性。
2.5肝組織CYP2E1和NF-κB蛋白表達的檢測 取適量肝組織,用組織蛋白裂解液提取組織總蛋白,經過10% SDS-PAGE 分離后,電轉移至硝酸纖維素膜上。室溫下用含10%脫脂奶粉的TBST溶液對膜封閉2 h或過夜;封閉完畢后用PBST洗膜5次,每次間隔5分鐘,洗膜后加入CYP2E1或NF-κB p65的 I 抗(1∶500),4 ℃孵育過夜;洗膜3次后,加入 II 抗(辣根過氧化物酶標記的羊抗兔),室溫下孵育1 h,洗膜5次,每次間隔5 min,最后加入化學發光增強劑,自顯影。采用圖像分析處理系統對蛋白條帶掃描分析,記錄吸光度。結果表示為與對照組的相對吸光度。
2.6肝臟病理學的觀察 取上述10%中性甲醛固定的肝組織,常規石蠟包埋,切片,經HE染色后觀察肝組織病理學改變并進行病理學評分。肝組織評分標準如下:肝竇充血;門管區水腫;炎性細胞浸潤;肝細胞壞死。分別依病情輕重評分(0分:無病變或非常輕微;1分:輕度病變;2分:中度病變;3分:重度病變;4分:極重度病變)。各項評定分數相加為肝損傷總評分。
3統計學處理
采用SPSS 13.0軟件行統計分析。計量資料以均數±標準差(mean±SD)表示,組間比較采用單因素方差分析(one-way ANOVA),Student-Newman-Keulq檢驗進行多重比較。組間比較采用Kruskal-Wallis 秩和檢驗。以P<0.05為差異有統計學意義。
結 果
1血清ALT、AST和TG水平的變化
與NS組比較,E組的ALT、AST及TG水平升高(P<0.01);與E組比較,E+M組和E+H組的ALT、AST及TG水平下降(P<0.05);與E+M組比較, E+H組的ALT、AST及TG水平下降(P<0.01),見表1。
表1右美托咪定對急性酒精性肝損傷小鼠血清ALT、AST及TG水平的影響
Table 1. The effects of dexmedetomidine on the serum levels of ALT, AST and TG in the mice with acute liver injury induced by alcohol (Mean±SD.n=10)
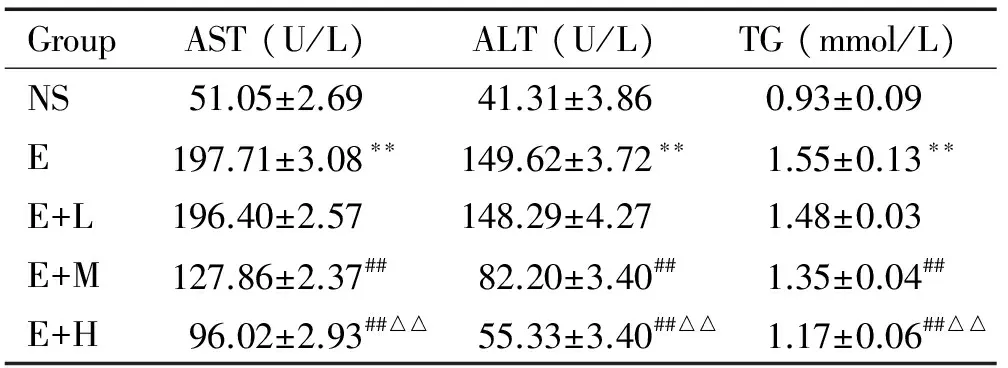
GroupAST(U/L)ALT(U/L)TG(mmol/L)NS51.05±2.6941.31±3.860.93±0.09E197.71±3.08??149.62±3.72??1.55±0.13??E+L196.40±2.57148.29±4.271.48±0.03E+M127.86±2.37##82.20±3.40##1.35±0.04##E+H96.02±2.93##△△55.33±3.40##△△1.17±0.06##△△
**P<0.01vsNS group;##P<0.01vsE or E+L group;△△P<0.01vsE+M group.
2肝組織MDA、GSH含量和SOD活性的變化
與NS組比較,E組的MDA含量增加(P<0.01),SOD活性及GSH含量降低(P<0.01);與E組比較,E+M組和E+H組的MDA含量降低(P<0.01),SOD活性及GSH含量升高(P<0.01);與E+M組比較, E+H組MDA含量降低(P<0.01),SOD活性及GSH含量升高(P<0.01),見表2。
表2右美托咪定對急性酒精性肝損傷小鼠肝組織MDA、SOD及GSH水平的影響
Table 2. The effects of dexmedetomidine on the levels of MDA, SOD and GSH in the liver of the mice with acute liver injury induced by alcohol (Mean±SD.n=10)
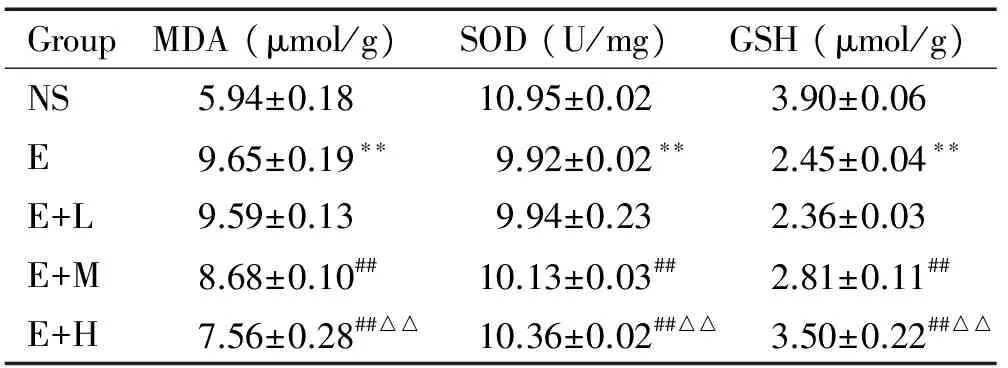
GroupMDA(μmol/g)SOD(U/mg)GSH(μmol/g)NS5.94±0.1810.95±0.023.90±0.06E9.65±0.19??9.92±0.02??2.45±0.04??E+L9.59±0.139.94±0.232.36±0.03E+M8.68±0.10##10.13±0.03##2.81±0.11##E+H7.56±0.28##△△10.36±0.02##△△3.50±0.22##△△
**P<0.01vsNS group;##P<0.01vsE or E+L group;△△P<0.01vsE+M group.
3肝組織TNF-α和IL-1β含量的變化
與NS組比較,E組TNF-α和IL-1β含量增加(P<0.01);與E組比較,E+M組和E+H組TNF-α和IL-1β含量降低(P<0.01);與E+M組比較,E+H組TNF-α和IL-1β含量降低(P<0.01),見圖1、2。
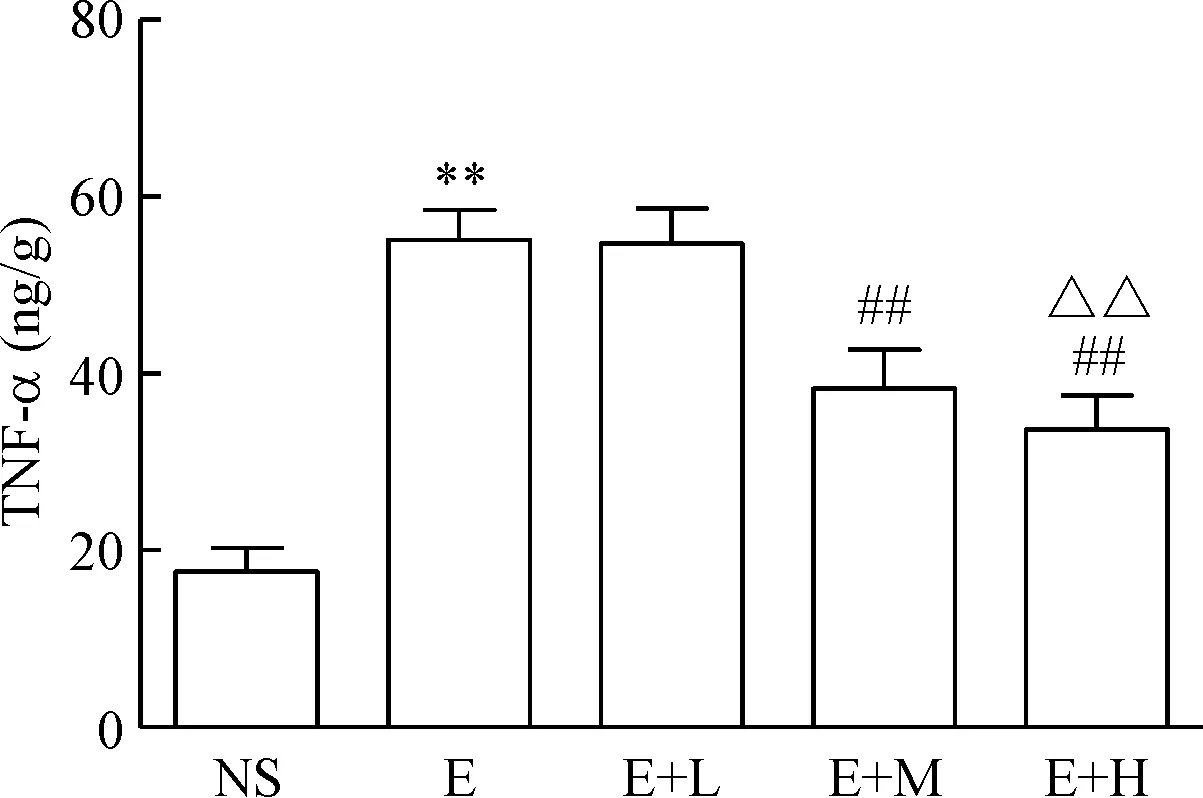
Figure 1. The effect of dexmedetomidine on TNF-α expression in the liver of the mice induced by alcohol. Mean±SD.n=10.**P<0.01vsNS group;##P<0.01vsE or E+L group;△△P<0.01vsE+M group.
圖1右美托咪定對各組肝組織TNF-α的影響
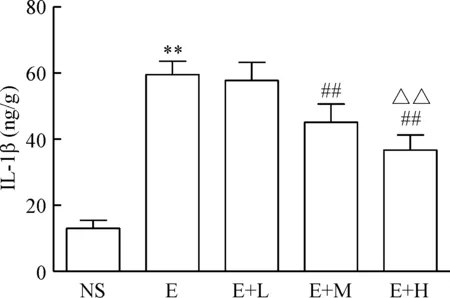
Figure 2. The effect of dexmedetomidine on IL-1β expression in the liver of the mice induced by alcohol. Mean±SD.n=10.**P<0.01vsNS group;##P<0.01vsE or E+L group;△△P<0.01vsE+M group.
圖2右美托咪定對各組肝組織IL-1β的影響
4肝組織病理學改變及肝損傷評分
NS組為正常的肝臟組織學結構,E組可見大量的炎性細胞及脂肪變性,與E組相比,E+H組炎性細胞及脂肪變性減少。與NS組比較,E組肝損傷評分增高(P<0.01);與E組比較,E+M組和E+H組肝損傷評分降低(P<0.01);與E+M組比較,E+H組肝損傷評分降低(P<0.01),見圖3。
5肝組織CYP2E1和NF-κB的表達
與NS組比較,E組CYP2E1表達增加(P<0.01);與E組比較,E+M組和E+H組的CYP2E1表達降低(P<0.01);與E+M組比較, E+H組的CYP2E1表達降低(P<0.01),見圖4。
與NS組比較,E組的NF-κB表達增加(P<0.01);與E組比較,E+M組和E+H組的NF-κB表達降低(P<0.01);與E+M組比較, E+H組NF-κB表達降低(P<0.01),見圖5。
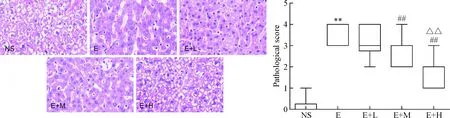
Figure 3. The histopathological changes and injury scores of the liver in the mice after treated with dexmedetomidine (HE staining, ×400). Median (minimum~maximum).n=10.**P<0.01vsNS group;##P<0.01vsE or E+L group;△△P<0.01vsE+M group.
圖3HE染色觀察右美托咪定對各組肝組織病理學改變及肝損傷評分的影響
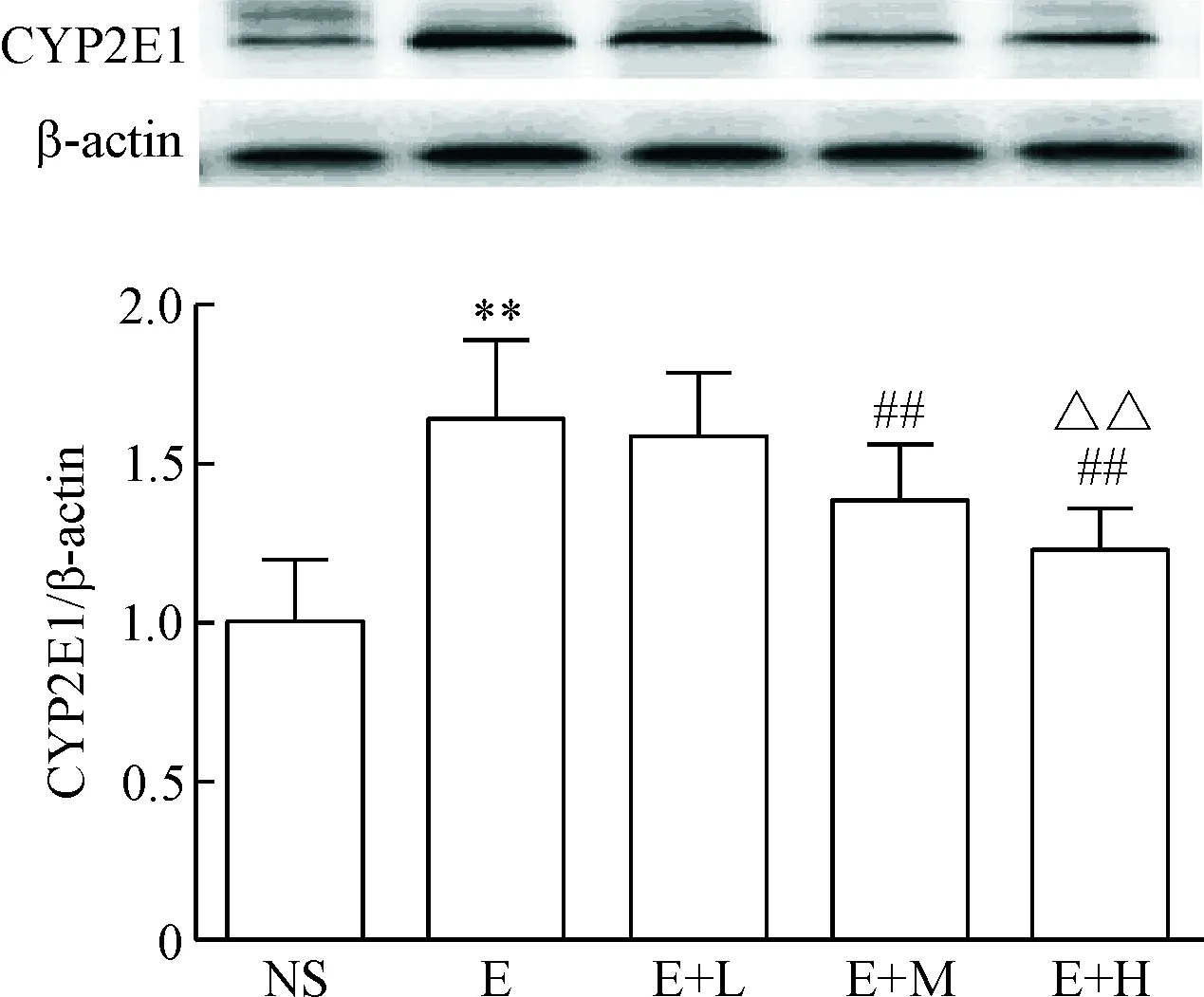
Figure 4. The effect of dexmedetomidine on CYP2E1 expression in the liver of the mice induced by alcohol. Mean±SD.n=10.**P<0.01vsNS group;##P<0.01vsE or E+L group;△△P<0.01vsE+M group.
圖4右美托咪定對各組肝組織CYP2E1表達的影響

Figure 5. The effect of dexmedetomidine on the expression of NF-κB in the liver of the mice induced by alcohol. Mean±SD.n=10.**P<0.01vsNS group;##P<0.01vsE or E+L group;△△P<0.01vsE+M group.
圖5右美托咪定對各組肝組織NF-κB表達的影響
討 論
一次性暴飲建立的急性酒精性肝損傷模型由于造模周期短、易復制, 且與人類豪飲造成的肝損害一致, 是研究急性酒精性肝損傷發病機制的理想模型。本實驗參照以往的研究復制急性肝損傷模型[10]。我們的研究發現,給予50%乙醇(4.8 g/kg)灌胃,可導致血液中ALT、AST和TG明顯升高;病理學顯示炎性細胞浸潤,產生嚴重組織損傷,表明50%乙醇灌胃成功誘導急性肝損傷。本實驗中,給予DEX 中、高劑量治療后,ALT、AST和TG降低,病理學改變減輕,表明DEX劑量依賴性減輕酒精誘導的急性肝損傷。
氧化應激在酒精性肝損傷中扮演重要角色。酒精刺激后,活性氧簇(reactive oxygen species,ROS)的產生是引起肝損害的重要因素[11]。過多的ROS通過損害DNA、蛋白變性等作用損害肝細胞。酒精誘導的ROS與多不飽和脂肪酸產生反應從而破壞細胞膜。在人體,ROS主要由SOD、GSH等酶類和非酶類抗氧化物質清除,以保持ROS濃度的平衡。MDA是機體脂質過氧化的終末產物,間接反映出細胞損傷的程度[12]。我們的研究發現,與對照組相比,酒精導致肝組織SOD活性及GSH含量降低,MDA含量增加,而DEX治療能夠增加SOD活性及GSH含量,降低MDA含量,表明抗氧化及減輕脂質過氧化反應是DEX減輕酒精導致肝損傷的機制之一。在肝臟,CYP2E1可被乙醇誘導并參與乙醇代謝,CYP2E1是一種有效的活性氧產生酶,產生超氧陰離子自由基和過氧化氫,是酒精導致的肝氧化應激的主要因素[13]。為了進一步探討DEX抗氧化機制,我們觀察了Dex對CYP2E1表達的影響。我們的研究發現,DEX治療抑制酒精誘導的CYP2E1表達,提示DEX的抗氧化作用可能與抑制肝細胞CYP2E1表達有關。
目前研究表明,乙醇誘導的氧化應激反應能增加腸黏膜的通透性及破壞腸上皮細胞的完整性,導致腸源性內毒素進入血液循環,激活肝細胞釋放TNF-α、IL-1β等炎癥因子,誘導肝炎性反應,進一步加重肝組織損傷,這也是酒精性肝損傷的重要發病機制[14]。TNF-α是炎性反應的促發因子,TNF-α激活后,其它炎性細胞因子相繼激活。研究表明,TNF-α、IL-1β在肝損傷中發揮重要作用[15-16]。臨床研究結果表明,血清TNF-α、IL-1β水平與酒精性肝疾病的肝功能和預后有關[17]。我們的研究發現,模型組小鼠肝臟炎癥因子TNF-α和IL-1β明顯升高,而Dex治療能降低肝組織TNF-α和IL-1β的濃度,表明抑制肝臟炎性反應是DEX減輕酒精誘導的肝損傷機制之一。NF-κB是調控包括TNF-α在內的諸多促炎分子基因表達的重要轉錄因子[18]。以往的研究表明,NF-κB活化在酒精灌胃加高脂飲食誘導的肝損害中可能起重要作用[19]。最近研究發現,NF-κB在酒精誘導的肝損傷中起重要作用[20]。我們的研究發現,酒精誘導肝組織NF-κB表達增加,而DEX治療抑制NF-κB的表達,提示DEX抑制炎性反應與抑制NF-κB的表達有關,因而抑制NF-κB的活性對酒精誘導的肝損傷也是有益的。
總之,DEX通過抗炎和抗氧化作用減輕酒精誘導的小鼠急性肝損傷,且呈劑量依賴性,其機制可能與抑制CYP2E1和NF-κB的表達有關。
[1] 于晨輝, 杜仲燕, 高 佳, 等. 4-HNE通過抑制TNF-α介導的NF-κB活化誘導酒精性肝損傷[J]. 中國病理生理雜志, 2013, 29(6):1046-1052.
[2] Liu Y, Wang J, Li L, et al. Hepatoprotective effects ofAntrodiacinnamomea: the modulation of oxidative stress signaling in a mouse model of alcohol-induced acute liver injury[J]. Oxid Med Cell Longev, 2017, 2017:7841823.
[3] Cai X, Yan A, Fu N, et al.Invitroantioxidant activities of enzymatic hydrolysate fromSchizochytriumsp. and its hepatoprotective effects on acute alcohol-induced liver injuryinvivo[J]. Mar Drugs, 2017, 15(4):E115.
[4] Chen C, Qian Y. Protective role of dexmedetomidine in unmethylated CpG-induced inflammation responses in BV2 microglia cells[J]. Folia Neuropathol, 2016, 54(4):382-391.
[5] 萬林駿, 黃青青, 岳錦熙, 等.右美托咪啶與咪達唑侖用于外科重癥監護病房術后機械通氣患者鎮靜的比較研究[J]. 中國危重病急救醫學, 2011, 23(9):543-546.
[6] Peng M, Wang YL, Wang CY, et al. Dexmedetomidine attenuates lipopolysaccharide-induced proinflammatory response in primary microglia[J]. J Surg Res, 2013, 179(1):e219-e225.
[7] Sezer A, Memis D, Usta U, et al. The effect of dexmedetomidine on liver histopathology in a rat sepsis model: an experimental pilot study[J]. Ulus Travma Acil Cerrahi Derg, 2010, 16(2):108-112.
[8] Sen V, Güzel A,en HS, et al. Preventive effects of dexmedetomidine on the liver in a rat model of acid-induced acute lung injury[J]. Biomed Res Int, 2014:621827.
[9] Tüfek A, Tokg?z O, Aliosmanoglu I, et al. The protective effects of dexmedetomidine on the liver and remote organs against hepatic ischemia reperfusion injury in rats[J]. Int J Surg, 2013, 11(1):96-100.
[10] 齊慧慧, 宋 佳, 陳岳祥. 小鼠急性酒精性肝損傷模型的建立[J]. 世界華人消化雜志, 2012, 20(9):759-763.
[11] Das SK, Vasudevan DM. Alcohol-induced oxidative stress[J]. Life Sci, 2007, 81(3):177-187.
[12] Li G, Ye Y, Kang J, et al. L-Theanine prevents alcoholic liver injury through enhancing the antioxidant capability of hepatocytes[J]. Food Chem Toxicol, 2012, 50(2):363-372.
[13] Butura A, Nilsson K, Morgan K, et al. The impact of CYP2E1 on the development of alcoholic liver disease as studied in a transgenic mouse model[J]. J Hepatol, 2009, 50(3):572-583.
[14] Mandrekar P, Szabo G. Signalling pathways in alcohol induced liver inflammation[J]. J Hepatol, 2009, 50(6):1258-1266.
[15] Candel S, de Oliveira S, López-Muoz A, et al. TNFα signaling through TNFR2 protects skin against oxidative stress-induced inflammation[J]. PLoS Biol, 2014, 12(5):e1001855.
[16] 張海云, 常香榮. 黃芪甲苷通過抑制JAK2/STAT3信號通路減輕重癥急性胰腺炎大鼠肝損傷[J]. 中國病理生理雜志, 2016, 32(6):984-989.
[17] Chen YL, Peng HC, Hsieh YC, et al. Epidermal growth factor improved alcohol-induced inflammation in rats[J]. Alcohol, 2014, 48(7):701-706.
[18] Nie Y, Lu YX, Lv LH. Effect of propofol on generation of inflammatory mediator of monocytes[J]. Asian Pac J Trop Med, 2015, 8(11):964-970.
[19] 馬曉燕, 司英奎, 韓雪霖. 脂肪性肝病中NF-κB活性變化及其意義[J]. 中國病理生理雜志, 2007, 23(11):2276-2271.
[20] da Silva BS, Rodrigues GB, Rocha SW, et al. Inhibition of NF-κB activation by diethylcarbamazine prevents alcohol-induced liver injury in C57BL/6 mice[J]. Tissue Cell, 2014, 46(5):363-371.
(責任編輯: 林白霜, 羅 森)
Dexmedetomidineattenuatesacutealcoholichepaticinjuryinmice
HUANG Qiang1, XIA Ming-zhu2,YANG Wen-jie1, DAI Zhong-liang1, JIANG Yuan-xu1
(1DepartmentofAnesthesiology,ShenzhenPeople’sHospital,ShenzhenAnesthesiologyEngineeringCenter,2HubeiCommunityHealthServiceCenter,LuohuHospitalgroup,Shenzhen518020,China.E-mail: 13613051840@163.com)
AIM: To investigate the effects of dexmedetomidine (DEX) on acute alcoholic hepatic injury in mice and to explore the possible mechanisms.METHODSKunming mice (n=50) were randomly divided into 5 groups (n=10): normal saline control (NS) group, acute alcoholic hepatic injury model (E) group, low-dose (10 μg/kg) DEX (E+L) group, medium-dose (50 μg/kg) DEX (E+M) group and high-dose (100 μg/kg) DEX (E+H) group. The animals were sacrificed at 6 h after gavage of alcohol or normal saline. The levels of alanine aminotransferase (ALT), aspartate aminotransferase (AST), triglyceride (TG), malondialdehyde (MDA), glutathione (GSH) and superoxide dismutase (SOD) were measured. The livers were removed for evaluation of histological characteristics and determining the content of tumor necrosis factor-α (TNF-α) amd interleukin-1β (IL-1β) in the liver tissues by ELISA. The expression levels of cytochrome P450 2E1 (CYP2E1) and nuclear factor -κB (NF-κB) in the liver tissues were evaluated by Western blot.RESULTSCompared with NS group, the levels of ALT, AST and TG were obviously increased in E group, which were obviously decreased in E+M and E+H groups. Compared with NS group, the levels of TNF-α, IL-1β and MDA were obviously increase in E group, which were obviously decreased in E+M and E+H groups. Compared with NS group, the activity of SOD and the content of GSH were obviously decreased in E group, which were obviously increased in E+M and E+H groups. Compared with NS group, the expression of CYP2E1 and NF-κB was obviously increase in E group, which was obviously decreased in E+M and E+H groups. Compared with NS group, ethanol induced marked liver histological injury, which was less pronounced in E+M and E+H groups.CONCLUSIONDEX has a protective effect on mouse liver with acute alcoholic injury by the involvement in the processes of antioxidation and antiinflammation, and its mechanism may be associated with the inhibition of CYP2E1 and NF-κB expression.
Dexmedetomidine; Alcoholic hepatic injury; Cytochrome P450 2E1; Nucler factor-κB
R575.1; R965
A
10.3969/j.issn.1000- 4718.2017.10.026
1000- 4718(2017)10- 1891- 05
2017- 03- 13
2017- 07- 06
深圳市科技研發基金資助項目(No. JCYJ20160422142317026)
△通訊作者 Tel: 0755-22948275; E-mail: 13613051840@163.com
雜志網址: http://www.cjpp.net

