NDA208542-Rociletinib的FDA審評案例分析
安 娜,唐健元
(國家食品藥品監督管理總局藥品審評中心 北京 100038)
NDA208542-Rociletinib的FDA審評案例分析
安 娜,唐健元*
(國家食品藥品監督管理總局藥品審評中心 北京 100038)
肺癌是全球死亡率最高的惡性腫瘤,其中非小細胞肺癌(Non-small Cell Lung Cancer,NSCLC)占85%。表皮生長因子受體(Epidermal Growth Factor Receptor,EGFR)基因是NSCLC中最常見的驅動基因之一。人表皮生長因子受體酪氨酸激酶抑制劑(Epidermal Growth Factor Receptor Tyrosine Kinase Inhibitors,EGFRTKIs)給EGFR基因敏感突變患者的治療帶了突破性進展。但是,EGFR-TKIs的耐藥性問題日益突出,臨床急需用于EGFR-TKI治療中或治療后出現進展并伴有EGFR T790M陽性突變的NSCLC患者的治療藥物。洛奇替尼(Rociletinib)擬定位于解決這一尚未被滿足的臨床需求,但是由于本品的有效性并不優于已上市的同類藥物,存在較高的安全性風險(高血糖、QT間期延長和猝死),且給藥劑量未被美國食品藥品監督管理局(Food and Drug Administration,FDA)認可,最終未能上市。本文從審評角度分析和總結本案例的經驗教訓,供業界爭鳴。
非小細胞肺癌 美國食品藥品監督管理局 審評審批 案例分析 新藥上市申請 精準醫學
肺癌是全球死亡率最高的惡性腫瘤,每年大約有150萬人死于肺癌[1]。在美國,高達85%的肺癌是非小細胞肺癌(NSCLC),在被確診的患者中大部分發現時已是ⅢB和Ⅳ期(進展期或轉移的)NSCLC[2]。以往對NSCLC的治療均采用鉑類等化療藥物,療效不盡如人意。隨著精準醫學概念的提出,“個性化治療”這個觀念逐漸被人們認可。研究表明,接近15%的NSCLC轉移患者出現表皮生長因子受體(EGFR)激活突變,因此把伴有EGFR突變的NSCLC患者作為一個獨立的治療亞群。針對EGFR突變的靶向治療藥物迅猛發展,以吉非替尼(Gefitinib)、厄洛替尼(Erlotinib)、埃克替尼(Icotinib)為代表的第一代和以阿法替尼(Afatinib)為代表的第二代表皮生長因子受體酪氨酸激酶抑制劑(EGFR-TKIs)已成為EGFR突變型晚期NSCLC的重要治療手段。多項前瞻性研究表明,EGFR突變的晚期NSCLC患者經EGFR-TKIs治療后客觀緩解率(Objective Response Rate,ORR)和無疾病進展時間(Progression Free Survival,PFS)的獲益遠超化學治療[3-8]。EGFR基因突變的NSCLC對已批準上市的EGFR抑制劑敏感,但藥物的耐藥性問題日益突出。研究發現應用EGFR-TKI治療的NSCLC患者出現獲得性耐藥的患者中50%可檢測到T790M突變[9]。對EGFR-TKI治療中或治療后出現進展并伴有EGFR T790M陽性突變的NSCLC患者的治療存在未被滿足的臨床需求。
洛奇替尼(Rociletinib)是克洛維斯腫瘤(Clovis Oncology)有限公司研發的新藥,用于治療EGFR-TKI治療中或治療后出現進展并伴有EGFR T790M陽性突變的NSCLC患者,為第三代EGFR-TKI藥物,本適應癥獲得美國食品藥品監督管理局(FDA)的加速批準認定。但是基于本品在確證性臨床試驗中的有效性、安全性數據和劑量問題,2016年4月12日,美國FDA抗癌藥專家委員會以12∶1的投票結果反對Rociletinib批準上市。本文從審評角度結合Rociletinib的FDA專家委員會材料[10],分析和總結本案例的經驗教訓,以供各位同仁思考和借鑒。
1 Rociletinib的作用機制
研究發現,EGFR突變患者中發生頻率最高的突變是EGFR受體酪氨酸激酶區域外顯子19氨基酸缺失和外顯子21點突變(EFGRL858R:EGFR受體酪氨酸激酶區域亮氨酸858突變為精氨酸)[11],這兩種突變占EGFR突變的85%。Rociletinib通過與EGFR的突變進行不可逆結合并抑制信號發送,如外顯子21L858R替換,外顯子19缺失以及T790M耐藥性突變。
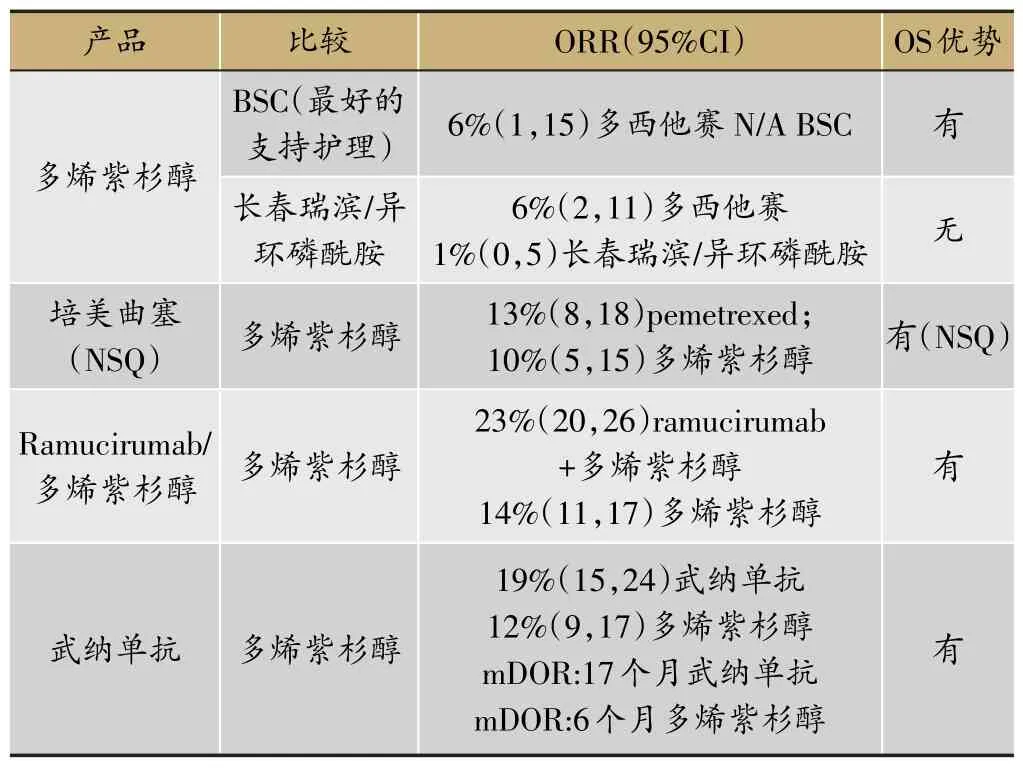
表1 2nd-Line轉移性NSCLC(非小細胞癌)的可用治療策略
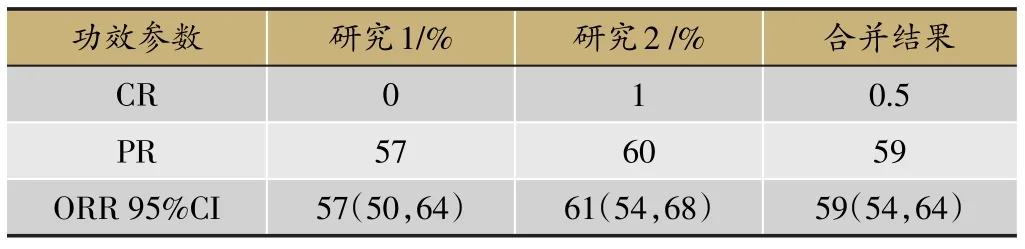
表2 奧希替尼功效研究結果(n=210)
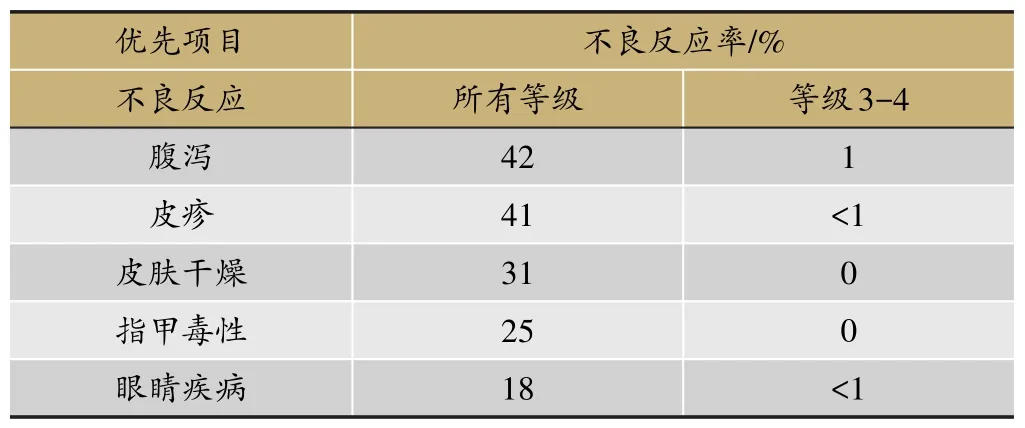
表3 奧希替尼常見不良反應(n=411)

表4 Rociletinib監管里程碑
2 Rociletinib的擬定適應癥
Rociletinib的適應癥人群為EGFR T790M突變陽性的NSCLC患者,此類人群在之前進行過EGFR靶點治療并且經已獲FDA批準的檢測方法檢測到EGFR T790M突變。基于本品的ORR和反應持續時間(Duration of Response,DoR)的數據,本適應癥獲得FDA的加速批準認定。但對于本適應癥的后續上市注冊審批,仍然需要依據確證性臨床試驗中臨床獲益的描述和驗證性結果。
2.1 非小細胞肺癌(NSCLC)
在美國,因肺癌導致癌癥死亡的原因較多,其中非小細胞肺癌患者約占肺癌患者的85%,
表皮生長因子受體突變的非小細胞肺癌患者在美國人群中約占10%-15%,而亞洲人群則高達30%-50%。
2.1.1 EGFR突變-NACLC治療藥物EGFR-TKIs
FDA批準的表皮生長因子受體突變的非小細胞肺癌治療藥物表皮生長因子受體-酪氨酸激酶抑制劑EGFR TKIs包括吉非替尼、厄洛替尼和阿法替尼,這類藥物治療與化學治療藥物相比,治療效果有所改善。但部分患者獲得了EGFR-TKIs耐藥性,服藥患者中的50%-60%患者發生T790M突變。已經批準的EGFR-TKIs對此部分患者無效,因此患者需要進行NSCLC2nd-Line治療(表1)。
2.1.2 EGFR突變-NSCLC的其他治療藥物
奧希替尼(Osimertinib)是新一代不可逆性EGFRTKI,對EGFR敏感突變和T790M耐藥突變均有更好的作用,也是目前唯一獲得美國FDA批準上市,用于治療EGFR-TKI治療中或治療后出現進展并伴有EGFR T790M陽性突變的NSCLC患者。多項臨床試驗結果充分證實了奧希替尼治療一線EGFR-TKI治療失敗且T790M突變陽性的晚期NSCLC患者的療效優于化療,最常見的≥3級以上的藥物不良反應為腹瀉、皮疹和皮膚干燥。其有效性結果和藥物不良反應如下(表2、表3)。
3 Rociletinib臨床試驗
Rociletinib藥物研究審批與監管過程如表4所示。
3.1 藥物使用劑量出現分歧
FDA與申請人存在的主要分歧是藥物的使用劑量,申請人反復提出的確認劑量為500 mg和625 mg。2015年4月,新英格蘭雜志(The New England Journal of Medicine)發表了Rociletinib進行的CO-1686-008(TIGER-X)臨床試驗,初步研究結果提示:未經確認的T790M陽性500 mg組Rociletinib治療的客觀緩解率(Objective Relapse Rate,ORR)為60%,625 mg組ORR為54%[12]。故申請人提出的建議劑量為500 mg,每日兩次。之后的CO-1686-019(TIGER-2)試驗顯示500mg組ORR為28%,625 mg組ORR為34%。申請人通過評估TIGER-X,TIGER-2兩個試驗中主要療效指標——ORR的結果,將劑量改為625 mg,每日兩次。但是,2016年2月FDA指出藥物代謝動力學試驗數據不支持625 mg的使用劑量。于是,2016年3月,申請人修改了采用開放、隨機、多中心臨床試驗設計的確證性試驗CO-1686-020(TIGER-3)的分組情況,在原500 mg劑量組和對照組的基礎上加入625 mg劑量組,以驗證625 mg劑量選擇的科學性。遺憾的是2016年5月,申請人終止了該項臨床試驗,也終止了Rociletinib的研發進程。
3.1.1 Rociletinib溶解度特性
在整個臨床試驗的分析過程中,確定主要獲益人群和主要療效終點非常重要。除此之外,藥物代謝關系的分析亦不容忽視,此為后期藥效關系以及整個療效評價的基石。藥代的個體差異性很大,穩態下的血液暴露量最高可達79%CV,半衰期很短,為3.7 h。但化合物溶解度很低,在pH>2時幾乎不溶。飲食對此也有影響,高脂肪飲食能夠增加54%AUC,藥物需要與食物一起服用。藥物代謝過程主要是酰胺水解和N-乙酰化作用(圖1)。
3.1.2 基于可利用的數據確定Rociletinib的合適劑量
FDA與公司所得試驗結果差異較大,FDA的結果進行了過二次確認,同時試驗的總人群存在有區別,并且數據讀取的方式不一樣。兩者標準的不同導致最后結果數據出現了差異。此次分析中,FDA將不同劑量安全性和有效性的數據匯總在一起進行比較,這種比較方法可以對Rociletinib腫瘤治療效果的有效性進行合理評估。結果顯示,藥物500-1000 mg BID劑量與血液暴露量關系變化趨勢平緩(非線性藥代動力學)。暴露量與有效性的關系變化趨勢平緩(圖2),暴露于高劑量Rociletinib的患者并不一定有更好的獲益。而有毒代謝物暴露量與安全性的關系變化趨勢較大(圖3),具有較高代謝物暴露量的患者QTc延長(與M460相關)和高血糖風險(與M502相關)增加。
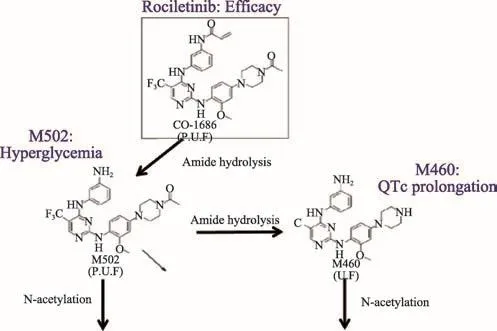
圖1 Rociletinib生物轉化途徑
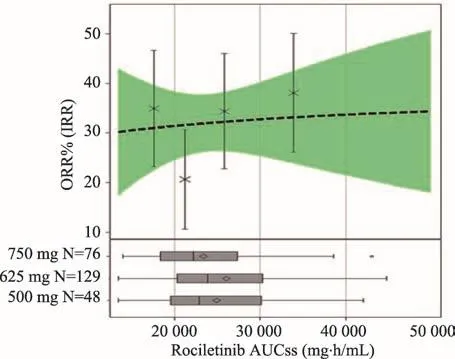
圖2 Rociletinib血液暴露量與有效性間關系
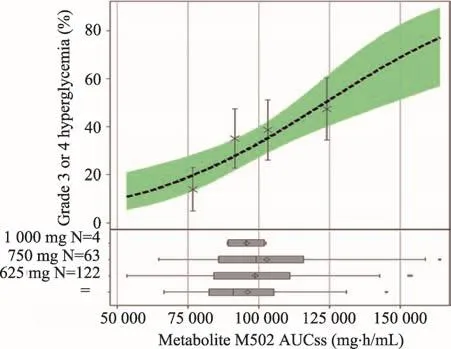
圖3 Rociletinib血液暴露量與安全性間關系
4 Rociletinib安全性
4.1 QTc延長與代謝物M460血液濃度具有相關性
將QTc信息綜合分析,從延長比例來看,可以看到QTcF≥450 ms的安全人群占63%,QTcF≥501 ms的安全人群占13%絕對值變化>30 ms的安全人群占76%,絕對值變化>60 ms的安全人群占34%。總的臨床結果調查顯示,有5例受試者出現了嚴重的心律失常甚至猝死。同時按照N-乙酰基轉移酶2基因多態性分成的快代謝、中等、慢代謝人群進行分析可以看出快代謝人群的有毒代謝物M460血液濃度最低,并且也存在QTc延長現象,慢代謝人群的有毒代謝物M460的血液濃度最高。最嚴重的QTc延長超過了60 ms,快代謝人群發生率為22.9%,但是慢代謝人群發生率則達到了51%,所以有毒代謝物M460血液濃度與QTc延長具有相關性。體外實驗也支持這一結論。
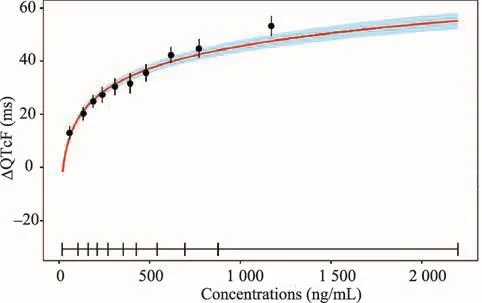
圖4 QTc延長與代謝物M460血液濃度的關系
4.2 Rociletinib安全性堪憂
2016年,美國臨床腫瘤學會(American Society of Clinical Oncology,ASCO)報道的研究結果顯示Rociletinib所有劑量組的平均ORR為33.9%,接受Rociletinib治療后,經血液、組織、尿液的任一標本類型檢測出的T790M突變陽性患者的ORR分別為32.1%、33.9%和36.7%其ORR緩解率相似。但在安全性方面,入組的548例患者中有35.2%的患者出現3級以上高血糖,10.2%的患者出現3級以上QT間期延長[13]。
在本品臨床試驗中,51%的受試者進行了劑量降低,最常見原因為高血糖(22%)和QTc延長(11%);47%的受試者出現了嚴重不良反應事件(Serious Adversary Event,SAE),需要特別關注QT間期延長和高血糖。對市場上流通的其他腫瘤治療藥物進行比較分析,在某些情況下,QTc延長并不是一件影響很大的事情,目前可導致QTc延長的許多相關藥物也都已獲得批準。Rociletinib針對的適應癥是NSCLC,本身是非常有臨床價值和優勢的,但QT>500 ms的發生率為13%,遠遠高于其他所有已獲批的腫瘤治療藥物,并且出現了1例尖端扭轉型室性心動過速,2例和猝死。與此相比,治療同一適應癥的奧希替尼,其QT>500 ms的發生率僅有0.2%,因此,Rociletinib的安全性堪憂,特別是在QTc延長方面,與同類藥物相比處于明顯劣勢。對于高血糖來講,由快代謝、中等和慢代謝可以清晰地看到,不管是從一般高血糖還是嚴重高血糖進行分析均可以分析,其發生率與N-乙酰基轉移酶2以及毒性代謝物M502的血液濃度都是密切相關的。
5 FDA審評意見
綜上所述,FDA認為Rociletinib在有效性方面,經正確的數據分析后的ORR只有30.2%,進一步將所有數據鋪在一起分析結果顯示,其ORR大約只有25%,DoR為8.9個月;在安全性方面,本品存在嚴重以及危及生命的不良反應。由于本品進行的是單組研究,所以其真正的發病率未知,同時其有毒代謝物暴露量因為受N-乙酰基轉移酶2(N-acetyltransferase 2,NAT2)基因多態性的影響而具有個體間差異大的特性。對于藥物的使用劑量,申請人提出的625 mg使用劑量也并未得到認同,其劑量改動比率較高,并且<500 mg劑量的數據非常有限。
FDA對Rociletinib(NDA208542)的審評意見為,從有效性角度分析,它是有活性的,但可能并不優于已上市的同類藥品。在安全性方面,提倡從機理角度去解釋和分析出現QT間期延長現象的人群差異。此外,在劑量選擇上,FDA并不同意申請人現在所提出的625 mg的使用劑量。對于此藥物,FDA的最后審評意見是在最終試驗結果出來以后,再確定審批結果。2016年4月12日,美國FDA抗癌藥專家委員會以12:1的投票結果反對Rociletinib批準上市。
5.1 關于藥物暴露量和有效性的報告
部分數據分析結果顯示,625 mg與500 mg劑量相比,625 mg的血液濃度有時反而較低,這種高劑量代謝物比低劑量的血液濃度反倒更低的現象的出現,是因為慢代謝、快代謝人群分布的差異。若試驗過程中,將這兩種人群進行平衡,使慢代謝和快代謝均勻分布,其血液濃度差異應該消除。在研究的血漿暴露量范圍內,血漿暴露量和它的療效基本是平行線,是因為療效已經達到最大限度,或者說是量效關系的平臺區。
5.2 試驗人群細分之結果利弊觀
不同的代謝方式酶的基因多態性會影響藥物血漿暴露量從而影響安全性和療效,不同種族間這種基因多態性是有差異的,FDA曾發布過一個不同地區的種族敏感性分析數據,要求2017年5月份之后提交的數據都要對種族或者民族進行分層,這方面可能對中國國內的國際多中心類的研究有一個很好的借鑒。
之前對國際多中心臨床試驗進行人群標記時較為模糊,現在就可以對不同種族和地區的人群進行標記。但這種更為詳細的劃分方法,從亞群的統計分析上來說可能會較為困難。樣本量太小,可能不具有普遍性,與整體人群差別較大,若出現此類異常結果,可嘗試從藥代、臨床藥理等角度進行分析反駁。從總體來講,注意大數據與小數據結果的有效整合更有利于試驗結果的透徹分析。
6 總結與展望
在本案例中,Rociletinib失敗的原因除了有效性、安全性和劑量選擇方面的缺陷,筆者認為另一不容忽視的問題是EGFR-TKI耐藥機制的復雜性,并不是所有EGFR-TKI耐藥都是由T790M突變產生。因此,多途徑挖掘并找到精準的適應癥人群才能做到真正的個體化精準治療。雖然,Rociletinib的上市注冊申請以失敗而告終,但該項研究對T790M突變的檢測經驗仍值得借鑒。T790M血液、組織和尿液檢測可相互補充,每種標本檢測均可發現其他標本未檢測出的病例,而且無論哪種標本檢測出的T790M陽性患者,接受Rociletinib治療,緩解率均相似,說明血液和尿液EGFR突變檢測應被視為可行的方法,在腫瘤組織無法獲得的情況下這種方法尤其值得推廣。
致謝:本文根據王亞寧博士在“思與行——精準醫療下的中藥研發及評價”系列講壇中的報告整理,并得到王博士的指導,非常感謝王博士的支持!
1 Jemal A,Bray F,Center M M,et al.Global cancer statistics.CA-Cancer J Clin,2011,61(2):69-90.
2 Houston K A,Henley S J,Li J,et al.Patterns in lung cancer incidence rates and trends byhistologic type in the United States,2004-2009.Lung Cancer,2014,86(1):22-28.
3 Mok T S,Wu Y L,Thongrasert S,et al.Gefitinib or carboplatinpaclitaxelin pulmonary adenocarcionoma.N Engl J Med,2009,361(10):947-957.
4 Maemondo M,Inoue A,Kobayashi K,et al.North-East Japan Study Group.Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR.N Engl J Med,2010,362(25):2380-2388.
5 Zhou C,Wu Y L,Chen G,et al.Erlotinib versus chemotherapy as firstline treatment for patients with advanced EGFR mutation-positive nonsmall cell lung cancer(OPTIMAL,CTONG-0802):a multicentre,openlabel,randomised,phase 3 study.Lancet Oncol,2011,12(8):735-742.
6 Rosell R,Carcereny E,Gervais R,et al.Spanish Lung Cancer Group in collaboration with GroupeFrancais de Pneumo-Cancerologie and AssociazioneItaliana Oncologis Toracica.Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer(EURTAC):amulticentre,open-label,randomised phase 3 trial.Lancet Oncol,2012,13(3):239-246.
7 Seauist L V,Yang J C,Yamamoto N,et al.Phase III study of afatinibor cisplat in plus pemetrexed in pat ient s with met a st at ic lungadenocarcinoma with EGFR mutations.J Clin Oncol,2013,31(27):3327-3334.
8 Yang J C,Wu Y L,Schuler M,et al.Afatinib versus cisplatin-based chemotherapy for EGFR mutation-positive lung adenocarcinoma(LUXLung3 and LUX-Lung 6):analysis of overall survival data from two randomised,phase 3 trails.Lancet Oncol,2015,16(2):141-151.
9 Wang S,Song Y,Yan F,et al.Mechanisms of resistance to third generation EGFR tyrosine kinase inhibitors.Front Med,2016,10(4):383-388.
10 Lola Fashoyin-Aje,Chao Liu.NDA 208542-Rociletinib FDA Presentation,Food and Drug Administration,2016.https://www.fda.gov/downloads/advisorycommittees/committeesmeetingmaterials/drugs/oncologicdrugsadvisorycommittee/ucm496630.pdf
11 Lynch T J,Bell D W,Sordella R,et al.Activating mutations in the epidermal growth factor receptor underlying responsiveness of nonsmall-cell lung cancer to gefitinib.N Engl J Med,2004,350(21):2129-2139.
12 Sequist L V,Soria J C,Goldman J W,et al.Rociletinib in EGFR-mutatednon-small-cell lung cancer.N Engl J Med,2015,372(18):1700-1709.
13 Wakelee H A,Gadgeel S M,Goldman J W,et al.Epidermal growth factor receptor(EGFR)enotyping of matched urine,plasma and tumor tissue from non-small cell lung cancer(NSCLC)patients(pts)treated with rociletinib.J Clin Oncol,2016,34(suppl):abstr 9001.
Analysis of FDA’s Review for NDA208542-Rociletinib
An Na,Tang Jianyuan
(Center for Drug Evaluation,China Food and Drug Administration,Beijing 100038,China)
Lung cancer is the highest mortality rate of malignancies in the world.Among them,non-small cell lung cancer(NSCLC)accounts for 85%.Epidermal growth factor receptor(EGFR)gene is one of the most common driving genes in NSCLC.The EGFR tyrosine kinase inhibitors(EGFR-TKIs)bring a breakthrough in the treatment for patients with EGFR gene-sensitive mutations.However,the drug resistance problem of EGFR-TKIs has been increasingly highlighted.So a drug for the patients accompanied by EGFR T790M positive mutation and along with progression in or after treatment with EGFR-TKI NSCLC is clinically urgent needed.Rociletinib is designed to address this unmet clinical need.While considering the non-superior effectiveness to the similar drugs in the market and the high risk of safety(hyperglycemia,QT prolongation and sudden death)of Rociletinib,the dosage was not accepted by the Food and Drug Administration(FDA).And Rociletinib did not make it to the market eventually.This paper discussed lessons learned from this case under review perspective for reference and inspiration.
Non-small cell lung cancer,U.S.Food and Drug Administration,review and approval,case analysis,new drug application,precision medicine
10.11842/wst.2017.07.001
R951
A
2017-07-10
修回日期:2017-07-20
* 通訊作者:唐健元,研究員,主要研究方向:藥品監管科學、政策法規和臨床評價。
(責任編輯:馬雅靜,責任譯審:王 晶)

