DEHP對土壤蚯蚓氧化脅迫及DNA損傷的研究*
劉文軍 高健鵬 王冠穎 朱魯生 王金花 王 軍
(山東農業大學資源與環境學院,山東省高校農業環境重點實驗室,山東泰安 271018)
DEHP對土壤蚯蚓氧化脅迫及DNA損傷的研究*
劉文軍 高健鵬 王冠穎 朱魯生 王金花 王 軍?
(山東農業大學資源與環境學院,山東省高校農業環境重點實驗室,山東泰安 271018)
土壤環境中的酞酸酯污染日益嚴重,為了探討和分析典型酞酸酯鄰苯二甲酸二(2-乙基己基)酯(Di(2-ethylhexyl)phthalate,DEHP)對土壤動物的生態毒理效應,以赤子愛勝蚓為指示生物,暴露于DEHP濃度為CK、0.1、1、10、50 mg kg-1人工土壤中,并于染毒后的7、14、21、28d取樣測定。通過蚯蚓體內的超氧化物歧化酶(SOD)、過氧化氫酶(CAT)、過氧化物(POD)、谷胱甘肽轉移酶(GST)等指標反映DEHP對蚯蚓的氧化激活程度,通過活性氧自由基(ROS)的含量反映DEHP對蚯蚓的細胞毒性,通過丙二醛(MDA)含量和Olive尾矩反映DEHP對蚯蚓的遺傳毒性,從多個角度評價DEHP對蚯蚓的生態毒理效應。結果表明:(1)在DEHP的刺激下,各濃度組蚯蚓的SOD、CAT、POD、GST活性均呈激活狀態,表明DEHP對蚯蚓的抗氧化酶有誘導作用;(2)DEHP影響蚯蚓的ROS含量,各染毒處理組與對照組相比均升高且差異性明顯,表現出明顯的劑量—效應關系;(3)對比各染毒處理組之間的數據,DEHP對蚯蚓MDA含量的影響無明顯規律;(4)DEHP可使蚯蚓GST呈激活狀態,表明中高濃度的DEHP對蚯蚓GST具有誘導作用;(5)DEHP能夠引起蚯蚓體腔細胞DNA的損傷,且隨著濃度的增加,Olive尾矩值隨之增加,說明DNA 損傷程度與DEHP濃度之間具有劑量-效應關系。從實驗結果可以看出,DEHP可以對蚯蚓機體和DNA造成一定程度的損傷,表現出較強的生態毒理效應。
鄰苯二甲酸二(2-乙基己)酯;抗氧化酶系;谷胱甘肽巰基轉移酶;丙二醛;活性氧;彗星實驗
鄰苯二甲酸酯(Phthalatic acid esters,PAEs)又稱酞酸酯,根據其烷基鏈的不同共有二十多種,其中鄰苯二甲酸二(2-乙基己基)酯(Di(2-ethylhexyl)phthalate,DEHP,[CAS 117-81-7])是使用范圍最廣、產量最大的一種增塑劑,約占塑化劑產量的75%,是鄰苯二甲酸酯類增塑劑中最重要的一種化合物[1-5]。研究表明,我國農業土壤中PAEs含量已經達到mg kg-1數量級[6-7]。在北方地區設施菜地土壤中DEHP的平均含量達到0.75~29.37 mg kg-1[8],其在土壤中降解速度較慢,半衰期為70d左右[9],并且具有類雌性激素的作用,會對土壤生態環境,尤其是土壤動物產生一定的影響。DEHP可能對生物造成多種危害,但其在生物體內的代謝復雜,生物毒性不易監測,因此DEHP的毒性研究越來越受到人們的關注,其生態毒理效應研究也是環境領域的熱點之一。近年來,DEHP對土壤微生物、水生生物與哺乳動物的研究已有較多報道[10-12],而關于DEHP對土壤無脊椎動物蚯蚓生態毒性效應的研究則相對較少。
蚯蚓是土壤中生物量最大的無脊椎動物,約占據土壤動物生物總量的60%,它易受到環境有毒有害物質的傷害,常作為污染物檢測的指示生物[13-15]。赤子愛勝蚓(Eisenia foetida)繁殖率高、適應性強,是國際上蚯蚓毒性試驗常用的品種。為了盡可能模擬蚯蚓生活的真實環境,并消除由于土壤差異而帶來的影響,采用人工土壤OECD進行實驗[16]。本研究以DEHP為研究對象,選取赤子愛勝蚓為指示生物,從氧化損傷和遺傳毒性的角度評價DEHP對蚯蚓的毒理效應,以評估DEHP的生態安全性,為全面認識PAEs對土壤的生態風險提供了數據支撐,對維持土壤生態系統的健康持續發展具有重要的意義。
1 材料與方法
1.1 材料與試劑
供試土壤為按OECD(2004)標準配制的人工土壤,其組成為:10%的泥炭蘚土,20%的高嶺黏土(高嶺土大于50%),70%的石英砂;混合均勻,調節pH至6.0±0.5。供試蚯蚓為赤子愛勝蚓,購于山東農業大學實驗站。試驗前在人工土壤中馴養一段時間,選取環帶明顯且大小較一致的健康成蚓進行試驗。
試驗試劑:D E H P標準品,純度≥9 9%(Sigma公司,美國);丙酮,分析純(天津永大);牛血清蛋白(Salarbio公司);考馬斯亮藍(G-250);L-甲硫氨酸(Salarbio公司);氮藍四唑(上海恒星);核黃素(上海藍季);愈創木酚(國藥集團);還原型谷胱甘肽,純度>98%(Salarbio公司);無水乙醇,分析純(天津凱通);愈創木酚甘油醚(Sigma公司);瓊脂糖(Sigma公司)。
1.2 試驗設計
染毒實驗前,用丙酮溶劑配制濃度為10、100、1000、5000 mg L-1的DEHP標準工作溶液。染毒設定濃度:0(CK)、0.1、1、10、50 mg kg-1,染毒由溶劑對照至高濃度依次進行。CK組添加5ml丙酮作為空白對照,其余各處理土樣添加5ml標準工作溶液,每組濃度設置3個重復。染毒時,每個處理用500g人工土,放入10條蚯蚓,置于溫度20℃±1℃,12h光照12h黑暗條件下培養[17]。在設定取樣時間7、14、21、28d將蚯蚓取出后,用生理鹽水沖洗干凈,放于20℃±1℃的培養箱中過夜吐泥,用于實驗測定。
1.3 樣品分析與測定
選擇超氧化物歧化酶(SOD)、過氧化氫酶(CAT)、過氧化物酶(POD)、谷胱甘肽-S-轉移酶(GST)、丙二醛(MDA)用于蚯蚓氧化損傷指標的測定,其中SOD檢測采用氮藍四唑光還原法,CAT檢測采用紫外分光光度計法,POD檢測采用愈創木酚比色法,MDA檢測采用硫代巴比妥酸法,GST檢測采用CDNB比色法。
活性氧自由基(R O S)采用二氯熒光素(DCFH-DA)的方法測定[18-19]。DEHP對蚯蚓體腔細胞DNA損傷的測定采用彗星實驗(Comet Assay)。彗星實驗又稱為單細胞凝膠電泳實驗(SCGE),是一種通過檢測DNA鏈的損傷程度來判別遺傳毒性的技術,具體方法參照文獻[20-21]。
1.4 數據處理
所有數據采用Microsoft Excel2010進行統計、計算與圖形繪制,采用SPSS19.0軟件進行數據的顯著性分析,單因素方差分析(One-way ANOVA)與LSD檢驗被用來分析各處理組與對照組以及各處理組之間的差異,顯著性水平為p<0.05。實驗結果以均數±標準差(mean±SD,n=3)的形式表示。
2 結 果
2.1 DEHP對蚯蚓抗氧化酶系的影響
SOD、CAT和POD的活性結果見圖1。可以看出,經過DEHP染毒之后的蚯蚓的SOD活性總體呈現上升趨勢,可見DEHP對蚯蚓的SOD活性有加強的功能,隨著DEHP濃度的升高,SOD活性呈現出不同程度的增加趨勢。經過不同濃度的DEHP處理后,CAT活性均有不同程度的增加,并且除了50 mg kg-1染毒組CAT活性較前一濃度有所降低外,其余染毒組CAT活性均隨藥劑濃度的升高而逐步上升。DEHP對蚯蚓POD活性有增強的作用,在低濃度條件下,POD活性均隨著濃度的升高呈現上升的趨勢,在高濃度條件下,POD活性增強趨勢較前幾組濃度組偶有降低的情況,因此高濃度DEHP對蚯蚓POD活性的影響與低濃度相似。
2.2 DEHP對蚯蚓MDA含量的影響
MDA含量結果見圖2。可以看出,不同濃度的DEHP對MDA含量較對照組均有提高,并且隨著DEHP濃度的升高,MDA含量整體呈現逐步升高的趨勢,但在染毒階段的前期,DEHP對MDA含量升高趨勢不明顯。總體而言,在整個染毒周期內,蚯蚓MDA含量水平呈升高狀態。

圖1 DEHP對蚯蚓SOD、CAT和POD活性的影響Fig. 1 Effect of DEHP on SOD,CAT andPOD activity in earthworms

圖2 DEHP對蚯蚓MDA含量的影響Fig. 2 Effect of DEHP on content of MDA in earthworms
2.3 DEHP對蚯蚓GST活性的影響
GST活性結果見圖3。如圖所示,除了DEHP濃度為50 mg kg-1處理組外,GST活性均隨藥劑濃度的增加而增強,DEHP對蚯蚓GST活性有促進作用。總體上看,GST活性在染毒初期7、14 d呈激活狀態,隨著染毒時間的增加,GST活性逐漸恢復至對照組水平,第28天時0.1、1 mg kg-1處理組與對照組相比差異性不明顯,10、50 mg kg-1處理組的GST活性激活程度較小。

圖3 DEHP對蚯蚓GST活性的影響Fig. 3 Effect of DEHP on GST activity in earthworms
2.4 DEHP對蚯蚓ROS含量的影響
蚯蚓ROS活性變化結果見圖4。可以看出不同濃度的DEHP對ROS含量均有促進作用,隨著DEHP的濃度升高ROS含量也升高,因此說明蚯蚓ROS含量與DEHP濃度之間存在劑量-效應關系。擬合方程為:第7天,y=31.796ln(x)+457.71,r=0.9904;第14天,y=41.781ln(x)+628.41,r=0.9117;第21天,y=23.414ln(x)+573.26,r=0.9314;第28天,y=27.635ln(x)+631.45,r=0.9764。高濃度處理組的ROS含量于14天時達到最高水平,隨后ROS含量有所回落;在染毒第14天與第21天低濃度0.1 mg kg-1處理組較對照組ROS含量有所升高,但是差異性不明顯。
2.5 DEHP對蚯蚓體腔細胞DNA的損傷
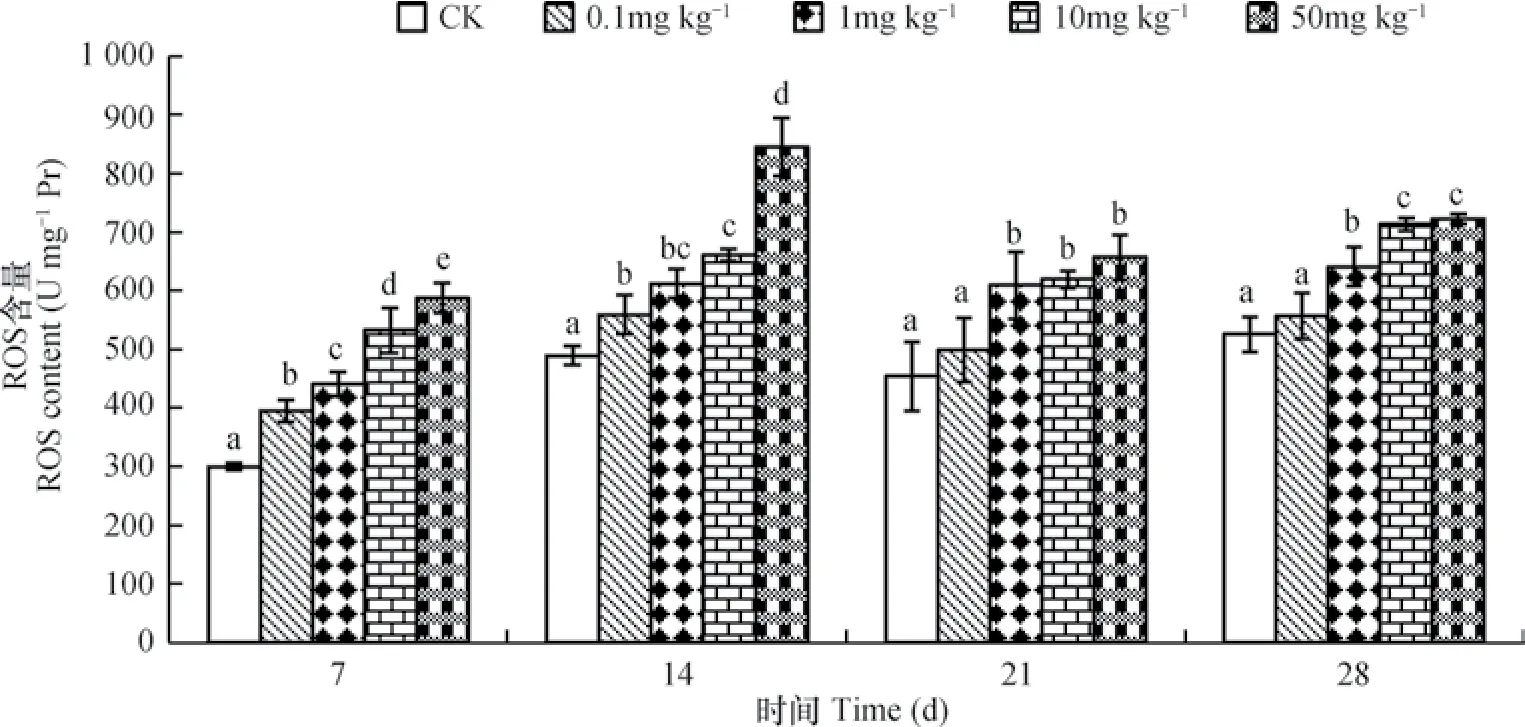
圖4 DEHP對蚯蚓ROS含量的影響Fig. 4 Effect of DEHP on content of ROS in earthworms
各濃度DEHP處理組的載玻片加入EB染色20 min后,用Olympus51熒光顯微鏡觀察,獲取彗星圖像如圖5所示,從圖中可以看出,對照組蚯蚓體腔細胞,細胞核的DNA成團、呈致密圓形,彗頭相對大而幾乎沒有彗尾。染毒處理組可以明顯看到細胞受損,經電泳后DNA斷鏈離開核DNA,產生像彗星一樣的圖像。且隨著染毒濃度增加,細胞核逐漸變得疏松,體積逐漸變大,DNA的遷移量逐漸增加;當濃度增加到10 mg kg-1和50 mg kg-1時,大部分DNA遷移出了細胞核,使細胞核成為一個鏤空的組織,表明DEHP處理能夠引起DNA損傷,且存在劑量-效應關系:第7天,y=1.581ln(x)+4.7441,r=0.9991;第14天,y=1.5794ln(x)+4.9675,r=0.9953;第21天,y=1.4058ln(x)+4.5581,r=0.9869;第28天,y=1.3846ln(x)+4.268,r=0.9861。
用CASP軟件分析彗星實驗圖像,獲得DEHP對蚯蚓體腔細胞DNA遷移的Olive尾矩的影響如圖6所示,從圖中可以看出,所有濃度處理組均能對蚯蚓體腔細胞造成DNA損傷,且隨著染毒濃度的增加,彗星Olive尾矩值隨之增加,且與對照組相比差異性明顯。但是相同濃度的處理組10、50 mg kg-1在整個染毒周期Olive尾矩值有減小的趨勢,DNA損傷程度有所減小,這可能是由于蚯蚓在應對高濃度的外界刺激下,具有一定的自我修復作用。

圖5 蚯蚓體細胞DNA損傷的彗星實驗圖像Fig. 5 Comet assay of DNA damage of somatocyte of the earthworms
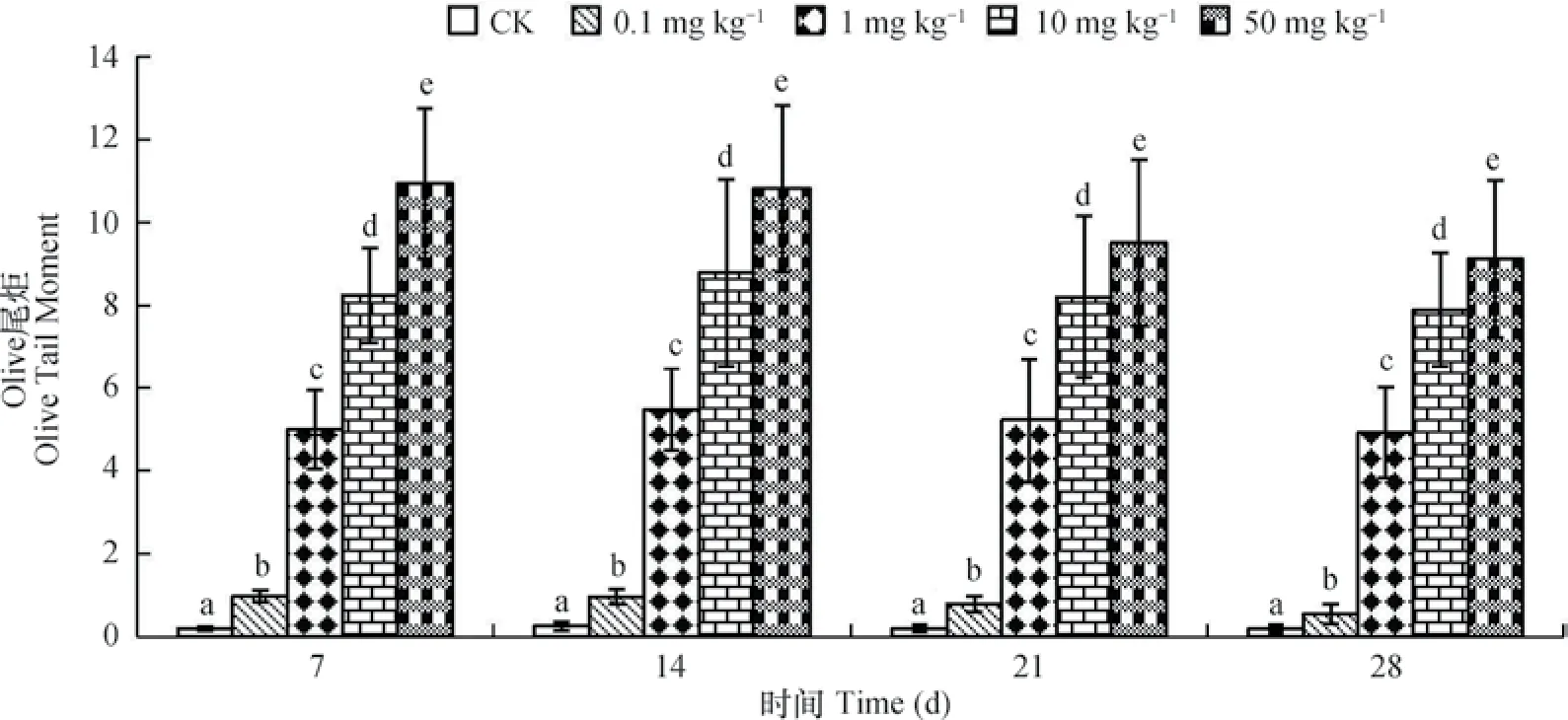
圖6 DEHP對蚯蚓體腔細胞DNA損傷程度(Olive尾矩)的影響Fig. 6 Effect of DEHP on Olive tails moment of coelomocyte in the earthworms
3 討 論
3.1 DEHP對蚯蚓各個測定指標的影響
機體抗氧化酶系主要包括SOD、CAT和POD等,在正常生理條件下,機體產生的活性氧可被細胞內的抗氧化酶系清除。SOD是一種天然的氧自由基清除劑,主要清除超氧自由基,在整個酶促防御系統中占有重要地位,其活性與生物的免疫水平存在一定的相關性[22]。CAT是一種含Fe-原卟啉的酶,在整個抗氧化酶防御系統中,CAT作為清除過氧化氫自由基的重要酶類。POD是生物體內產生的一種氧化還原酶,它能夠催化很多反應,主要清除過氧化物自由基。
實驗研究發現,在整個染毒周期內,所有濃度處理組的SOD活性整體上呈激活狀態,且與對照組相比差異性顯著,這說明蚯蚓在DEHP的脅迫下體內產生了超氧陰離子,在這些超氧陰離子的作用下機體SOD活性增加,機體通過提高SOD活力來抵御氧化損傷,這是生物應激的一種體現。對于CAT,低濃度處理組0.1 mg kg-1在染毒初期與對照相比差異性明顯,隨著染毒時間的增加,低濃度處理組的CAT活性逐漸回落至對照水平,與對照組無明顯差異,這可能是由于蚯蚓體內抗氧化防御系統介入,快速消除了活性氧;而高濃度處理組的CAT活性顯著增加,SOD通過歧化超氧陰離子(·O2-)產生大量過氧化氫(H2O2),從而顯著提高了蚯蚓體內的CAT活性,用于清除機體因污染脅迫而產生的自由基,以適應環境變化保持體內平衡[23]。這與蔡文貴等[11]研究的翡翠貽貝內臟團和外套膜中抗氧化酶SOD、CAT活性的變化情況一致,在不同濃度DEHP長時間脅迫下,翡翠貽貝的SOD、CAT活性具有明顯的影響,組織內發生脂質過氧化損傷,并且這種損傷在短期內無法消除。由于SOD活性被激活,因此產生了部分過氧化物,從而POD呈現激活狀態,在低濃度0.1 mg kg-1處理組中,處理組與對照組差異性不明顯,可能是由于在低濃度時DEHP對蚯蚓造成的影響被SOD及CAT消除了,隨著污染物質濃度的提高,POD活性顯著增強,處于被激活狀態,表明蚯蚓在接收到外界的刺激后產生應激反應,通過自身的調節激活POD來達到消除過氧化物的作用。
根據活性氧學說[24],蚯蚓在DEHP的刺激作用下,引起體內O2-的產生量增加,從而引起SOD、CAT、POD生物合成量的顯著增加。但在高濃度處理組中,SOD、CAT活性相較于中等濃度處理組有所降低,造成這一現象的原因可能是過量的DEHP進入生物有機體后,對該有機體造成的脅迫作用增強,間接導致SOD與CAT清除活性氧自由基的速度低于活性氧的產生速度[25],進而使SOD、CAT消耗殆盡。此時,生物酶的活性降低,細胞膜受到氧化損傷,活性氧自由基累積,降低了生物的適應能力和健康水平,引起中毒反應,從而導致SOD、CAT產生機制的損害,使SOD、CAT的產生量進一步降低。
ROS是生理性氧的代謝產物。蚯蚓體內ROS含量水平隨著染毒濃度的增加而增加,且差異性顯著,說明蚯蚓在不同濃度的DEHP的脅迫下體內產生了超氧陰離子自由基、氧離子、過氧化物等,激活了蚯蚓體內抗氧化酶,這是一種氧化應激的體現。在低濃度處理組中,其對蚯蚓的ROS含量造成了一定的增強,但顯著性不明顯,隨著DEHP濃度升高,ROS含量明顯增高,對于50 mg kg-1處理組,在染毒的第14天出現含量最高值,隨著染毒周期的延長,ROS含量出現回落現象,說明蚯蚓在經過外界刺激后所產生的抗氧化酶對ROS起到了良好的消除作用,但是尚未達到平衡,有過量的活性氧存在,故而DEHP對ROS的含量隨著染毒周期的延長呈現先升高后降低的趨勢。
MDA是自由基引發的脂質過氧化作用的最終分解產物,是細胞發生脂質過氧化反應中最具代表性的產物,其含量的多少可直接反應脂質過氧化的程度,間接反應自由基對機體的損傷程度[26]。王莉等[12]研究了DEHP對小鼠的氧化損傷情況,試驗結果表明小鼠肝臟MDA含量在DEHP脅迫下增加。本實驗中各濃度處理組蚯蚓的MDA含量均升高,除低濃度處理組0.1 mg kg-1與對照組相比沒有明顯差異,其余濃度處理組與對照組相比均有明顯差異。這可能是由于蚯蚓在DEHP的脅迫下產生了過量的活性簇,引起了細胞的脂質過氧化反應。隨著染毒周期延長,中、高濃度組的蚯蚓體內MDA含量整體呈波動狀,跟機體抗氧化酶活性升高或降低有關,表明此時機體的氧化—抗氧化酶系統有一定的自我恢復的能力。
GST是生物體內的一種重要的代謝酶,主要是在肝臟中參與生物轉化第二相反應的一種生物酶,是具有解毒功能的三大酶系之一。蚯蚓在各濃度的DEHP脅迫下,體內GST活性均有所升高,這可能是由于蚯蚓在DEHP的刺激下,激活了體內的GST,以消除有毒物質的氧化損傷。并且研究發現,低濃度0.1 mg kg-1處理組雖較對照組在對GST的激活作用上有一定程度的增強,但是與對照組無顯著性差異,可能是由于DEHP濃度較低,不需要GST進行工作,便可對外界刺激進行自我調控。
蚯蚓在經過不同濃度DEHP染毒處理后,蚯蚓細胞DNA均有損傷,且損傷程度隨著染毒濃度的增加而增加,Olive尾矩值也隨著濃度的增加而增加,這說明DNA損傷程度隨DEHP的劑量增加而增大。Wang等[27]通過研究DEHP對人類胚胎腎細胞系293(HEK-293)的毒性作用發現,DEHP可能通過氧化脅迫導致DNA損傷。趙春風等[28]研究了DEHP短期脅迫對馬氏珠母貝胚胎發育的影響及胚胎DNA的損傷情況,實驗結果表明,DEHP對馬氏珠母貝D型面盤幼蟲的發育有顯著性影響,對胚胎DNA造成明顯的損傷,DNA損傷和染毒濃度之間存在劑量—效應關系,亦與本實驗中DEHP對蚯蚓的DNA損傷結果一致。在高濃度50 mg kg-1處理下,隨著時間的增長,蚯蚓受損體腔細胞Olive尾矩具有減小的趨勢,說明在高濃度的外界刺激下,蚯蚓可能表現出了一定的自我修復功能。
3.2 各個測定指標的相關性
如圖7所示,在對蚯蚓進行染毒后,DEHP進入到蚯蚓的體腔細胞中,在短期內產生大量的活性氧自由基,造成ROS含量的升高,ROS含量的升高對蚯蚓抗氧化酶防御系統(包括SOD、CAT、POD)以及GST等造成一定的刺激,使其酶活性升高,來抑制ROS含量的升高,使機體內的活性氧自由基穩定在一定的水平內。然而隨著DEHP作用進一步增強,相應的會產生更多的活性氧自由基,GST的活性受到抑制,而蚯蚓抗氧化酶系統的活性逐步增強,但蚯蚓抗氧化酶系統與GST不能完全消除大量新產生的活性氧自由基,導致ROS使脂質發生過氧化作用產生MDA,使蚯蚓體內的MDA含量的升高。隨著染毒時間的延長,雖然蚯蚓體內的抗氧化酶系統的活性也會增強,來抑制ROS和MDA含量的升高,但過量的ROS和MDA還是在氧化脅迫作用下對蚯蚓的DNA造成了傷害,導致彗星實驗中Olive尾矩逐漸增大。
為探討不同DEHP濃度污染暴露下蚯蚓各氧化損傷指標和DNA損傷之間的相關性,采用SPSS統計軟件對其做了相關性分析。由表1看以看出,除DEHP濃度與染毒天數沒有相關性之外,其他指標均與染毒天數存在相關性,其中與MDA和ROS含量相關性最高,說明隨著染毒時間的增加,DEHP對蚯蚓的氧化脅迫和脂質過氧化作用不斷增強,而GST活性和染毒天數存在顯著的負相關性,說明隨著染毒時間的增加,GST活性明顯被抑制。DEHP濃度與各檢測指標之間均具有較高的正相關性,說明本實驗選擇的染毒濃度CK、0.1、1、10和50 mg kg-1比較合理,隨著染毒濃度的增加,DEHP對蚯蚓的影響也逐漸加強,尤其DEHP濃度與ROS含量和Olive尾矩之間具有極顯著的正相關,可以看出DEHP濃度與ROS含量和Olive尾矩之間存在劑量—效應關系。SOD、CAT和POD活性之間均具有極顯著的相關性,說明同屬于蚯蚓抗氧化酶防御系統的這三種酶,在蚯蚓受到DEHP污染后,對抑制蚯蚓的氧化脅迫和脂質過氧化具有相似的作用。GST活性和Olive尾矩之間具有極顯著的相關性,Olive尾矩反映DEHP對蚯蚓DNA損傷的程度,由前面可以知道,隨著染毒時間的增加,GST活性逐漸降低,由此可以看出隨著GST活性的降低,蚯蚓DNA損傷程度逐漸增強。MDA是ROS使脂質發生過氧化作用的產物,由表1可以看出,MDA和ROS含量之間具有極顯著的正相關性。ROS、MDA含量和Olive尾矩之間具有顯著的相關性,由于ROS和MDA含量的上升,越來越強的氧化脅迫導致蚯蚓DNA損傷越來越嚴重,因此Olive尾矩也越來越長。

圖7 蚯蚓各檢測指標關系圖Fig. 7 Matrix of the indices obtained in various tests of the earthworms
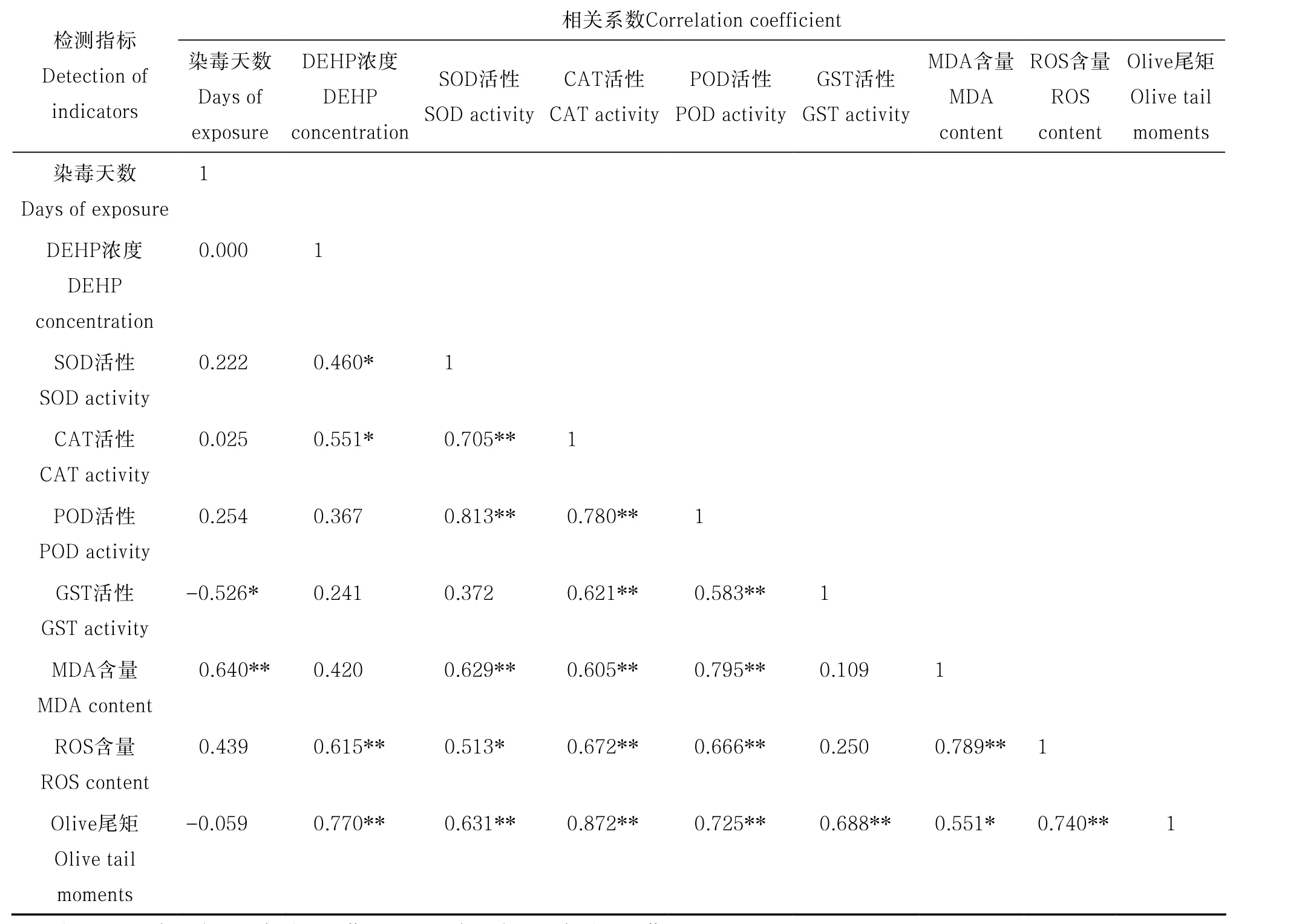
表1 不同DEHP濃度污染暴露下蚯蚓各檢測指標之間的相關性Table 1 Relationships between the indices obtained in various tests of the earthworms exposed to DEHP relative to concentration of the substance
4 結 論
DEHP進入蚯蚓體內后,對蚯蚓體內的抗氧化酶防御系統(SOD、CAT、POD)和GST有誘導作用,使其被激活以保護機體不受傷害;但DEHP還是引起蚯蚓體內ROS含量上升,并且隨著DEHP濃度升高,表現出明顯的劑量—效應關系;過量的ROS使脂質發生過氧化作用產生MDA;在ROS和MDA的共同作用下,蚯蚓細胞內的DNA也受到損傷,且DNA損傷程度與DEHP濃度之間具有劑量—效應關系。總之,DEHP可以對蚯蚓機體和DNA造成一定程度的損傷,表現出較強的生態毒理效應,需要引起足夠的重視。
[1] He L,Gielen G,Bolan N S,et al. Contamination and remediation of phthalic acid esters in agricultural soils in China:Areview. Agronomy for Sustainable Development,2015,35:519—534
[2] Daiem M MA,Rivera-Utrilla J,Ocampo-Pérez R,et al. Environmental impact of phthalic acid esters and their removal from water and sediments by different technologies-A review. Journal of Environmental Management,2012,109:164—178
[3] 黃慧娟,蔡全英,呂輝雄,等. 土壤 - 蔬菜系統中鄰苯二甲酸酯的研究進展. 廣東農業科學,2011(9):50—53 Huang H J,Cai Q Y,Lü H X,et al. Progresses on phthalic acid esters in the soil-vegetable system(In Chinese). Guangdong Agricultural Sciences,2011(9):50—53
[4] 楊杉,呂圣紅,汪軍,等. 酞酸酯在土壤中的環境行為與健康風險研究進展. 中國生態農業學報,2016,24(6):695—703 Yang S,Lü S H,Wang J,et al. Environmental fate and health risks of phthalate acid esters in soils:A review(In Chinese). Chinese Journal of Eco-Agriculture,2016,24(6):695—703
[5] 夏慶兵. 鄰苯二甲酸二(2-乙基己)酯對土壤微生物群落結構多樣性的影響. 山東泰安:山東農業大學,2016 Xia Q B. Effects of di-(2-ethylhcxyl)phthalate on the diversities of microbial community in soil(In Chinese). Tai’an,Shandong:Shandong Agricultural University,2016
[6] 蔡全英,莫測輝,李云輝,等. 廣州、深圳地區蔬菜生產基地土壤中鄰苯二甲酸酯(PAEs)研究. 生態學報,2005,25(2):283—288 Cai Q Y,Mo C H,Li Y H,et al.The study of PAEs in soils from typical vegetable fields in areas of Guangzhouand Shenzhen,South China(In Chinese).Acta Ecologica Sinica,2005,25(2):283—288
[7] 陳永山,駱永明,章海波,等. 設施菜地土壤酞酸酯污染的初步研究. 土壤學報,2011,48(3):516—523 Chen Y S,Luo Y M,Zhang H B,et al. Preliminary study on PAEs pollution of greenhouse soils(In Chinese). Acta Pedologica Sinica,2011,48(3):516—523
[8] Wang J,Luo Y M,Teng Y,et al. Soil contamination by phthalate esters in Chinese intensive vegetable production systems with different modes of use of plastic film. Environmental Pollution,2013,180:265—273
[9] 秦華,林先貴,尹睿,等. 接種降解菌對土壤中鄰苯二甲酸二異辛酯降解的影響. 應用與環境生物學報,2006,12(6):842—845 Qin H,Lin X G,Yin R,et al.Degradation of di-(2-Ethylhexyl)phthalatein soil by inoculating microorganisms(In Chinese). Journal of Applied and Environmental Biology,2006,12(6):842—845
[10] Wang X H,Yuan X,Hou Z G,et al. Effect of di-(2-ethylhexyl)phthalate(DEHP)on microbial biomass C and enzymatic activities in soil. European Journal of Soil Biology,2009,45(4):370—376
[11] 蔡文貴,秦潔芳,賈曉平,等. 鄰苯二甲酸二乙基己酯對翡翠貽貝( Perna viridis)生化指標的影響. 生態學雜志,2012,31(1):100—105 Cai W G,Qin J F,Jia X P,et al.Effects of di-(2-ethylhexyl)phthalate on the biochemical indices of green mussel(Perna viridis)(In Chinese).Chinese Journal of Ecology,2012,31(1):100—105
[12] 王莉,郭靖,韓冰,等. 鄰苯二甲酸二乙基己酯(DEHP)對小鼠的氧化損傷及黃豆異黃酮對其保護作用的研究. 生態毒理學報,2012,7(3):268—276 Wang L,Guo J,Han B,et al.Oxidative damage induced by di-(2-ethylhexyl)phthalate and protective effects of soybean isoflavones in mice(In Chinese).Asian Journal of Ecotoxicology,2012,7(3):268—276
[13] 顏增光,何巧力,李發生. 蚯蚓生態毒理試驗在土壤污染風險評價中的應用. 環境科學研究,2007,20(1):134—142 Yan Z G,He Q L,Li F S. The use of earthworm ecotoxicological test in risk assessment of soil contamination(In Chinese). Rresearch of Environmental Sciences,2007,20(1):134—142
[14] 王廣馳. 烯啶蟲胺和啶蟲脒對蚯蚓的氧化脅迫及基因毒性. 山東泰安:山東農業大學,2015 Wang G C.Oxidative stress and genetoxicity induced by nitenpyram and acetamiprid exposure in earthworm(In Chinese).Tai’an,Shandong:Shandong Agricultural University,2015
[15] 盧明珠,呂憲國,管強,等. 蚯蚓對土壤溫室氣體排放的影響及機制研究進展. 土壤學報,2015,52(6):1209—1225 Lu M Z,Lü X G,Guan Q,et al.Advancement in study on effect of earthworm on greenhouse gas emission in soil and its mechanism(In Chinese). Acta Pedologica Sinica ,2015,52(6):1209—1225
[16] 周垂帆. 重金屬和草甘膦復合污染生態毒理研究.南京:南京林業大學,2013 Zhou C F. Study of the ecology toxic effects of single and combined pollution between heavy metal and glyphosate(In Chinese).Nanjing:Nanjing Forestry University,2013
[17] Liu W,Zhu L S,Wang J,et al. Assessment of the genotoxicity of endosulfan in earthworm and white clover plants using the comet assay. Archives of Environmental Contamination and Toxicology,2009,56:742—746
[18] Rastogi R P,Singh S P,H?der D P,et al. Detection of reactive oxygen species(ROS)by the oxidantsensing probe 2',7'-dichlorodihydrofluorescein diacetate in the cyanobacterium Anabaena variabilis PCC 7937. Biochemical and Biophysical Research Communications,2010,397:603—607
[19] Dikalov S I,Harrison D G. Methods for detection of mitochondrial and cellular reactive oxygen species.Antioxidants& Redox Signaling,2014,20(2):372—382
[20] Song Y,Zhu L S,Wang J,et al. DNA damage and effects on antioxidative enzymes in earthworm(Eisenia foetida)induced by atrazine. Soil Biology &Biochemistry,2009,41:905—909
[21] Song Y,Zhu L S,Xie H,et al. Effects of atrazine on DNA damage and antioxidative enzymes inVicia faba.Environmental Toxicology and Chemistry,2009,28(5):1059—1062
[22] 殷健. 重金屬對斑馬魚的毒性效應及作用機制研究. 北京:北京協和醫學院,2014 Yin J.Studies on toxic effect and mechanism of heavymetals on zebrafish(In Chinese). Beijing:Peking Union Medical College,2014
[23] 鄭麗萍,馮艷紅,趙欣,等. 氯丹和滅蟻靈污染場地土壤對蚯蚓的毒性效應研究. 農業環境科學學報,2010,29(10):1924—1929 Deng L P,Feng Y H,Zhao X,et al.Toxicity effects of chlordane and mirex contaminated soil on earthworm(Eisenia foetida)(In Chinese).Journal of Agro-Environment Science,2010,29(10):1924—1929
[24] Mittler R. Oxidative stress,antioxidants and stress tolerance. Trends in Plant Science,2002,7(9):405—410
[25] Wang X F,Xing M L,Shen Y,et al. Oral administration of Cr(VI)induced oxidative stress,DNA damage and apoptotic cell death in mice. Toxicology,2006,228(1):16—23
[26] 陳漢,王慧君,李學鋒,等. 甲基苯丙胺對大鼠腦組織中NO,SOD和MDA的影響. 中國藥物依賴性雜志,2007,16(2):102—104 Chen H,Wang H J,Li X F,et al.Change of NO,SOD and MDA in methamphetamine-treated rat brain and theircorrelation(In Chinese).Chinese Journal of Drug Dependence,2007,16(2):102—104
[27] Wang X,Jiang L J,Ge L,et al. Oxidative DNA damage induced by di-(2-ethylhexyl)phthalate in HEK-293 cell line. Environmental Toxicology and Pharmacology,2015,39(3):1099—1106
[28] 趙春風,刁曉平,曹佳,等. 鄰苯二甲酸二(2-乙基己)酯(DEHP)對馬氏珠母貝(Pinctada maetensii)胚胎發育的影響及DNA 損傷. 海洋環境科學,2015,34(4):546—552 Zhao C F,Diao X P,Cao J,et al.Effects of DEHP on embryonic development and DNA damage of Pinctada maetensii(In Chinese). Marine Environmental Science,2015,34(4):546—552
Oxidating Stress and DNA Damage of DEHP to Soil Earthworms
LIU Wenjun GAO Jianpeng WANG Guanying ZHU Lusheng WANG Jinhua WANG Jun?
(College of Resources and Environment,Key Laboratory of Agricultural Environment in Universities of Shandong,Shandong Agricultural University,Tai’an,Shandong271018,China)
【Objective】Phthalate acid esters(PAEs),also known as phthalate esters or “plasticizer”,are the reaction product of phthalic anhydride and alcohol. PAEs are widely used in the production of a huge number of products such as agricultural plastic film,toys,medical bags and hoses for transfusion,food packaging,cleansers,vinyl floor and wallpaper,and personal care products. Among them,Di(2-ethylhexyl)phthalate(DEHP)is one PAE,the highest in output and consumption and also a toxic organic compound highly hazardous to human health,disturbing endocrine systems and causing cancers,mutation,oxidative damage and genetic toxicity. As DEHP is weakly bonded to the plastic matrix by hydrogen bond and van der Waals force,it is easily detached and diffused into the air,water and soil environments.Therefore,its pollution and hazard to human health has aroused more and more attention from the people.So far studies have proven that DEHP can enter organisms via a variety of ways,causing poisonous damage to tissues and organs of the organisms. As DEHP is extensively used in agriculture and hence exists in large volumes in the soil system,it is necessary to investigate its ecological and toxicological effects,such as oxidative stress and DNA damage,on typical soil animals,in the hope that the study may serve as scientific basis for reasonable assessment of soil ecological risk of DEHP.【Method】To explore eco-toxicological effects of DEHP on soil animals,Earthworms(Eisenia foetida),used as bio-indicator,were exposed to DEHP varying in concentration(0,0.1,1,10 and 50 mg kg-1)in artificial soil. Earthworms were sampled after 7,14,21 and 28 days of exposure for analysis of superoxide dismutase(SOD),catalase(CAT),peroxidase(POD)and glutathione(GST),which are the indices reflecting the degree of DEHP activating oxidation of earthworms,reactive oxygen species(ROS),which is the indicator of cytotoxicity of DEHP to earthworms,and malondiadehyde(MDA)and olive tail moment,which are the indices reflecting genotoxicity of the substance to earthworms.【Result】(1)DEHP,above 0.1 mg kg-1in concentration,significantly enhanced the activities of SOD,CAT,POD and GST inEisenia foetidaby a degree varying with the concentration of DEHP,which demonstrates that DEHP induces antioxidant enzymes in earthworms;(2)DEHP increased ROS concentration in earthworms as compared with control and the effect varied between treatments,displaying an apparent dose-effect relationship;(3)Comparison between the treatments shows that DEHP did have some effect on content of MDA,but the effect did not follow any specific rule and was the most obvious in earthworms exposed to DEHP,10 mg kg-1and 50 mg kg-1in concentration;(4)In the presence of DEHP. GST in the earthworms was apparently activated,except for the treatment of 0.1 mg kg-1,where the earthworms did not have much difference from those in control. The observation demonstrates that DEHP,higher than 0.1 mg kg-1in concentration induces GST in the earthworms;(5)Single cell gel electrophoresis shows that coelomocyte DNA of the earthworms was damaged in the presence of DEHP,regardless of concentration and Olive tail moment increased with the rising DEHP concentration,which suggests that DNA damage caused by DEHP is dose-dependent.【Conclusion】 Once DEHP enters earthworms,it activates the defense system of antioxidant enzymes(SOD,CAT and POD)and GST detoxification enzyme in the earthworms to protect the organisms from injury. Nevertheless,DEHP still raises ROS content in the earthworms,and excessive ROS triggers peroxidation of lipids,producing MDA. ROS and MDA act jointly damaging cell DNA of the earthworms. To sum up,DEHP may cause a certain degree of damage to organisms and DNA of the earthworms,manifesting fairly strong eco-toxicological effects. Therefore,adequate attention should be paid to DEHP disposal.
DEHP;Antioxidant enzymes;GST;MDA;ROS;Comet assay
X171
A
10.11766/trxb201703060625
* 國家重點研發計劃項目(2016YFD0800304)和山東農業大學泉林黃腐酸肥料工程實驗室開放課題(QL2016-26)資助Supported by the National Key Research and Development Program of China(No. 2016YFD0800304)and the Quanlin Fulvic Acid Fertilizer Engineering Laboratory Open Project of Shandong Agricultural University(No. QL2016-26)
? 通訊作者 Corresponding author,E-mail:jwang@sdau.edu.cn
劉文軍(1990—),男,碩士研究生,主要從事環境毒理學方面的研究。E-mail:jun2012jun@163.com
2017-03-06;
2017-05-05;優先數字出版日期(www.cnki.net):2017-05-11
(責任編輯:盧 萍)

