美國藥品注冊的電子提交
李 莎
(重慶藥友制藥有限責任公司,重慶 401121)
美國藥品注冊的電子提交
李 莎
(重慶藥友制藥有限責任公司,重慶 401121)
為順應電子化的發展趨勢,全球多個藥政當局都陸續開始推行申報文件的電子提交,以美國食品藥品監督管理局(FDA)、歐洲藥品評審中心(EMA)、日本厚生勞動省(Ministry of Health,Labor and Welfare)為首,各國也相應開始著手規范藥品電子遞交系統。本文以美國FDA電子提交為例,重點介紹了電子提交軟件的優劣勢,及美國FDA對電子提交的規范程序。通過實際的操作案例及總結的編寫經驗,凸顯了電子申報的各種優勢,總結了提交過程的要點及常見的缺陷,以幫助各制藥企業更順利的完成電子提交,搶占歐美藥品市場。
藥品注冊;電子提交;eCTD
1 電子提交全球現狀
藥品電子通用技術文件(eCTD)最早源于國際協調組織(ICH),該組織的M2專家工作組(EWG)于2003年10月制定并發布了關于藥品電子提交的通用標準,并被美國食品藥品監督管理局(FDA)、歐洲藥品當局(EMA)、日本厚生勞動省(MHLW)以及加拿大等國廣泛推行。其規定了申請人向藥政當局提交電子文件的目錄結構及文檔格式,并采用XML語言的文件類型對整個遞交及各申報文件的元數據進行管理,以組成綜合的目錄并提供相應的引索。同時簡化了申報文件的創建、審核、生命周期的管理以及文件的儲存。
為何電子遞交的方式受到全球藥政當局的推崇和支持,原因在于電子化的提交相比紙質文件更自動化和標準化;減少了紙質文件的打印、裝訂的人力物力;同時減少了對紙質文件的儲存和管理的費用及空間;對于藥政當局的評審人員來說更是增加了文件間的關聯性及透明度,加快了其評審的速度和效率。
2 eCTD概述及構架
2003年,ICH Multi-disciplinary Group 2(M2)在CTD的基礎上制定了eCTD的標準,eCTD可以說是電子化的CTD注冊申報方式,是一個接口,用于行業與監管機構間信息的傳輸,以便于文件的創建、審查、生命周期管理和電子提交。其利用專門的軟件進行編輯轉化生成eCTD文件,通過與FDA建立專門的電子通道遞交。
eCTD的結構包括XML骨架、枝干(各模塊,如模塊1到模塊5)及枝葉(內容)三部分。每個枝干(模塊)都有多枝葉文件組合而成,除模塊2、模塊4、模塊5中有word或SAS格式的文件外,其余大部分枝葉文件均為PDF格式。申請人可以對已創建好的eCTD枝葉文件進行替換(Replace)、新增(Append)、刪除(Delete)以維護整個電子文件的生命周期。XML主干實例如圖1。
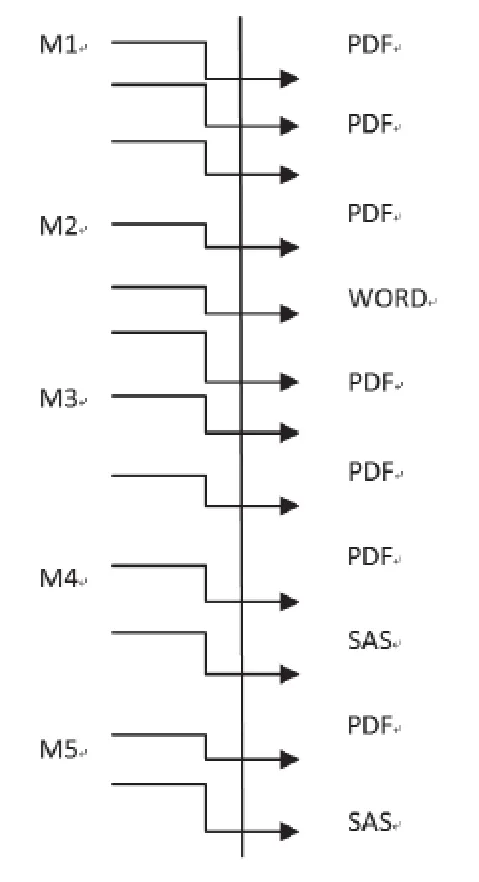
圖1 XML主干實例Figue 1 XML Backbone
3 eCTD申報范例
3.1 軟件選擇及用戶測評
藥品注冊申報從紙制時代走向電子時代, eCTD標準提交的軟件產品也隨之層出不窮,相關的軟件可提供的功能包括羅列整個藥品的序列(Sequence);管理整個藥品注冊的生命周期(LifeCycle);管理整個藥品注冊過程中的藥政活動(Regulatory Activity),例如增補、變更、年報等等;對創建的eCTD文件的完整性進行驗證(Validation)等等。申請人及當局的評審員都需要相關的軟件予以支持。
如何選擇適合自己公司的產品是各個廠家需要考慮的問題。衡量的關鍵點包括公司預算、服務器位置、技術支持程度、適用性及軟件的兼容性等等幾個方面。例如預進行電子提交的公司如果每年有充足的預算且每年有多個電子提交的項目,即可考慮引進大牌的軟件;服務器的位置將決定遞交FDA的速度,速度越快越能確保文件遞交的順暢度及完整性;從軟件的售后服務來看,如果軟件商能夠提供較優越的服務,例如24小時在線答疑等,將會更便于申報人員應對遞交過程中出現的突發狀況。目前市場運用的電子提交軟件較多,例如德國產的Extedo,該軟件為EMA絕大多數歐盟成員國推行,包括瑞士、南非、阿拉伯等運用較廣;德國的Lorenz,為歐洲的EDQM及少數幾個歐盟成員國推行使用,另外還包括泰國、加拿大、澳大利亞等藥政當局;印度制造的GlobalSubmit,是美國FDA推薦使用的軟件;另外還有CSC,pharmaREADY,KnowledgeNet等等。藥企在選擇軟件的同時需要對各軟件的優劣進行分析評估,選擇適合自己的才是最好的。
3.2 編制操作
選擇好軟件后,即通過軟件模板,對各個章節進行了單獨的編制。并對定稿的word版文件進行了適當的格式化,以確保FDA審閱文件時的美觀性和可讀性。在將word文檔轉換成PDF文檔之后,按照FDA發布的PDF文檔標準,需要對超過5頁的PDF文件編制書簽(bookmark),并建立文件內的交叉引用和超級鏈接,以節省FDA官員在審核文件時查找相關文件的時間。每個文件都必須包括目錄、表格及圖表清單,且所有的表格、圖表、文獻及附錄都需以超級鏈接的形式體現在書簽和目錄中。
根據eCTD申報軟件的標準創建電子申報文件,手動拖拽各獨立單元(除質量綜述中的word文件及模塊4、模塊5中的SAS格式文件外,大部分為PDF格式)進入相應的eCTD枝干框架中,以XML語言形式呈現各章節內容,再通過軟件定位并設定web鏈接,鎖定文件并提交生成。
申請人及FDA審核官員可通過IE打開相應的XML語言的申報文件,通過點擊相應的web鏈接進行審核。
基西米河洪水控制工程于1954年啟動,該工程不僅為流域上游區域提供防洪保障,而且保證了下游農業開發。但該工程也造成了基西米河運河化,對流域植被和物種多樣性造成了破壞。
3.3 eCTD提交
按照FDA的要求,任何小于10GB的注冊文件都必須通過FDA的電子遞交通道(ESG)進行上傳。而由于絕大部分的注冊提交文件都是小于10GB的,為順利完成提交工作,建議預進行電子提交申報的廠家應盡早申請獲得FDA電子提交通道的賬戶。
獲得電子提交通道賬戶的過程包括:(1)申請賬戶;(2)預備工作;(3)注冊檢測賬戶;(4)針對ESG調整電腦設置;(5)發送檢測申請;(6)批準產品賬戶。其中設計的檢測階段,是用以確保FDA的電子提交通道能成功的接收你的電子文件以及你提交的文件是否符合指南的規定。檢測由FDA電子提交通道的檢測系統完成。一旦通過檢測,即成功建立允許通過FDA電子提交通道的產品賬戶。
在獲得電子提交通道賬戶并成功生成定稿的eCTD文件之后,即可通過電子提交通道向FDA提交eCTD文件。在上傳eCTD文件前,按照FDA電子提交的3.2版DTD標準,需通過eCTD軟件對生成的電子文檔進行驗證(Validation),通過提示的錯誤,對文件進行修改,以確保提交的資料的完整性及準確性。值得注意的是切勿重復遞交已按紙質版或其他電子形式遞交過的文件,僅提供新的或變更的信息即可。FDA在收到申請人的eCTD之后,即刻會給申請人反饋一封接收函,說明已成功接收到申報文件;隨后FDA平臺還會對遞交的文件進行自動驗證,如無問題,隨即發送一封通過驗證的通知函,告知申請人文件完整性無問題,即順利進入遞交文件的正式審查,持續時間大約為90天左右。
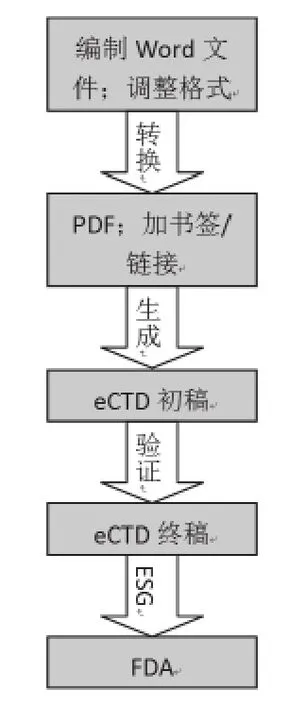
圖2 eCTD創建及提交全過程Figure 2 Flow Chart of eCTD Creating and Submission
4 總 結
4.1 常見的eCTD缺陷及注意事項
電子文檔的編制和準備是個極其復雜和繁瑣的過程。在生成定稿電子申報文件之前,注冊團隊除了需要對申報資料內容進行重重審核外,還需要對電子文檔的系統功能進行反復檢驗,以確保申報內容及電子文件的書簽、鏈接的準確性。后期的工作對注冊團隊要求也較高,必須具備廣泛的專業知識及熟練的計算技能。現如今FDA對各廠家申報文件的審查越發的嚴格,出現10個微小缺陷及1個重大缺陷即拒絕接收申報文件,例如批記錄或圖譜中出現未翻譯的中文即有可能被FDA認為是重大缺陷而退審,不但從經濟上造成企業的重大損失,也從時間上耽誤了上市的有利時機。常見的eCTD缺陷包括如下。
(1)文件中帶有未翻譯的中文
(2)圖片、圖譜不清晰
(3)PDF書簽
a)未對超過5頁的PDF編制書簽
b)書簽不夠詳細,層次不夠宣明
c)書簽的名稱不準確
(4)交叉引索及超級鏈接
a)未編制引索或鏈接
b)引索或鏈接失效或無效
c)文件目錄無鏈接
d)鏈接未標示成藍色字體(Blue text)
4.2 葉標題不夠清楚
另還需注意每個獨立的文件應標注頁碼;調整紙張方向時,可以豎頁的盡量豎頁,方便官員審核;簽署的法規文件應加上公司頁眉等等。在文件創建、上傳過程中,申請人應選擇較好的網絡環境及遞交時機,以避免網絡斷點等的遞交失誤。
4.3 電子提交的展望
電子提交對于申請人來說大大提高了注冊效率,便于后期整個文件生命周期的管理,節約了紙質文件的打印裝訂的工序及成本并保證了文件的完整性及標準化;而對于藥政當局的評審員來說,自動化的接收及審核方式為其節約了更多的時間及空間,確保了申報資料的安全、環保和有效利用,提高了藥品技術審評的質量和效率。
現如今,FDA預將電子申報擴展到更廣闊的領域,包括醫療器械的各種申報,藥品登記,場地登記等等。電子提交以其明顯的操作優勢贏得了全球大部分藥政當局的認可,中國也不例外。國務院辦公廳在2007年4月下發的《國家食品藥品安全“十一五”規劃》,提出推進藥品、醫療器械監管信息化進程。2013年4月18日,藥品審評中心發布了《藥審中心將試點開展藥品注冊申報資料電子提交工作》的新聞,明確指出為提升藥品注冊申報資料的管理水平,將試點開展藥品注冊申報資料電子遞交工作。2015年11月27日,總局辦公廳下發關于征求化學仿制藥CTD格式申報資料撰寫要求意見的通知。可見中國也在逐步的實施電子化遞交的方式。未來隨著醫藥企業信息化水平的提高,基于eCTD規范、運用專業的eCTD工具軟件簡化的申報、審核、儲存流程,電子遞交將迎來注冊申報管理的新紀元。
[1] ICH technical specification,Electronic Common Technical Document Speci fi cation v3.2.2.
[2] Guidance for Industry Providing Regulatory Submissions in Electronic Format — Certain Human Pharmaceutical Product Applications and Related Submissions Using the eCTD Speci fi cations.
[3] Electronic Submissions Gateway.
R95
A
ISSN.2095-8242.2017.48.9478.02
本文編輯:吳 衛

