遙感反演植被含氮量研究進展
陳永喆,傅伯杰,馮曉明,*
1 中國科學院生態環境研究中心城市與區域生態國家重點實驗室,北京 100085 2 中國科學院大學,北京 100049
遙感反演植被含氮量研究進展
陳永喆1,2,傅伯杰1,2,馮曉明1,2,*
1 中國科學院生態環境研究中心城市與區域生態國家重點實驗室,北京 100085 2 中國科學院大學,北京 100049
植被含氮量表征植被氮素狀態。它作為植被生長狀況的重要指標,在生態系統健康狀況檢測、生態系統生產估測、精準農業、生態系統干擾評估等方面均有重要意義。遙感監測植被含氮量主要基于高光譜和多光譜數據,采用的算法包括經驗方法(波譜指數與回歸分析)及物理方法(輻射傳輸模型法)。但受數據源和研究方法的局限,目前植被氮含量遙感監測局限于區域范圍較小且內部植被類型與環境條件(氣候、地形等)基本一致的情形,而對復雜生態系統的監測能力不足。未來的研究需針對氮沉降和人類活動的生態系統響應這一重大研究需求,發展和改進現有植被含氮量遙感反演方法。可考慮開展對不同環境條件下、不同類型植被光譜曲線進行標準化的研究,以形成普適的植被含氮量反演方法。并考慮綜合運用多種數據(如微波遙感、無人機遙感),形成多尺度同步監測,以提高遙感對區域乃至全球范圍內植被氮含量常規監測的能力。
植被氮含量;遙感;反演方法;困境和挑戰
氮元素是植物生長重要營養元素,也是參與光合作用蛋白的重要組成元素,因此在植物光合作用與生長發育中發揮著重要作用[1]。植物氮素狀況可用組織含氮量(tissue nitrogen content, TNC)或植物氮積累量(plant nitrogen accumulation, PNA)表征。組織含氮量是植物體各組織的含氮量,但由于植物冠層主要由葉片構成,所以一般可將植被葉片含氮量(leaf nitrogen content, LNC)作為組織含氮量。葉片含氮量表示為植物單位干重葉片所含氮素質量;而植物氮積累量定義為單位面積土地上植被所含氮素總量,即組織含氮量與單位面積植被干生物量的乘積,一般可用于反映農作物生長狀況或受脅迫情況[2]。對比兩者,植被葉片含氮量測定較簡便,且遙感反演葉片含氮量準確性也較植物氮積累量高[3],因此在本文涉及的研究領域研究者大都測定和反演植被葉片含氮量。
大量研究表明,植被葉片氮元素濃度的高低與植被光合作用效率和強度密切相關[4],進而影響生態系統生物量累積和其他碳水循環過程。因此植被葉片含氮量變化監測對農業生態系統而言有助于提升作物產量與質量;對非農業生態系統,葉片含氮量監測對于了解生態系統植被生長狀況、受脅迫與干擾程度、凈初級生產力等生態系統特征有重要意義。可以預計,隨著氮沉降這一全球變化研究的深入,植被葉片氮含量監測在全球變化和人類活動的生態系統響應研究中將發揮越來越重要的作用。
隨著遙感技術的不斷發展,在中大尺度上通過遙感反演植被參數代替地面實測已成為當今生態學研究發展趨勢。遙感反演植被參數可以實時獲取大范圍的數據,此外還可利用遙感重復觀測的優勢,形成長期、連續的觀測序列,特別是可獲取過去時刻數據資料。因此遙感反演植被葉片氮含量已成為地球系統科學研究中具有重要價值的部分。但需注意,對于冠層結構較復雜的喬灌木,遙感手段通常僅可獲取植被冠層反射率,因此實際反演所得為冠層葉片平均含氮量,即“植被冠層葉片含氮量”,或簡稱“冠層含氮量”。本文中將喬灌木冠層含氮量與草本作物葉片含氮量統稱為植被含氮量。
下文將針對植被含氮量遙感監測的發展需求,通過綜合相關文獻,分析遙感反演植被含氮量的生態學意義、原理、數據來源及具體反演方法,并在此基礎上分析目前遙感反演植被氮素含量存在的缺陷不足,最后面向未來應用的需求總結該領域今后的研究中應重點關注和改進的內容。
1 遙感反演植被含氮量的生態學意義
由于植被氮元素濃度的高低直接影響植被的光利用效率[5],因而植被含氮量與凈初級生產力之間有密切關聯,在研究中往往通過測定植被含氮量估測生態系統生產力狀況,并可通過生產力估算進一步進行生態系統碳固定等生態系統服務的評估。如:Smith與Ollinger等使用成像光譜儀或高光譜影像反演冠層含氮量,并通過構建森林冠層含氮量與森林地上凈初級生產力相關性,較準確地估計了地上凈初級生產力[6-7];Wythers等模擬植被含氮量對生態系統碳固定的影響[8];Waring等將遙感所得植被含氮量作為生態系統過程模型的重要參數之一評估生態系統固碳服務功能及植被生長過程中的水資源利用量等[9]。
植被氮元素濃度的顯著變化可反映生態系統受外界干擾或脅迫的程度,在生態系統變化監測中發揮著十分重要的作用。McNeil等指出舞毒蛾造成的毀葉干擾與遙感所得植被含氮量的減少程度存在顯著相關性[10];Deel等發現基于TM影像的森林綜合干擾指數與植被冠層含氮量顯著相關[11];伴隨南非森林破碎化,植被冠層平均含氮量相應降低[12];在物種組成對區域植被平均含氮量影響較大的地區,對植被含氮量的長期監測,可了解當地植被群落物種結構是否發生變化,為認識群落演替趨勢和發展方向提供重要信息。Asner等根據遙感獲取的植被氮含量深入分析了夏威夷生物入侵過程[13]。
此外,作為氮循環的重要環節,植被氮素水平和大氣、土壤和水體等各生態系統組分的氮元素狀況密切相關。因此植被氮素監測將在大氣氮沉降這一全球變化重大問題的研究,以及土壤和水體氮元素變化監測中發揮更重要的作用。氮素循環對生態系統維持至關重要,但人類活動正破壞氮的自然循環過程,表現為因化石燃料消耗和農業生產中大量化肥的施用引起的大氣氮沉降。研究表明大氣氮沉降會不同程度地影響植被初級生產量及固碳能力[14],并使植被對各類災害敏感度提高。Aber等人的研究顯示,森林冠層氮含量與森林對大氣氮沉降的截留能力相關[15],因此可通過測定植被含氮量推算生態系統大氣氮沉降量的動態變化;農業生產中含氮化肥農藥的排放造成水體富營養化,而河岸植被對氮素的吸收能力可通過植被含氮量監測進行估計[16];此外,研究發現植被含氮量與土壤氮素凈礦化率、硝化率成正比,同時還與土壤含氮量/碳氮比密切相關,其相關性受樹種及干擾程度的影響[17],這表明監測植被含氮量可用于研究土壤氮相關化學過程與養分結構;目前在精準農業和畜牧業中已經實現遙感實時大面積監測作物含氮量,測定食草動物飼料的質量,在此基礎上確定氮肥投入量,實現作物高產的同時將環境影響降到最小[18]。
2 遙感反演植被含氮量的原理與數據來源
植物葉片中的氮元素大多存在于蛋白質中,少量存在于葉綠素中。目標葉片中含氮化學鍵在一定強度光譜輻射下產生震動并引發對特定光譜波段的吸收與反射,而光譜吸收強度與這些化學鍵的含量密切相關。此外,由氮元素組成的葉片色素(葉綠素等)也會對特定波長光譜強烈吸收(相比而言蛋白質的光譜吸收特性較差)。因此植被含氮量的變化會造成特定波段反射率的改變。Curran最先發現并總結了與氮素吸收相關的波段,包括640,660,1020,1690,2060,2130,2180,2240,2300nm等[19],Kokaly等指出當植被氮含量增加時,近紅外波段(中心波長約2100nm處)反射率減少是源于2055nm及2172nm處存在兩個蛋白質吸收波段[20]。Mutanga認為紅邊680nm與植被含氮量的相關性來自葉綠素吸收[21]。此外,約500nm處反射率與植被含氮量有一定相關性[22],或與其他色素如β-胡蘿卜素有關[23]。現一般可將與植被含氮量最相關的波段分為三類,除近紅外波段(1200nm左右)外,還有紅邊波段(680—780nm)與短波紅外某些與蛋白質吸收相關的波段(1680, 2050, 2170nm)[24]。
高光譜遙感相對傳統寬波段遙感光譜分辨率大大提高,使其能探測植被精細光譜信息,特別是植被各種生化組分的吸收光譜信息[25],因此高光譜遙感觀測技術的進步在很大程度上推動遙感反演植被含氮量的發展。最早的高光譜遙感是使用機載高光譜監測植被冠層生化組分。1983年美國研制了航空成像光譜儀Airborne Imaging Spectrometers I(AIS-1)并獲取了第一幅高光譜圖像。1988年Wessman與Peterson分別用AIS獲取的高光譜影像反演了植被生化參數[26-27],標志著高光譜遙感用于植被理化參數反演的開端。隨后,更多且性能更好的機載高光譜傳感器問世,其中美國的AVIRIS傳感器是應用于植被含氮量的反演的最重要的機載數據源(如Martin等采用該數據[28])。此外,其他機載高光譜影像也可用于含氮量反演,如澳大利亞HyMAP及加拿大Compact Airborne Spectrographic Imager(CASI)。其中,浦瑞良與宮鵬在1997年利用CASI數據反演美國森林冠層含氮量[29],是首批開展這方面研究的中國學者。表1介紹了國內外已有的代表性機載高光譜系統。
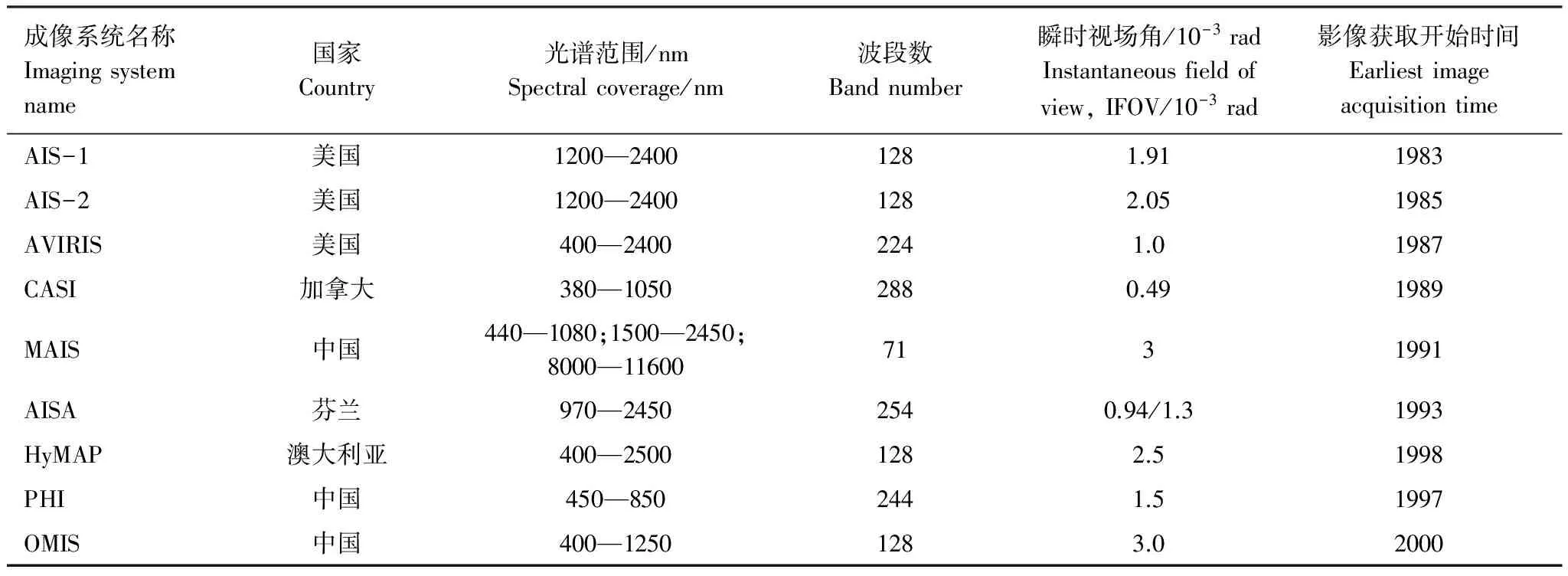
表1 國內外典型機載高光譜遙感系統參數
2000年11月,美國成功發射的EO-1衛星搭載了高光譜傳感器Hyperion,標志星載高光譜時代正式到來。Hyperion數據也成為至今使用最廣泛的星載高光譜數據。但Hyperion反演效果往往不及機載AVIRIS傳感器[30],主要原因是Hyperion空間分辨率較粗糙且信噪比(signal-noise ratio,SNR)較低,另外大氣校正精度也不足。在不久的將來,還會有更多星載高光譜傳感器如HISUI,EnMAP,PRISMA及HyspIRI提供更多高光譜數據[31](表2),為植被含氮量反演提供數據基礎。在缺少高光譜資料的地區,現有的研究也考慮采用通道較多的多光譜影像替代高光譜影像進行植被氮素反演。Ollinger等的研究中MODIS影像各波段反射率與冠層含氮量擬合程度高達88%[32],但不足在于空間分辨率較低(500m)。
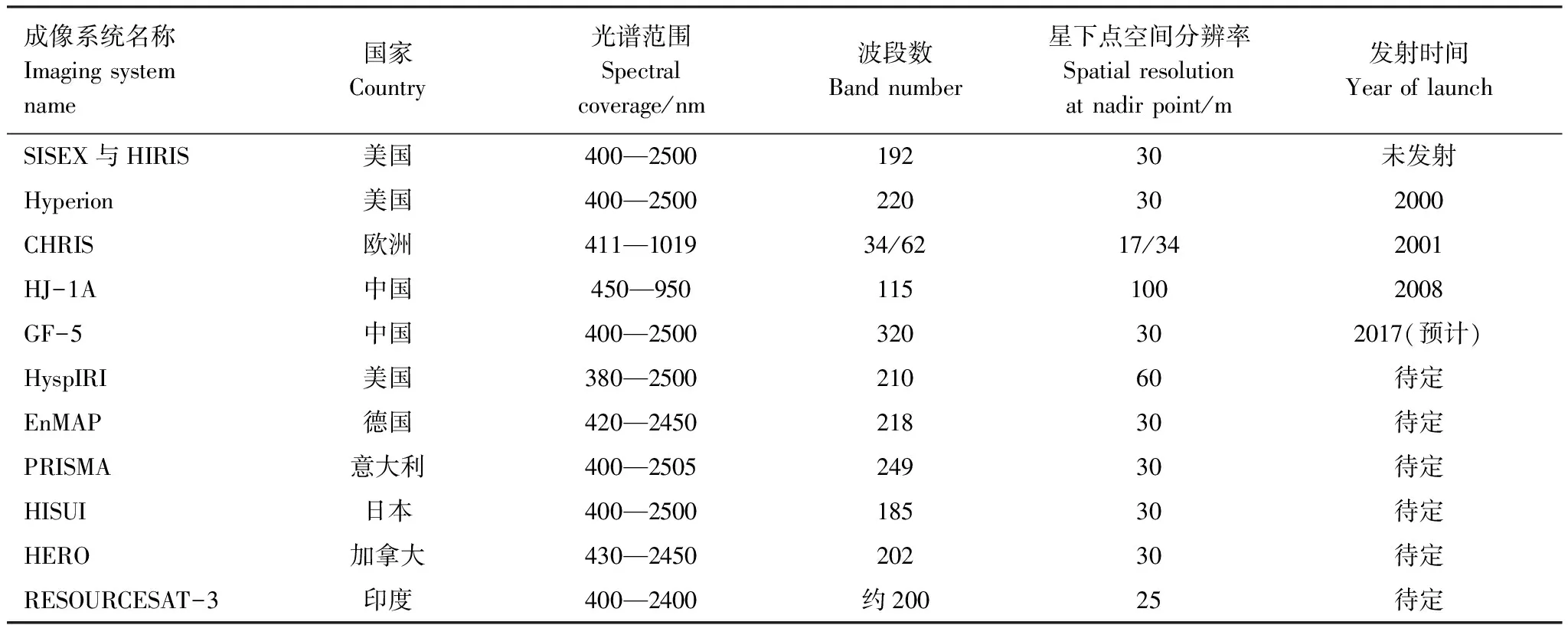
表2 國內外典型星載高光譜遙感系統參數
傳感器得到的反射率曲線通常存在噪聲和背景信號干擾造成的誤差,如葉片水分對氮元素光譜吸收的影響。因此通常需進行光譜變換以降噪、消除干擾信息并分離相互重疊的吸收特征。較常采用的是Kokaly與 Clark的連續統去除(continuum removal)方法。該方法可有效消除葉片水分、土壤背景、傳感器噪聲等造成的誤差干擾。該方法首先對反射率R進行連續統(包絡線)去除,所得相對反射率Ri可用于辨析并剔除與研究目標物質(植被氮)無關的吸收波段,之后進行波深中心歸一化[33]。最終得連續統去除后的反射率值CR具體公式為:
CR=(1-R/Ri)/(1-RC/RiC)
(1)
式中,RiC是Ri在吸收中心位置處值,RC是R位于吸收中心處值,波深表示為1-R/Ri[34]。研究證明對于植被覆蓋度不高的地區(40%以下),如半干旱地區,經此光譜變換所得光譜曲線對植被含氮量有了更好的反演效果[35]。田慶久等用波深一體化后包絡線面積估算水稻氮素含量[36]。
此外,標準導數分析法(standard derivative analysis,SDR),即對波譜進行對數平滑[Log10(1/R)]后求一次導數可部分消除水分與葉面積變化的影響,故也可提高反演準確性[37];一些濾波方法如S Golay濾波可起到平滑降噪的作用[38];去除水分吸收干擾的算法也在不斷發展[39-40];波段面積歸一化也可提高反演精度[41]。而在高植被覆蓋且傳感器接近垂直下視的理想條件下,不進行處理效果反而更好[42]。
3 遙感反演植被含氮量的進展
3.1 光譜指數法
遙感反演植被含氮量的波譜指數由Rouse提出的植被指數衍生而來,一般有兩種形式:歸一化指數形式(NDSI)和比值形式(RSI),表示為:
NDSI(x,y)=(y-x)/(x+y)
(2)
RSI(x,y)=x/y
(3)
式中,x,y可以是原始反射率,也可以是經過一系列變換后的相對反射率。具體方法是對所有波段(或篩選后波段)進行兩兩組合,計算相應的波譜指數并與實測植被含氮量數據進行擬合。選出擬合效果最佳的組合,即擬合優度確定系數最大。
目前已有30余種主要的波譜指數,表3列出了較常用的植被含氮量光譜指數。首先是根據氮吸收波長所得的歸一化氮指數NDNI(normalized difference nitrogen index)。此外基于植被葉綠素濃度與含氮量之間的顯著相關性[43],常利用由葉綠素吸收波長構成的葉綠素含量指數來間接計算含氮量,其中常用的指數包括MCARI指數(Modified Chlorophyll Absorption in Reflectance Index), TCARI指數(Transformed Chlorophyll Absorption in Reflectance Index)[44]及孟慶野等改進后提出的MTCARI指數[45],和由反映葉綠素含量的歸一化紅邊指數NDRE(normalized difference red-edge index)得到的CCCI指數(Canopy Chlorophyll Content Index)。其中CCCI指數是當前運用最廣泛的植被含氮量光譜指數,Tilling 首次將此指數利用于機載高光譜數據進行小麥含氮量反演[46]。

表3 植被含氮量估測常用波譜指數
*其中ρi表示inm處的波譜反射率,(NDRE)max和(NDRE)min分別表示NDRE的最大和最小值
研究者還針對不同傳感器的特點提出相應的含氮量光譜指數。如Li等針對多角度高光譜遙感數據,指出觀測角度的改變對采用普通植被指數反演植被氮濃度的效果造成影響,因此提出對角度不敏感的植被指數AIVI(Angular Insensitivity Vegetation Index),并證明該指數與冬小麥葉片氮濃度有較強相關性[47]。另外基于MERIS數據,研究者提出一種紅邊波譜指數MTCI(MERIS terrestrial chlorophyll index),該指數初用于葉綠素含量的反演,后證明也可用于反演植被含氮量[48]。Cho等采用高空間分辨率(RapidEye)遙感影像,用MTCI指數準確估算非洲森林含氮量分布[12],證明該指數有較廣泛的運用價值。
在具體的研究中,根據研究區域和研究對象的不同,用于構建波譜指數的波段也不盡相同,從而發展了不同的植被氮指數。如Inoue等研究發現由一次導數光譜740nm(D740)和552nm(D552)處構建的RSI指數反演水稻葉片含氮量效果最佳,并推測D740與葉面積指數LAI成正比而D552與葉片單位面積的含氮量成反比關系[49]。而譚昌偉認為紅邊波長范圍內一階微分波段值總和SDr與藍邊波長范圍內一階微分波段值總和SDb的歸一化值對水稻氮素最敏感,并以此建立水稻氮素營養高光譜遙感診斷模型[50]。此外還有許多學者采用了推算最佳波譜指數的方法,其中多數是對農作物含氮量的地面高光譜或高光譜遙感反演[51],且波譜指數反演準確性往往優于其它方法所得結果,說明波譜指數法很適合反演農作物含氮量。
3.2 回歸分析法
在植被氮含量遙感監測中最早使用的反演方法就是逐步線性回歸。除Wessman與Peterson外,之后Kokaly[34]、Curran[35]等也都采用了這種較簡單的回歸方法。但該回歸方法存在過度擬合的問題,且所得波段往往與已知吸收波段無關,同時隨數據組的改變結果差異很大而難以信服[52]。而現今最常用的是偏最小二乘回歸(partialleast squares regression,PLSR),大量研究采用該方法并得到很高的回歸精度[42]。PLSR方法原理類似主成分回歸(principle component regression, PCR),兩種回歸方法均有效避免了多項式回歸中多重共線性的問題,因此波段越多時越適用,即特別適用于高光譜數據。偏最小二乘回歸可表達為:
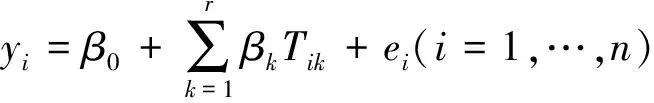
(4)
式中,yi是目標變量,xij是反射率(自變量),m是波段數,n是樣本數,ei是誤差,βk是Tik對yi的回歸系數,Tik是中間變量(即潛在變量),ckj是xij對Tik的回歸系數。
PLSR一般要優于PCR,這是由于PCR中主成分僅由自變量方差決定而PLSR中的潛在變量由自變量和因變量之間協方差共同決定。因此對高光譜反射率信息進行回歸分析時一般用PLSR代替PCR。但PLSR波段數量過大,可能出現波段冗余,給出的分析結果中也很可能包含一些與氮素吸收無關的波段。這些波段構成了較多干擾,降低結果可信度[53]。因此改進的方法是在PLS回歸前根據交叉驗證的結果,按照對均方根誤差(rootmean square error,RMSE)貢獻大小對波段進行篩選,剔除對RMSE貢獻較大的波段,剩余有間隔的波譜。這種方法稱為間隔偏最小二乘回歸(interval PLSR, iPLSR)[54]。iPLSR可得到較PLSR更高的回歸精度,在植被含氮量反演中具有很好的應用潛力[49]。郭超凡等改進了最佳波段篩選策略,采用“舍一交叉法”,進行譜帶分區、分區最佳波段選取與不穩定波段剔除,得蘆葦(香蒲)含氮量反演最佳波段集為550(555)、580、715nm,并指出入選波段可從生化參數角度解釋[55]。
此外還有支持向量機和神經網絡回歸方法,如Axelsson對紅樹林葉片含氮量反演中認為支持向量機回歸效果優于PLSR,其中采用least squares SVR (LS-SVR)所得回歸效果最佳[56]。而Huang等的研究中神經網絡回歸相比PLSR及逐步多元回歸相比擬合度更高,說明植被葉片生化含量與冠層反射率可能存在非線性關系[57]。Wang等的研究用反向傳播神經網絡(BPN)反演油菜含氮量效果優于逐步線性回歸[58]。Mutanga等也通過神經網絡回歸得到草地氮素含量很好的反演結果[59]。
研究者也在陸續推出新的經驗反演方法,李旭青等將隨機森林算法應用于水稻冠層氮素含量反演,在實驗區達到較高的預測精度(R=0.83)[60]。此外,Ollinger等提出近紅外波段雙向反射因子(bidirectional reflectance factor, BRF)與植被含氮量存在顯著相關性,因此可反演植被含氮量[32]。但隨后有研究者對此提出質疑,指出BRF與含氮量之間的相關性是源于BRF與不同種類植被葉片結構之間的相關性以及植被種類與含氮量之間的相關性。當消除植被種類(結構)的效應后,BRF與植被含氮量之間相關性減弱,甚至存在一定負相關[61]。
3.3 輻射傳輸模型方法
植被輻射傳輸模型是根據電磁波(太陽光)經大氣吸收、散射后到達地面,被地表植被及土壤等吸收、反射、散射,而后再經過大氣衰減后到達傳感器的過程而建立的反射率(傳感器接收輻射通量與太陽光輻射通量比值)與地表(植被)參數及大氣參數等之間關系的物理模型。其中一些輻射傳輸模型可以用于反演植被含氮量。
LIBERTY模型是唯一一個有葉片含氮量作為輸入因子的植被葉片輻射傳輸模型,因而可以直接反演葉片氮素含量。但由于該模型比較復雜,在實際的反演中很少被采用。目前植被含氮量反演更多采用的是形式較簡單的PROSPECT模型,即對PROSPECT模型中的植被參數進行反演,然后采用植被參數來間接推算植被含氮量。PROSPECT模型用來建立和植被含氮量相關關系最常用的參數是葉綠素。植被中葉綠素由類囊體組成,而類囊體成分主要是蛋白質,所以植被含氮量與葉綠素含量一般存在正比關系[1]。通過輻射傳輸模型進行葉綠素含量反演一般依賴于高光譜數據,對針葉樹葉綠素反演一般都較成功,如Malenovsk[62]與Zarco-Tejada等[44]的研究。近年也有研究者使用普通多光譜遙感數據對闊葉林葉綠素進行了比較成功的反演[63]。
除PROSPECT外,常用的輻射傳輸模型還有四分量(4-scale)模型、SAIL模型、PROSAIL模型等。此外還可將四分量模型和PROSPECT模型組合,如Zhang, Chen等利用PROSPECT 建立葉片生化參數的查找表,并用4-Scale 建立一個將冠層光譜轉化為葉片光譜的查找表,進行分步反演[63-64]。此外,單位面積葉片質量(leaf mass per unit area, LMA)與等效水厚度( equivalent water thickness, EWT)也可作為參數進行反演[65],再通過LMA與含氮量(單位葉面積的氮素質量,Narea)[66]、EWT與含氮量(單位葉面積的氮素質量,Narea)的相關性[67]反演含氮量。Wang等的研究中由PROSPECT模型所得植被等效水厚度反演含氮量精度最高[68]。
3.4 國內遙感反演植被含氮量研究總結
自浦瑞良與宮鵬之后,國內研究者也相繼開展了遙感反演植被含氮量的相關研究工作。其中陳鏡明等對PROSPECT模型反演植被葉綠素含量及進一步反演含氮量作出了重要貢獻[63-64]。此外一些中國學者對已有方法提出改進,如孟慶野等對TCARI指數進行改進[45];郭超凡等改進了偏最小二乘回歸前最佳波段篩選策略[55]。而將國外比較新穎的經驗方法應用于植被氮素含量反演也是很有價值的嘗試,如王淵等采用反向傳播神經網絡回歸方法[58];李旭青等采用了機器學習中的隨機森林算法[60]等。
目前國內遙感反演植被含氮量總體仍處于起步階段, 主要是已有植被含氮量反演方法的應用。國內反演植被含氮量研究比較集中在利用地面光譜儀進行局地尺度的農作物氮素反演,這是由于我國是農業大國,農作物的產量與質量對維系國計民生至關重要。相比而言,采用機載或星載高光譜數據反演較大區域草地或森林植被含氮量的研究工作還較少,因此未來的研究中應加強這方面的工作,特別是針對經濟社會發展、人類干擾增強對草地與森林生態系統植被含氮量變化的影響的研究。搭載了具有甚高空間分辨率與光譜分辨率的高光譜傳感器的高分五號遙感衛星預計將于今年9月下旬發射,必將很大程度上推動國內該領域相關研究的發展。
4 遙感反演植被含氮量面臨的困境和挑戰
遙感監測使得區域范圍實時動態監測植被含氮量成為可能,目前的監測主要依賴于高光譜遙感數據,采用的波譜指數法、回歸分析法和輻射傳輸模型分析法各自存在局限,因此植被含氮量反演還存在很大的不確定性。
波譜指數法簡單易行,通過確定最佳組合波段,構建的波譜指數反演植被含氮量精度或優于其他方法。但波譜指數對土壤背景等較敏感,且最終篩選出的波段可能與已知植被氮元素吸收波段無關,在機理層面難解釋。而已有的經典植被含氮量指數大多本質上是葉綠素含量指數。但研究發現,當葉綠素濃度或含氮量較高時[69],或對于氮素限制不顯著的生態系統如熱帶雨林[70],葉綠素含量與氮素含量均不存在顯著相關性。在這些情形下用葉綠素含量指數推算植被含氮量會產生較大誤差。在應用領域方面,波譜指數法一般僅適用于空間范圍很小且植被種類與結構特征單一的情形,因而常被用于基于地面光譜儀或低空無人機高光譜數據的農作物生長狀況監測,反演森林植被含氮量通常無法獲得較準確結果,這極大限制了該方法的應用與發展。
回歸分析法是植被含氮量遙感反演中應用最廣泛的方法,偏最小二乘回歸與神經網絡等被廣泛應用于森林植被含氮量反演。但一些回歸方法常常出現過度擬合的問題,所得主要用于回歸的波段也大多與已知氮素吸收相關波段難以紊合。另一方面,回歸分析方法是建立在實測植被含氮量數據準確的假設下的。實測數據的誤差可能導致回歸方程出現整體性偏差,因此回歸分析反演對實測數據誤差的敏感性高于波譜指數法。但地面實測葉片平均含氮量誤差似乎不可避免,特別是對于目前星載高光譜數據,由于空間分辨率有限,單一像元面積大,使得實測葉片含氮量時僅能在像元面積范圍內隨機選取少量葉片進行測定。即使測定過程是準確的,所得數值也無法準確反映該像元內部整體平均葉片含氮量。此外,回歸分析法一般需采用上百個波段的反射率數據,遠遠大于波譜指數法與輻射傳輸模型法所用到的波段。而遙感傳感器不同波段的信噪比不同,如主要用于回歸的波段中有一部分信噪比較大,那么反演結果的真實與準確性便也難保證。因此未來仍需不斷提高星載高光譜數據質量,提高傳感器空間分辨率,降低信噪比。
使用遙感輻射傳輸模型進行植被含氮量的反演具有理論依據,且同時適用于高光譜遙感和其他傳感器的影像數據(如多角度、多光譜數據)。但葉片中含氮化合物較多使得直接反演植被含氮量非常困難,一般僅能通過葉綠素含量、單位面積葉片質量LMA、等效水厚度EWT的反演間接得到植被含氮量,因此反演所得含氮量與葉片其它性質間不可避免地存在較大協變性[71]。且需注意到,葉綠素含量與植被含氮量之間在氮素豐富環境下相關性較差;LMA與植被含氮量之間關系受樹葉年齡與季節變化[72]、樹種及生存環境[73]等因素的影響;EWT與植被含氮量之間直接相關性研究很少,在生理層面也較難解釋[68],可能僅對特定環境與植被類型成立,因此同樣存在較大不確定性。另一方面,輻射傳輸反演模型參數眾多,計算過程復雜,在一定尺度下才適用[74],再加上輻射傳輸模型構建本身的一系列假定均會帶來反演誤差,在實際應用中植被含氮量的反演精度可能還不及經驗方法。
此外,遙感反演的是像元平均植被含氮量,以上遙感反演方法適用于植被覆蓋度高的農田或森林區域。對于中低植被覆蓋區域植被含氮量,混合像元帶來的反演誤差是目前困擾植被含氮量遙感反演的難題[74]。
總體來說,受研究方法的局限,目前植被含氮量遙感監測仍局限于較小的區域,一個小區域的反演方法無法推廣至其它區域,也無法推廣至景觀水平以上。因現今反演方法均要求研究區內部環境條件基本一致,植被類型單一,如以常綠闊葉林為主,甚至是單一物種如水稻或小麥。
5 結論與展望
植被含氮量作為表征植被生長狀況的重要指標,在評估生態系統生產力和表征生態系統動態等方面起到了不可忽視的作用,在當今生態系統氮元素循環干擾日益加劇的情勢下,植被含氮量監測在人類活動和氣候變化的生態系統響應研究中將處于更重要的位置。目前的遙感監測植被含氮量主要是針對特定區域和特定植被類型的植被健康狀況監測、生態系統凈初級生產估算、農業精準化以及干擾評估等問題,采用的算法可分為經驗方法(波譜指數與回歸分析法)與輻射傳輸模型法,主要基于高光譜或多光譜遙感數據進行反演。目前各類植被氮含量反演方法反演準確性均有待提升,且應用局限性強,主要表現在對復雜生態系統的監測能力不足,魯棒性差,無法形成大區域范圍的監測能力。
因此未來的研究需針對全球氣候變化和人類活動的生態系統響應這一研究需求,進一步發展和改進植被含氮量遙感反演方法。特別是針對目前森林生態系統監測能力的不足,擴大遙感監測的范圍和精度,提高遙感監測植被含氮量的能力。可以考慮從以下兩方面進行(圖1):
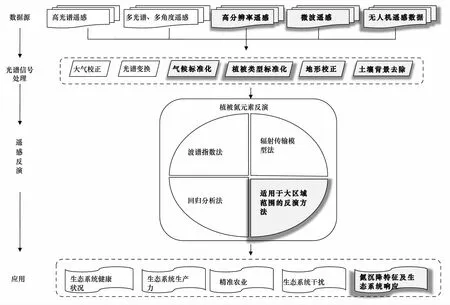
圖1 植被含氮量遙感反演方法及未來研究重點(未來研究重點以灰色表示)Fig.1 Remote sensing inversion methods of vegetation nitrogen content (Grey areas indicate the main research points in near future)
(1)發展大尺度的植被含氮量遙感反演方法
環境條件及由植被類型不同造成的林冠層結構參數的差異對光譜的影響是制約大區域范圍內植被含氮量監測的根本原因,目前在各個小研究區內發展并使用的經驗算法難以推廣使用。
Martin等通過Meta-Analysis,整合美國、哥斯達黎加與澳大利亞8個氣候、地形、樹種構成均有差異的郁閉森林生態系統,采用求總體平均的思路,得到較普適的回歸方程[42]。但該法僅對環境條件及樹種含氮量適中的地區有較好的擬合,因其并未解決如何消除環境條件及樹種差異對植被反射率的影響這一根本問題。因此,發展更普適的植被氮含量反演方法需引入環境標準化因子和植被類型標準化因子對光譜數據進行標準化處理。
其中環境標準化因子可簡化為“氣候標準化系數”和地形校正系數。其中“氣候標準化系數”用于消除同類植被由所處氣候區不同造成的植被生長狀況及冠層結構差異對冠層反射率的影響,可定義為其它氣候區內相近含氮量的某類型植被各波段反射率校正至預設的“標準氣候區”內該類植被相應波段反射率的系數。另一方面,由于森林植被大多處于地形復雜的山區,陰坡和陽坡波譜反射率有時差異很大。因此對森林冠層含氮量遙感反演時,利用地形校正系數將坡面植被波譜反射率校正為近平地植被反射光譜很有必要。現有的地形校正模型包括C校正、SCS校正、Minnaert校正、SCS+C校正、Sandmeire校正等,對于植被覆蓋度較高的山區,SCS+C方法所得地形校正系數一般較準確[75]。
而引入植被類型標準化因子是為了降低相同或相近環境條件下因不同類型植被冠層結構不同(如針葉與闊葉林)導致的光譜曲線的差異。如DASF(雙向面積散射因子,directional area scattering factor)與森林中針葉林與闊葉林的組成比例有一定相關性,因而將其作為除數或能起到一定的光譜標準化作用[61]。此外也可通過建立光譜數據庫,將一定氣候區內不同類型植被光譜標準化至該氣候區“標準植被類型”的反射光譜。具體方法同“氣候標準化系數”的確定。
(2)多源數據聯合使用反演植被含氮量
大區域范圍的植被含氮量反演需聯合采用多種來源的數據資料,并考慮多尺度聯合監測以及進行尺度上推的反演思路。
采用經驗方法進行植被含氮量反演必須建立在準確的地面實測數據上。其中目標樣地不同樹種葉面積比例通過傳統的點樣方照相法獲取費時費力,可考慮采用無人機搭載高分辨率相機航拍的方式取代。其次,星載高光譜數據(可以Hyperion為例)空間分辨率較低,使得單一柵格平均葉片含氮量實測困難,準確性低。因此必須補充中間尺度數據才能進一步提升反演準確性,無人機遙感的應用可以實現這一點。用無人機搭載光譜儀在低空拍攝,使取景范圍限制在幾十平米,結合地面實測數據可獲得植被含氮量光譜反演回歸式。而后升高無人機高度,對Hyperion影像中4個相鄰柵格(為避免空間配準誤差造成的影響)區域成像,經配準、裁剪后利用上述反演式可計算出此區域內平均植被含氮量。將其作為實測值,再與Hyperion影像的波譜反射率進行回歸分析便可得到該區域內Hyperion數據反演植被含氮量的回歸式。因此,無人機遙感的應用有助于提升實測數據準確性并可實現植被含氮量從小尺度向大尺度的推演。此外,無人機遙感還可彌補普通機載與星載高光譜數據時間分辨率較低的問題,有助于實現對生態系統,特別是農田生態系統植被含氮量的長期、實時監測。
機載或星載高光譜影像中提取的植被光譜經大氣校正后,仍包含土壤的光譜信息。在植被較稀疏的情況下,土壤的光譜反射率會對植被含氮量的反演造成較大干擾。消除土壤背景的干擾需要融合高空間分辨率遙感(如Worldview,IKONOS,QuickBird等)或激光雷達遙感(LiDAR)數據,從中提取植被冠層覆蓋度信息,并據此建立研究區植被指數(可由高光譜影像計算得到)與植被覆蓋度之間的相關性,從而推算出影像各柵格處植被覆蓋度及相應裸土面積比例。
高光譜和多光譜遙感是非極化測量的方式,無法區分植被表層(冠層頂部)含氮量與冠層內部含氮量[61]。未來的研究中將主動微波極化測量數據融合,利用葉片表面反射輻射是部分極化的這一特性區分光譜曲線中分別來自于植被冠層表層與內部的理化參數的影響也是值得考慮的。
最后,未來的研究也需要考慮將遙感反演植被氮含量和生態系統模型,地統計學模型等方法的有機結合,以拓寬植被氮含量監測結果的應用領域。特別是需加強植被含氮量監測對大氣氮沉降和人類活動對生態系統干擾程度的表征作用。
[1] Field C, Mooney H A. The photosynthesis-nitrogen relationship in wild plants//Givnish T J, ed. On the Economy of Plant form and Function. Cambridge: Cambridge University Press, 1986.
[2] 馮偉, 朱艷, 田永超, 曹衛星, 姚霞, 李映雪. 基于高光譜遙感的小麥葉片氮積累量. 生態學報, 2008, 28(1): 23-32.
[3] Ranjan R, Chopra U K, Sahoo R N, Singh A K, Pradhan S. Assessment of plant nitrogen stress in wheat (TriticumaestivumL.) through hyperspectral indices. International Journal of Remote Sensing, 2012, 33(20): 6342-6360.
[4] Reich P B, Walters M B, Kloeppel B D, Ellsworth D S. Different photosynthesis-nitrogen relations in deciduous hardwood and evergreen coniferous tree species. Oecologia, 1995, 104(1): 24-30.
[5] Green D S, Erickson J E, Kruger E L. Foliar morphology and canopy nitrogen as predictors of light-use efficiency in terrestrial vegetation. Agricultural and Forest Meteorology, 2003, 115(3/4): 163-171.
[6] Smith M L, Ollinger S V, Martin M E, Aber J D, Hallett R A, Goodale C L. Direct estimation of aboveground forest productivity through hyperspectral remote sensing of canopy nitrogen. Ecological Applications, 2002, 12(5): 1286-1302.
[7] Ollinger S V, Smith M L. Net Primary production and canopy nitrogen in a temperate forest landscape: an analysis using imaging spectroscopy, modeling and field data. Ecosystems, 2005, 8(7): 760-778.
[8] Wythers K R, Reich P B, Tjoelker M G, Bolstad P B. Foliar respiration acclimation to temperature and temperature variableQ10alter ecosystem carbon balance. Global Change Biology, 2005, 11(3): 435-449.
[9] Waring R H, Coops N C, Landsberg J J. Improving predictions of forest growth using the 3-PGS model with observations made by remote sensing. Forest Ecology and Management, 2010, 259(9): 1722-1729.
[10] Mcneil B E, de Beurs K M, Eshleman K N, Foster J R, Townsend P A. Maintenance of ecosystem nitrogen limitation by ephemeral forest disturbance: an assessment using MODIS, Hyperion, and Landsat ETM+. Geophysical Research Letters, 2007, 341(19): L19406.
[11] Deel L N, McNeil B E, Curtis P G, Serbin S P, Singh A, Eshleman K N, Townsend P A. Relationship of a Landsat cumulative disturbance index to canopy nitrogen and forest structure. Remote Sensing of Environment, 2012, 118: 40-49.
[12] Cho M A, Ramoelo A, Debba P, Mutanga O, Mathieu R, van Deventer H, Ndlovu N. Assessing the effects of subtropical forest fragmentation on leaf nitrogen distribution using remote sensing data. Landscape Ecology, 2013, 28(8): 1479-1491.
[13] Asner G P, Vitousek P M. Remote analysis of biological invasion and biogeochemical change. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(12): 4383-4386.
[14] Lamarque J F, Kiehl J T, Brasseur G P, Butler T, Cameron‐Smith P, Collins W D, Collins W J, Granier C, Hauglustaine D, Hess P G, Holland E A, Horowitz L, Lawrence M G, McKenna D, Merilees P, Prather M J, Rasch P J, Rotman D, Shindell D, Thornton P. Assessing future nitrogen deposition and carbon cycle feedback using a multimodel approach: analysis of nitrogen deposition. Journal of Geophysical Research, 2005, 110(D19): D19303.
[15] Aber J, McDowell W, Nadelhoffer K, Magill A, Berntson G, Kamakea M, McNulty S, Currie W, Rustad L, Fernandez I. Nitrogen saturation in temperate forest ecosystems: hypotheses revisited. Bioscience, 1998, 48(11): 921-934.
[16] Wang X L, Wang Q, Yang S T, Zheng D H, Wu C Q, Mannaerts C M. Evaluating nitrogen removal by vegetation uptake using satellite image time series in riparian catchments. Science of the Total Environment, 2011, 409(13): 2567-2576.
[17] Ollinger S V, Smith M L, Martin M E, Hallett R A, Goodale C L, Aber J D. Regional variation in foliar chemistry and N cycling among forests of diverse history and composition. Ecology, 2002, 83(2): 339-355.
[18] Moran M S, Inoue Y, Barnes E M. Opportunities and limitations for image-based remote sensing in precision crop management. Remote Sensing of Environment, 1997, 61(3): 319-346.
[19] Curran P J. Remote sensing of foliar chemistry. Remote Sensing of Environment, 1989, 30(3): 271-278.
[20] Kokaly R F. Investigating a physical basis for spectroscopic estimates of leaf nitrogen concentration. Remote Sensing of Environment, 2001, 75(2): 153-161.
[21] Mutanga O, Skidmore A K, van Wieren S. Discriminating tropical grass (Cenchrusciliaris) canopies grown under different nitrogen treatments using spectroradiometry. ISPRS Journal of Photogrammetry and Remote Sensing, 2003, 57(4): 263-272.
[22] Johnson L F, Hlavka C A, Peterson D L. Multivariate analysis of AVIRIS data for canopy biochemical estimation along the oregon transect. Remote Sensing of Environment, 1994, 47(2): 216-230.
[23] Mitchell J J, Glenn N F, Sankey T T, Derryberry D R, Germino M J. Remote sensing of sagebrush canopy nitrogen. Remote Sensing of Environment, 2012, 124: 217-223.
[25] 方紅亮, 田慶久. 高光譜遙感在植被監測中的研究綜述. 遙感技術與應用, 1998, 13(1): 62-69.
[26] Peterson D L, Aber J D, Matson P A, Card D H, Swanberg N, Wessman C, Spanner M. Remote sensing of forest canopy and leaf biochemical contents. Remote Sensing of Environment, 1988, 24(1): 85-108.
[27] Wessman C A, Aber J D, Peterson D L, Melillo J M. Remote sensing of canopy chemistry and nitrogen cycling in temperate forest ecosystems. Nature, 1988, 335(6186): 154-156.
[28] Martin M E, Aber J D. High spectral resolution remote sensing of forest canopy lignin, nitrogen, and ecosystem processes. Ecological Applications, 1997, 7(2): 431-443.
[29] 浦瑞良, 宮鵬. 森林生物化學與CASI高光譜分辨率遙感數據的相關分析. 遙感學報, 1997, 1(2): 115-123.
[30] Smith M L, Martin M E, Plourde L, Ollinger S V. Analysis of hyperspectral data for estimation of temperate forest canopy nitrogen concentration: comparison between an airborne (AVIRIS) and a spaceborne (Hyperion) sensor. IEEE Transactions on Geoscience and Remote Sensing, 2003, 41(6): 1332-1337.
[31] Staenz K, Held A. Summary of current and future terrestrial civilian hyperspectral spaceborne systems//Proceedings of 2012 IEEE International Geoscience and Remote Sensing Symposium. Munich, Germany: IEEE, 2012.
[32] Ollinger S V, Richardson A D, Martin M E, Hollinger D Y, Frolking S E, Reich P B, Plourde L C, Katul G G, Munger J W, Oren R, Smith M L, Paw U K T, Bolstad P V, Cook B D, Day M C, Martin T A, Monson R K, Schmid H P. Canopy nitrogen, carbon assimilation, and albedo in temperate and boreal forests: functional relations and potential climate feedbacks. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(49): 19336-19341.
[33] Clark R N, Roush T L. Reflectance spectroscopy: quantitative analysis techniques for remote sensing applications. Journal of Geophysical Research, 1984, 89(B7): 6329-6340.
[34] Kokaly R F, Clark R N. Spectroscopic determination of leaf biochemistry using band-depth analysis of absorption features and stepwise multiple linear regression. Remote Sensing of Environment, 1999, 67(3): 267-287.
[35] Curran P J, Dungan J L, Peterson D L. Estimating the foliar biochemical concentration of leaves with reflectance spectrometry: testing the Kokaly and Clark methodologies. Remote Sensing of Environment, 2001, 76(3): 349-359.
[36] 田慶久, 陳君穎. 基于Hyperion影像的水稻冠層氮和葉綠素含量反演研究//第16屆全國遙感技術學術交流會論文集. 北京: 中國地質學會, 2008,
[37] 王淵, 黃敬峰, 王福民, 劉占宇. 油菜葉片和冠層水平氮素含量的高光譜反射率估算模型. 光譜學與光譜分析, 2008, 28(2): 273-277.
[38] Madden H H. Comments on the Savitzky-Golay convolution method for least-squares-fit smoothing and differentiation of digital data. Analytical Chemistry, 1978, 50(9): 1383-1386.
[39] Gao B C, Goetz A F H. Extraction of dry leaf spectral features from reflectance spectra of green vegetation. Remote Sensing of Environment, 1994, 47(3): 369-374.
[40] Schlerf M, Atzberger C, Hill J, Buddenbaum H, Werner W, Schüler G. Retrieval of chlorophyll and nitrogen in Norway spruce (PiceaabiesL.Karst.) using imaging spectroscopy. International Journal of Applied Earth Observation and Geoinformation, 2010, 12(1): 17-26.
[41] 陳君穎, 田慶久, 亓雪勇, 劉曉臣, 管仲. 基于Hyperion影像的水稻冠層生化參量反演. 遙感學報, 2009, 13(6): 1106-1121.
[42] Martin M E, Plourde L C, Ollinger S V, Smith M L, Mcneil B E. A generalizable method for remote sensing of canopy nitrogen across a wide range of forest ecosystems. Remote Sensing of Environment, 2008, 112(9): 3511-3519.
[43] Daughtry C S T, Walthall C L, Kim M S, de Colstoun E B, McMurtrey III J E. Estimating corn leaf chlorophyll concentration from leaf and canopy reflectance. Remote Sensing of Environment, 2000, 74(2): 229-239.
[44] Haboudane D, Miller J R, Tremblay N, Zarco-Tejada P J, Dextraze L. Integrated narrow-band vegetation indices for prediction of crop chlorophyll content for application to precision agriculture. Remote Sensing of Environment, 2002, 81(2/3): 416-426.
[45] 孟慶野, 董恒, 秦其明, 王金梁, 趙江華. 基于高光譜遙感監測植被葉綠素含量的一種植被指數MTCARI. 光譜學與光譜分析, 2012, 32(8): 2218-2222.
[46] Tilling A K, O′Leary G J, Ferwerda J G, Jones S D, Fitzgerald G J, Rodriguez D, Belford R. Remote sensing of nitrogen and water stress in wheat. Field Crops Research, 2007, 104(1/3): 77-85.
[47] He L, Song X, Feng W, Guo B B, Zhang Y S, Wang Y H, Wang C Y, Guo T C. Improved remote sensing of leaf nitrogen concentration in winter wheat using multi-angular hyperspectral data. Remote Sensing of Environment, 2016, 174: 122-133.
[48] Dash J, Curran P J. Evaluation of the MERIS terrestrial chlorophyll index (MTCI). Advances in Space Research, 2007, 39(1): 100-104.
[49] Inoue Y, Sakaiya E, Zhu Y, Takahashi W. Diagnostic mapping of canopy nitrogen content in rice based on hyperspectral measurements. Remote Sensing of Environment, 2012, 126: 210-221.
[50] 譚昌偉, 周清波, 齊臘, 莊恒揚. 水稻氮素營養高光譜遙感診斷模型. 應用生態學報, 2008, 19(6): 1261-1268.
[51] Chen P F, Wang J H, Huang W J, Tremblay N, Ou Y Z, Zhang Q. Critical nitrogen curve and remote detection of nitrogen nutrition index for corn in the Northwestern Plain of Shandong province, China. IEEE Journal of Selected Topics in Applied Earth Observations and Remote Sensing, 2013, 6(2): 682-689.
[52] Grossman Y L, Ustin S L, Jacquemoud S, Sanderson E W, Schmuck G, Verdebout J. Critique of stepwise multiple linear regression for the extraction of leaf biochemistry information from leaf reflectance data. Remote Sensing of Environment, 1996, 56(3): 182-193.
[53] Spiegelman C H, Mcshane M J, Goetz M J, Motamedi M, Yue Q L, Coté G L. Theoretical justification of wavelength selection in PLS calibration: development of a new algorithm. Analytical Chemistry, 1998, 70(1): 35-44.
[54] N?rgaard L, Saudland A, Wagner J, Nielsen J P, Munck L, Engelsen S B. Interval partial least-squares regression (iPLS): a comparative chemometric study with an example from near-infrared spectroscopy. Applied Spectroscopy, 2000, 54(3): 413-419.
[55] 郭超凡, 段福洲, 郭逍宇, 趙文吉, 劉克. 基于最佳波段判別的濕地植物葉片全氮反演研究. 生態學報, 2014, 34(17): 4839-4849.
[56] Axelsson C, Skidmore A K, Schlerf M, Fauzi A, Verhoef W. Hyperspectral analysis of mangrove foliar chemistry using PLSR and support vector regression. International Journal of Remote Sensing, 2013, 34(5): 1724-1743.
[57] Huang Z, Turner B J, Dury S J, Wallis I R, Foley W J. Estimating foliage nitrogen concentration from HYMAP data using continuum removal analysis. Remote Sensing of Environment, 2004, 93(1/2): 18-29.
[58] Wang Y, Wang F M, Huang J F, Wang X Z, Liu Z Y. Validation of artificial neural network techniques in the estimation of nitrogen concentration in rape using canopy hyperspectral reflectance data. International Journal of Remote Sensing, 2009, 30(17): 4493-4505.
[59] Mutanga O, Skidmore A K. Integrating imaging spectroscopy and neural networks to map grass quality in the Kruger National Park, South Africa. Remote Sensing of Environment, 2004, 90(1): 104-115.
[60] 李旭青, 劉湘南, 劉美玲, 吳伶. 水稻冠層氮素含量光譜反演的隨機森林算法及區域應用. 遙感學報, 2014, 18(4): 923-945.
[61] Knyazikhin Y, Schull M A, Stenberg P, M?ttus M, Rautiainen M, Yang Y, Marshak A, Latorre Carmona P, Kaufmann R K, Lewis P, Disney M I, Vanderbilt V, Davis A B, Baret F, Jacquemoud S, Lyapustin A, Myneni R B. Hyperspectral remote sensing of foliar nitrogen content. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(3): E185-E192.
[63] Croft H, Chen J M, Zhang Y, Simic A. Modelling leaf chlorophyll content in broadleaf and needle leaf canopies from ground, CASI, Landsat TM 5 and MERIS reflectance data. Remote Sensing of Environment, 2013, 133: 128-140.
[64] Zhang Y Q, Chen J M, Miller J R, Noland T L. Leaf chlorophyll content retrieval from airborne hyperspectral remote sensing imagery. Remote Sensing of Environment, 2008, 112(7): 3234-3247.
[65] Ceccato P, Flasse S, Tarantola S, Jacquemoud S, Grégoire J M. Detecting vegetation leaf water content using reflectance in the optical domain. Remote Sensing of Environment, 2001, 77(1): 22-33.
[66] Rosati A, Day K R, DeJong T M. Distribution of leaf mass per unit area and leaf nitrogen concentration determine partitioning of leaf nitrogen within tree canopies. Tree Physiology, 2000, 20(4): 271-276.
[67] Sullivan F B, Ollinger S V, Martin M E, Ducey M J, Lepine L C, Wicklein H F. Foliar nitrogen in relation to plant traits and reflectance properties of New Hampshire forests. Canadian Journal of Forest Research, 2013, 43(1): 18-27.
[68] Wang Z H, Skidmore A K, Darvishzadeh R, Heiden U, Heurich M, Wang T J. Leaf nitrogen content indirectly estimated by leaf traits derived from the PROSPECT model. IEEE Journal of Selected Topics in Applied Earth Observations and Remote Sensing, 2015, 8(6): 3172-3182.
[69] Yoder B J, Pettigrew-Crosby R E. Predicting nitrogen and chlorophyll content and concentrations from reflectance spectra (400-2500 nm) at leaf and canopy scales. Remote Sensing of Environment, 1995, 53(3): 199-211.
[70] Asner G P, Martin R E. Airborne spectranomics: mapping canopy chemical and taxonomic diversity in tropical forests. Frontiers in Ecology and the Environment, 2009, 7(5): 269-276.
[71] Kokaly R F, Asner G P, Ollinger S V, Martin M E, Wessman C A. Characterizing canopy biochemistry from imaging spectroscopy and its application to ecosystem studies. Remote Sensing of Environment, 2009, 113(Suppl 1): S78-S91.
[72] Reich P B, Walters M B, Ellsworth D S. Leaf age and season influence the relationships between leaf nitrogen, leaf mass per area and photosynthesis in maple and oak trees. Plant, Cell & Environment, 1991, 14(3): 251-259.
[73] Niinemets ü. Research review. Components of leaf dry mass per area-thickness and density-alter leaf photosynthetic capacity in reverse directions in woody plants. New Phytologist, 1999, 144(1): 35-47.
[74] 肖艷芳, 周德民, 趙文吉. 輻射傳輸模型多尺度反演植被理化參數研究進展. 生態學報, 2013, 33(11): 3291-3297.
[75] Soenen S A, Peddle D R, Coburn C A. SCS+C: a modified Sun-canopy-sensor topographic correction in forested terrain. IEEE Transactions on Geoscience and Remote Sensing, 2005, 43(9): 2148-215
Overviewandoutlookofremotesensinginversionofvegetationnitrogencontent
CHEN Yongzhe1,2, FU Bojie1,2, FENG Xiaoming1,2,*
1StateKeyofUrbanandRegionalEcology,ResearchCenterforEco-EnvironmentalSciences,ChineseAcademyofSciences,Beijing100085,China2UniversityofChineseAcademyofSciences,Beijing100049,China
Vegetation nitrogen content is an important indicator of vegetation growth, which plays an important role in fields of ecosystem monitoring including ecosystem health, net primary ecosystem, the disturbance of ecosystem, as well as in the precision agriculture management.Remote sensing inversion of vegetation nitrogen content currently relies on the hyperspectral/multispectral data. The inversion methods can be categorized into that based onvegetation indices, regression analysis (e.g. partial least squares regression) and radiation transfer models separately. Current satellite-based inversion of vegetation nitrogen content is limited to a small area, uniformed in species of vegetation and the environmental condition (e.g. climatecondition, topography et al). As a result, the inversion works poor for complex ecosystems. In order to meet the requirements of increasingly meaningful research projects such as global nitrogen deposition and the response of ecosystems to human activities, current methods of vegetation nitrogen content inversion need further development. It may be a potential solution to carry out research on the standardization of vegetation spectrum of different types of plants, as well as under different environmental conditions to generate more general or even universal inversion methods of vegetation nitrogen content. On the other hand, comprehensive utilization of multiple data from various sources (e.g. microwave remote sensing and unmanned aerial vehicle remote sensing data) will be an alternative solution to multi-scale simultaneous monitoring, which helps to improve remote sensing′s routine monitoring capability of regional and worldwide vegetation nitrogen content.
vegetation nitrogen content; remote sensing; inversion method; limitation and challenge
國家自然科學基金重大項目(41390464)
2017- 07- 13;
2017- 09- 11
*通訊作者Corresponding author.E-mail: fengxm@rcees.ac.cn
10.5846/stxb201707131271
陳永喆,傅伯杰,馮曉明.遙感反演植被含氮量研究進展.生態學報,2017,37(18):6240- 6252.
Chen Y Z, Fu B J, Feng X M.Overview and outlook of remote sensing inversion of vegetation nitrogen content.Acta Ecologica Sinica,2017,37(18):6240- 6252.

