Let-7b對骨髓基質干細胞誘導分化為神經元的作用研究
李進領,李 智,李 琳,張 靜,賈延劼,安 穎
1.450007河南省鄭州市,鄭州大學附屬鄭州中心醫院神經內科 2.119991俄羅斯莫斯科,莫斯科國立謝東諾夫第一醫科大學 3.450052河南省鄭州市,鄭州大學第一附屬醫院神經內科
·論著·
*通信作者:張靜,主治醫師;E-mail:yzkl0112@163.com
Let-7b對骨髓基質干細胞誘導分化為神經元的作用研究
李進領1,李 智2,李 琳1,張 靜3*,賈延劼3,安 穎1
1.450007河南省鄭州市,鄭州大學附屬鄭州中心醫院神經內科 2.119991俄羅斯莫斯科,莫斯科國立謝東諾夫第一醫科大學 3.450052河南省鄭州市,鄭州大學第一附屬醫院神經內科
目的探討Let-7b在大鼠骨髓間充質干細胞(MSCs)分化為神經元過程中的作用。方法2013年1—12月將80只SPF級SD大鼠隨機分為空白對照組、陰性對照組、Let-7b-up慢病毒載體(LV-rno-Let-7b-up)組、Let-7b-inhibition慢病毒載體(LV-rno-Let-7b-inhibition)組,每組20只。將陰性對照組、LV-rno-Let-7b-up組、LV-rno-Let-7b-inhibition組大鼠分別感染EGFP空病毒,采用頸椎脫臼法處死4組大鼠,并獲取MSCs,傳代培養4代后備用。取傳代培養的MSCs感染慢病毒,具體為:空白對照組、陰性對照組不進行感染,LV-rno-Let-7b-up組、LV-rno-Let-7b-inhibition組分別感染LV-rno-Let-7b-up、Let-7b-inhibition,采用MTT法檢測感染前、感染后24 h、感染后5 d MSCs存活率。采用法舒地爾對4組進行誘導實驗,觀察MSCs分化為神經元的分化效率。采用免疫組化法檢測4組神經元烯醇化酶(NSE)、神經微管結合蛋白(MAP-2)、微管相關蛋白(Tau)水平,RT-PCR法檢測4組NSE、MAP-2、Tau mRNA水平。結果LV-rno-Let-7b-up組MSCs于LV-rno-Let-7b-up感染后第3天熒光表達最強,LV-rno-Let-7b-inhibition組MSCs于LV-rno-Let-7b-inhibition感染后第5天熒光表達最強。感染第5天時,陰性對照組、LV-rno-Let-7b-up組、LV-rno-Let-7b-inhibition組MSCs感染率分別為87.46%、86.81%、87.12%。感染后24 h、5 d陰性對照組、LV-rno-Let-7b-up組、LV-rno-Let-7b-inhibition組MSCs存活率低于空白對照組(P<0.05);陰性對照組、LV-rno-Let-7b-up組、LV-rno-Let-7b-inhibition組感染后5 d MSCs存活率高于感染后24 h(P<0.05)。陰性對照組和空白對照組部分MSCs呈現神經元樣改變;LV-rno-Let-7b-up組極大部分MSCs出現典型的神經元樣結構;LV-rno-Let-7b-inhibition組僅有少量MSCs出現典型的神經元樣結構。LV-rno-Let-7b-up組NSE、MAP-2、Tau及其mRNA水平高于空白對照組、陰性對照組(P<0.05);LV-rno-Let-7b-inhibition組NSE、MAP-2、Tau及其mRNA水平低于空白對照組、陰性對照組(P<0.05)。結論感染LV-rno-Let-7b-up后大鼠MSCs分化為神經元的分化效率增加,提示Let-7b可促進MSCs向神經元分化。
神經元;干細胞,骨髓;慢病毒屬;Let-7b;細胞分化
骨髓基質干細胞(MSCs)是骨髓中除造血干細胞外的具有高度可塑性的細胞群體,其在特定條件下可以分化為成骨細胞、成軟骨細胞、脂肪細胞、肌細胞、神經元、骨骼肌細胞和心肌細胞[1-4]。MicroRNAs(miRNAs)是真核生物內發現的一種能起到調控作用的核苷酸單環非編碼RNA,其可以調控多種病理生理過程,包括細胞的增殖、分化、凋亡、神經元突觸形成、腫瘤發生等。miRNAs參與了所有動物的發生、發展和病理過程,其生物合成受嚴格的時間和空間控制。Let-7家族是較早發現的一類人類miRNAs,其可調控干細胞的生物學行為,與人類多種疾病的發生存在密切關系[5-10],分為10個亞型,Let-7b為其中之一。由于Let-7b在大鼠MSCs分化為神經元過程中的作用機制尚不清楚,故本研究采用慢病毒載體感染MSCs,誘導、分化神經元,檢測神經元烯醇化酶(NSE)、神經微管結合蛋白(MAP)-2、微管相關蛋白(Tau)水平表達變化,探討Let-7b在MSCs分化為神經元過程中的作用,為MSCs的研究提供理論依據。
1 材料與方法
1.1 實驗材料
1.1.1 實驗動物及細胞 雌雄不限的SPF級SD大鼠80只,6~8周齡,體質量100~120 g,購自河南省實驗動物中心,許可證號:SCXK(豫)2010-0002。EGFP空病毒購自北京博奧森生物技術有限公司。
1.1.2 實驗分組 將80只大鼠隨機分為空白對照組、陰性對照組、Let-7b-up慢病毒載體(LV-rno-Let-7b-up)組、Let-7b-inhibition慢病毒載體(LV-rno-Let-7b-inhibition)組,每組20只。
1.1.3 研究時間 2013年1—12月。
1.2 研究方法
1.2.1 獲取MSCs 4組大鼠常規飼養2周后,將陰性對照組、LV-rno-Let-7b-up組、LV-rno-Let-7b-inhibition組分別感染EGFP空病毒,采用頸椎脫臼法處死所有大鼠,于75%乙醇中浸泡5 min后從大鼠股骨和脛骨中獲取MSCs,48 h后半量換液,4 d后全換液,此后根據細胞生長情況每2~3 d換液1次繼續培養,當細胞融合度達80%~90%時再進行傳代。MSCs根據以上方法連續傳代培養4代后浸入液氮中備用。
1.2.2 LV-rno-Let-7b-up、LV-rno-Let-7b-inhibition感染 從液氮中取出4組傳代培養4代以上的大鼠MSCs,感染前18~24 h將貼壁細胞以1×105個/孔的密度接種至24孔板,培養2~3 d,直至細胞融合度達50%左右,按3個不同的最適感染復數(MOI)值(MOI=3、10、20)添加病毒液(LV-rno-Let-7b-up、Let-7b-inhibition)和終濃度為5 μg/ml的聚凝胺;即空白對照組、陰性對照組不進行感染,LV-rno-Let-7b-up組、LV-rno-Let-7b-inhibition組分別感染LV-rno-Let-7b-up、Let-7b-inhibition,培養24 h后換液。再培養48 h后,在倒置熒光顯微鏡下觀察各組感染情況,并采用MTT法檢測感染前、感染后24 h、感染后5 d MSCs存活率。
1.2.3 體外誘導MSCs分化為神經元 采用法舒地爾對各組細胞進行誘導實驗。取各組感染后的細胞進行誘導,待成活細胞熒光表達最強和細胞融合度達50%左右時,去除DMEM完全培養基,采用PBS沖洗3次(貼培養板孔壁緩慢加入,防止細胞脫壁)后,加入預誘導劑(DMEM+10%胎牛血清+200 μmol/L法舒地爾)置于37 ℃、5% CO2的細胞培養箱中培養2 h,并于倒置熒光顯微鏡下觀察分化效率。
1.2.4 免疫組化法檢測NSE、MAP-2、Tau水平 將各組感染后并誘導分化2 h的細胞采用PBS沖洗3次,加入4%多聚甲醛1 ml固定,置于4 ℃冰箱過夜。次日吸出多聚甲醛,0.1% TBST緩沖液500 μl沖洗3次,3~5 min/次(或TBST緩沖液浸潤10 min),用移液管吸出棄去。加入5%胎牛血清500 μl,封閉1 h,吸出封閉液,加稀釋后的一抗(1∶200)NSE抗體(1.0 mg/L)、MAP-2抗體(1.0 mg/L)、Tau抗體(1.0 mg/L)各500 μl,置于4 ℃冰箱過夜。棄除一抗,用0.1% TBST緩沖液500 μl沖洗3次,3~5 min/次。加稀釋后的二抗Cy3標記的山羊抗兔IgG(1∶200)500 μl,室溫下放置1 h。用移液管吸出二抗并棄去,0.1%TBST緩沖液500 μl沖洗3次。采用熒光顯微鏡進行觀察,應用Image Pro Plus 6.0進行圖像分析NSE、MAP-2、Tau水平。
1.2.5 采用RT-PCR法檢測NSE、MAP-2、Tau mRNA水平 參照Gotaq qPCR Master Mix (Promega)操作說明和1.5 Light Cycler RT-PCR系統(Roche)對cDNA進行PCR擴增。MAP-2上游引物為5′-CCACCCAGAAAACCTCATGA-3′,下游引物為5′-CATCCCGGTAAGTCCAATCA-3′;NSE上游引物為5′-TGAGGTAGTAGGTTGTGTGGTT-3′,下游引物為5′-AACCACACAACCTACTACCTCA-3′;Tau上游引物為5′-CTCAACTGGTGTCGTGGA-3′,下游引物為5′-AACGCTTCACGAATTTGCGT-3′。PCR反應條件:94 ℃變性30 s,60 ℃退火30 s,共30個循環,然后72 ℃延伸5 min,4 ℃靜置。采用相對定量法(2-ΔΔCt法)計算NSE、MAP-2、Tau mRNA水平。
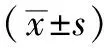
2 結果
2.1 MSCs培養情況 體外傳代培養第2代MSCs呈扁圓形,體外培養第5代MSCs呈長梭形(見圖1,本文圖1~3彩圖見本刊官網www.chinagp.net電子期刊相應文章)。
2.2 LV-rno-Let-7b-up、LV-rno-Let-7b-inhibition感染情況 LV-rno-Let-7b-up組MSCs于LV-rno-Let-7b-up感染后第3天熒光表達最強,LV-rno-Let-7b-inhibition組MSCs于LV-rno-Let-7b-inhibition感染后第5天熒光表達最強。感染第5天時,陰性對照組、LV-rno-Let-7b-up組、LV-rno-Let-7b-inhibition組MSCs感染率分別為87.46%、86.81%、87.12%(見圖2)。
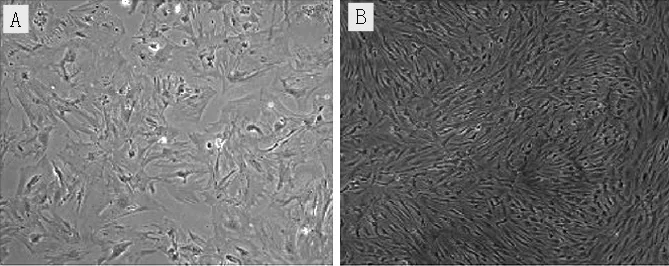
注:A為體外傳代培養第2代,B為體外傳代培養第5代
圖1 普通光學顯微鏡下MSCs形態(×200)
Figure1 MSCs morphology under the normal optical microscope

注:A為陰性對照組,B為Let-7b-up慢病毒載體(LV-rno-Let-7b-up)組,C為Let-7b-inhibition慢病毒載體(LV-rno-Let-7b-inhibition)組
圖2 熒光顯微鏡下感染第5天時MSCs形態(×200)
Figure2 Morphology of MSCs on the fifth day after infection under fluorescence microscopy
2.3 4組感染前后不同時間點MSCs存活率比較 4組感染前MSCs存活率比較,差異無統計學意義(P>0.05);4組感染后24 h、感染后5 d MSCs存活率比較,差異有統計學意義(P<0.05);感染后24 h、5 d陰性對照組、LV-rno-Let-7b-up組、LV-rno-Let-7b-inhibition組MSCs存活率低于空白對照組,差異有統計學意義(P<0.05);陰性對照組、LV-rno-Let-7b-up組、LV-rno-Let-7b-inhibition組感染后5 d MSCs存活率高于感染后24 h,差異有統計學意義(P<0.05,見表1)。
2.4 MSCs分化為神經元的分化效果 陰性對照組和空白對照組部分MSCs呈現神經元樣改變,發起多個分支,突起變長,胞體收縮,連接成網狀,且兩組分化效果相似;LV-rno-Let-7b-up組極大部分MSCs出現突起,胞體收縮,交織成網,形成典型的神經元樣結構;LV-rno-Let-7b-inhibition組僅有少量MSCs出現典型的神經元樣結構(見圖3)。
2.5 4組NSE、MAP-2、Tau水平比較 4組NSE、MAP-2、Tau水平比較,差異有統計學意義(P<0.05);LV-rno-Let-7b-up組NSE、MAP-2、Tau水平高于空白對照組、陰性對照組,差異有統計學意義(P<0.05);LV-rno-Let-7b-inhibition組NSE、MAP-2、Tau水平低于空白對照組、陰性對照組,差異有統計學意義(P<0.05,見表2、圖4)。
2.6 4組NSE、MAP-2、Tau mRNA水平比較 4組NSE、MAP-2、Tau mRNA水平比較,差異有統計學意義(P<0.05);LV-rno-Let-7b-up組NSE、MAP-2、Tau mRNA水平高于空白對照組、陰性對照組,差異有統計學意義(P<0.05);LV-rno-Let-7b-inhibition組NSE、MAP-2、Tau mRNA水平低于空白對照組、陰性對照組,差異有統計學意義(P<0.05,見表3)。
3 討論
MSCs在臨床研究中擁有廣泛的應用前景[11]。因MSCs為具備較強增殖、多向分化潛能的干細胞,在特定條件下能夠向內胚層、中胚層及外胚層分化,其作為供體細胞越來越多地應用于細胞治療及組織工程。作為供體細胞的MSCs具有幾個優勢:(1)相對易獲取;(2)體外培養時能快速增殖;(3)具有免疫耐受性或免疫無反應性;(4)可長時間存活并能與宿主體內的結構相整合;(5)能被穩定轉染,作為基因載體能長期表達外源性基因;(6)能夠自體移植,解決了免疫排斥的問題。臨床上已有將MSCs應用于阿爾茨海默病、多發性硬化的臨床治療[12-13]。1993年,LEE等[14]在秀麗新桿狀線蟲中首次發現了miRNAs,隨后miRNAs在MSCs生物學行為中的重要調控作用逐步顯現。miRNAs可經轉錄、表觀遺傳學調控基因組及異染色質形成等方式調控基因組的表達,參與MSCs重要生物學進程,包括增殖、分化、信號轉導、死亡等[15-17]。人類細胞中的Let-7可起到促進分化的重要作用[18-19]。Let-7參與多個信號通路[11,20-23],其可通過不止一個環節抑制Insulin-磷脂酰肌醇 (PI3K)-mTOR通路,而后者參與了干細胞的增殖、神經分化和自噬。
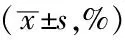
表1 4組感染前、感染后24 h、感染后5 d MSCs存活率比較
注:與空白對照組比較,aP<0.05;與感染后24 h比較,bP<0.05;LV-rno-Let-7b-up=Let-7b-up慢病毒載體,LV-rno-Let-7b-inhibition=Let-7b-inhibition慢病毒載體
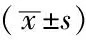
表2 4組NSE、MAP-2、Tau水平比較
注:NSE=神經元烯醇化酶,MAP=神經微管結合蛋白,Tau=微管相關蛋白;與空白對照組比較,aP<0.05;與陰性對照組比較,bP<0.05
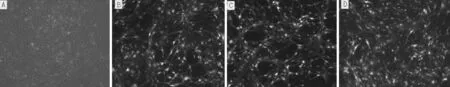
注:A為空白對照組,B為陰性對照組,C為LV-rno-Let-7b-up組,D為LV-rno-Let-7b-inhibition組
圖3 熒光顯微鏡下誘導分化2 h后MSCs形態(×200)
Figure3 MSCs morphology at 2 h after inducement and differentiation under fluorescence microscopy
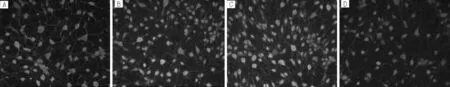
注:A為空白對照組,B為陰性對照組,C為LV-rno-Let-7b-up組,D為LV-rno-Let-7b-inhibition組
圖4 熒光顯微鏡下4組MAP-2表達情況(免疫組化染色,×200)
Figure4 Expression level of MAP-2 in the 4 groups under fluorescence microscopy
表3 4組NSE、MAP-2、Tau mRNA水平比較
注:與空白對照組比較,aP<0.05;與陰性對照組比較,bP<0.05
NSE是一種糖酵解酶,特異性地存在于神經元及神經內分泌細胞中。近年來,NSE成為神經元損傷的敏感性、特異性標志物[24]。MAP是細胞骨架中微管主干蛋白之外的一些蛋白成分,其中Tau主要見于中樞神經系統的神經元中,且少見于其他細胞,可作為神經軸突的標志分子[25]。MAP-2是構成神經元骨架的重要蛋白,參與形成細胞內的絲網狀結構,維持細胞形態,是原始神經上皮中所表達的最早的神經元標志物之一,并廣泛應用于神經生物學研究[26]。
Let-7b作為Let-7家族成員之一,其在MSCs分化為神經元過程中的作用目前尚不清楚。本研究采用Let-7b過表達和抑制慢病毒載體感染MSCs,觀察Let-7b在MSCs誘導分化中的作用。YU等[27]發現,Let-7家族在胚胎干細胞分化為神經前體細胞后,其水平急劇增加,并占主導地位,說明Let-7參與調控神經干細胞分化。本研究結果顯示,空白對照組、陰性對照組、LV-rno-Let-7b-up組、LV-rno-Let-7b-inhibition組感染前MSCs存活率無差異,感染后24 h、感染后5 d MSCs存活率有差異,表明Let-7b可以高效感染大鼠MSCs,感染后EGFP可穩定表達。MTT法檢測結果顯示,感染Let-7b后MSCs存活率下降,免疫組化結果顯示,MSCs感染Let-7b后神經元分化效率明顯提高,神經元的早、中期標志物NSE和成熟神經元特異性標志物MAP-2水平均顯著增高。考慮Let-7b可能在MSCs橫向分化為神經元過程中起作用,提高Let-7b水平,可促進MSCs向神經元分化。本研究結果顯示,單獨感染Let-7b并不能使MSCs分化為神經元,必須在法舒地爾作為誘導劑的條件下MSCs才能分化神經元,表明Let-7b在MSCs橫向分化為神經元過程中的作用不是唯一的,可能是對某一些信號途徑控制,如TLR信號通路、Wnt信號通路、Hmga2信號通路等,從而提高誘導效率。
由于本研究未進行MSCs體內移植實驗,MSCs在體內存活率及分化為神經元的效率也未得到研究,異體移植所引起的免疫排斥反應如何也未研究。本課題組擬在后續實驗中繼續觀察感染的MSCs體內存活率、細胞分化效率及免疫排斥反應,進一步探討Let-7b慢病毒載體感染MSCs后移植入大鼠體內所產生各種反應的分子機制。
綜上所述,感染LV-rno-Let-7b-up能加快MSCs分化為神經元的分化效率,同時其NSE、MAP-2、Tau水平亦升高,本結果可為干細胞的臨床試驗提供一定的理論依據。
作者貢獻:李進領資進行料收集整理,撰寫論文;李智、安穎對論文進行校對,并負責英文潤色;李琳進行實驗實施、評估、資料收集;張靜進行實驗設計與實施、資料收集整理,撰寫論文;賈延劼進行質量控制及審校。
本文無利益沖突。
[1]YU J M,WU X,GIMBLE J M,et al.Age-related changes in mesenchymal stem cells derived from rhesus macaque bone marrow[J].Aging Cell,2011,10(1):66-79.DOI:10.1111/j.1474-9726.2010.00646.x.
[2]KILPINEN L,TIGISTU-SAHLE F,OJA S,et al.Aging bone marrow mesenchymal stromal cells have altered membrane glycerophospholipid composition and functionality[J].J Lipid Res,2013,54(3):622-635.DOI:10.1194/jlr.M030650.
[3]WEI H,SHEN G,DENG X,et al.The role of IL-6 in bone marrow (BM)-derived mesenchymal stem cells (MSCs) proliferation and chondrogenesis[J].Cell Tissue Bank,2013,14(4):699-706.DOI:10.1007/s10561-012-9354-9.
[4]LI M,IKEHARA S.Bone-marrow-derived mesenchymal stem cells for organ repair[J].Stem Cells Int,2013,2013:132642.DOI:10.1155/2013/132642.
[5]LEHMANN S M,KRUGER C,PARK B,et al.An unconventional role for miRNA:let-7 activates Toll-like receptor 7 and causes neurodegeneration[J].Nat Neurosci,2012,15(6):827-835.DOI:10.1038/nn.3113.
[6]LONG G,WANG F,LI H,et al.Circulating miR-30a,miR-126 and Let-7b as biomarker for ischemic stroke in humans[J].BMC Neurol,2013,13:178.DOI:10.1186/1471-2377-13-178.
[7]BAO M H,FENG X,ZHANG Y W,et al.Let-7 in cardiovascular diseases,heart development and cardiovascular differentiation from stem cells[J].Int J Mol Sci,2013,14(11):23086-23102.DOI:10.3390/ijms141123086.
[8]HOU W,TIAN Q,STEUERWALD N M,et al.The let-7 microRNA enhances heme oxygenase-1 by suppressing Bach1 and attenuates oxidant injury in human hepatocytes[J].Biochim Biophys Acta,2012,1819(11/12):1113-1122.DOI:10.1016/j.bbagrm.2012.06.001.
[9]GAO Y,MENG H,LIU S,et al.LncRNA-HOST2 regulates cell biological behaviors in epithelial ovarian cancer through a mechanism involving microRNA Let-7b[J].Hum Mol Genet,2015,24(3):841-852.DOI:10.1093/hmg/ddu502.
[10]THORNTON J E,GREGORY R I.How does Lin28 let-7 control development and disease?[J].Trends Cell Biol,2012,22(9):474-482.DOI:10.1016/j.tcb.2012.06.001.
[11]SUPOKAWEJ A,NIMSANOR N,SANVORANART T,et al.Mesenchymal stem cell in vitro labeling by hybrid fluorescent magnetic polymeric particles for application in cell tracking[J].Med Mol Morphol,2015,48(4):204-213.DOI:10.1007/s00795-015-0102-7.
[12]PERICO N,CASIRAGHI F,INTRONA M,et al.Autologous mesenchymal stromal cells and kidney transplantation:a pilot study of safety and clinical feasibility[J].Clin J Am Soc Nephrol,2011,6(2):412-422.DOI:10.2215/CJN.04950610.
[13]ZHAO J J,LIN J,LWIN T,et al.microRNA expression profile and identification of miR-29 as a prognostic marker and pathogenetic factor by targeting CDK6 in mantle cell lymphoma [J].Blood,2010,115(13):2630-2639.DOI:10.1182/blood-2009-09-243147.
[14]LEE R C,FEINBAUM R L,AMBROS V.The C.elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14[J].Cell,1993,75(5):843-854.
[15]INUI M,MARTELLO G,PICCOLO S.MicroRNA control of signal transduction[J].Nat Rev Mol Cell Biol,2010,11(4):252-263.DOI:10.1038/nrm2868.
[16]GUO L,ZHAO R C,WU Y.The role of microRNAs in self-renewal and differentiation of mesenchymal stem cells[J].Exp Hematol,2011,39(6):608-616.DOI:10.1016/j.exphem.2011.01.011.
[17]LAINE S K,HENTUNEN T,LAITALA-LEINONEN T.Do microRNAs regulate bone marrow stem cell niche physiology?[J].Gene,2012,497(1):1-9.DOI:10.1016/j.gene.2012.01.
045.
[18]BUSSING I,SLACK F J,GROSSHANS H.let-7 microRNAs in development,stem cells and cancer[J].Trends Mol Med,2008,14(9):400-409.DOI:10.1016/j.molmed.2008.07.001.
[19]WRIGHT J E,CIOSK R.RNA-based regulation of pluripotency[J].Trends Genet,2013,29(2):99-107.DOI:10.1016/j.tig.2012.10.007.
[20]JING L,JIA Y,LU J,et al.MicroRNA-9 promotes differentiation of mouse bone mesenchymal stem cells into neurons by Notch signaling[J].Neuroreport,2011,22(5):206-211.DOI:10.1097/WNR.0b013e328344a666.
[21]SOLOMON A,MIAN Y,ORTEGA-CAVA C,et al.Upregulation of the let-7 microRNA with precocious development in lin-12/Notch hypermorphic caenorhabditis elegans mutants[J].Dev Biol,2008,316(2):191-199.DOI:10.1016/j.ydbio.2007.12.046.
[22]WHELAN J T,HOLLIS S E,CHA D S,et al.Post-transcriptional regulation of the Ras-ERK/ MAPK signaling pathway[J].J Cell Physiol,2012,227(3):1235-1241.DOI:10.1002/jcp.22899.
[23]TOLEDANO H,D′ALTERIO C,CZECH B,et al.The let-7-Imp axis regulates ageing of the Drosophila testis stem-cell niche[J].Nature,2012,485(7400):605-610.DOI:10.1038/nature11061.
[24]KULPA J,WOJCIK E,REINFUSS M,et al.Caricinoembryonic antigen,squamous cell carcinoma antigen,CYFRA21-1,and neron-specificenolase in squamous cell lung cancer patients[J].Clin Cheem,2002,48(11):1931-1937.
[25]WANG J Z,LIU F.Microtubule-associated protein tau in development,degeneration and protection of neurons[J].Prog Neurobiol,2008,85(2):148-175.DOI:10.1016/j.pneurobio.2008.03.002.
[26]SUI G P,WU C,SEVERS N,et al.The association between T-type Ca2+current and out ward current in isolated human detrusor cells from stable and overactive bladders[J].BJU Int,2007,99(2):436-441.
[27]YU F,YAO H,ZHU P,et al.Let-7 regulates self renewal and tumorigenicity of breast cancer cells[J].Cell,2007,131(6):1109-1123.
EffectofLet-7bontheDifferentiationofBoneMarrowMesenchymalStemCellsintoNerveCells
LIJin-ling1,LIZhi2,LILin1,ZHANGJing3*,JIAYan-jie3,ANYing1
1.DepartmentofNeurology,ZhengzhouCentralHospitalAffiliatedtoZhengzhouUniversity,Zhengzhou450007,China2.I.M.SechenovFirstMoscowStateMedicalUniversity,Moscow119991,Russia3.DepartmentofNeurology,theFirstAffiliatedHospitalofZhengzhouUniversity,Zhengzhou450052,China
*Correspondingauthor:ZHANGJing,Attendingphysician;E-mail:yzkl0112@163.com
ObjectiveTo investigate the role of Let-7b in the differentiation of rat bone marrow mesenchymal stem cells (MSCs) into neurons.MethodsThis study was conducted in 2013.Eighty SPF grade SD rats were randomly divided into blank control group,negative control group,Let-7b-up lentiviral vector (LV-rno-Let-7b-up) group,Let-7b-inhibition lentiviral vector (LV-rno-Let-7b-inhibition) group,20 rats in each group.The negative control group,LV-rno-Let-7b-up group,LV-rno-Let-7b-inhibition group were injected EGFP blank virus respectively.Four groups of rats were sacrificed by cervical dislocation,and MSCs were obtained and cultured for 4 generations.Subculture of MSCs were infected with lentivirus,that is,the blank control group and the negative control group were not infected,LV-rno-Let-7b-up group,LV-rno-Let-7b-inhibition group were infected with LV-rno-Let-7b-up,Let-7b-inhibition,respectively.The survival rate of MSCs was detected by MTT before infection,at 24 h after infection,on the fifth day after infection.Four groups were induced by fasudil,and the differentiation efficiency of MSCs into neurons was observed.The levels of NSE,MAP-2 and Tau were detected by immunohistochemistry.The levels of NSE mRNA,MAP-2 mRNA and Tau mRNA were detected by RT-PCR.ResultsThe MSCs of LV-rno-Let-7b-up group had the strongest fluorescence expression on the third day after LV-rno-Let-7b-up infection.The MSCs of LV-rno-Let-7b-inhibition group had the strongest fluorescent expression on the fifth day after LV-rno-7b-inhibition infection.On the fifth day after infection,the MSCs infection rates of the negative control group,LV-rno-Let-7b-up group and LV-rno-Let-7b-inhibition group were 87.46%,86.81% and 87.12%,respectively.At 24 h after infection,and on the fifth day after infection the blank control group presented higher survival rate of MSCs than the other three groups (P<0.05).The survival rate of MSCs on the fifth day after infection was found to be higher than that at 24 h after infection in the negative control group,LV-rno-Let-7b-up group and LV-rno-Let-7b-inhibition group (P<0.05).Some MSCs showed neuronal changes in the negative control group and the blank control group,almost all the MSCs showed typical neuron-like structures in LV-rno-Let-7b-up group,but only a small number of MSCs showed a typical neuron-like structure in the LV-rno-Let-7b-inhibition group.The protein and mRNA levels of NSE,MAP-2,Tau in LV-rno-Let-7b-up group were higher than those in blank control group and negative control group(P <0.05);the protein and mRNA levels of NSE,MAP-2,Tau in LV-rno-Let-7b-inhibition group were lower than those in blank control group and negative control group (P<0.05).ConclusionWe found that the differentiation efficiency of MSCs into neurons was increased after infection with LV-rno-Let-7b-up,which suggests that Let-7b promotes the differentiation of MSCs into neurons.
Neurons;Stem cells,myeloid;Lentivirus;Let-7b;Cell differentiation
國家自然科學基金資助項目(81071114,81371385)
R 322.8 R 329.24
A
10.3969/j.issn.1007-9572.2017.00.122
李進領,李智,李琳,等.Let-7b對骨髓基質干細胞誘導分化為神經元的作用研究[J].中國全科醫學,2017,20(33):4156-4161.[www.chinagp.net]
LI J L,LI Z,LI L,et al.Effect of Let-7b on the differentiation of bone marrow mesenchymal stem cells into nerve cells[J].Chinese General Practice,2017,20(33):4156-4161.
2017-03-03;
2017-07-21)
(本文編輯:毛亞敏)

