噻嗪酮在稻米中殘留分析方法研究
黃蘭淇,陳 秀,張正煒,占繡萍,馬 琳
?
噻嗪酮在稻米中殘留分析方法研究
黃蘭淇,陳 秀,張正煒,占繡萍,馬 琳
(上海市農業技術推廣服務中心,上海 201103)
建立了稻米中噻嗪酮殘留量高效液相色譜-串聯質譜檢測方法。在樣品中加入乙腈,勻漿提取,經改進的QuEChERS方法凈化后過膜上機。以甲醇和水(含0.1%甲酸)為流動相梯度洗脫,電噴霧正離子(ESI+)模式電離,多反應監測(MRM)模式檢測,外標法定量。噻嗪酮在0.01~1.0 mg/L范圍內線性關系良好,相關系數()≥0.999;糙米中噻嗪酮回收率為89.02%~94.85%,變異系數為4.43%~5.92%;谷殼中噻嗪酮回收率為87.02%~94.35%,變異系數為0.37%~4.16%。最小檢出量為2×10-11g,最小檢出濃度為0.01 mg/L。該方法操作簡單,快速,準確,滿足農藥殘留分析要求。
噻嗪酮;稻米;殘留;LC-MS/MS
噻嗪酮是噻二嗪類昆蟲生長調節劑,對飛虱、葉嬋有特效,具有高活性、高選擇性、長殘效期的特點,在水稻種植過程中使用廣泛,主要防治水稻葉嬋、飛虱等害蟲[1-2]。噻嗪酮的檢測方法主要有氣相色譜質譜聯用和氣相色譜法[3-4]。國內對于噻嗪酮的檢測已有報道,胡連英[5]等以丙酮為提取液,經過濾、減壓、濃縮后正己烷萃取3次,氣相色譜儀測定大米中噻嗪酮殘留量。劉檀[6]等以乙腈作為提取液,經氨基固相萃取小柱凈化,以彈性石英玻璃毛細管柱為分離柱,用氣相色譜電子俘獲檢測器測定大米中噻嗪酮的殘留量。汪芙蓉等[7]采用氯仿/丙酮(體積比2︰1)超聲提取,丙酮定容后經氣相色譜電子捕獲器檢測。張永忠等[8]以乙腈為提取液,氨基固相萃取小柱萃取凈化后經氣相色譜電子捕獲器檢測。以上文獻方法存在提取、凈化步驟繁瑣,所用溶劑多,時間長等問題,因此本文旨在建立一種科學、快速、簡便的,同時能達到定性和定量要求,滿足批量稻米中噻嗪酮快速檢測要求的高效液相色譜-串聯質譜技術。
1 材料與方法
1.1 儀器設備與試劑
Agilent 6460 三重四級桿液相色譜-質譜聯用儀(美國Aglient公司);勻漿機IKA T25(德國IKA公司);旋渦混合器TYXH-Ⅱ(上海比朗儀器有限公司);離心機TDL-5-A(上海安亭科學儀器廠);Milli-Q Advantage A10 (美國Millipore公司)。
噻蟲嗪標準品(純度為98.6%,上海市農藥研究所);C18(博納艾杰爾公司);PSA(美國Aglient公司);硫酸鎂(德國CNW科技公司);乙腈、甲醇均為色譜級(霍尼韋爾公司)
1.2 試驗方法
1.2.1 儀器條件
液相色譜條件:色譜柱:Poroshell 120 EC-C18(3.0 mm×100 mm,2.7 m);柱溫:30 ℃;進樣體積:2.0 μL;流動相:A相為純水(含0.1%甲酸);B相為甲醇;流速:0.4 mL/min;梯度洗脫程序:0~2.0 min,10%B~80%B;2~3 min,80%B~90%B;3~5 min,90%B~95%B;6 min,95%B。
質譜條件:離子源:可加熱的ESI源;檢測方式:多反應監測(MRM);掃描模式:正離子掃描;進樣體積:2 μL;干燥氣溫度:300℃;干燥氣流量:7 mL/min;霧化氣壓力:0.28 Mpa;鞘氣溫度:350 ℃;鞘氣流量:11 mL/min;其他質譜參數見表1。
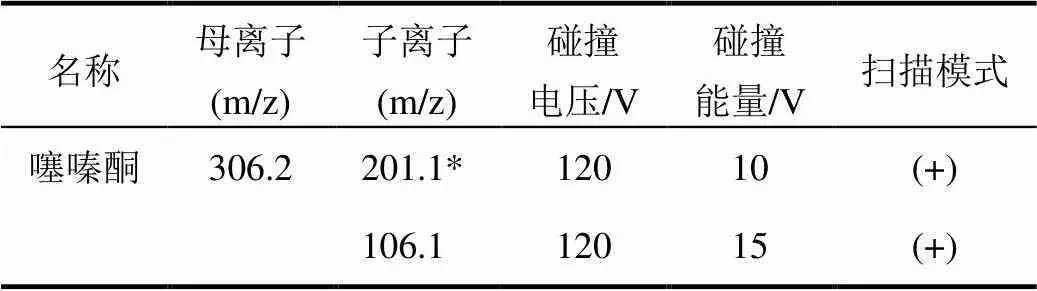
表1 質譜采集離子信息
注:*該離子用于定量
1.2.2 樣品前處理
1.2.2.1 樣品提取
分別稱取10 g糙米/谷殼樣品至50 mL離心管中,加入40 mL乙腈,在勻漿機中高速勻漿1 min,再離心2 min后靜置,制成待測液。
1.2.2.2 樣品凈化
采用改進的QuEChERS方法,取4 mL待測液加入到裝有300 mg MgSO4,100 mg PSA和100 mg C18的離心管中,渦旋1 min后離心,取3 mL濃縮至近干,用甲醇定容至750 μL,待測。
1.2.3 標準儲備液和標準曲線的繪制
準確稱取噻嗪酮標準品10 mg(精確至0.01 mg),用甲醇溶解并定容至10 mL,配成質量濃度1 000 mg/L的標準母液。
標準溶液的配制:取適量的標準母液用甲醇稀釋成0.01~1.0 mg/L一系列濃度的標準溶液,上機檢測。以每個濃度測得的峰面積為縱坐標,相對應的噻嗪酮標準溶液濃度為橫坐標。繪制標準曲線。
2 結果與討論
2.1 標準曲線繪制
在0.01~1.0 mg/L濃度時,噻嗪酮峰面積與濃度呈良好線性關系(圖1),線性方程=1E+06+82 224,相關系數()≥0.999。最低檢測濃度為0.01 mg/L,該方法下噻嗪酮標樣保留時間為4.90 min,色譜圖如圖2所示。
圖1 噻嗪酮標準曲線
圖2 0.01 mg/L噻嗪酮標樣
2.2 提取條件優化
2.2.1 提取溶劑的選擇
參考現有文獻報道[6,9],結合QuEChERS方法常用提取溶劑[10],本文亦采用乙腈作為提取溶劑。
2.2.2 提取方法的選擇
對比文獻報道[6],本文采用攪拌勻漿1 min提取方式。糙米和谷殼中添加0.1 mg/L噻嗪酮,由表4可以看出,回收率和變異系數都滿足試驗要求,且提取時間更短。
2.3 凈化方法優化
空白樣品中添加噻嗪酮濃度為1 mg/L,糙米和谷殼提取液分別采用改進的QuEChERS(見1.2.2.2)和氨基固相萃取小柱2種凈化方法,對比添加回收率(表2、3),結果表明在改進的QuEChERS凈化方法下糙米和谷殼提取液回收率較好,且變異系數滿足試驗要求,因此本文選擇改進的QuEChERS方法凈化。
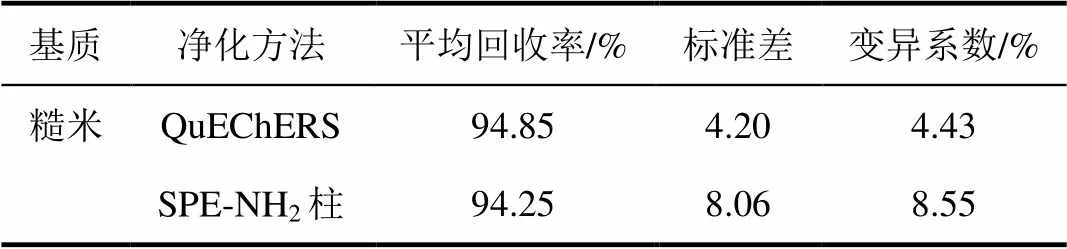
表2 不同凈化方法對糙米中噻嗪酮回收率影響
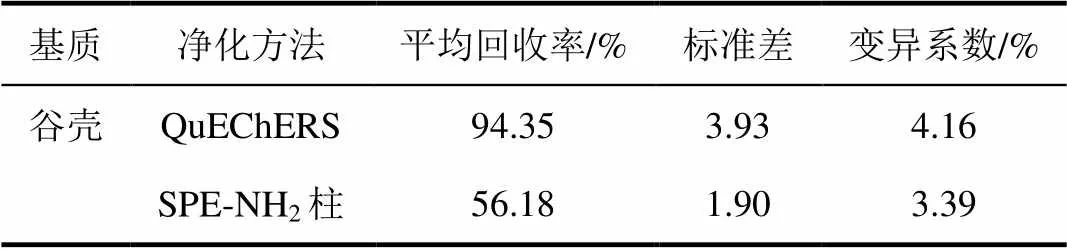
表3 不同凈化方法對谷殼中噻嗪酮回收率影響
2.4 添加回收率
采用空白樣品添加標準溶液方法,分別向糙米和谷殼中添加一定體積的噻嗪酮工作溶液,使其濃度為0.01、0.1、1.0 mg/L。采用優化后建立的條件進行提取、凈化、測定,結果為在添加濃度范圍內,糙米中噻嗪酮回收率為89.02%~ 94.85%,變異系數為4.43%~5.92%;谷殼中噻嗪酮回收率為87.02%~94.35%,變異系數為0.37%~4.16%(表4)。這表明該方法可以達到農藥殘留分析要求。圖3為糙米和谷殼中噻嗪酮添加濃度為0.01 mg/L回收樣品色譜圖。
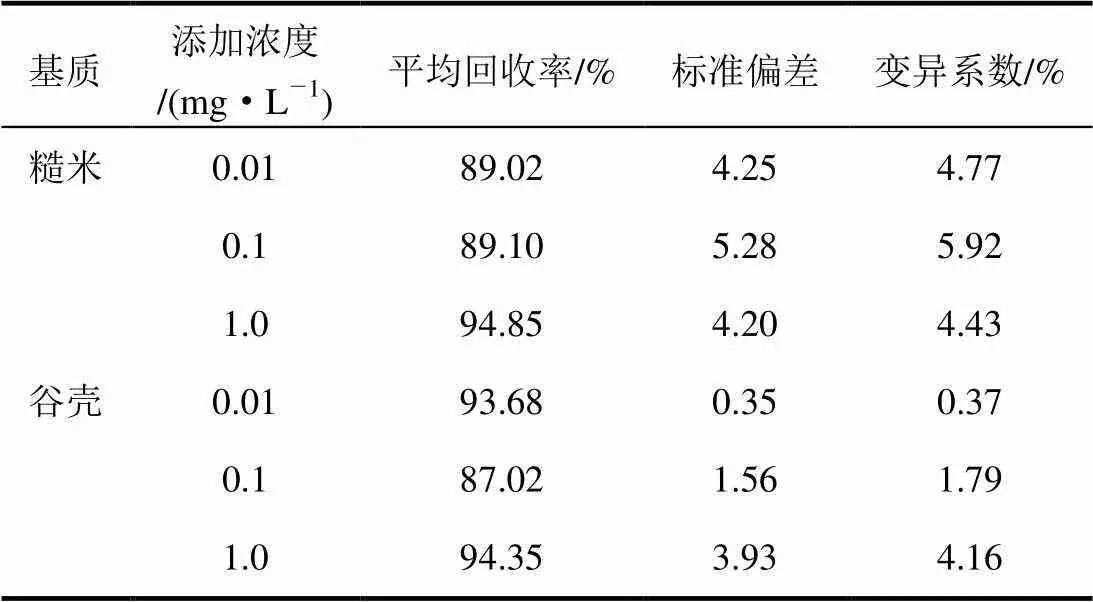
表4 糙米和谷殼樣品中噻嗪酮添加回收結果
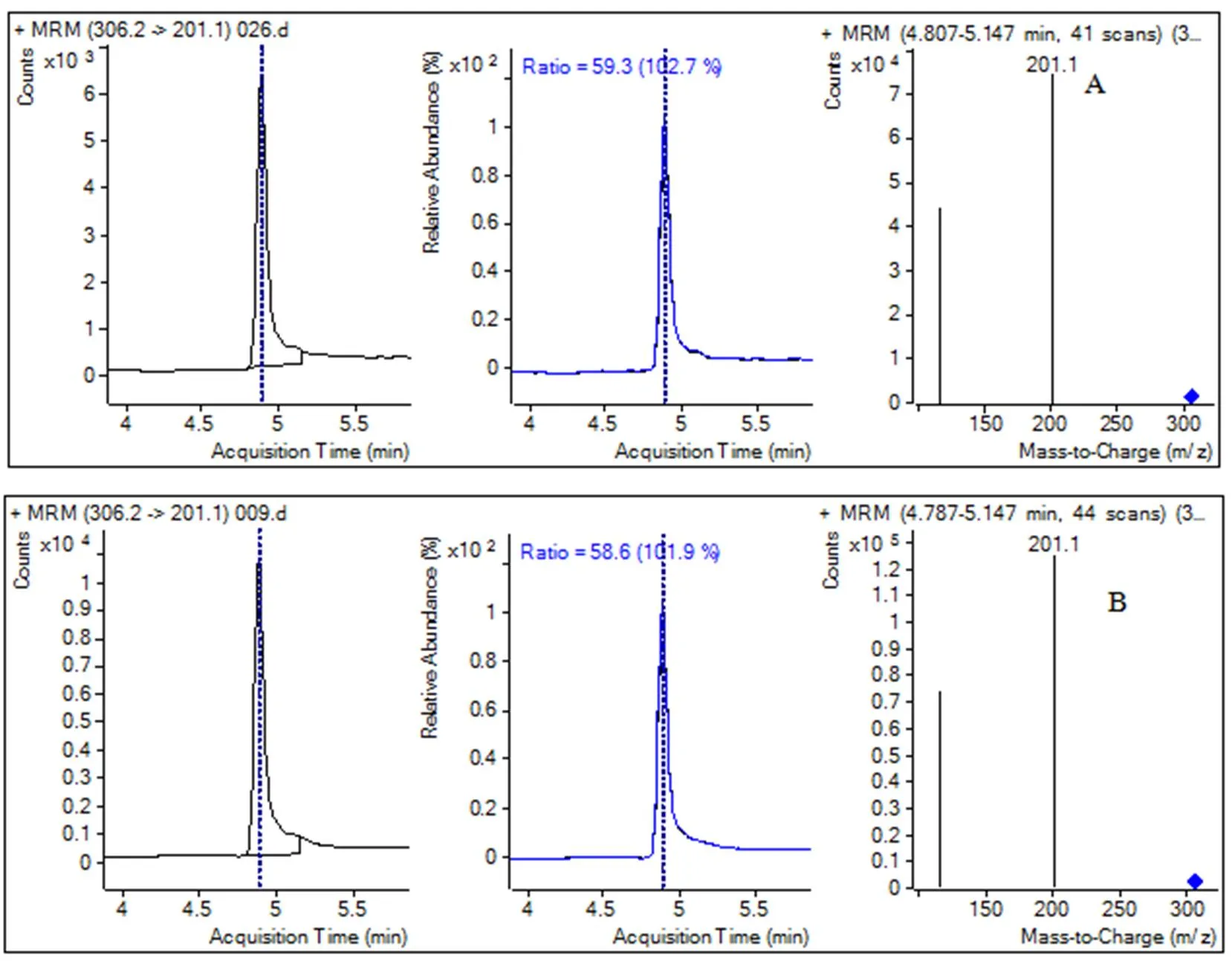
圖3 谷殼(A)、糙米(B)中噻嗪酮0.01 mg/L添加回收譜圖
3 結 論
本文建立了稻米中噻嗪酮殘留量快速高效液相色譜-串聯質譜檢測方法。以乙腈作為提取溶劑,采用攪拌勻漿1 min的提取方式,經改進的QuEChERS方法凈化后過膜上機,糙米和谷殼中噻嗪酮回收率和變異系數均符合試驗要求。本方法具有操作簡單,準確,分析速度快等優點,滿足快速檢測稻米中噻嗪酮殘留分析要求。
[1] 化工部農藥信息總站.國外農藥品種手冊[M]. 沈陽: 化工出版社, 1996.
[2] 韓熹萊.中國農業百科全書: 農藥卷[M]. 北京: 中國農業出版社, 1993.
[3] NISHIZAWA H,SHIGEMURA M,SUZUKI T,. Simple cleanup procedure for analysis of buprofezin residues and its metabolite in crops by gas chromatography[J]. Journal of AOAC International, 1994, 77: 1631-1633.
[4] SANTOS TF,AQUINO A,DOREA HS,. MSPD procedure for determining buprofezin,tetradifon, vinclozolin and bifenthrin residues in propolis by gas chromatography mass-spectrometry[J]. An-alytical and Bioanalytical Chemistry, 2008, 390: 1425-1430.
[5] 胡蓮英. 氣相色譜法測定噻嗪酮在水稻中的殘留量[J]. 農藥, 1988, 31(1): 43.
[6] 劉檀, 任紅波, 陳國峰, 等. 大米中吡蟲啉和噻嗪酮殘留分析方法[J]. 中國糧油學報, 2012, 27(2): 118-121, 128.
[7] 汪芙蓉, 張家俊, 吳萍, 等. 噻嗪酮—烯啶蟲胺在水稻田樣品中的殘留檢測方法[J]. 南京農業大學學報, 2013, 36(6): 128-134.
[8] 張永忠, 劉檀, 任紅波, 等. 16%吡蟲啉·噻嗪酮可濕性粉劑在水稻田中的殘留動態研究[J]. 東北農業大學學報, 2013, 44(4): 88-93.
[9] ANASTASSIADES M, LEHOTAY S J, STAJNBAHER D,Fast and easy multiresidue methodemploy-ing acetonitrile extraction/ partitioning and "dispersivesolid-phase extraction" for the determination of pesticide residues in produce[J]. Journal of Aoac International, 2003, 86(2): 412-431.
[10] 高陽, 徐應明, 孫揚, 等. QuEChERS提取法在農產品農藥殘留檢測中的應用進展[J]. 農業資源與環境學報, 2014, 31(2): 110-117.
The Analytical Method Study of Buprofezin Residues in Rice
HUANG Lanqi, CHEN Xiu, ZHANG Zhengwei,ZHAN Xiuping, MA Lin
(Shanghai Agriculture Technology Extension & Service Center, Shanghai 2017, China )
A method was established for the residue determination of buprofezin in rice by liquid chromatography-tandem mass spectrometry (LC-MS/MS).Buprofezin was extracted by acetonitrile with homogenizedmixing, purified with improved QuEChERS method, filtered through 0.22 μm of organic membrane and injected into LC-MS/MS. The analyte was separated with the mobile phases of water and methanol (containing 0.1% formic acid), detected by MS/MS with positive electrospray ionization (ESI+) in multiple reaction monitoring (MRM) mode, and quantified by external standard method. The correlation coefficient () of buprofezin was not lower than 0.999 in the concentration of 0.01~1.0 mg/L. The average recoveries and coefficient of variations were 89.02%~94.85%, 4.43%~5.92% forrice, and 87.02%~94.35%, 0.37%~4.16% for husk of rice. The minimum detectable amount and concentration was 2×10-11g and 0.01 mg/L. The method is easy, fast and accurate, and meets the requirements of residue analysis of pesticide.
buprofezin; rice; residue; LC-MS/MS
10.16201/j.cnki.cn31-1827/tq.2017.05.10
TQ450.7
A
1009-6485(2017)05-0050-04
黃蘭淇(1987—),女,黑龍江人,農藝師,碩士,主要從事農藥殘留分析。E-mail: huanglanqi0208@126.com。
2017-06-02。

