豬瘟免疫程序設計試驗研究
彭 峰 鄭逢梅 章四新 王建舉 蘇 雷
(河南省諸美種豬育種集團有限公司,河南正陽 463612)
豬瘟免疫程序設計試驗研究
彭 峰 鄭逢梅 章四新 王建舉 蘇 雷
(河南省諸美種豬育種集團有限公司,河南正陽 463612)
針對某規模化豬場仔豬豬瘟免疫效果不理想的情況,先后設計并開展了3次試驗:不同廠家豬瘟疫苗免疫效果對比、新免疫程序制定、新舊免疫程序對比。試驗采集的樣品統一使用IDEXX公司阻斷ELISA方法檢測豬瘟抗體效價。結果表明:不同廠家豬瘟疫苗免疫效果差異顯著;根據母源抗體監測結果制定出仔豬35日齡首免、75日齡二免的免疫程序;新免疫程序效果良好,育肥后期豬群仍能達到免疫抗體保護水平。
豬瘟;免疫程序;母源抗體;免疫試驗
豬瘟是世界動物衛生組織(OIE)規定的必須上報的傳染病之一,給中國以及多個國家帶來嚴重的經濟損失。近十幾年來,豬高致病性藍耳病疫情、豬偽狂犬病疫情、豬流行性腹瀉疫情相繼暴發并流行,導致豬瘟問題被很多豬場忽視。豬瘟病毒曾作為國內豬場的頭號殺手,廣泛流行于全國大小豬場。截止到目前,國內絕大多數豬場仍是豬瘟病原的陽性場,育肥后期豬群不穩定、疾病感染流行等與豬瘟病原有千絲萬縷的關系。同時很多學者調查發現,養殖場豬瘟疫苗免疫效果一直不理想[1-3],對豬場免疫程序調查研究也發現,多數豬場的豬瘟免疫程序制定混亂、隨意,需要調整[4],豬瘟的防控壓力仍然巨大。
影響豬瘟防控效果的因素很多,免疫預防是其中最重要的環節之一,而免疫程序是免疫成敗的決定因素。制定合理的免疫程序需要充分考慮母源抗體的狀況、仔豬的健康狀況以及豬場的管理水平等。
河南省某規模化豬場仔豬豬瘟抗體水平一直不理想,針對該場現狀,先后設計開展三次試驗,制定合理的豬瘟免疫程序,旨在為抗體水平不理想的豬場提供科學、合理的試驗思路以及免疫程序借鑒。
1 材料與方法
1.1 試驗材料
1.1.1 試驗用豬
選擇年齡、胎次(2~4胎)、環境狀況、營養狀況相近的種母豬所生產的仔豬作為試驗用豬。在仔豬10日齡時考察健康狀況,對外觀健康豬只進行隨機分組用于試驗,根據試驗設計,每組20頭,每次小試驗用40頭仔豬,三次試驗共計使用120頭仔豬。試驗仔豬23日齡斷奶,常規飼養管理。
1.1.2 試驗疫苗
選擇國內知名的兩家生物制品公司(A公司和B公司)生產的豬瘟高效傳代細胞苗,每瓶20頭份。
1.1.3 試驗試劑
豬瘟病毒抗體檢測試劑盒(阻斷ELISA),美國IDEXX公司生產。
1.2 試驗方法
1.2.1 試驗設計
試驗分成三次小試驗:第一次試驗在舊免疫程序的基礎上對比A公司(原有疫苗)和B公司(新增疫苗)的疫苗。A組20頭仔豬,免疫A公司疫苗,采用20日齡首免、60日齡二免的免疫程序;B組20頭仔豬,免疫B公司疫苗,采用20日齡首免、60日齡二免的免疫程序;A、B兩組均在18日齡、35日齡、58日齡、80日齡、140日齡采血。第二次試驗確定B公司疫苗的首免日齡及免疫程序。在全群使用B公司疫苗半年以上(其中母豬已普防2次)后開展仔豬母源抗體消減規律試驗,C組20頭仔豬不進行免疫,D組20頭仔豬使用B公司疫苗正常免疫,C、D組均在21日齡、28日齡、35日齡、42日齡、56日齡、70日齡采血。第三次試驗開展B公司疫苗新舊免疫程序對比。E組20頭仔豬使用B公司疫苗,35日齡首免、75日齡二免;F組20頭仔豬使用B公司疫苗,20日齡首免、60日齡二免;E、F組均在33日齡、73日齡、96日齡、124日齡、152日齡采血。詳見表1。
對于試驗豬的其他疾病預防,按照該場原有的免疫程序執行;對于所有豬只,在疫苗免疫前后4天不添加抗生素、抗病毒藥物。
1.2.2 疫苗接種及樣品采集
經檢查保存完好的疫苗按說明書稀釋后,充分搖勻備用。確定豬只后,在其兩側耳根后頸部消毒后接種疫苗,逐頭更換針頭。按表1的采血日齡,對每組的仔豬全部采樣,前腔靜脈采血,常規方法分離血清,記錄編號,置-20℃冰箱中保存備用。每次小試驗采樣全部結束后統一檢測抗體效價,針對每次小試驗的樣品在同一天檢測抗體并使用同一批次試劑盒。
1.2.3 免疫副反應觀察
免疫后72小時內觀察豬免疫后的接種反應,每隔4小時測量1次體溫、觀察記錄豬只采食情況以及精神狀況。若有異常,及時救治并記錄。
1.2.4 樣品檢測及結果判定
檢測樣品的抗體水平按照IDEXX豬瘟病毒抗體檢測試劑盒說明書進行操作。樣品阻斷率≥40%為陽性,≤30%為陰性,30%~40%為可疑。
2 試驗結果
2.1 免疫副反應觀察
豬只免疫接種后均觀察72小時,所有豬只精神、食欲、體溫均正常,注射局部無不良反應,說明A公司和B公司的疫苗均安全。
2.2 第一次豬瘟試驗結果
第一次豬瘟試驗是在原有防疫程序的基礎上對比了兩個不同廠家豬瘟疫苗的免疫效果。A組和B組仔豬豬瘟抗體平均阻斷率檢測結果以及離散度情況見表2。

表1 各組免疫程序、免疫劑量、采血時間
原有免疫程序是20日齡首免,檢測發現A組和B組18日齡時抗體阻斷率平均值在87%以上,抗體水平較高;免疫后抗體水平出現大幅度下降,35日齡時兩組的抗體阻斷率平均值降到了32%左右,且離散度均較高;58日齡(二免前)與35日齡抗體水平差異不明顯;60日齡(二免后)兩種疫苗免疫的抗體水平均有所提升,但提升幅度不大,后期均出現抗體水平下降情況;140日齡時抗體阻斷率平均值在49%左右,育肥后期到出欄前面臨抗體水平不能保護的局面。其中58日齡、80日齡、140日齡A組和B組的豬瘟抗體阻斷率差異均極顯著(<0.01)。試驗表明:仔豬免疫程序設計不合理是導致仔豬免疫抗體水平上不去的主要原因;B組所用的B廠家疫苗效果優于A組的A廠家疫苗,后期試驗選擇B廠家疫苗進行。
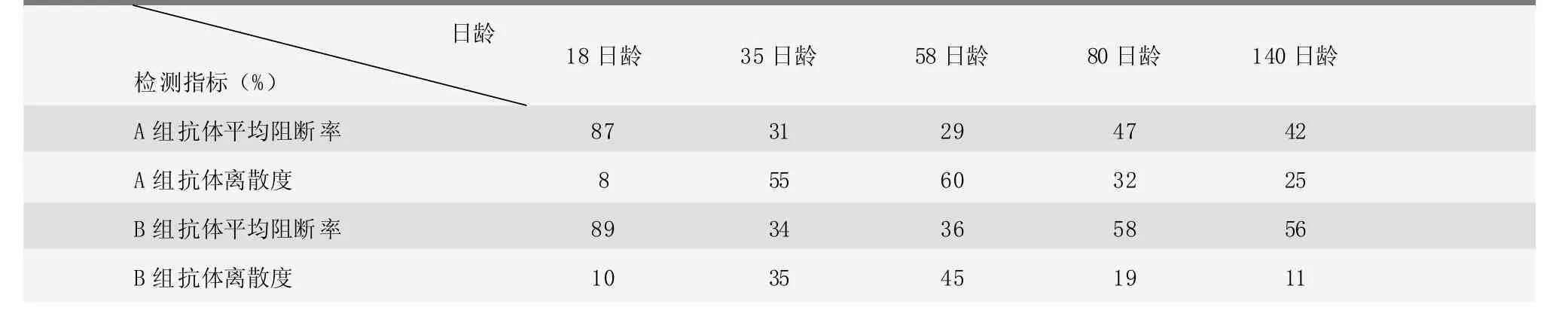
表2 第一次豬瘟試驗A組、B組抗體平均阻斷率和離散度結果
2.3 第二次豬瘟試驗結果
第二次試驗與第一次試驗時間間隔半年,間隔期間母豬普防2次,使用的均是B廠家豬瘟疫苗。第二次試驗研究母源抗體消長規律,制定免疫程序。C組不免疫,D組是第一次試驗B組的重復試驗。C組和D組仔豬豬瘟抗體平均阻斷率檢測結果以及離散度情況見表3。由表3可知,D組和B組試驗結果近似:35日齡時抗體水平下降至平均阻斷率在可疑或者陰性范圍;二免前抗體阻斷率沒有升高,停留在35日齡的水平,二免后抗體水平開始出現上升趨勢。C組由于沒有免疫豬瘟疫苗,抗體水平在70日齡之前呈一直下降的狀態;同時發現28日齡時抗體平均阻斷率為79%,抗體水平過高,此時不適合免疫;35日齡抗體阻斷率平均值下降到50%,此時離散度比較高,35日齡抗體陽性率為43%(數據未顯示),比較符合首免日齡;42日齡時抗體阻斷率持續下降,降到可疑或者陰性范圍,離散度也在降低;56日齡和70日齡抗體阻斷率均在陰性范圍,抗體水平過低。綜合分析,35日齡時抗體水平符合首免日齡要求,因此首免日齡定為35日齡,同時與B廠家疫苗技術服務人員溝通,根據其他養殖場豬瘟免疫試驗數據分析,首免和二免間隔時間可仍定為40天,因此制定新的豬瘟免疫程序為:35日齡首免,75日齡二免,使用B廠家豬瘟疫苗。
該養殖場母豬豬瘟免疫常年采用3次/年的普防程序,0胎母豬占基礎母豬群的30%左右,母豬群胎次結構合理。由于仔豬23日齡斷奶,因此A組、B組的18日齡抗體水平以及C組的21日齡抗體水平基本能反映出對應母豬的抗體水平,而且A組和B組試驗前母豬免疫的是A廠家豬瘟疫苗,C組試驗前母豬免疫的是B廠家豬瘟疫苗,從檢測結果上看A廠家和B廠家豬瘟疫苗免疫母豬效果均比較理想,抗體阻斷率平均值均較高。
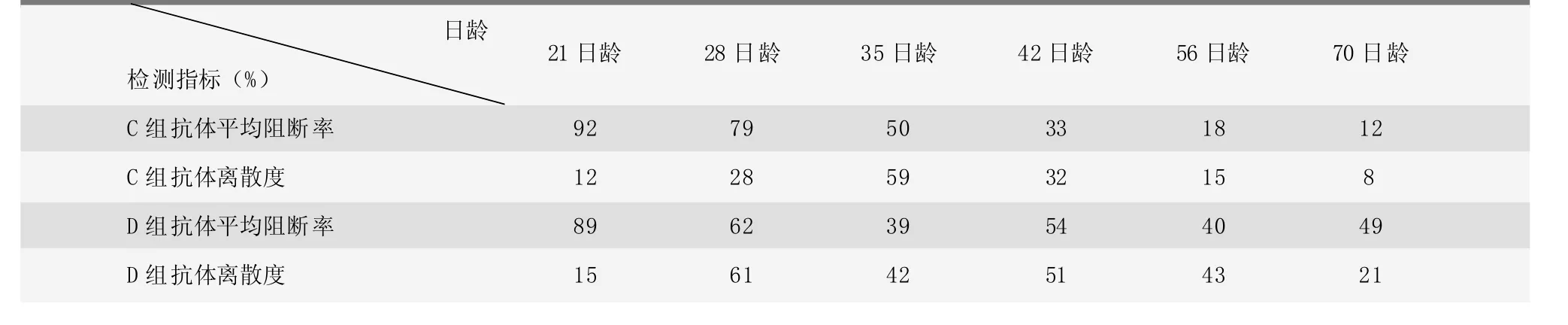
表3 第二次豬瘟試驗C組、D組抗體平均阻斷率和離散度結果
2.4 第三次豬瘟試驗結果
第三次試驗目的是對比新免疫程序(35日齡首免、75日齡二免)與舊免疫程序(20日齡首免、60日齡二免),采用新免疫程序的E組和舊免疫程序的F組使用的均是B廠家豬瘟疫苗。E組和F組仔豬豬瘟抗體平均阻斷率檢測結果以及離散度情況見表4。
E組抗體水平明顯高于F組:33日齡時,E組沒有免疫,F組已經首免,E組抗體水平高于F組;96日齡時兩組差異開始明顯,此時E組處于二免后21天,抗體水平較二免前的73日齡明顯提高,阻斷率平均上升13%;124日齡時E組抗體水平仍有小幅上升,但是F組抗體水平已經出現下降,二者差距顯著;152日齡時E組抗體阻斷率平均值在56%,仍在保護水平以上,雖然出現下降趨勢,仍能保護育肥豬至出欄,而F組抗體水平持續下降,阻斷率降至35%,已經不能對育肥豬產生抗體保護作用,在育肥豬出欄前豬瘟免疫抗體均不能達到保護水平。這說明,新免疫程序在該場試驗效果良好,遠遠優于舊免疫程序,該場應采用新免疫程序。
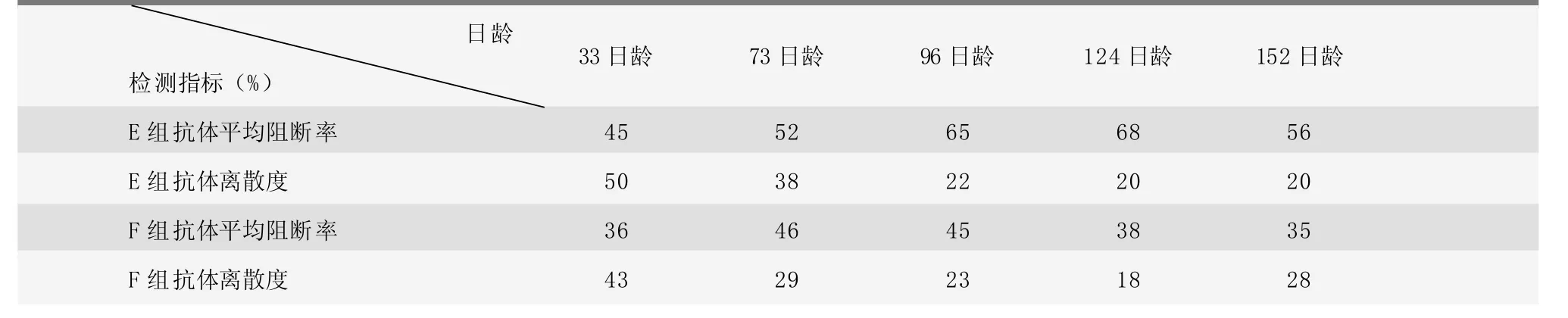
表4 第三次豬瘟試驗E組、F組抗體平均阻斷率和離散度結果
4 討論
仔豬母源抗體絕大多數是從分娩母豬的初乳中獲得的,少部分是從常乳中獲得的。隨著仔豬日齡的增長,母源抗體滴度緩慢下降[5]。在非疫情期,母源抗體持續時間和滴度水平直接決定著仔豬豬瘟疫苗的首免時間,首免過早會出現A組、B組、D組以及F組的情況,疫苗抗原被仔豬體內的高水平母源抗體中和,降低了仔豬本身的抗體水平;而首免過晚,保育仔豬會產生抗體空白期,增加了感染豬瘟野毒的風險。
該試驗豬場多年來一直沿用20日齡首免、60日齡二免的免疫程序,免疫效果一直不理想。為探討該場合適的仔豬豬瘟免疫程序,設計了三次試驗,不僅對比了A廠家和B廠家的豬瘟疫苗、探討了母源抗體消長規律,同時制定了新的免疫程序。試驗結果表明:B廠家疫苗免疫效果優于A廠家,因此選擇使用B廠家疫苗;35日齡時仔豬體內的母源抗體下降到臨近保護狀態,是進行首免的最佳時機,制定了35日齡首免、75日齡二免的新免疫程序,與舊免疫程序對比差異顯著,效果明顯較好。
造成豬免疫失敗的直接原因主要有三方面:免疫抑制性因素,主要包括免疫抑制性疾病以及霉菌毒素;疫苗因素,主要包括抗原含量、制備工藝、疫苗毒株;免疫程序不合理,主要包括首免日齡以及免疫頻率不合理。針對豬瘟免疫,因豬瘟屬于免疫抑制性疾病,豬場存在豬瘟野毒容易造成免疫失敗;不同廠家豬瘟疫苗雖然毒株相同,但是制備工藝以及實際抗原含量仍有差異,實際選擇上仍需進行免疫試驗,不能聽信疫苗生產廠家廣告宣傳[6],本次試驗用的兩種疫苗均是由國內知名疫苗廠家生產,免疫效果卻差異顯著;免疫程序不合理是造成豬瘟免疫失敗的關鍵因素,業內專家學者關于豬瘟免疫程序的研究主要集中在首免日齡、免疫劑量、免疫程序上[7,8]。必須通過監測母源抗體確定合理的首免日齡;關于免疫頻率方面,在參考疫苗廠家建議的基礎上以抗體檢測結果為評判標準,應能夠保證育肥豬出欄前豬瘟抗體水平均能達到保護水平。
除了造成免疫失敗的直接原因,管理因素也是決定養殖場免疫成績好壞以及是否穩定的間接原因。在防疫管理方面,養殖場應制定免疫監測計劃,定期對豬群的抗體水平檢測,連續2次抗體水平較差的項目需要引起關注,應逐一排查抗體水平較差的原因,排查的先后順序為:管理(防疫員技術水平、防疫人員責任心、防疫程序的執行情況)—豬場帶毒狀況、健康狀況—操作(防疫技巧)—疫苗質量—免疫程序。根據排查結果修正疫病預防方案,必要時設計試驗,探討合理的免疫方案以及疫病預防方案。
對豬瘟抗體檢測的方法主要有:豬瘟正向間接血凝法、Dot-ELISA法、免疫金標試紙檢測法、間接ELISA法、阻斷ELISA法等等。各種檢測方法對操作人員技術要求不一,檢測結果也有一定的差異性[9]。ELISA方法具有簡便、快捷、靈敏度高、重復性強、易操作等特點,是多數研究學者檢測豬瘟抗體的首選方法[10],也是農業部豬瘟疫病凈化要求中指定的檢測方法之一。養殖場根據免疫監測計劃進行抗體監測,能夠及時掌握本場的免疫效果、評價疫苗、監測淘汰免疫耐受豬只、輔助疫病凈化等。抗體監測在豬病防控中的作用日益突出。
[1]江春春,張任娜,賈亞偉,等.集約化豬場不同階段仔豬豬瘟抗體水平檢測與分析[J].豬業科學,2014(12):96-97.
[2]王亞,袁彥.某規模化豬場7種重大疾病免疫抗體監測及分析[J].養豬,2014(8):72-73.
[3]劉嫦,苗淑淑,高洪,等.云南省曲靖部分地區豬瘟病毒抗體水平調查[J].上海畜牧獸醫通訊,2016(4):38-39.
[4]陳橙,杜德利,呂景福,等.母豬與仔豬豬瘟免疫程序的觀察與分析[J].上海畜牧獸醫通訊,2016(5):30-31.
[5]呂仁洪,滕遠,石繼超.豬瘟免疫效果不佳的原因探討[J].中國豬業,2005(3):37-38.
[6]盧紀和,李官兵,楊新新.五種豬瘟疫苗免疫效果的試驗報告[J].中國豬業,2013(s2):130-132.
[7]陳耀,劉用玲.仔豬豬瘟母源抗體及免疫抗體監測實驗研究[J].西昌學院學報(自然科學版),2012,26(1):19-22.
[8]梁桂燕,韋建華.規模化豬場豬瘟超前免疫和非超前免疫效果實驗分析[J].中國畜牧獸醫文摘,2016,32(1):193.
[9]劉勝宇,汪峰,胡元元.液相阻斷ELISA法與正向間接血凝(IHA)法檢測豬瘟抗體結果比較[J].養豬,2015(7):31-32.
[10]李琳,尹榮蘭,呂亞堅.應用間接ELISA方法監測規模化豬場豬瘟抗體水平的研究[J].吉林畜牧獸醫,2015(5):25-26.
S858.28
A
1673-4645(2017)10-0056-04
2017-07-15
彭峰(1977-),高級畜牧師,現為河南省諸美種豬育種集團有限公司總經理,E-mail:707149529@qq.com

