耐藥肝癌細胞p62表達與順鉑敏感性的關系
鄭志明,鄒海鵬,林碧華,龍冰清
(1中山市小欖人民醫院,廣東中山528415;2濱州醫學院煙臺附屬醫院;3廣東醫科大學生物化學與分子生物學教研室;4廣東省醫學分子診斷重點實驗室)
·論著·
耐藥肝癌細胞p62表達與順鉑敏感性的關系
鄭志明1,鄒海鵬2,林碧華3,4,龍冰清1
(1中山市小欖人民醫院,廣東中山528415;2濱州醫學院煙臺附屬醫院;3廣東醫科大學生物化學與分子生物學教研室;4廣東省醫學分子診斷重點實驗室)
目的觀察順鉑耐藥的肝癌細胞中p62的表達情況,及p62基因沉默后耐藥肝癌細胞對順鉑敏感性的變化。方法培養肝癌親本細胞HepG2、Huh7,通過濃度梯度法建立順鉑耐藥細胞模型,采用Western blotting法檢測親本HepG2、Huh7細胞和耐藥HepG2、Huh7細胞中的p62蛋白。將耐藥HepG2、Huh7細胞分為沉默組和耐藥組,分別轉染p62 siRNA和siRNA Negative Control。在轉染48 h后的0、1、2、3、4、5 d測算沉默組和耐藥組細胞存活率。轉染后48 h進行Hochest 33258染色觀察沉默組和耐藥組細胞凋亡核形態、計數凋亡細胞,采用Annexin V-FITC/PI流式細胞術測算細胞凋亡率。轉染后48 h采用Western blotting法檢測沉默組與耐藥組細胞中的核因子紅細胞前體2相關因子2(Nrf2),RT-PCR法檢測Nrf2蛋白下游的谷氨酸半胱氨酸合成酶(GCL)、谷胱甘肽S轉移酶(GST)、NADP(H)醌氧化還原酶(NQO1)、血紅素氧化酶1(HO-1)、多藥耐藥蛋白(Mrp)基因。結果耐藥的HepG2、Huh7細胞中p62蛋白相對表達量分別高于親本HepG2、Huh7細胞(P均<0.05)。轉染48 h后的0、1、2、3、4、5 d沉默組HepG2、Huh7細胞存活率低于耐藥組(P均<0.05)。沉默組凋亡細胞數及凋亡率均高于耐藥組(P均<0.05)。沉默組細胞中Nrf2蛋白及NQO1、GCL、GST、HO-1、Mrp mRNA相對表達量均低于耐藥組(P均<0.05)。結論順鉑耐藥的肝癌細胞中p62蛋白表達上調;p62基因沉默后耐藥肝癌細胞對順鉑的敏感性增強,其機制可能與Nrf2及其下游基因表達下調有關。
肝癌;肝癌細胞;耐藥;順鉑;p62;基因沉默;核因子紅細胞前體2相關因子2
肝癌是最常見的惡性腫瘤之一[1],中國是肝癌高發國家,肝癌發病率占世界總數的50.5%,病死率占世界總數的51.4%[2]。肝癌惡性程度高,易復發和轉移,遠期療效并不理想[3]。化療是治療肝癌的最主要方法之一,但化療藥物耐藥問題成為肝癌治療的瓶頸[4]。尋找肝癌化療耐藥的關鍵調控因子,闡明耐藥作用機制,對肝癌的治療具有重要意義。p62是一種多功能泛素化接頭蛋白,最早被發現在細胞自噬調節中發揮重要作用[5]。近年來研究表明,p62在多種腫瘤中異常表達,如肝癌[6]、胃癌[7]、肺癌[8]、結腸癌[9]、乳腺癌[10]等,廣泛參與腫瘤細胞的增殖、分化、抗凋亡等過程,與腫瘤患者的不良預后顯著相關[11,12]。目前關于p62與肝癌細胞耐藥性的關系報道較少。本研究觀察了順鉑耐藥的肝癌細胞中p62的表達情況,選擇p62基準值相對較低的順鉑耐藥肝癌細胞株HepG2和Huh7,以細胞存活率、細胞凋亡率和耐藥相關基因表達作為化療敏感性的指標,觀察p62基因沉默后耐藥肝癌細胞對順鉑敏感性的變化,并探討其相關機制,現報告如下。
1 材料與方法
1.1 細胞與主要實驗材料 人肝癌細胞株HepG2和Huh7均來源于中國科學院上海細胞庫,由本實驗室規范培養保存。順鉑耐藥肝癌細胞株是本課題組前期經過3個月小劑量濃度梯度法誘導建立而成,培養過程中重復測定其耐藥性,經凍存再復蘇后耐藥性質穩定。順鉑購自Selleck公司。RPMI-1640培養基、Opti-MEM培養基、胎牛血清(FBS)、0.05%胰蛋白酶液、Lipofectamine3000轉染試劑、TRIzol試劑購自Thermofisher Scientific公司。Anti-SQSTM1/p62小鼠單克隆抗體(ab56416)、anti-核因子紅細胞前體2相關因子2(Nrf2)兔單克隆抗體(ab62352)、anti-p84兔單克隆抗體(ab131268)購自Abcam公司。anti-α-tubulin兔多克隆抗體(11224-1-AP)購自Proteintech Group公司。p62 siRNA片段及對應的siRNA Negative Control購自Invitrogen公司。Hoechest33258購自阿拉丁公司。Annexin V-FITC/PI細胞凋亡檢測試劑盒購自南京凱基生物科技有限公司。MTT購自鼎國昌盛生物技術公司。逆轉錄試劑盒及SYBR Green定量PCR試劑盒購自Roche公司。酶標儀為Biotek公司產品。CFX96實時熒光定量PCR儀為Bio-Rad公司產品。Gallios流式細胞儀為Beckman Coulter公司產品。
1.2 順鉑耐藥肝癌細胞模型建立及p62蛋白檢測
電子文檔由于創新性比較強,其保存過程中一定要注意其密級的界定,很多研究檔案或者研究數據在投放市場涉及科研機密,管理人員要及時與資源生產者聯系,確定使用范圍以及保密期限,方便電子文檔的使用。①對電子文檔使用范圍進行界定,哪些電子文檔資源是可以在本校使用的,哪些是可以在行業內進行共享的,都需要與資源擁有者進行協商。②涉及館外人員的電子文檔,在保存和使用中要與當事人進行協商,界定可使用的范圍,一方面要盡量保護讀者的權益的同時,也要盡量的保證電子文檔社會效益的發揮。
1.2.1 耐藥細胞模型建立 人肝癌親本細胞HepG2和Huh7用含10%FBS、1%青霉素+鏈霉素和1%谷氨酰胺的RPMI-1640培養液培養。采用濃度梯度法誘導順鉑耐藥的肝癌細胞:用初始順鉑濃度0.1 μg/mL處理細胞后,可觀察細胞生長緩慢,形態衰老,繼續培養至出現新的克隆,使其在0.1 μg/mL順鉑環境中穩定生長,傳代2次后將順鉑濃度提升至0.15 μg/mL;重復上述步驟,梯度提高順鉑濃度至細胞能在1 μg/mL順鉑環境中穩定生長,總誘導時間為3個月。耐藥細胞在1 μg/mL順鉑環境下,放入37.0 ℃、5% CO2恒溫恒濕培養箱中培養。
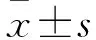
超微粉碎技術對靈芝中三萜類成分溶出的影響…………………………………………………… 張福君等(5):599
1.3 p62基因沉默的耐藥肝癌細胞對順鉑敏感性觀察
2.3 沉默組與耐藥組凋亡細胞數及凋亡率比較 沉默組細胞出現明顯細胞核固縮碎裂,染色質凝集,呈大小不等碎塊狀濃染,耐藥組細胞核形態清晰,進行正常細胞有絲分裂。沉默組凋亡細胞數及凋亡率均高于耐藥組(P均<0.05)。詳見表3。
2.1 耐藥肝癌細胞中p62蛋白的表達變化 親本HepG2細胞及耐藥HepG2細胞中p62蛋白相對表達量分別為0.25±0.05、0.58±0.16,親本Huh7細胞及耐藥Huh7細胞中p62蛋白相對表達量分別為0.22±0.04、0.52±0.11,耐藥的HepG2、Huh7細胞中p62蛋白相對表達量分別高于親本HepG2、Huh7細胞(P均<0.05)。
用于評估被試參加團輔的主觀感受,共包括4個開放式題目,分別是參加團輔后情緒變化、對團輔內容的評價、對自我的認識、對本次團輔的建議.在團輔結束時進行集體施測,當場回收.
1.3.4 Nrf2蛋白及其下游靶基因檢測 轉染48 h后,采用Western blotting法檢測Nrf2蛋白。將HepG2、Huh7耐藥組和沉默組細胞用1×PBS洗2次,加入RIPA細胞裂解液冰上裂解10 min,4 ℃下12 000 g離心,收集上清,按BCA蛋白定量試劑盒說明書進行蛋白定量,加入蛋白變性劑后沸水浴變性蛋白。各組樣品上樣量為30 μg,使用SDS-PAGE蛋白電泳系統分離蛋白,電濕轉法將蛋白轉移至0.2 μm的PVDF膜上。5%脫脂奶粉封閉后,加入稀釋的一抗工作液(Anti-SQSTM1/p62小鼠單克隆抗體),4 ℃孵育過夜,1×TBST漂洗3次。加入稀釋的辣根過氧化物酶標記的二抗工作液,室溫孵育1 h,1×TBST漂洗。滴加新鮮配置的ECL化學發光液,在暗室中曝光顯影。用Photoshop軟件分析得到目的條帶與內參條帶的灰度值,將二者比值作為目的蛋白的相對表達量。采用RT-PCR法檢測兩組細胞中的谷氨酸半胱氨酸合成酶(GCL)、谷胱甘肽S轉移酶(GST)、NADP(H)醌氧化還原酶(NQO1)、血紅素氧化酶1(HO-1)、多藥耐藥蛋白(Mrp)基因。收集沉默組與耐藥組細胞,加入1 mL的TRIzol試劑裂解細胞,采用氯仿萃取異丙醇沉淀提取總RNA。隨后按PrimeScript RT reagent Kit說明書操作,將RNA逆轉錄為cDNA;按SYBR Premix Ex Taq Ⅱ Kit說明書操作,GAPDH為內參(引物信息見表1);在CFX96實時定量PCR系統上進行PCR反應;以2-ΔΔCt表示目的基因相對表達量。

表1 Nrf2下游靶基因及內參基因引物序列
1.2.2 p62蛋白檢測 采用Western blotting法檢測p62蛋白。將HepG2、Huh7細胞及對順鉑耐藥的HepG2、Huh7細胞用1×PBS洗兩次,加入RIPA細胞裂解液(150 mmol/L NaCl、1% NP-40,0.5%脫氧膽酸鈉、0.2%SDS、2%甘油)冰上裂解10 min,4 ℃下12 000 g離心,收集上清,按BCA蛋白定量試劑盒說明書進行蛋白定量,加入蛋白變性劑后沸水浴變性蛋白。各組樣品上樣量為30 μg,使用SDS-PAGE蛋白電泳系統分離蛋白,電濕轉法將蛋白轉移至0.2 μm的PVDF膜上。5%脫脂奶粉封閉后,加入稀釋的一抗工作液(Anti-SQSTM1/p62小鼠單克隆抗體),4 ℃孵育過夜,1×TBST漂洗3次。加入稀釋的辣根過氧化物酶標記的二抗工作液,室溫孵育1 h,1×TBST漂洗。滴加新鮮配置的ECL化學發光液,在暗室中曝光顯影。用Photoshop軟件分析得到目的條帶與內參條帶的灰度值,將二者比值作為目的蛋白的相對表達量。
但事實卻是,想象和現實之間總存在著巨大的鴻溝。在擺弄過奧迪R8 RWS之后,勞拉表示:“它動力強勁,但也一定程度上導致了轉向過度。當出現轉向過度的傾向時,發動機的輸出會有些不太受控制,這一點和普通的奧迪R8完全不同。”另一點在于,降擋之后,那臺V10發動機的轉速會突然飆升,導致車尾在制動的過程中會突然喪失下壓力,進一步增加了轉向不足的概率。
2 結果
1.3.2 細胞存活率測算 轉染48 h后,利用MTT法檢測細胞存活情況。將沉默組和耐藥組細胞消化后接種于96孔培養板中(200 μL,1×103個細胞),全過程用添加順鉑的培養基培養,次日開始每天(共5 d)觀察兩組細胞的存活情況。具體方法:每組設置3個復孔,加入20 μL的MTT,繼續培養細胞4 h后加入160 μL的DMSO(選擇一個空白孔加入160 μL的DMSO作為空白對照);酶標儀上490 nm波長處測定光密度值(OD值),根據結果繪制細胞生存曲線。根據公式計算細胞存活率:細胞存活率=(實驗組OD值-空白組OD值)/(對照組OD值-空白組OD值)×100%。
2.2 沉默組與耐藥組細胞存活率比較 轉染48 h后的0、1、2、3、4、5 d沉默組HepG2、Huh7細胞存活率低于耐藥組(P均<0.05)。見圖1、表2。
1.3.1 p62基因沉默方法 將耐藥的HepG2、Huh7細胞分為耐藥組和沉默組。待細胞生長至指數增殖階段(密度為60%~70%)進行轉染,更換新的完全培養基。用Lipofectamine3000試劑進行轉染,沉默組轉染p62 siRNA(終濃度100 nmol/L),耐藥組轉染siRNA Negative Control(終濃度100 nmol/L)。將細胞放于培養箱中繼續培養,轉染48 h時進行后續實驗。
1.3.3 凋亡細胞觀察及凋亡率測算 采用Hochest33258染色法觀察細胞凋亡情況。將沉默組和耐藥組細胞消化后接種于24孔培養板中(1 mL,6×104個細胞,板中事先鋪好細胞爬片),培養過夜后棄除培養基,4%多聚甲醛固定細胞10 min,去除固定液,1×PBS洗兩次;加入0.5 mg/L的Hoechest33258染液避光室溫染色20 min,1×PBS洗兩次,避光風干;倒置熒光顯微鏡下觀察并拍照,視野中隨機選取5個視野,計數凋亡細胞(細胞核固縮碎裂,染色質凝集,呈大小不等碎塊狀濃染)。將沉默組與耐藥組細胞消化后離心棄上清,1×PBS洗兩次,按每孔106個細胞加入500 μL的Binding buffer充分重懸細胞,加入5 μL的Annexin V-FITC染液混勻,室溫避光孵育10 min,再加入10 μL的PI染液混勻后避光孵育5 min,1 h內上流式細胞分析儀測算兩組細胞凋亡率。

圖1 轉染后0~5 d沉默組與耐藥組細胞存活率
2.4 沉默組與耐藥組細胞中Nrf2蛋白及其下游靶基因表達比較 沉默組細胞中Nrf2蛋白及NQO1、GCL、GST、HO-1、Mrp mRNA相對表達量均低于耐藥組(P均<0.05)。詳見表4。
3 討論
肝癌是中國最常見的惡性腫瘤之一[2],常規治療方法為手術切除,但其術后復發率高,且晚期肝癌患者不能進行手術,因此化療是目前治療復發肝癌及晚期肝癌的首選方案[13~16]。然而,大量臨床實踐p62攜帶多個功能結構域,是調控多個信號轉導通路的關鍵節點,如N端的PB1區域能夠使其自身寡聚化及多聚化[18],ZZ鋅指結構可與NF-κB通路關鍵蛋白相互作用[19],TBS序列能夠與TRAF6結合調控炎癥反應[20],C端的UBA結構域能夠與泛素化蛋白相互作用從而促進自噬途徑降解過程[21]。p62的這些結構域決定了其功能的多樣性,主要涉及細胞存活、凋亡、選擇性自噬等方面。因此,探討p62在不同模型中的功能及其作用機制具有重要意義。本研究成功構建了對順鉑耐藥的肝癌細胞系,發現相對于親本細胞,耐藥細胞中p62蛋白高表達,預示p62在肝癌耐藥性中可能發揮關鍵作用。進一步研究發現,轉染48 h后的0、1、2、3、4、5 d 檢測細胞存活率,發現沉默組HepG2、Huh7細胞存活率低于耐藥組細胞,沉默組凋亡細胞數及凋亡率均高于耐藥組細胞,提示干擾p62能夠增強耐藥肝癌細胞對順鉑的敏感性,意味著p62可能在順鉑誘導耐藥過程中發揮核心作用,參與肝癌耐藥性的產生。

表2 轉染48 h后0~5 d沉默組與耐藥組細胞存活率比較
注:與耐藥組同類細胞相比,*P<0.05。
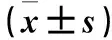
表3 沉默組與耐藥組凋亡細胞數及凋亡率比較
注:與耐藥組同類細胞相比,*P<0.05。表明肝癌細胞具有強耐藥性,嚴重影響化療效果[17]。因此,深入探究肝癌細胞耐藥的分子機制,尋找耐藥相關的治療靶點是目前研究的熱點和難點。
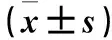
表4 沉默組與耐藥組細胞中Nrf2蛋白及其下游靶基因表達比較
注:與耐藥組同類細胞相比,*P<0.05。
Nrf2是一個與腫瘤耐藥相關的重要轉錄因子,通過激活腫瘤細胞的抗氧化應答和誘導一系列抗氧化基因轉錄,從而對抗化療藥物在氧化應激過程中產生的有害物質,起到保護腫瘤細胞的作用[15,22,23]。目前認為受Nrf2調控的靶基因主要有三類:細胞內氧化還原平衡蛋白如GCL和GST,第Ⅱ相解毒酶如NQO1和GST,ATP依賴性耐藥泵基因如Mrps等[22~24]。研究表明,p62在細胞中的作用機制可能與其調節轉錄因子Nfr2表達有關。而Nrf2被報道通過轉錄激活下游基因的表達,參與腫瘤細胞耐藥[14,15]。所以我們推測,p62對肝癌細胞耐藥性的作用可能是通過調控Nrf2的表達實現的。本研究結果顯示,沉默組細胞中Nrf2蛋白及NQO1、GCL、GST、HO-1、Mrp mRNA相對表達量均低于耐藥組,推測p62參與肝癌細胞耐藥可能與調控Nrf2及其下游基因表達有關。有研究表明p62的KIR結構域能與Keap1的Kelch結構域結合,阻斷Keap1與Nrf2的相互作用,促使Keap1經自噬降解,從而激活Nrf2[13]。關于本研究中p62具體是通過何種機制調控Nrf2,目前的數據不足以說明此機制,還有待進一步深入研究來證實。
教師的歷史教學能力,不僅表現在對歷史事件與觀點講述上,還體現在對歷史事件與觀點的論證上。信息技術的發展,便于學生更好的獲取歷史信息,使學生能夠接觸大量的歷史事件與觀點。在此背景下,教師在完成教授學生主流歷史觀點任務后,還應該提升自身歷史論證能力。而教師收集、選取史料中,事實上就是分析、總結歷史教材,是提升教師歷史論證能力的過程。在歷史教學中,教師有效的運用史料教學,能夠體現歷史教學的魅力,并且還能夠提升歷史教學質量,從而使學生學習到全面的歷史知識。
綜上所述,順鉑耐藥的肝癌細胞中p62蛋白表達上調;p62基因沉默后耐藥肝癌細胞對順鉑的敏感性增強,其機制可能與Nrf2及其下游基因表達下調有關。p62可能成為逆轉肝癌細胞順鉑耐藥的一個新的潛在靶點。
[1] Chen W, Zheng R, Baade PD, et al. Cancer statistics in china, 2015 [J]. CA Cancer J Clin, 2016,66(2):115-132.
[2] 魏礦榮,彭俠彪,梁智恒,等.全球肝癌流行概況[J].中國腫瘤,2015,24(8):621-630.
[3] 楊浩,楊連粵.肝癌術后復發轉移相關因素研究進展[J].中國實用外科雜志,2012,32(10):868-876.
[4] Cao H, Phan H, Yang LX. Improved chemotherapy for hepatocellular carcinoma [J]. Anticancer Res, 2012,32(4):1379-1386.
[5] Moscat J, Diaz-Meco MT. P62 at the crossroads of autophagy, apoptosis, and cancer [J]. Cell, 2009,137(6):1001-1004.
[6] Umemura A, He F, Taniguchi K, et al. P62, upregulated during preneoplasia, induces hepatocellular carcinogenesis by maintaining survival of stressed hcc-initiating cells [J]. Cancer cell, 2016,29(6):935-948.
[7] Qian HR, Yang Y. Functional role of autophagy in gastric cancer [J]. Oncotarget, 2016,7(14):17641-17651.
[8] Schlafli AM, Adams O, Galvan JA, et al. Prognostic value of the autophagy markers lc3 and p62/sqstm1 in early-stage non-small cell lung cancer [J]. Oncotarget, 2016,7(26):39544-39555.
[9] Kosumi K, Masugi Y, Yang J, et al. Tumor sqstm1 (p62) expression and t cells in colorectal cancer [J]. Oncoimmunology, 2017,6(3):1284720.
[10] Puvirajesinghe TM, Bertucci F, Jain A, et al. Identification of p62/sqstm1 as a component of non-canonical wnt vangl2-jnk signalling in breast cancer [J]. Nat Commun, 2016,7(2):10318.
[11] Arai A, Chano T, Ikebuchi K, et al. P62/sqstm1 levels predicts radiotherapy resistance in hypopharyngeal carcinomas [J]. Am J Cancer Res, 2017,7(4):881-891.
[12] Liu JL, Chen FF, Lung J, et al. Prognostic significance of p62/sqstm1 subcellular localization and lc3b in oral squamous cell carcinoma [J]. Br J Cancer, 2014,111(5):944-954.
[13] Komatsu M, Kurokawa H, Waguri S, et al. The selective autophagy substrate p62 activates the stress responsive transcription factor nrf2 through inactivation of keap1 [J]. Nat Cell Biol, 2010,12(3):213-223.
[14] Hayden A, Douglas J, Sommerlad M, et al. The nrf2 transcription factor contributes to resistance to cisplatin in bladder cancer [J]. Urol Oncol, 2014,32(6):806-814.
[15] Jaramillo MC, Zhang DD. The emerging role of the nrf2-keap1 signaling pathway in cancer [J]. Genes Dev, 2013,27(20):2179-2191.
[16] Pauwels EK, Erba P, Mariani G, et al. Multidrug resistance in cancer: Its mechanism and its modulation [J]. Drug News Perspect, 2007,20(6):371-377.
[17] Shaaban S, Negm A, Ibrahim EE, et al. Chemotherapeutic agents for the treatment of hepatocellular carcinoma: Efficacy and mode of action [J]. Oncol Rev, 2014,8(1):246.
[18] Moscat J, Diaz-Meco MT, Albert A, et al. Cell signaling and function organized by pb1 domain interactions [J]. Mol Cell, 2006,23(5):631-640.
[19] Duran A, Serrano M, Leitges M, et al. The atypical pkc-interacting protein p62 is an important mediator of rank-activated osteoclastogenesis [J]. Dev Cell, 2004,6(2):303-309.
[20] Sanz L, Diaz-Meco MT, Nakano H, et al. The atypical pkc-interacting protein p62 channels nf-kappab activation by the il-1-traf6 pathway [J]. EMBO J, 2000,19(7):1576-1586.
[21] Harper JW, Schulman BA. Structural complexity in ubiquitin recognition [J]. Cell, 2006,124(6):1133-1136.
[22] 張凱茹,閆惠琴,王燕,等.Nrf2及其靶基因在人肺腺癌A549順鉑耐藥細胞株中的表達和意義[J].中國肺癌雜志,2009,12(11):1150-1154.
[23] 莫享陽,喬洪源,歐陽學農,等.Keap1-Nrf2-ARE信號通路介導非小細胞肺癌耐藥機制的研究進展[J].現代腫瘤醫學,2015,23(9):1322-1324.
[24] Seng S, Avraham HK, Birrane G, et al. Nrp/b mutations impair nrf2-dependent nqo1 induction in human primary brain tumors [J]. Oncogene, 2009,28(3):378-389.
Relationshipbetweenp62expressionincisplatin-resistantlivercancercellsandsensitivitytocisplatin
ZHENGZhiming1,ZOUHaipeng,LINBihua,LONGBingqing
(1XiaolanPeople′sHospitalofZhongshan,Zhongshan528415,China)
ObjectiveTo investigate the expression of p62 in cisplatin-resistant liver cancer cells and the chemotherapeutic sensitivity of p62-silenced cisplatin-resistant liver cancer cells to cisplatin.MethodsHuman liver cancer cell lines HepG2 and Huh7 were used to induce cisplatin-resistant cell lines by slowly increasing cisplatin concentrations. The protein expression of p62 was detected in parental cells and cisplatin-resistant cells by Western blotting. The liver cancer cisplatin-resistant cell lines (HepG2/CDDP and Huh7/CDDP) were divided into the p62-silenced group and cisplatin-resistant group, and were treated by p62 siRNA and siRNA Negative Controls, respectively. After 48-hour transfection, MTT assay was applied to detect cell viability of the two groups at 0, 1, 2, 3, 4, and 5 d. Apoptotic nuclear changes were evaluated with Hochest 33258 staining, and apoptotic cells were quantified. Meanwhile, the apoptosis rate was calculated by Annexin V-FITC/PI flow cytometry at 48 h after transfection. The protein expression of NF-E2-related factor 2 (Nrf2) and the mRNA expression of its target genes glutamate cysteine ligase (GCL), glutathione S transferase (GST), quinone oxidoreductase 1 (NQO1), glutathione S transferase (GST), heme oxygenase-1(HQ-1) and multidrug resistance-associated protein (Mrp) was evaluated by Western blotting and RT-PCR, respectively.ResultsThe cisplatin-resistant cells (HepG2 and Huh7) expressed much higher protein levels of p62 than their parental cells (allP<0.05). The cell viability of the two groups at 0, 1, 2, 3, 4, and 5 d of the p62-silenced group was lower than that of the cisplatin-resistant cells (allP<0.05), and the apoptosis of cisplatin-resistant group increased as compared with that of the p62-silenced group (allP<0.05). The expression of Nrf2 protein and its target genes NQO1, GCL, GST, HO-1, and Mrp mRNA of the p62-silenced group was lower than that of the cisplatin-resistant group (allP<0.05).ConclusionsThe protein level of p62 is up-regulated in cisplatin-resistant liver cancer cells. Silencing p62 increases the sensitivity of liver cancer cells to cisplatin by down-regulating the expression of Nrf2 and its target genes.
liver carcinoma; liver cancer cells; drug resistance; cisplatin; p62; gene silencing; NF-E2-related factor 2
10.3969/j.issn.1002-266X.2017.39.001
R735.7
A
1002-266X(2017)39-0001-05
國家自然科學基金項目(81272434);廣東省醫學科研基金項目(A2016395);廣東省中醫藥局科研項目(20172085);中山市科技計劃項目(2015B1061)。
鄭志明(1988-),男,碩士,臨床藥師,主要研究方向為臨床藥學。E-mail: zhiyu06224@163.com
龍冰清(1985-),女,本科,藥師,主要研究方向為臨床藥學。E-mail: zzm06224@yeah.net
2017-06-29)

