二氯乙酸對膀胱癌細胞株T24增殖、凋亡的影響及其機制探討
謝智彬,付偉金,陸春宇,楊小麗,李佳桐,趙東
(1廣西醫科大學第一附屬醫院,南寧530021;2廣西醫科大學)
二氯乙酸對膀胱癌細胞株T24增殖、凋亡的影響及其機制探討
謝智彬1,付偉金1,陸春宇1,楊小麗2,李佳桐2,趙東2
(1廣西醫科大學第一附屬醫院,南寧530021;2廣西醫科大學)
目的觀察二氯乙酸(DCA)對膀胱癌細胞株T24增殖、凋亡的影響,并探討其相關機制。方法培養T24細胞并隨機分成4個組,其中實驗1組、實驗2組和實驗3組分別加入含5、10、20 mmol/L DCA的培養基,對照組加入等量含0.1% DMSO的培養基。分別于給藥24、48、72 h后采用MTT法檢測細胞增殖能力。給藥48 h后,行Hoechst33258熒光染色觀察并計數凋亡細胞,采用JC-1染色法檢測細胞線粒體膜電位,采用Western blotting法檢測各組細胞中的Bax、Bcl-2、Caspase-3蛋白。結果實驗1、2、3組給藥24、48、72 h細胞增殖能力均低于對照組,且隨著DCA作用時間濃度增大、給藥時間延長,細胞增殖抑制越明顯(P均<0.05)。實驗1、2、3組凋亡細胞數均高于對照組,線粒體膜電位均低于對照組(P均<0.05)。實驗1、2、3組細胞中Bax、Caspase-3相對表達量高于對照組,Bcl-2相對表達量低于對照組(P均<0.05)。結論DCA可抑制膀胱癌細胞株T24的增殖并誘導其凋亡,推測作用機制與線粒體膜電位降低、Bcl-2表達下調及Bax、Caspase-3表達上調有關。
二氯乙酸;膀胱癌;膀胱癌細胞;細胞增殖;細胞凋亡;線粒體膜電位
在歐美地區,膀胱癌是泌尿系腫瘤中最常見的惡性腫瘤,其發病率和病死率均居泌尿系腫瘤首位[1]。在我國,膀胱癌發病率也有逐步上升的趨勢[2]。膀胱癌的主要治療方法是經尿道膀胱腫瘤電切除(TURB-t),術后輔助化療。但傳統化療會引起患者局部及全身一系列不良反應,如膀胱刺激、過敏反應及骨髓抑制等。因此尋找低毒、廉價、高效的新型化療替代藥是當前抗膀胱癌研究的熱點。二氯乙酸(DCA)是一種小分子代謝調節劑,臨床上主要用于治療乳酸中毒和線粒體遺傳性疾病[3]。DCA通過抑制丙酮酸脫氫酶激酶,激活丙酮酸脫氫酶,促使更多丙酮酸進入線粒體進行氧化磷酸化[4]。近年來研究發現DCA能有效抑制多種腫瘤細胞增殖并誘導腫瘤細胞凋亡[5~8],但有關DCA對膀胱癌的作用目前報道較少。2016年5~12月,我們觀察了不同濃度DCA對膀胱癌T24細胞增殖、凋亡的影響,并探討其可能機制。現報告如下。
1 材料與方法
1.1 主要試劑與儀器 DCA、噻唑藍(MTT)、二甲基亞砜(DMSO)、PBS、Hoechst33258染料、JC-1試劑盒、RIPA細胞裂解液、BCA試劑盒購自Sigma公司;β-actin、Bax、Bcl-2及Caspase-3兔抗人多克隆抗體購自美國abcam公司。CKX41倒置顯微鏡(Olympus公司)。
1.2 細胞培養及分組 膀胱癌細胞株T24購于中國科學院。T24細胞用含有10%胎牛血清和1%青鏈霉素溶液的RPMI1640培養液于5% CO2、37 ℃恒溫培養箱中常規培養。取對數生長期的T24細胞,隨機分為實驗1、2、3組和對照組。
1.3 DCA對T24細胞增殖能力的影響觀察 采用MTT法。將T24細胞以4×103/孔均勻接種于96孔板,終體積為200 μL/孔。恒溫箱內培養12 h待細胞貼壁后,實驗1、2、3組分別加入含5、10、20 mmol/L二氯乙酸的培養基,對照組加入等量含0.1% DMSO的培養基培養,每個濃度5個復孔。分別于培養24、48、72 h后按20 μL/孔將5 mg/mL的MTT溶液加入培養孔。將培養板置于恒溫培養箱內,繼續培養4 h,吸去上清液。每孔加入200 μL的DMSO,室溫避光震蕩10 min,在酶標儀上測定490 nm波長處各孔的光密度值(OD值),以此表示細胞的增殖能力。實驗獨立重復3次,取均值。
1.4 DCA對T24細胞凋亡的影響觀察 采用Hoechst33258熒光染色法。取對數生長期的T24細胞均勻接種于底面鋪有無菌蓋玻片的6孔板中,恒溫培養箱內培養12 h,待細胞貼壁后各組按“1.3”的方法添加藥物繼續培養48 h。棄去培養基,PBS潤洗后加入4%多聚甲醛常溫固定10 min,再用配置好的Hoechst33258工作液避光孵育10 min,PBS潤洗,取出蓋玻片,用抗熒光淬滅封片。熒光顯微鏡下(200×)觀察細胞核變化,計算凋亡細胞個數。實驗重復3次,取均值。
1.5 DCA對T24細胞線粒體膜電位的影響觀察 收集“1.4”培養48 h后的各組細胞,PBS清洗3次,加入500 μL的JC-1工作液,于37 ℃、5% CO2避光孵育20 min,棄去上清液,PBS潤洗3次,熒光顯微鏡下觀察,用白光、488 nm激光、530 nm激光三通道中速掃描細胞,采集圖片。當細胞線粒體膜電位水平升高時,JC-1主要以聚合體形式存在,呈紅色熒光;當線粒體膜電位水平降低時,JC-1主要以單體形式存在,呈綠色熒光。用Image Pro Plus6.0軟件分析細胞內紅色、綠色熒光強度,以紅色熒光與綠色熒光強度的比值代表線粒體膜電位水平。實驗重復3次,取均值。
1.6 DCA對T24細胞中Bax、Bcl-2和caspase-3蛋白表達的影響觀察 采用Western blotting法。收集“1.4”培養48 h后的4組細胞,PBS潤洗后加入含有蛋白酶抑制劑的RIPA裂解液,4 ℃裂解30 min,高速離心后取上清液。按BCA試劑盒說明書測定總蛋白濃度后加入適量蛋白上樣緩沖液,沸水浴加熱10 min使蛋白變性后分裝,-20 ℃保存。取60 μg總蛋白經12% SDS-PAGE凝膠電泳后轉印到PVDF膜上,5%脫脂牛奶封閉1 h,TBST潤洗后分別加β-actin、Bax、Bcl-2和Caspase-3抗體4 ℃孵育過夜,抗體稀釋度均為1∶1 000。TBST潤洗5 min×5次,常溫搖床下孵育二抗(1∶5 000)1 h;TPBS溶液洗膜5 min×5次,用雙色紅外熒光掃描成像系統掃膜。采用Image J軟件分析蛋白條帶灰度值,以目的蛋白條帶灰度值與β-actin條帶灰度值的比值表示目的蛋白相對表達量。
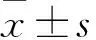
2 結果
2.1 各組細胞增殖能力比較 實驗1、2、3組給藥24、48、72 h細胞增殖能力均低于對照組,且隨著DCA作用時間濃度增大、給藥時間延長,細胞增殖抑制越明顯(P均<0.05)。詳見表1。
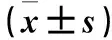
表1 兩組細胞OD值比較
注:與對照組同時點比較,*P<0.05;與實驗1組同時點相比,△P<0.05;與實驗2組同時點相比,△△P<0.05;與同組給藥24 h時相比,#P<0.05;與同組給藥48 h時相比,##P<0.05。
2.2 各組凋亡細胞數比較 實驗1組、實驗2組、實驗3組、對照組給藥48 h后T24細胞凋亡數分別為(9±1.83)、(26.5±5.8)、(48.75±2.99)、(3.25±0.96)個/HP,實驗1、2、3組凋亡細胞數均高于對照組(P均<0.05)。
2.3 各組細胞線粒體膜電位比較 實驗1組、實驗2組、實驗3組、對照組細胞線粒體膜電位分別為1.32±0.21、0.87±0.13、0.53±0.16、1.73±0.12,實驗1、2、3組線粒體膜電位均低于對照組(P均<0.05)。
2.4 各組細胞中Bax、Bcl-2、Caspase-3表達比較 實驗1、2、3組細胞中Bax、Caspase-3相對表達量高于對照組,Bcl-2相對表達量低于對照組(P均<0.05)。詳見表2、圖1~3。
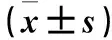
表2 各組細胞中Bax、Bcl-2、Caspase-3相對 表達量比較
注:與對照組相比,*P<0.05。

圖1 各組細胞中Bax蛋白表達情況

圖2 各組細胞中Bcl-2蛋白表達情況

圖3 各組細胞中Caspase-3蛋白表達情況
3 討論
膀胱癌是源于膀胱黏膜上皮的惡性腫瘤,多以移行細胞癌為主,發病因素多與長期吸煙、職業暴露、感染等有關[9]。膀胱癌早期癥狀不典型,臨床上早期診斷困難,治療效果欠佳,且易復發,預后差。目前膀胱癌TURB-t術后輔行膀胱化療,但常規化療藥物在殺傷腫瘤細胞的同時,也會引起患者局部及全身一系列不良反應,如過敏反應、骨髓抑制及膀胱刺激等,嚴重損害患者生活質量,甚至影響治療進程。DCA是一種用于治療新陳代謝紊亂癥的小分子代謝調節劑,為丙酮酸脫氫酶激酶的抑制劑,可使丙酮酸脫氫酶激活,促進更多丙酮酸進入線粒體,抑制糖酵解,減少乳酸堆積,使微環境不利于腫瘤生存[10];同時大量釋放大量自由基降低膜電位,啟動線粒體介導的凋亡通路,促進腫瘤細胞凋亡[11]。DCA對多種惡性腫瘤細胞具有抗腫瘤效應,如腎癌、結腸癌、乳腺癌、宮頸癌等[5~8],但對健康細胞卻無損害。本研究結果顯示,DCA對膀胱癌T24細胞具有顯著的增殖抑制效應,且呈時間和劑量依賴性。
細胞凋亡是由基因控制的細胞程序性死亡,凋亡調控異常在惡性腫瘤的發生、發展中占有重要地位。凋亡信號通路是目前抗腫瘤研究的熱點[12]。細胞凋亡主要包括線粒體/細胞色素C介導的細胞內途徑和膜死亡受體介導的細胞外凋亡途徑[13]。Bax、Bcl-2是調控線粒體凋亡通路的關鍵凋亡蛋白。Bcl-2是抗凋亡基因,能促進腫瘤細胞增殖,Bax蛋白卻可抑制Bcl-2的活性。Bax和Bcl-2可通過改變線粒體膜通透性和細胞色素C的釋放,影響下游區Caspase-3的活性從而促進細胞凋亡[14,15];當細胞受外信號刺激后,促使膜死亡受體與Caspase-3家族前體蛋白結合,啟動Caspase-3級聯反應,激活Caspase-3,降解細胞內蛋白而促進細胞凋亡。本研究結果顯示,DCA能誘導T24細胞凋亡,且隨DCA濃度升高,凋亡細胞數明顯增加,呈劑量依賴性,與MTT結果相符。上述結果提示DCA是通過誘導細胞凋亡而抑制T24細胞增殖。
孫潔等[16]通過Hoechst3342染色觀察發現,DCA可誘導人結腸癌HCT116細胞凋亡,且聯合順鉑用藥后則凋亡細胞明顯增多,認為DCA的促凋亡作用與線粒體跨膜電位降低和Bcl-2表達下調等有關。Kinnaird等[7]研究發現DCA能夠抑制腎透明細胞癌786-0細胞株增殖,其可能機制是激活線粒體代謝功能(如增強細胞有氧呼吸、促進三羧酸循環代謝、增加線粒體活性氧水平)同時增強p53的活性。DCA還可通過mTOR通路抑制腫瘤細胞生長,誘導腫瘤細胞發生自噬[17,18]。Tong等[19]研究發現DCA能協同5-FU抑制人結腸癌細胞增殖,并通過線粒體凋亡通路下調Bcl-2表達、上調Bax、Caspase-3表達從而誘導腫瘤細胞凋亡。
研究[20]表明,線粒體膜電位降低是細胞凋亡的早期表現,即提示細胞凋亡的開始。我們用不同濃度的DCA作用于T24細胞,發現隨DCA濃度增加,細胞線粒體膜電位依次降低,提示DCA可誘導T24細胞早期凋亡,這可能與DCA降低T24細胞線粒體膜電位作用有關。同時,本研究結果還顯示,隨著DCA作用濃度升高,實驗組細胞中Bax、Caspase-3蛋白相對表達量依次升高,Bcl-2蛋白相對表達量依次降低,提示DCA對膀胱癌細胞的增殖抑制、促凋亡作用可能與Bax、Caspase-3蛋白表達上調,Bcl-2蛋白表達下調有關。
綜上所述,DCA可抑制膀胱癌T24細胞的增殖并誘導其凋亡,推測其作用機制與降低線粒體膜電位、下調Bcl-2表達及上調Bax、Caspase-3表達有關。上述研究結果為DCA用于膀胱癌的治療提供了理論基礎。
[1] Siegel RL, Miller KD, Jemal A, et al. Cancer statistics,2016[J]. CA Cancer J Clin, 2016,66(1):7-30.
[2] Chen W, Zheng RH, Zeng H, et al. Annual report on status of cancer in China,2011[J]. Chin J Cancer Res, 2015,27(1):2-12.
[3] Michelakis ED, Webster L, Mackey JR, et al. Dichloroacetate (DCA) as a potential metabolic-targeting therapy for cancer[J]. Br J Cancer, 2008,99(7):989-994.
[4] Richard SM, Martinez Marignac VL. Sensitization to oxaliplatin in HCT116 and HT29 cell lines by metformin and ribavirin and differences in response to mitochondrial glutaminase inhibition[J]. J Cancer Res Ther, 2015,11(2):336-340.
[5] Zhu D, Hou L, Hu B, et al. Crosstalk among proteome, acetylome and succinylome in colon cancer HCT116 cell treated with sodium dichloroacetate[J]. Sci Rep, 2016,6:37478.
[6] Woo SH, Seo SK, Park Y, et al. Dichloroacetate potentiates tamoxifen-induced cell death in breast cancer cells via downregulation of the epidermal growth factor receptor[J]. Oncotarget, 2016,7(37):59809-59819.
[7] Kinnaird A, Dromparis P, Saleme B, et al. Metabolic Modulation of Clear-cell Renal Cell Carcinoma with Dichloroacetate, an Inhibitor of Pyruvate Dehydrogenase Kinase[J]. Eur Urol, 2016,69(4):734-744.
[8] Li B, Li X, Ni Z, et al. Dichloroacetate and metformin synergistically suppress the growth of ovarian cancer cells[J]. Oncotarget, 2016,7(37):59458-59470.
[9] 白云金,李金洪,魏強.膀胱癌病因學研究進展[J].現代泌尿外科雜志,2014,19(10):693-697.
[10] 閆曉歡,王婉,鄭英如.二氯乙酸鹽通過促進Mcl-1降解誘導宮頸癌細胞凋亡[J].第三軍醫大學學報,2016,38(7):693-696.
[11] Bonnet S, Archer SL, Allalunis-Turner J, et al. A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth[J]. Cancer Cell, 2007,11(1):37-51.
[12] Plati J, Bucur O, Khosravi-Far R. Apoptotic cell signaling in cancer progression and therapy[J]. Integr Biol (Camb), 2011,3(4):279-296.
[13] Spencer SL, Sorger PK. Measuring and modeling apoptosis in single cells[J]. Cell, 2011,144(6): 926-939.
[14] Brentnall M, Rodriguez-Menocal L, De Guevara RL, et al. Caspase-9,caspase-3 and caspase-7 have distinct roles during intrinsic apoptosis[J]. BMC Cell Biol, 2013,14:32.
[15] Rudrapatna VA, Bangi E, Cagan RL. Caspase signalling in the absence of apoptosis drives Jnk-dependent invasion[J]. EMBO Rep, 2013,14(2):172-177.
[16] 孫潔,孟祥軍.二氯乙酸聯合順鉑對人結腸癌HCT116細胞凋亡的影響[J].中華普通外科雜志,2015,30(2):138-141.
[17] Kumar A, Kant S, Singh SM. Novel molecular mechanisms of antitumor action of dichloroacetate against T cell lymphoma:Implication of altered glucose metabolism, pH homeostasis and cell survival regulation[J]. Chem Biol Interact, 2012,199(1):29-37.
[18] Kumar A, Kant S, Singh SM. Antitumor and chemosensitizing action of dichloroacetate implicates modulation of tumor microenvironment:a role of reorganized glucose metabolism, cell survival regulation and macrophage differentiation[J]. Toxicol Appl Pharmacol, 2013,273(1):196-208.
[19] Tong J, Xie G, He J, et al. Synergistic antitumor effect of dichloroacetate in combination with 5-fluorouracil in colorectal cancer[J]. J Biomed Biotechnol, 2011,2011:740564.
[20] Sun RC, Board PG, Blackburn AC, et al. Targeting metabolism with arsenic trioxide and dichloroacetate in breast cancer cells[J]. Mol Cancer, 2011,10(5):142.
EffectsofdichloroacetateonproliferationandapoptosisofbladdercancerT24cells
XIEZhibin1,FUWeijin,LUChunyu,YANGXiaoli,LIJiatong,ZHAODong
(1TheFirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning530021,China)
ObjectiveTo observe the effects of dichloroacetate (DCA) on the proliferation and apoptosis of bladder cancer cells T24 in vitro and to study the underlying mechanism.MethodsThe bladder cancer cells T24 were randomly divided into four groups: experimental group 1, experimental group 2, experimental group 3, and the control group. Cells in the experimental groups 1, 2, and 3 were added with 5, 10, and 20 mmol/L DCA, respectively; cells in the control group were added with 0.1% dimethyl sulfoxide (DMSO). The cell proliferation of T24 cells were detected by MTT assay at 24, 48, and 72 h after DCA treatment. At 48 h, the apoptosis was examined by Hoechst33258 staining, the mitochondrial membrane potential was detected by using JC-1 staining, and the expression levels of Bax protein, Bcl-2 protein and Caspase-3 protein were determined by Western blotting.ResultsThe cell proliferation in the experimental groups 1, 2, and 3 was lower than that of the the control group at 24, 48 and 72 h, and with the time and increasing concentrations of DCA, the inhibition of cell proliferation was more significant (allP<0.05). The number of apoptosis cells in the experimental groups 1, 2 and 3 was higher than that of the control group, and the mitochondrial membrane potential was lower than that of the control group (allP<0.05). Compared with the control group, the expression of Bax protein and Caspase-3 protein significantly increased, while the expression of Bcl-2 protein significantly decreased in the experimental groups 1, 2, and 3 (allP<0.05).ConclusionsDCA can inhibit the proliferation and induce the apoptosis of bladder cancer cell line T24, which suggests that the mechanism may be related to the decrease of mitochondrial membrane potential level, up-regulation of Bax protein and Caspase-3 protein, and down-regulation of Bcl-2 protein.
dichloroacetate; bladder carcinoma; bladder carcinoma cells; cell proliferation; apoptosis; mitochondrial membrane potential
10.3969/j.issn.1002-266X.2017.39.003
R737.14
A
1002-266X(2017)39-0011-04
廣西自然科學基金資助項目(2015GXNSFAA139180)。
謝智彬(1990-),男,碩士研究生,主要研究方向為膀胱癌的基礎和臨床。E-mail: 2970849596@qq.com
付偉金(1978-),男,碩士研究生導師,主要研究方向為膀胱癌的基礎與臨床。E-mail: fuwj66@aliyun.com
2017-05-29)

